GILENYA® (fingolimod)
Lista de Verificação
do Médico Prescritor
Este medicamento está sujeito a monitorização adicional
Versão 6 - fevereiro 2016
Lista de verificação dirigida ao médico
com informação de segurança importante
acerca do Gilenya® (fingolimod)
Este medicamento está indicado como terapêutica única de modificação da doença na esclerose múltipla
com exacerbação-remissão muito ativa. Embora o tratamento possa ser adequado para muitos doentes,
a informação que se segue diz respeito aos doentes para os quais o tratamento com este medicamento
está contraindicado ou não recomendado.
Considerações acerca do início do tratamento
O início do tratamento com este medicamento origina uma redução transitória da frequência cardíaca e
pode também estar associado a atrasos na condução auriculo-ventricular. Todos os doentes devem ser
monitorizados durante um mínimo de 6 horas no início do tratamento. Em seguida é fornecido um resumo
dos requisitos de monitorização.
CONTRAINDICAÇÕES:
Síndrome de imunodeficiência conhecida, doentes com risco aumentado de infeções oportunistas
(incluindo doentes imunocomprometidos), infeções ativas graves, infeções crónicas ativas,
neoplasias ativas conhecidas, compromisso hepático grave e hipersensibilidade à substância ativa
ou a qualquer um dos excipientes.
Os seguintes doentes não devem ser tratados com este
medicamento:
• Mulheres grávidas;
• Doentes a tomar antiarrítmicos de classe Ia ou classe III.
Não Recomendado
Equisci
qui risco-benefício
ipsapite ecum
esto
etcardiologista
evellaccatur
Considerardignihit
apenas apósre
avaliação
avaliação
por um
• Volupta quisqui dero tempore dolecto
Deverá ser consultado um cardiologista para determinar a monitorização apropriada da primeira dose em
• Maximust quamet ad qui cum sintibusda
doentes com:
Bradiarritmia*, prolongamento significativo do intervalo
QTc‡, apneia do sono grave não tratada, doença
cardiovascular significativa†, hipertensão não controlada,
doença cerebrovascular ou história de síncope recorrente.
É recomendado prolongamento da
monitorização pelo menos durante
a noite.
Deverá ser consultado um cardiologista para considerar a substituição do tratamento por medicamentos que não diminuam a frequência cardíaca em doentes a tomar:
Bloqueadores-beta, bloqueadores dos canais de cálcio
com efeito bradicardizante ¥, outras substâncias que
podem diminuir a frequência cardíaca§.
2
Se não for possível a alteração da
medicação, é recomendado um
prolongamento da monitorização
pelo menos durante a noite.
Bradiarritmia inclui bloqueio auriculoventricular (AV) de 2º grau Mobitz Tipo II ou superior, síndrome
do nódulo sinusal, bloqueio cardíaco sino-auricular, história de bradicardia sintomática.
†
Doença cardiovascular significativa inclui: doença isquémica cardíaca (incluindo angina de peito),
história de enfarte do miocárdio, insuficiência cardíaca congestiva, história de paragem cardíaca
¥
Inclui verapamilo, diltiazem ou ivabradina
§
Inclui digoxina, agentes anticolinesterásicos ou pilocarpina.
‡
QTc >470 mseg (mulheres) ou >450 mseg (homens).
*
Versão 6 - fevereiro 2016
Antes de iniciar o tratamento
Assegurar que os doentes não estão em tratamento concomitante com medicamentos antiarrítmicos de classe Ia ou classe III
Realizar um ECG de avaliação basal e medir a pressão arterial
O tratamento com Gilenya® não está recomendado para os seguintes grupos de doentes, exceto para aqueles cujos benefícios previsíveis são considerados superiores aos potenciais riscos:
• Doente com bradiarritmia*, doença cardiovascular significativa† , prolongamento
significativo do intervalo QT, hipertensão não controlada, doença cerebrovascular,
apneia do sono grave ou história de síncope recorrente.
Antes do início do tratamento, deve-se obter a opinião de um cardiologista; nestes
doentes, a monitorização da primeira dose deverá ser feita pelo menos durante a
noite.
• Doentes tratados com bloqueadores-beta, bloqueadores dos canais de cálcio (ex.:
verapamilo, diltiazem, ivabradina) ou outras substâncias que podem diminuir a
frequência cardíaca (ex.: digoxina, agentes anticolinesterásicos, pilocarpina).
Antes do início do tratamento, deve-se obter a opinião de um cardiologista
relativamente à possível alteração para substâncias que não diminuam a
frequência cardíaca.
Se o tratamento com medicamentos que diminuem a frequência cardíaca
não puder ser interrompido, deve-se obter a opinião de um cardiologista para
uma monitorização adequada da primeira dose. Recomenda-se que esta seja
prolongada pelo menos durante a noite.
Não devem ser administradas conjuntamente terapêuticas imunomoduladoras,
imunossupressoras e anti-neoplásicas devido ao risco de efeitos aditivos no
sistema imunitário. Pela mesma razão, a decisão do tratamento concomitante com
corticosteroides de utilização prolongada deve ser tomada após uma avaliação
adequada.
Obter os valores recentes (últimos 6 meses) dos níveis de transaminases e bilirrubina
Obter os valores recentes (últimos 6 meses ou após descontinuação da terapêutica anterior) do hemograma completo.
Confirmar o resultado negativo do teste de gravidez
Informar o doente sobre a importância de uma contraceção eficaz em mulheres em
idade fértil devido ao risco teratogénico para o feto
Adiar o início do tratamento em doentes com infeção grave ativa, até que seja resolvida
Verificar a presença de anticorpos para o vírus varicella zoster (VVZ) em doentes sem
antecedentes de varicela confirmada por profissional de saúde ou vacinação prévia
documentada. Se o resultado for negativo, é recomendado um ciclo completo de
vacinação com a vacina da varicela e o início do tratamento com Gilenya® deve ser
adiado por 1 mês para que ocorra o efeito total da vacinação
Realizar um exame oftalmológico em doentes com antecedentes de uveíte ou diabetes
mellitus
Disponibilizar aos doentes o Cartão de Informação para o Doente
Versão 6 - fevereiro 2016
3
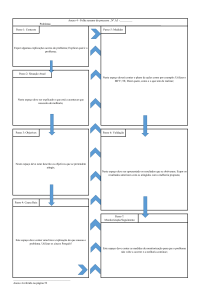
Algoritmo de início do tratamento
Todos os doentes necessitam de ser monitorizados durante, pelo menos, 6 horas no início do
tratamento com este medicamento, tal como se encontra descrito no algoritmo apresentado abaixo.
Recomenda-se o aconselhamento de um cardiologista acerca da monitorização apropriada para
os doentes aos quais este medicamento não é recomendado. Nestes doentes, é recomendado que
durante a primeira dose, seja, pelo menos, prolongada a monitorização durante a noite.
Monitorizar pelo menos 6 horas
Avaliação da pressão arterial e ECG antes da toma
Monitorizar
num período mínimo de 6 horas sinais e sinto mas de bradicardia com avaliação hora
a hora da frequência cardíaca e pressão arterial. Se o doente tiver sintomas, continuar
a monitorização até à resolução.
- É recomendada a monitorização de ECG contínua em tempo real durante as 6h após a toma
Avaliação de ECG às 6 horas
Monitorizar durante
a noite numa
unidade médica.
O procedimento de
monitorização deve
ser repetido após a
2ª dose
O doente necessitou de intervenção
farmacológica durante a monitorização
da primeira toma?
NÃO
SIM
Ocorreu algum bloqueio AV de 3º grau, em
qualquer momento, durante o período de
monitorização?
Prolongar
monitorização, pelo
menos, durante a
noite até resolução.
NÃO
No final do período de monitorização, algum dos
seguintes critérios foi atingido?
Frequência cardíaca <45 bpm
Aparecimento de bloqueio AV de 2º grau ou
superior, ou intervalo QTc ≥ 500 ms
SIM
NÃO
No final do período de monitorização a
frequência cardíaca tem o valor mais baixo
desde a administração da primeira dose?
4
NÃO
Monitorização da primeira dose completa
AV - Auriculoventricular; ECG=eletrocardiograma;
QTc – intervalo QT corrigido para a frequência cardíaca
Versão 6 - fevereiro 2016
SIM
Prolongar
monitorização, pelo
menos 2 horas, até
que a frequência
cardíaca aumente.
O procedimento de monitorização da 1ª
dose deve ser seguido quando se reinicia
o tratamento com Gilenya® caso este tenha
sido descontinuado por:
• 1 dia ou mais dias durante as primeiras
duas semanas de tratamento
• Mais do que 7 dias durante a 3ª e 4ª
semanas de tratamento
• Mais do que 2 semanas após o 1º mês de
tratamento
Durante o tratamento
Realizar um exame oftalmológico completo 3 a 4 meses após o início do tratamento
• Realizar exames oftalmológicos periódicos em doentes com antecedentes de uveíte ou diabetes mellitus
• Informar os doentes que devem comunicar qualquer perturbação da visão
• Avaliar o fundo ocular, incluindo a mácula, e interromper o tratamento em caso de confirmação
de edema macular
Informar os doentes de que devem comunicar sinais e sintomas de infeção
• Quando indicado, deve iniciar-se rapidamente tratamento antimicrobiano
• Realizar uma avaliação diagnóstica imediata em doentes que apresentem sinais e sintomas consistentes com meningite criptocócica, e iniciar o tratamento adequado após diagnóstico.
• Verificar sintomas clínicos ou alterações nas ressonâncias magnéticas que sejam sugestivos de Leucoencefalopatia Multifocal Progressiva (PML). Se houver suspeita de PML, o tratamento com este medicamento deve ser suspenso até confirmação de exclusão de diagnóstico de PML.
• Suspender o tratamento durante infeções graves
Verificar periodicamente o hemograma completo, ao mês 3 e depois pelo menos anualmente,
e interromper o tratamento se confirmar uma contagem de linfócitos <0,2x109/L
Verificar as transaminases hepáticas aos 1, 3, 6, 9 e 12 meses e, em seguida, periodicamente,
ou sempre que ocorram sinais ou sintomas de disfunção hepática
• Monitorizar com mais frequência se as transaminases hepáticas se elevarem para um valor acima
de 5 vezes o Limite Superior do Normal e interromper o tratamento se permanecerem elevadas
acima deste nível, até à recuperação
Durante o tratamento e até 2 meses após a interrupção
• As vacinas poderão ser menos eficazes
• Vacinas vivas atenuadas poderão acarretar risco de infeção e devem ser evitadas
Devem ser repetidos exames de gravidez em intervalos apropriados. Interromper o tratamento
se a doente engravidar
• Para ajudar a determinar os efeitos da exposição a Gilenya® em doentes com esclerose múltipla grávidas, os médicos são encorajados a notificar doentes grávidas que possam ter sido
expostas ao medicamento a qualquer momento durante a gravidez (a partir de 8 semanas antes da
última menstruação em diante) à Novartis através do número 21 0008600 ou do correio eletrónico
[email protected], para que seja possível monitorizar estas doentes através do Programa
de Monitorização Intensiva de Efeitos na Gravidez (PRIM – Pregnancy Outcomes Intensive Monitoring
Program).
É recomendada vigilância para o carcinoma basocelular.
Após a interrupção do tratamento
Repetir o procedimento de monitorização da 1ª dose ao reiniciar o tratamento com este medicamento
caso este tenha sido descontinuado por:
• 1 dia ou mais durante as primeiras 2 semanas de tratamento
• Mais do que 7 dias durante a 3ª e 4ª semanas de tratamento
• Mais do que 2 semanas após um mês de tratamento
Informar os doentes de que devem comunicar sintomas e sinais de infeção no período de até dois
meses após a interrupção
Informar as doentes da necessidade de uma contraceção eficaz no período de até dois meses após
a interrupção
Versão 6 - fevereiro 2016
5
Versão 6 - fevereiro 2016