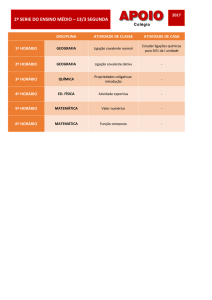
TUTORIAL – 3B
Data:
Aluno (a):
Série: 3ª
Ensino Médio
Turma:
Equipe de Química
QUÍMICA
Ligações Químicas
Ligação iônica: acontece entre átomos com tendências opostas: geralmente entre metal e ametal,
ou entre metal e hidrogênio. Os metais possuem tendência a ceder elétrons a fim de adquirir
estabilidade. Os ametais possuem tendência de receber elétrons a fim de adquirir a configuração
eletrônica de um gás nobre e ficar estável.
Ao doar elétrons o metal fica com carga positiva, e ao receber elétrons o ametal passa a ter carga
negativa, a diferença eletrostática faz com que os átomos se atraiam e a ligação aconteça.
Este é o único tipo de ligação onde ocorre transferência definitiva de elétrons, tal transferência só
acontece porque a diferença de eletronegatividade entre os átomos participantes da ligação é igual ou
maior do que 1,7.
Os compostos iônicos apresentam alto ponto de fusão, são sólidos à temperatura ambiente e são
solúveis em água.
Ligação covalente: acontece entre átomos com a mesma tendência. Geralmente entre: ametal –
ametal, ametal – hidrogênio, hidrogênio – hidrogênio. Quando os átomos envolvidos tentem a receber
elétrons e a diferença de eletronegatividade entre eles é menor que 1,7, ocorre o compartilhamento de
elétrons, característica deste tipo de ligação.
Quando não há diferença de eletronegatividade entre os átomos participantes, a ligação é dita
covalente apolar. Quando há diferença de eletronegatividade entre os átomos participantes da ligação,
a ligação é dita covalente polar, sendo o polo negativo voltado para o átomo mais eletronegativo.
Os compostos covalentes podem ser encontrados nos 3 estados físicos, apresentam ponto de fusão
e ebulição mais baixos em relação aos compostos iônicos e quando puros não conduzem eletricidade.
Estrutura de Lewis / eletrônica
Para representar esses compostos/moléculas pode-se utilizar a estrutura de Lewis, onde o átomo é
representado pelo seu símbolo bem como os elétrons presentes em sua camada de valência
(geralmente representados por bolinhas).
Exs.:
Colégio A. LIESSIN – Scholem Aleichem
-1-
NANDA/ABR/2014 – 304
Exercícios
1. As substâncias químicas constituem parte fundamental da nossa vida. A respiração, a alimentação, a
ingestão de água ou outros líquidos e o tratamento com medicamentos são alguns exemplos de
atividades essenciais que envolvem compostos químicos formados por átomos ou íons que se unem
uns aos outros.
Assinale a resposta INCORRETA.
a) No sal (NaCl) que costumamos adicionar aos nossos alimentos, a ligação química é iônica.
b) A molécula de gás oxigênio que inspiramos é composta de dois átomos que se unem através de
ligação covalente polar.
c) A molécula de gás carbônico que expiramos apresenta duas ligações duplas.
d) Os compostos iônicos são formados por cátion e ânions.
e) A grande maioria dos medicamentos é constituída de substâncias orgânicas, nas quais o tipo mais
comum de ligação química presente é a covalente.
2. Alguns materiais, quando submetidos a baixas temperaturas, podem apresentar supercondutividade,
isto é, um fenômeno em que a resistência elétrica se iguala a zero. Um material com essa característica
é uma cerâmica que contém os óxidos HgO, CaO, BaO e CuO. Disponha os óxidos HgO, CaO, BaO e
CuO em ordem decrescente de caráter covalente das suas ligações.
a) CaO>BaO>CuO>HgO
b) BaO>CuO>CaO>HgO
c) BaO >CaO>CuO>HgO
d) BaO>CaO>HgO>CuO
e) HgO>CuO>CaO>BaO
3. Leia, com atenção, o fragmento abaixo:
“As alterações climáticas globais, decorrentes da emissão excessiva de gases e partículas na
atmosfera, aumentam o chamado “efeito estufa”. A concentração de dióxido de carbono (CO2), que
antes do ano de 1850 era de 280 ppm (partes por milhão), atinge hoje 370 ppm e pode subir para 1000
ppm no final desse século.”
Fonte: Ciência Hoje, julho de 2004.
NÃO É CORRETO dizer, sobre o CO2, que:
a) em contato com a água da chuva, produz ácido carbônico.
b) é um composto molecular.
c) é um dos produtos obtidos pela queima de combustíveis nos motores de automóveis.
d) possui ligações polares e, portanto, é uma molécula polar.
e) o seu excesso na atmosfera causa o “efeito estufa”.
4. “A ligação covalente estabelecida entre dois elementos químicos será tanto mais polar quanto maior
a diferença entre as ______________ desses elementos.”
Complete-se corretamente esta afirmação acima :
Colégio A. LIESSIN – Scholem Aleichem
-2-
NANDA/ABR/2014 – 304
a) Massas atômicas
b) Eletronegatividades
c) Temperaturas de fusão
d) Densidades
e) Cargas nucleares.
5. Os tipos de ligações existentes nos compostos CO, Cl2, KCl, HCl são, respectivamente:
a) covalente polar, covalente polar, iônica e covalente polar.
b) covalente polar, covalente apolar, iônica e covalente polar.
c) iônica, covalente polar, covalente polar e iônica.
d) covalente polar, covalente apolar, iônica e iônica.
e) covalente polar, covalente polar, iônica e iônica.
6. No envenenamento por monóxido de carbono (CO), as moléculas deste gás se ligam aos átomos de
ferro da hemoglobina, deslocando o oxigênio e causando, rapidamente, asfixia.
Quantos pares de elétrons disponíveis existem na molécula do CO para se ligarem ao ferro da
hemoglobina através de ligação covalente dativa?
a) 1.
b) 2.
c) 3.
d) 4.
e) 6.
7. Dentre os compostos abaixo, o que apresenta elementos com maior diferença de eletronegatividade
é:
a) OF2.
b) LiCl.
c) CCl4.
d) NaF.
e) AlCl3
.
8. A molécula que apresenta somente uma ligação covalente normal é: (Dados: O=8; C= 6; F=9; H=1)
a) F2.
b) O2.
c) CO.
d) O3.
e) H2O.
9. Analise as seguintes afirmativas:
I – HClO3 possui duas ligações covalentes normais e duas ligações dativas.
II – H3PO4 apresenta apenas ligações covalentes simples.
III – H2SO4 possui seis ligações covalentes normais e uma ligação dativa.
Colégio A. LIESSIN – Scholem Aleichem
-3-
NANDA/ABR/2014 – 304
Está(ão) corretas:
a) I apenas.
b) II apenas.
c) III apenas.
d) I e II apenas.
e) I e III apenas.
10. Apresentam somente ligações covalentes:
a) NaCl e H2SO4
b) Mn2O3 e MgH2
c) HCl e Cl2O3
d) KNO3 e LiF
e) LiOH e CsI
Gabarito:
1 (B)
2 (E)
3 (D)
4(B)
5(B)
6 (A)
7(D)
8 (A)
9 (A)
10 (C)
Colégio A. LIESSIN – Scholem Aleichem
-4-
NANDA/ABR/2014 – 304