Arq Bras Cardiol
2003; 81: 309-13.
Pêgo-FernandesBreve
e cols
Comunicação
Ligadura do ducto torácico para tratamento de quilotórax
Ligadura do Ducto Torácico para o Tratamento de
Quilotórax em Cardiopatas
Paulo M. Pêgo-Fernandes, Fábio B. Jatene, Clayton Cesar Tokunaga, Danielle Tiemi Simão,
Ricardo Beirutty, Eliza Rumiko Iwahashi, Sérgio Almeida de Oliveira
São Paulo, SP
O quilotórax em crianças decorre, principalmente,
de cirurgias cardíacas e torácicas. Uma das formas de seu
tratamento pós-cirúrgico é a ligadura do ducto torácico,
quando falham tratamentos conservadores. Relatamos os
casos de 4 pacientes com quilotórax, que seguiram a
orientação e que apresentaram diminuição da drenagem
pleural e resolução do quilotórax, sem recorrências.
O quilotórax corresponde ao acúmulo de fluido linfático em um ou ambos os espaços pleurais, resultante do vazamento do ducto torácico ou de uma de suas divisões principais1. Foi descrito pela primeira vez em 1875, quando Quinke
relatou o extravasamento de quilo no tórax após ruptura
traumática do ducto torácico2.
Quando não tratado, apresenta um alto risco de mortalidade, com índices acima de 45%3, necessitando, na maioria
das vezes, de uma intervenção agressiva para tratamento.
Segundo DeMeester4, o quilotórax pode ser dividido,
de acordo com sua etiologia, em congênito, traumático,
neoplásico ou de causas mistas. Entre as causas traumáticas, os procedimentos cirúrgicos de abordagem torácica
podem, eventualmente, ocasionar a lesão do ducto torácico,
levando ao desenvolvimento de quilotórax. O quilotórax
pós-cirúrgico ocorre em menos de 1% das cirurgias torácicas, com prevalência de 0,5% a 2%5 e pode causar deficiências nutricionais, acometimento do aparelho respiratório,
desidratação e imunossupressão, tornando o paciente mais
vulnerável às infecções.
O quilotórax pós-cirúrgico, de modo geral, é abordado
de forma conservadora, inicialmente6. O tratamento constitui na retirada do quilo dos espaços pleurais e/ou do peri-
Instituto do Coração da Faculdade de Medicina da Universidade de São Paulo.
Correspondência: Paulo M. Pêgo-Fernandes – INCOR - Av. Dr. Eneas de Carvalho
Aguiar,44 – 05403-000 – São Paulo, SP – e-mail: [email protected]
Recebido para publicação em 15/5/02
Aceito em 14/1/03
cárdio por métodos aspirativos ou através de drenagem
contínua por tubo, reposição eletrolítica e de fluidos, e
suporte nutricional. O método de escolha para o suporte
nutricional é a hiperalimentação parenteral, uma vez que a
alimentação por via oral pode estimular a produção de quilo,
agravando o quadro7.
Caso o tratamento conservador não demonstre eficácia, deve-se considerar a possibilidade de um tratamento
cirúrgico8. Estudos indicam que a ligadura do ducto torácico e a pleurodese constituem alternativas eficazes na resolução do quilotórax9.
Recentemente, tem se preconizado, como forma de tratamento para quilotórax não responsivo a tratamento conservador, a ligadura do ducto torácico por meio da cirurgia
torácica vídeo-assistida10. Kirby e cols. a descreveram com
menor queixa de dor pelos pacientes e menos complicações
pós-operatórias11.
Pereira e cols.12 descreveram a utilização de ligadura
linfática para o tratamento de quilopericárdio pós-cirúrgico.
Entretanto, em nosso meio, a ligadura de ducto torácico para
o tratamento de quilotórax pós-cirúrgico é um procedimento
ainda pouco realizado, havendo controvérsia em relação ao
momento em que se deve suspender o tratamento conservador e se indicar uma alternativa cirúrgica. Dessa forma,
nosso estudo avalia os resultados iniciais da ligadura de
ducto torácico em 4 pacientes que apresentaram quilotórax
pós-cirúrgico não responsivo a tratamento conservador.
Relato dos Casos
Caso 1- Paciente do sexo masculino, 4 anos de idade,
portador de cardiopatia congênita com cianose ao nascimento, apresentando antecedentes de atresia pulmonar
com septo interventricular íntegro, ventrículo único tipo
esquerdo, com ventrículo direito hipoplásico com sinusóides, estenose da artéria pulmonar esquerda e fístula coronário-cavitária, sendo que, aos 5 dias de vida, fora submetido
à atriosseptotomia através da manobra de Rashkind e 2 dias
após, realizado Blalock Taussig modificado à esquerda.
Arq Bras Cardiol, volume 81 (nº 3), 309-13, 2003
309
Pêgo-Fernandes e cols
Ligadura do ducto torácico para tratamento de quilotórax
Aos quatro anos de idade, submeteu-se à cirurgia de
Glenn bidirecional, com manutenção do Blalock anterior,
evoluindo no pós-operatório com baixo débito cardíaco,
sustentado por uso de drogas vasoativas. Recebeu alta no
5° dia pós-operatório, quando foi suspeitado derrame
pleural pequeno e indicada radiografia de tórax.
Diagnosticado quilotórax, o paciente foi submetido à
instalação de drenos. Introduziu-se jejum e nutrição parenteral após 1 semana. Evoluiu com manutenção de drenagem
significativa. Dezenove dias após a instalação do quadro,
foram feitas a redrenagem e limpeza cirúrgica. No 49° dia de
internação, devido à manutenção do quilotórax, o paciente
foi submetido à cirurgia de ligadura do ducto torácico por
toracotomia ântero-lateral direita. Foram encontrados
pequena quantidade de líquido quiloso, múltiplas aderências pleuro-pulmonares e saco pericárdico abaulado. Após
dissecção, isolamento e ligadura do ducto torácico, foi
aberto o saco pericárdico, drenando-se sob pressão cerca
de 100 ml de líquido quiloso. Drenos foram mantidos no 6°
espaço intercostal. Paciente evoluiu bem, com retirada dos
drenos direito e esquerdo no 16° e no 18° pós-operatório,
respectivamente.
Caso 2 - Paciente do sexo feminino, com 1 ano de idade,
apresentando história de miocardite viral (soro + para
Cocksakie), evoluindo para miocardiopatia dilatada, insuficiência cardíaca congestiva grave e insuficiência renal aguda. Foi encaminhada ao nosso Serviço para estabilização
do quadro e possível indicação para transplante cardíaco.
Cerca de 1 mês após a internação, radiografia de tórax mostrou imagem sugestiva de derrame pleural à esquerda, posteriormente puncionado, com saída de líquido de aspecto
leitoso, diagnosticado através de análise bioquímica como
quilotórax. Suspeita-se de que a causa do quilotórax tenha
sido a lesão do ducto torácico durante passagem de intracath dias antes. O tratamento iniciou-se com colocação de
dreno à esquerda e manutenção da paciente em jejum e
nutrição parenteral.
Após 19 dias, devido à persistência da drenagem
pleural acentuada e ao mau estado geral da paciente, com
grande perda ponderal, procedeu-se com a identificação,
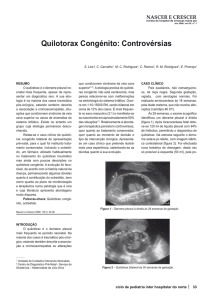
isolamento e ligadura do ducto torácico (fig.1), por meio de
toracotomia póstero-lateral em 7° espaço intercostal direito.
A paciente evoluiu bem, com diminuição da drenagem
pleural. Foi introduzida dieta orogástrica 2 dias após, porém
com manutenção da nutrição parenteral até o 8° dia pósoperatório. A paciente apresentou melhora clínica progressiva e foi submetida a transplante cardíaco 25 dias após a
ligadura do ducto torácico.
Caso 3 - Paciente do sexo masculino, com 2 anos de
idade, submetido a procedimento de secção e sutura de
canal arterial, evoluindo com saída de drenagem pleural
acima do normal. A partir do 4° pós-operatório, o líquido
proveniente da drenagem pleural, que ainda permanecia
acentuada, adquiriu um aspecto mais leitoso e encaminhado
para análise bioquímica permitiu o diagnóstico de quilotórax. Paciente foi tratado por 5 dias com dieta oral hipogordurosa, não apresentando, entretanto, diminuição do volume
310
Arq Bras Cardiol
2003; 81: 309-13.
Fig. 1 - Ligadura de ducto torácico.
drenado. Introduziu-se então jejum e nutrição parenteral
por 10 dias, havendo persistência de drenagem significativa e perda ponderal importante.
Dada a persistência do quilotórax, optou-se pela ligadura do ducto torácico por meio de pequena toracotomia
vídeo-assistida. Paciente evoluiu bem, com retirada de
drenos no 8° dia pós-operatório.
Caso 4 - Paciente do sexo masculino, com 70 anos, foi
submetido à cirurgia de revascularização do miocárdio. No
3° pós-operatório, evoluiu com saída de secreção leitosa
pelo dreno pleural esquerdo que, posteriormente, revelou
alta quantidade de triglicérides. No 7° pós-operatório instituiu-se dieta parenteral (BNJ5). No 14° pós-operatório, o
paciente foi submetido à ligadura do ducto torácico por
toracoscopia direita, sendo mantidos drenos pleurais
esquerdo e direito. O dreno direito foi removido 3 dias após
a ligadura. No 19° pós-operatório da cirurgia de revascularização foi reinstituída dieta liquida VO. A nutrição parenteral
foi interrompida no 21° pós-operatório e estabelecida dieta
enteral leve, sem gorduras e complementada com triglicérides de cadeia média.
No 24° pós-operatório, o paciente realizou radiografia
de tórax que evidenciou derrame pleural bilateral, importante
à esquerda com septação e discreto à direita. Após 4 dias, o
paciente foi submetido a toracotomia esquerda e realizadas
decorticação pleural precoce, limpeza pleural e pleurodese,
com colocação de drenos pleurais anterior e posterior. A
cultura de líquido pleural indicou presença de Pseudomonas aeruginosa. No 5° pós-operatório (33 dias após a
revascularização) foi instituída dieta geral VO. No 7° pósoperatório, os drenos foram retirados. O paciente recebeu
alta hospitalar no 9° pós-operatório (37 dias após a revascularização).
Arq Bras Cardiol
2003; 81: 309-13.
Pêgo-Fernandes e cols
Ligadura do ducto torácico para tratamento de quilotórax
Discussão
O quilotórax caracteriza-se pela efusão de fluido linfático para a cavidade pleural. Entre outras causas, pode se
originar como complicação secundária a intervenções cirúrgicas 13, principalmente aquelas de abordagem torácica,
quando é chamado de quilotórax pós-cirúrgico.
Nos três pacientes pediátricos deste estudo, o quilotórax resultou de procedimentos cirúrgicos, dois deles relacionados diretamente à abordagem cardíaca e um, possivelmente, à colocação de intra-cath, assemelhando-se aos dados de
outros estudos que mostram que, em pacientes pediátricos, o
quilotórax pós-cirúrgico ocorre, principalmente, como complicação de cirurgias torácicas e cardíacas14.
O 4º paciente, de 70 anos, desenvolveu quilotórax
após cirurgia de revascularização do miocárdio com artéria
torácica interna, constituindo rara complicação desse procedimento, dada a localização do ducto torácico15.
O quilotórax pós-cirúrgico pode se desenvolver cerca
de 2 dias a 4 semanas após o ato operatório, apresentandose de forma leve ou severa, de acordo com o volume e a taxa
de perda de quilo14. Embora seja uma condição rara, quando
não tratado, o quilotórax pós-cirúrgico apresenta uma alta
taxa de mortalidade, atingindo até 50%6.
O extravasamento de quilo na cavidade pleural pode
comprimir o pulmão ipsislateral e quando a secreção é intensa, causar a elevação do mediastino, comprometendo o
outro pulmão e a própria função cardíaca16. Além disso, a
perda de quilo promove a diminuição do número de linfócitos T circulantes, comprometendo o sistema imunológico e
predispondo os pacientes a infecções5. A espoliação de
quilomícrons, com ácidos graxos de cadeia longa, e de
eletrólitos determina as alterações metabólicas.
A maioria dos pacientes com quilotórax apresenta
falta de ar e secreção pleural. O diagnóstico pode ser confirmado por exames bioquímicos e microscópicos do líquido
drenado, verificando-se a presença de triglicérides e quilomícrons. A causa pode ser definida por investigação da
parede torácica, pleura, pulmões, linfonodos intra-torácicos,
linfáticos pulmonares ou do ducto torácico13.
O tratamento de quilotórax visa basicamente: a) reduzir
a produção de quilo, b) tratar a causa de base c) drenagem
intra-pleural com reposição de fluidos e d) obliteração do
espaço pleural13.
Para o quilotórax pós-cirúrgico, o tratamento inicia-se
geralmente de forma conservadora, baseado na drenagem
do espaço pleural e suporte nutricional, com uso de triglicerídeos de cadeia média7, alimentação oral hipogordurosa ou
repouso entérico com uso de nutrição parenteral total17.
Entretanto, o uso de triglicerídeos de cadeia média é evitado
por alguns grupos, após Peitersen e Jacobsen18 terem demonstrado que ele aumenta substancialmente o conteúdo
de triglicerídeos na efusão pleural. Além disso, a drenagem
repetida ou contínua da secreção pleural muitas vezes é
ineficiente, e promove perda de fluido, proteínas de plasma
e eletrólitos.
Na ausência de melhora, deve-se suspender o trata-
mento conservador e optar-se por uma abordagem cirúrgica. Não existe um consenso na literatura sobre o momento
de interromper-se o tratamento conservador e optar-se por
abordagem cirúrgica. Alguns estudos recomendam a intervenção cirúrgica se houver persistência de drenagem por 1
a 3 semanas 17, baseando-se também na quantidade de
fluido drenado, quando esta excede 200ml a 500ml por dia.
As modalidades de tratamento cirúrgico de quilotórax
incluem pleurodese19, ligadura de vasos linfáticos e ligadura
do próprio ducto torácico17.
A ligadura do ducto torácico, realizada pela primeira
vez em 1948 por Lampson3, mostrou-se bastante eficaz e
com baixa mortalidade. Há evidências de que a ligadura do
ducto torácico promove a formação de circulação colateral
linfática, independentemente do nível da ligadura. Assim,
mesmo com a remoção do ducto torácico e da cisterna do
quilo, não há desencadeamento de efeitos negativos10.
A ligadura do ducto torácico por cirurgia torácica
vídeo-assistida no tratamento de quilotórax espontâneo e
pós-operatório tem sido amplamente descrita nos últimos
anos 6. Apresenta-se como um procedimento bastante
eficaz, permitindo a identificação do ducto torácico e sua
ligadura seletiva e podendo ser indicada na vigência de tratamento conservador ineficaz, embora a presença de extensa aderência pleural possa ser fator de complicação e forçar
a conversão para cirurgia aberta10. Outro fator importante é
que essa cirurgia provoca menos dor pós-operatória e diminui o risco de disfunção pulmonar11. Segundo Fahimi e
cols.6, a ligadura do ducto torácico por cirurgia torácica
vídeo-assistida é uma ótima alternativa para o tratamento
precoce de quilotórax pós-operatório persistente, dados o
baixo custo e a facilidade de uso, associados a um menor
índice de mortalidade.
Para a utilização da cirurgia torácica vídeo-assistida no
tratamento de quilotórax, Sachs e cols.20 propuseram o uso
de linfangiografia como um método eficiente para localização pré-operatória do sítio de extravazamento e consideraram a tomografia computadorizada como um método adicional, porém não necessário. Fahimi e cols.6 defendem, entretanto, a administração de refeição cremosa contendo preto
de Sudan, que permite a identificação pré-operatória do
sítio de extravazamento de quilo na maioria dos casos, de
forma simples, eficiente e não invasiva, quando comparada
à linfangiografia e à tomografia computadorizada.
Segundo Fahimi e cols.6, o tratamento de quilotórax
pós-operatório deve seguir a seguinte conduta (fig.2). O
uso da cirurgia torácica vídeo-assistida está indicado quando a drenagem diária de líquido pleural exceder 200 ml após
2 semanas de tratamento conservador.
Alguns estudos mostram que a ligadura do ducto torácico usando cirurgia torácica vídeo-assistida ou toracotomia para o tratamento de quilotórax em crianças pode falhar,
dadas as variações anatômicas do ducto torácico ou devido
à impossibilidade de identificar os sítios de vazamento
quilífero21.
Tal dificuldade para identificar e isolar estruturas com
o uso da cirurgia torácica vídeo-assistida está em parte tam311
Pêgo-Fernandes e cols
Ligadura do ducto torácico para tratamento de quilotórax
Arq Bras Cardiol
2003; 81: 309-13.
Fig. 2 - Tratamento de quilotórax pós-operatório segundo Fahimi e cols.6. CTVA: Cirurgia torácica vídeo-assistida.
bém relacionada com o tempo de quilotórax que, se presente
por muito tempo, promove o desenvolvimento de aderências pleuroesofágicas, já citado10, dificultando o isolamento
e a manipulação das estruturas mediastinais. No caso, a ligadura do ducto pode ser feita através de cirurgia aberta,
como realizada nos pacientes 1 e 2.
Em outras condições, a pleurodese pode ser associada à ligadura do ducto torácico no controle do quilotórax,
como no caso 4 que, devido a processo infeccioso, houve
persistência do quilotórax mesmo após ligadura.
A ligadura do ducto torácico constitui um método eficaz para o tratamento de quilotórax. Assim, deve ser sugerida a possibilidade de sua realização precoce, uma vez que
o menor tempo com tratamentos conservadores, aos quais
os pacientes muitas vezes não respondem, poderia minimizar os custos e os danos aos pacientes, como a perda pon-
deral resultante da dieta restritiva e a dor promovida pela
permanência do quilotórax. Sieczka e Harvey5 relatam que o
tratamento considerado conservador pode acarretar um
atraso desnecessário, aumentando o risco de pobreza no
estado nutricional e, consequentemente, de imunocomprometimento, além de expor o paciente às complicações do
acesso venoso central.
Em conclusão, todos os pacientes apresentaram melhora importante do quadro de quilotórax após a ligadura
do ducto torácico. Tratamento que caracterizou-se como
boa alternativa terapêutica para quilotórax pós-cirúrgico,
quando não há resposta a tratamentos conservadores. A
realização precoce da ligadura do ducto torácico poderia
descartar as possíveis falhas dos tratamentos conservadores, diminuindo as agressões e o tempo de sofrimento dos
pacientes.
Referências
1.
2.
3.
4.
Miller JI. Chylothorax and anatomy of the thoracic duct. In Shields TW. General
Thoracic Surgery Philadelphia: Lea & Febiger, 1989. 625.
Wurnig PN, Hollaus PH, Ohtsuka T, et al. Thoracoscopic direct clipping of the
thoracic duct for chylopericardium and chylothorax. Ann Thorac Surg 2000;
70:1662-5.
Fahimi H, Casselman FP, Mariani MA, et al. Current management of
postoperative chylothorax. Ann Thorac Surg 2001; 71:448-50;450-1.
Demeester TR. The pleura. In Sabiston DCaS, EC. Surgery of the Chest. Philadelphia: Lea & Febiger, 1983.
312
5.
6.
7.
8.
9.
Sieczka EM, Harvey JC. Early thoracic duct ligation for postoperative chylothorax. J Surg Oncol 1996; 61:56-60.
Fahimi H, Casselman FP, Mariani MA, et al. Current management of postoperative
chylothorax. Ann Thorac Surg 2001; 71:448-51.
Hashim SA, Roholt HB, Babayan VK, Itallie TB. Treatment of chyluria and chylothorax with medium-chain triglyceride. N Engl J Med 1964; 270:756-61.
Graham DD, McGahren ED, Tribble CG, et al. Use of video-assisted thoracic
surgery in the treatment of chylothorax. Ann Thorac Surg 1994; 57:1507-12.
Allen EM, van Heeckeren DW, Spector ML, Blumer JL. Management of nutritio-
Arq Bras Cardiol
2003; 81: 309-13.
10.
11.
12.
13.
14.
15.
nal and infectious complications of postoperative chylothorax in children. J
Pediatr Surg 1991; 26:1169-74.
Wurnig PN, Hollaus PH, Ohtsuka T, et al. Thoracoscopic direct clipping of the
thoracic duct for chylopericardium and chylothorax. Ann Thorac Surg 2000;
70:1662-5.
Kirby TJ, Mack MJ, Landreneau RJ, Rice TW. Lobectomy-video-assisted thoracic surgery versus muscle-sparing thoracotomy: a randomized trial. J Thorac
Cardiovasc Surg 1995; 109:997-1002.
Pereira WM, Kalil RAK, Prates PR, Nesralla IA. Cardiac tamponade due to
chylopericardium after cardiac surgery. Ann Thorac Surg 1988; 46:572-3.
Browse NL, Allen DR, Wilson NM. Management of chylothorax. Br J Surg 1997;
84:1711-6.
Stringel G, Mercer S, Bass J. Surgical management of persistent postoperative
chylothorax in children. Can J Surg 1984; 27:543-6.
Pego-Fernandes PM, Ebaid GX, Nouer GH, et al. Chylothorax after myocardial
revascularization with the left internal thoracic artery. Arq Bras Cardiol 1999;
73:383-90.
Pêgo-Fernandes e cols
Ligadura do ducto torácico para tratamento de quilotórax
16. Wolff AB, Silen ML, Kokoska ER, Rodgers BM. Treatment of refractory chylothorax with externalized pleuroperitoneal shunts in children. Ann Thorac Surg
1999; 68:1053-7.
17. Bond SJ, Guzzetta PC, Snyder ML, Randolph JG. Management of pediatric postoperative chylothorax. Ann Thorac Surg 1993; 56:469-73.
18. Peitersen B, Jacobsen B. Medium chain triglycerides for treatment of spontaneous, neonatal chylothorax: lipid analysis of the chyle. Acta Paediatr Scand
1977; 66:121-5.
19. Adler RH, Levinsky L. Persistent chylothorax: treatment by talc pleurodesis. J
Thorac Cardiovasc Surg 1978; 76:859-64.
20. Sachs PB, Zelch MG, Rice TW, et al. Diagnosis and localization of laceration of the
thoracic duct: usefulness of lymphangiography and CT. Am J Roentgenol 1991;
157:703-5.
21. Merrigan BA, Winter DC, O’Sullivan GC. Chylothorax. Br J Surg 1997;
84:15-20.
Bula resumida – MICARDIS® Telmisartam - Uso adulto - Forma farmacêutica e apresentações: Comprimidos de 40 mg: embalagens com 14 e 28 comprimidos. Comprimidos de 80 mg: embalagens com 14 e 28
comprimidos. Composição: Cada comprimido contém 40 mg ou 80 mg de telmisartam. Excipientes q.s.p. 1 comprimido. Indicações: Tratamento da hipertensão arterial, como monoterapia ou em associação com
outros agentes anti-hipertensivos. Contra-indicações: Hipersensibilidade ao ingrediente ativo ou aos excipientes. Gravidez e lactação. Obstrução biliar. Disfunção hepática ou renal grave. Intolerância hereditária
à frutose. Precauções: Hipertensão renovascular: pacientes com estenose arterial renal bilateral ou estenose da artéria com um único rim funcionando: risco aumentado de hipotensão grave e insuficiência renal.
Disfunção renal ou transplante hepático: monitoração periódica dos níveis séricos de potássio e creatinina. Não há experiência em pacientes com transplante renal recente. Desidratação: hipotensão
sintomática, especialmente após a primeira dose, pode ocorrer em pacientes que têm volemia e/ou sódio depletado, o que deve ser corrigido antes do início da terapêutica com MICARDIS. Outras condições de
estimulação do SRAA e condições dependentes da atividade SRAA (insuficiência cardíaca congestiva grave): hipotensão aguda, hiperazotemia, oligúria ou, raramente, insuficiência renal aguda.
Hiperaldosteronismo primário: não se recomenda o uso de MICARDIS. Estenose valvar aórtica e mitral e cardiomiopatia hipertrófica obstrutiva: Recomenda-se precaução especial. Hipercalemia: recomendase monitoração adequada dos níveis séricos de potássio em pacientes de risco. Diuréticos poupadores de potássio, suplementos de potássio, sais de potássio ou outros medicamentos que podem aumentar
os níveis de potássio, como a heparina: podem levar a um aumento da potassemia. Portanto, nestas situações MICARDIS deve ser administrado com cautela. Distúrbios hepatobiliares: pode-se esperar redução
da depuração em pacientes com disfunções obstrutivas do sistema biliar ou insuficiência hepática, pois a eliminação da droga é principalmente biliar. Intolerância à frutose: os comprimidos de MICARDIS contém
sorbitol; portanto, é inadequado para pacientes com intolerância hereditária à frutose. Outros: menor eficácia na redução da pressão arterial na população negra do que na população não-negra. Cardiopatia
isquêmica ou doença cardiovascular isquêmica pode resultar em infarto do miocárdio. Interações medicamentosas: MICARDIS pode aumentar o efeito hipotensor de outros agentes anti-hipertensivos. Observouse um aumento de 20% da concentração plasmática média de digoxina. Relataram-se aumentos reversíveis das concentrações séricas de lítio e de toxicidade; portanto, recomenda-se cuidadosa monitoração
do uso concomitante com lítio. Gravidez e lactação: Contra-indicado. Reações adversas: As reações adversas à droga obtidas a partir de todos os estudos clínicos com telmisartam foram: Infecções do trato
urinário, infecções do trato respiratório superior, ansiedade, visão anormal, vertigem, dor abdominal, diarréia, boca seca, dispepsia, flatulência, dor de estômago, eczema, aumento de suor, artralgia, dor nas
costas, cãibras nas pernas ou dores nas pernas, mialgia, sintomas de tendinite, dor no peito, sintomas de gripe. Além disso, desde a introdução de telmisartam no mercado, relataram-se casos raros de eritema,
prurido, desmaio, insônia, depressão, vômito, hipotensão, bradicardia, taquicardia, dispnéia, eosinofilia, trombocitopenia, fraqueza e perda de eficácia. Relataram-se casos isolados de angioedema, urticária
e outros eventos relacionados. Investigações: Raramente, observaram-se diminuição na hemoglobina ou aumento no ácido úrico. Observaram-se aumentos na creatinina ou nas enzimas hepáticas. Efeitos
na habilidade de dirigir e utilizar máquinas: Ainda não se realizaram estudos específicos. Contudo, ao dirigir ou operar máquinas, pode ocasionalmente ocorrer tontura ou sonolência. Posologia: A dose
recomendada é de 40 mg uma vez ao dia. Alguns pacientes podem apresentar benefício com dose diária de 20 mg. Em casos em que a pressão arterial pretendida não seja atingida, a dose de MICARDIS pode
ser aumentada para no máximo 80 mg uma vez ao dia. Alternativamente, MICARDIS pode ser usado em combinação com diuréticos tiazídicos, como a hidroclorotiazida, para se obter uma redução maior da
pressão arterial. Quando se considerar um aumento da dose, deve-se levar em conta que o máximo efeito anti-hipertensivo é geralmente atingido quatro a oito semanas após o início do tratamento. MICARDIS
pode ser administrado com ou sem alimento. Insuficiência renal: Não há necessidade de ajustes de dose em pacientes com insuficiência renal leve a moderada. Telmisar tam não é removido do sangue por
hemofiltração. Insuficiência hepática: Nos pacientes portadores de insuficiência hepática leve a moderada, não se deve exceder a dose diária de 40 mg. Pacientes idosos: Não são necessários ajustes de doses.
Crianças e adolescentes: Não há dados de segurança e eficácia de MICARDIS em crianças e adolescentes. VENDA SOB PRESCRIÇÃO MÉDICA - MS - 1.0367.0110 - Boehringer Ingelheim do Brasil Química
e Farmacêutica Ltda.
Bula resumida – MICARDIS ® HCT – Telmisartam/Hidroclorotiazida - Uso adulto - Composição: Cada comprimido de MICARDIS HCT contém 40 mg/12,5 mg ou 80 mg/12,5 mg de telmisartam/hidroclorotiazida.
Embalagens com 14 e 28 comprimidos. Excipientes q.s.p. 1 comprimido. Indicações: Tratamento da hipertensão arterial. MICARDIS HCT, como associação de dose fixa, é indicado em pacientes cuja pressão
arterial não é adequadamente controlada com telmisartam ou hidroclorotiazida isoladamente. Posologia: MICARDIS HCT deve ser administrado uma vez ao dia. A dose de MICARDIS pode ser aumentada
gradativamente antes de substituí-lo pelo MICARDIS HCT. A substituição direta da monoterapia pelas combinações fixas pode ser considerada. MICARDIS HCT 40/12,5 mg pode ser administrado em pacientes
cujas pressões sangüíneas não sejam adequadamente controladas por MICARDIS 40 mg ou hidroclorotiazida. MICARDIS HCT 80/12,5 mg pode ser administrado em pacientes cujas pressões arteriais não sejam
adequadamente controladas por MICARDIS 80 mg ou por MICARDIS HCT 40/12,5 mg. O máximo efeito anti-hipertensivo é obtido após 4 a 8 semanas de tratamento. Quando necessário, MICARDIS HCT pode ser
administrado com outros anti-hipertensivos. MICARDIS HCT pode ser administrado com ou sem alimento. Devido ao componente hidroclorotiazida, MICARDIS HCT não deve ser usado em pacientes com
disfunção renal grave. Nos casos leves a moderados, não se observaram efeitos adversos renais e não é necessário ajuste de dose. Recomenda-se monitoração periódica da função renal. Nos casos de
insuficiência hepática leve a moderada, não se deve exceder a dose de 40/12,5 mg uma vez ao dia. MICARDIS HCT não é indicado em pacientes com insuficiência hepática grave. Não são necessários ajustes
de dose conforme a idade. Ainda não se estabeleceram a segurança e a eficácia de MICARDIS HCT em pacientes menores de 18 anos. Contra-indicações: Hipersensibilidade aos componentes ativos,
excipientes ou substâncias derivadas de sulfonamidas (como HCT). Gravidez e lactação. Colestase e distúrbios obstrutivos biliares. Insuficiência hepática ou renal grave (depuração de creatinina <30 ml/min).
Hipopotassemia refratária e hipercalcemia. Precauções: Não utilizar nos casos de colestase, distúrbios biliares obstrutivos ou insuficiência hepática grave. Usar com cautela nos casos de função hepática
alterada ou doença hepática progressiva, pois pode ocorrer coma hepático. Há maior risco em pacientes com estenose arterial renal bilateral ou estenose com um único rim funcionando. Micardis HCT não deve
ser administrado em pacientes portadores de disfunção renal grave. Não há experiência quanto à administração de MICARDIS HCT em pacientes com grave insuficiência renal ou com um rim transplantado
recentemente. Recomenda-se a monitoração periódica dos níveis séricos de potássio, creatinina e ácido úrico. A azotemia associada a diuréticos tiazídicos pode ocorrer em pacientes com função renal alterada.
Pode ocorrer hipotensão sintomática em pacientes que têm volemia e/ou sódio depletado. Insuficiência cardíaca congestiva grave ou doença renal, estenose da artéria renal tratada concomitantemente com
drogas que afetem o sistema renina-angiotensina-aldosterona foram associados com hipotensão aguda, hiperazotemia, oligúria ou, raramente, insuficiência renal aguda. Aldosteronismo primário: não se
recomenda o uso de telmisartam, precaução especial em estenose valvar aórtica ou mitral e cardiomiopatia hipertrófica obstrutiva. Como tiazidas podem prejudicar a tolerância à glicose, pode ser necessário
ajuste no tratamento em diabéticos e pode ocorrer manifestação de diabetes latente. A hidroclorotiazida aumenta os níveis de colesterol e triglicérides; contudo, nenhum ou poucos efeitos adversos foram
relatados na dose de 12,5 mg contida em MICARDIS HCT. Pode ocorrer hiperuricemia ou precipitação de gota devido a hidroclorotiazida. Pode ser necessária monitoração periódica dos níveis séricos de
eletrólitos, uma vez que a hidroclorotiazida pode causar desequilíbrio eletrolítico ou de fluidos (hipopotassemia, hiponatremia e alcalose hipoclorêmica). O tratamento concomitante com telmisartam pode
reduzir a hipopotassemia induzida por diuréticos, devido aos efeitos antagônicos. Diuréticos poupadores de potássio, suplementos de potássio ou substitutos do sal contendo potássio devem ser utilizados
concomitantemente com cautela. Não há evidências de que MICARDIS HCT reduza ou previna hiponatremia induzida por diuréticos. A deficiência de cloreto é geralmente leve. Tiazidas podem causar elevação
dos níveis séricos de cálcio e magnésio. Interromper o uso antes dos testes de função da paratireóide. Não utilizar em intolerância hereditária à frutose. A redução excessiva da pressão arterial no caso de doença
cardiovascular isquêmica pode ser prejudicial. Relatou-se exacerbação ou ativação do lupus eritematoso sistêmico com o uso de hidroclorotiazida. Recomenda-se cautela no uso de anti-hipertensivos ao dirigir
e operar máquinas. Interações medicamentosas: Relataram-se aumentos reversíveis das concentrações séricas de lítio durante administração concomitante com inibidores da enzima conversora de
angiotensina. Relataram-se casos de interação com antagonistas dos receptores da angiotensina II. O risco de toxicidade por lítio pode ser aumentado com o uso de MICARDIS HCT. Recomenda-se a monitoração
dos níveis séricos de lítio durante o uso concomitante. O efeito de depleção de potássio da hidroclorotiazida é atenuado pelo efeito poupador de potássio do telmisartam, mas é potencializado por outros diuréticos
caliuréticos, laxantes, corticosteróides, ACTH, anfotericina, carbenoxolona, penicilina G sódica, ácido salicílico e derivados. Por outro lado, o uso concomitante de diuréticos poupadores de potássio,
suplementos/sais de potássio ou outras drogas podem aumentar os níveis séricos de potássio. Nesses casos, recomenda-se a monitoração dos níveis plasmáticos de potássio. Recomenda-se monitoração
periódica de potássio na administração de MICARDIS HCT com digitálicos, antiarrítmicos e drogas que são conhecidamente indutoras de torsades de pointes. Telmisartam pode aumentar o efeito hipotensor de
outros agentes anti-hipertensivos. Observou-se um aumento de 20% da concentração plasmática média de digoxina. Não se identificaram outras interações de importância clínica. Interações com a
hidroclorotiazida: álcool, barbitúricos ou narcóticos (potencialização da hipotensão ortostática); drogas antidiabéticas (ajustes de dose podem ser necessários); metformina (risco de acidose láctica);
colestiramina e resina colestipol (absorção de hidroclorotiazida é prejudicada); corticosteróides, ACTH (depleção eletrolítica, principalmente aumento de hipopotassemia); glicosídeos digitálicos
(hipopotassemia ou hipomagnesemia induzida por tiazídicos favorece o aparecimento de arritmias cardíacas induzidas por digitálicos); drogas antiinflamatórias não-esteroidais (a administração de droga
antiinflamatória não-esteroidal pode reduzir o efeito diurético, natriurético e anti-hipertensivo dos diuréticos tiazídicos em alguns pacientes). Os efeitos das aminas hipertensoras podem ser levemente
diminuídos. Os relaxantes musculares esqueléticos não-despolarizantes são potencializados pela hidroclorotiazida. Medicamentos uricosúricos podem requerer ajustes. Verificou-se aumento da incidência
de reações de hipersensibilidade ao alopurinol. Os efeitos hiperglicêmicos dos beta-bloqueadores e diazóxido podem ser aumentados pelas tiazidas. Os agentes anticolinérgicos (por exemplo, atropina,
biperideno) podem aumentar a biodisponibilidade das tiazidas. As tiazidas podem aumentar os eventos adversos da amantadina. As tiazidas podem reduzir a excreção renal de drogas citotóxicas (por exemplo,
ciclofosfamida, metotrexato). Gravidez e lactação: É contra-indicado. Se ocorrer gravidez, telmisartam deve ser descontinuado o mais breve possível. As tiazidas atravessam a barreira placentária e podem
causar distúrbios eletrolíticos no feto e é possível que ocorram outras reações. Relataram-se casos de trombocitopenia ou icterícia neonatal com o tratamento tiazídico materno. Tiazidas são excretadas no leite
humano e podem inibir a lactação. Reações adversas: Foram relatadas as seguintes reações adversas: Bronquite, faringite, sinusite, infecções do trato respiratório superior, infecções do trato urinário,
sialadenite, eosinofilia, anemia aplástica, anemia hemolítica, depressão da medula óssea, leucopenia, neutropenia/agranulocitose, trombocitopenia, alergia, reações anafiláticas, perda do controle da diabete,
hipercolesterolemia, hiperuricemia, hipopotassemia, causa ou aumento da depleção de volume, desequilíbrio eletrolítico, hiponatremia, anorexia, perda de apetite, hiperglicemia, ansiedade, depressão,
inquietação, tontura, desmaio, insônia, escotomas, parestesia, distúrbios do sono, visão alterada, visão borrada temporariamente, xantopsia, vertigem, bradicardia, taquicardia, arritmias cardíacas, hipotensão,
hipotensão postural, angiite necrotizante (vasculite), dispnéia, sofrimento respiratório (incluindo pneumonite e edema pulmonar), dor abdominal, diarréia, dispepsia, gastrite, dor de estômago, boca seca,
flatulência, vômito, constipação, pancreatite, icterícia (icterícia hepatocelular ou colestática), eczema, aumento do suor, eritema, prurido, reações cutâneas do tipo lupus eritematoso, vasculite cutânea, reações
de fotossensibilidade, erupções cutâneas, reativação do lupus eritematoso cutâneo, necrólise epidérmica tóxica, atralgia, artrose, dor nas costas, dor nas pernas, mialgia, cãibras nas pernas, sintomas de
tendinite, fraqueza, espasmo muscular, nefrite intersticial, disfunção renal, glicosúria, impotência, sintomas de gripe, dor, dor no peito, perda da eficácia, febre. Investigações: Diminuição da hemoglobina, aumento
do ácido úrico, aumento na creatinina, aumento das enzimas hepáticas, aumento dos triglicérides. Assim como ocorre com outros antagonistas da angiotensina II, relataram-se casos isolados de angioedema,
urticária e outras reações relacionadas. VENDA SOB PRESCRIÇÃO MÉDICA. - MS 1.0367.0134 Boehringer Ingelheim do Brasil Química e Farmacêutica Ltda.
313