1
Química Analítica I
Expressão química e numérica dos
resultados em análises químicas
Profª Simone Noremberg Kunz
2
Expressar a concentração:
% peso (%m/%m): massa de A/massa da amostra
% volume (%v/%v): volume de A/volume da amostra
% peso/volume (%m/%v): massa de A/volume da amostra
ppm ( parte por milhão) – mg/L
ppb (parte por bilhão) - μg/L
ppt (parte por trilhão) - ng/L
Molaridade – mol/L
Concentração comum – g/L
3
Algumas unidades físicas de massa e volume:
Massas
Volumes
1kg = 103g
1L = 103mL
1g = 103mg
1mL = 103µL
1g = 106µg
1L = 106µL
1mg = 103µg
1 cm3 = 1 mL
1 dm3 = 1 L
4
Porcentagem: significa partes por cem
5 %: 5 partes em 100
Partes por milhão (ppm)
5 ppm: 5 partes em um milhão ( ou 106 partes)
EXEMPLO: Se a quantidade de mercúrio em amostra for 5 mg, sua
concentração em ppm é
5 mg
1 kg
=
5 mg
5 ppm
=
106 mg
( Note que 1 kg = 103 g = 106 mg e que mg/kg é portanto o mesmo que ppm.)
5
Partes por bilhão (ppb)
5 ppb: 5 partes em um bilhão ( ou 109 partes)
EXEMPLO: Se a quantidade de mercúrio em amostra for 5 μg, sua
concentração em ppb é
5 μg = 5 μg = 5 ppb
1 kg
109 μg
( Note que 1 kg = 103 g = 106 mg = 109 μg e que μg /kg é portanto o mesmo que ppb.)
6
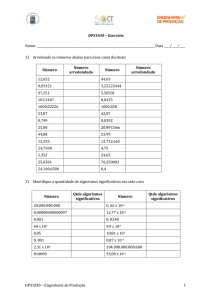
Algarismos significativos
• Representam os números de dígitos necessários para
expressar os resultados de uma medida.
• Ex.: 0,032 g; 0,1000 N; 0,2080 g; 3,50 mL
• Os
valores que resultam de observações devem ser
registrados com apenas 1 algarismo duvidoso.
• Ex.: 1 g ≠ 1,0 g ≠ 1,05 g ≠ 1,053 g ≠ 1,0539 g
7
Algarismos significativos
O número de algarismo significativos é o número mínimo
de algarismos necessário para escrever um determinado valor em
notação cientifica sem a perda da exatidão.
142,7
0,004571
1,427 x 102
4,571 x 10-3
O algarismo zero é significativo quando se encontra:
(i) no meio de um número ou (ii) no final do número do lado direito
da vírgula decimal.
106
0,0204
0,804
0,3070
Determinação da concentração de Cd em amostra de bolo x legislação.
8
Algarismos significativos
O dígito 0 (zero) pode ser parte significante de uma
medida.
Exemplos:
• 0,261 3 algarismos significativos
• 90,7 3 algarismos significativos
• 800,0 4 algarismos significativos
• 0,0670 3 algarismos significativos
• 9,3660 x 105 5 algarismos significativos
9
Algarismos significativos
0,837 x 106
3 algarismos significativos
0,0837 x 107
8,37 x 105
8,370 x 105
4 algarismos significativos
10
Algarismos significativos
5 algarismos significativos
8,3700 x 105
O Zero como algarismo significativo
800,0
4 algarismos significativos
11
Algarismos significativos
0,261
3 algarismos significativos
90,7
0,0670
9,3660 x 104
9,3660 x 105
5 algarismos significativos
12
Operações com Algarismos significativos
O resultado deve ter tantas casas decimais quantas
existirem na parcela com o menor número delas.
•
Adição e subtração
65,3
+ 2,1437
67,4437
•
Multiplicação e divisão
15,29
X 0,1202
1,837858
13
Arredondamento de números
Avalia-se o algarismo duvidoso:
• Se maior que 5 + 1 unidade
• Se menor que 5 mantém o número
• Se igual a 5 arredonda-se para o algarismo par ou
considera-se os próximos números
Ex.:
• 9,47 = 9,5
• 9,43 = 9,4
• 9,451= 9,5
• 43,55= 43,6
• 1,425= 1,42
• 1,42501= 1,43
14
Tamanho da Amostra
líquido amniótico
Tipo de Análise
Macro
solo
Semi
micro
água
Micro
poeira
Ultra
micro
sangue
0,0001
0,001
0,01
Tamanho da amostra / g
0,1
Método
Amostra sólida
Amostra líquida
Macro
> 100 mg
> 100 l
10 a 100 mg
50 a 100 l
1 a 10 mg
50 l
< 1 mg
---
Semi micro
Micro
Ultramicro
15
Quantidades aproximadas dos constituintes
de uma amostra
Constituintes (analitos)
Quantidades
Majoritário
> 1%
Minoritário
~0,1% a 1%
Traços
Ultratraços
< 0,1%
ppm; ppb; ppt
16
Nível do Analito
Majoritário
Como varia o erro relativo
Tipo de Constituinte
a análise em função do
Minoritário
nível de concentração do
Traço
analito?
Ultra micro
1 ppb
1 ppm
Nível do analito
0,1%
100%
17
Exatidão e precisão de uma medida
• Exatidão:
Grau de concordância entre o valor achado e o valor
verdadeiro (ou o mais provável)
Proximidade do “real”
• Precisão:
Grau de concordância entre medidas repetidas de uma
quantidade. Exprime a “reprodutibilidade” de uma série
de medidas.
18
A
B
C
D
19
Teoria dos Erros
• Erros determinados:
• Erros
operacionais e erros pessoais. Ex.: perdas
mecânicas de materiais nas diversas etapas da análise;
observação de mudança de cor, em uma titulação visual;
erros matemáticos nos cálculos.
• Erros instrumentais e erros de reagente. Ex.: falhas ou
defeitos nos aparelhos; aparelhos mal calibrados; uso de
reagentes contendo impurezas.
• Erros de método (método analítico). Ex.: reações laterais
e incompletas.
20
Teoria dos Erros
• Erros indeterminados:
• Refletem pequeninas diferenças entre os valores
experimentais de uma série de medidas
(números de observações). Esses erros não
podem ser evitados.
• Leis matemáticas de probabilidade podem ser
usadas para tratar os valores de uma série de
medidas. Os erros indeterminados tendem a
seguir uma distribuição normal (ou curva
gaussiana).
21
Erros
É possível realizar uma análise química totalmente livre de erros ou incertezas?
Resultados de 6 determinações
de Fe em uma solução padrão
contendo 20,00 mg/L de Fe (III).
Faixa: 19,4 – 20,3 mg/L
Cada medida é influenciada por muitas incertezas dispersão dos resultados
Incertezas nunca podem ser completamente eliminadas, uma vez que o valor real de uma
medida é sempre desconhecido.
A grandeza provável de um erro em uma medida geralmente pode ser determinada os limites
podem ser definidos, dentro dos quais encontra-se o valor real a um dado nível de probabilidade
22
Distribuição Normal ou Gaussiana
23
Mediana e Média Aritmética
Mediana:
Num conjunto disposto em ordem de grandeza, o valor acima
e abaixo do qual há um mesmo número de casos
Média Aritmética:
O quociente da soma de x valores por N elementos.
Exemplo:
X
X
N
Resultados da análise da acidez total do vinagre:4,62%; 4,68% e 4,59%
Mediana = 4,62%
Média Aritmética = 4,63%
24
Exatidão: proximidade entre o resultado e
1
2
seu valor real (aceito como real).
Erro Absoluto = Xi – Xr
3
4
Xi = valor medido e Xr = valor real
Erro Relativo = (Xi – Xr) x 100 %
Xr
Ex.: O resultado de uma análise é 36,97g. O valor aceito (valor
verdadeiro) para a mesma análise é 37,06g. Calcular o erro
relativo.
25
Precisão: descreve a proximidade entre as medidas, ou seja, a proximidade
entre os resultados que foram obtidos exatamente da mesma forma.
Desvio padrão - Expressa a precisão de uma série de medidas
(número observações).
s
2
x
m
N 1
s - desvio padrão estimado de um conjunto finito
de valores experimentais, para N 30,
(N – 1) - graus de liberdade,
X - média estimada (média aritmética),
m - valor experimental individual em uma série de
medidas (número de observações).
Desvio padrão relativo (DPR% ou RSD%) ou Coeficiente de
Variação (CV):
s
RSD % .100
X
26
Calcular o Desvio padrão, desvio padrão relativo :
Determinação de ferro em um minério
Valores em mg/L: 450, 465, 448, 457, 450, 380.
27
Para calibrar uma balança com 3 casas de precisão
um técnico utilizou um peso de 50,000 g. Os resultados das
pesagens foram: 50,010; 50,002; 50,005; 50,006. Como
podemos expressar a exatidão da balança? E a precisão?
28
Rejeição de resultados
• Usamos o teste Q para rejeitar valores grosseiros em uma
série de medidas
• Qexp é comparado com Qcrit (valores críticos para o quociente
Q de rejeição; encontram-se tabelados).
• Se Qexp > Qcrit rejeitar o valor suspeito; caso contrário reter o
valor.
Qexp
xsuspeito x próximo
xmaior xmenor
Química Analítica Clássica
REJEIÇÃO DE DADOS – TESTE Q
Teste Q - Solução
30
Rejeição de resultados
Ex:
Valores: 450, 465, 448, 457, 450, 380.
Ordenar os resultados em ordem crescente:
380, 450, 450, 448, 457, 465.
Calcular Q para 380 e 465.
31
Exercícios para resolução
HARRIS, D. C. Análise Química Quantitativa. 8ª edição
Capítulo 3 : Erro experimental
3-1
3-2
3-5
3-13
1 - Quantos algarismos significativos possuem cada um dos
seguintes valores:
a) 7,9 X 105
b) 300,45
c) 5,043 X 10-4
32
2 – Medidas replicadas para determinar o conteúdo de ferro em uma liga
deram como resultado 94,67, 94,54, 94,62, 94,93% Fe. Calcule o desviopadrão relativo dessas análises.
3 – Calcule o erro relativo em porcentagem para análise de uma amostra de
água extraída de um rio, cujo valor registrado é de 15,7 ppm Cu, quando o
verdadeiro valor é, de fato, 18,0 ppm Cu. O erro relativo está relacionado à
exatidão ou precisão? Justifique.
4 – Uma serie de medidas replicadas do conteúdo de água em uma amostra
de etanol, feitas com o método Karl-Fischer, resultou nos seguintes dados:
a) 0,77% b) 0,67% c) 0,71% d) 0,90% e) 0,78%
Utilizando o teste-Q, qual a confiabilidade para rejeitar o ponto (d)?