QUÍMICA 1
Resoluções das atividades
Aula 4
Número de oxidação – Nox
Atividades para sala
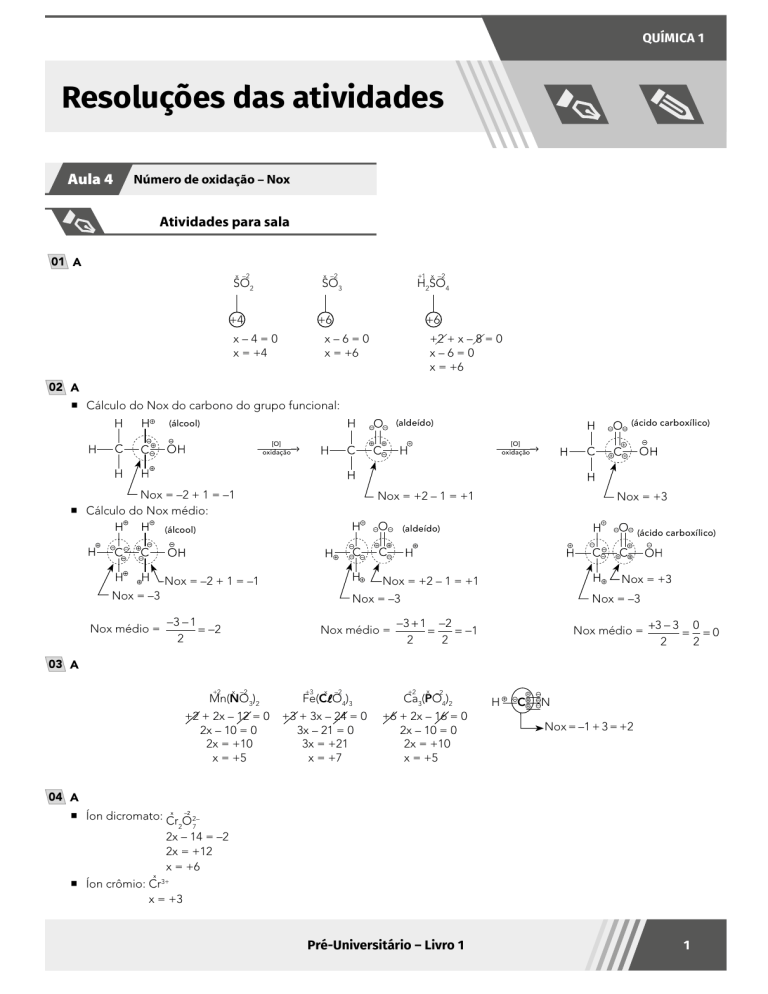
01 A
x –2
x –2
+1 x –2
SO2SO3H2SO4
+4
+6
x–4=0
x = +4
+6
x–6=0
x = +6
+2 + x – 8 = 0
x–6=0
x = +6
02 A
A Cálculo do Nox do carbono do grupo funcional:
(aldeído)
(álcool)
(ácido carboxílico)
[O]
oxidação
[O]
oxidação
Nox = –2 + 1 = –1
A Cálculo do Nox médio:
Nox = +2 – 1 = +1
(aldeído)
(álcool)
(ácido carboxílico)
Nox = +3
Nox = +2 – 1 = +1
Nox = –2 + 1 = –1
Nox = –3
Nox médio =
Nox = +3
Nox = –3
−3 − 1
= −2
2
Nox médio =
Nox = –3
−3 + 1 −2
=
= −1
2
2
Nox médio = +3 − 3 = 0 = 0
2
2
03 A
+2
x –2
Mn(NO3)2
+2 + 2x – 12 = 0
2x – 10 = 0
2x = +10
x = +5
+3
x
–2
Fe(ClO4)3
+3 + 3x – 24 = 0
3x – 21 = 0
3x = +21
x = +7
+2
x –2
Ca3(PO4)2
+6 + 2x – 16 = 0
2x – 10 = 0
2x = +10
x = +5
H
C
N
Nox = –1 + 3 = +2
04 A
x
–2
A Íon dicromato: Cr
O 2–
7
2
2x – 14 = –2
2x = +12
x = +6
x
A Íon crômio: Cr3+
x = +3
Pré-Universitário – Livro 1
1
QUÍMICA 1
x
AEtanol:
Nox: –2 + 1 = –1
Atividades propostas
01 C
I.
NO e N2
Nox →
Equações
Dessa forma, os estados de oxidação nos nitrogênios são
dados a seguir.
+2
II.
x +1
CO e CO2
Nox →
+2
x –2
NH+4NO3–
0
x + 4 = +1
x = –4 + 1
x = –3
+4
02 A
05 D
Nox = –3
14243
Nox = –3 H
N
H2N C
C
N
N
Cs
C
N
H
Cs
CH
Nox = –3 H
H
Cs
Cs
C
N
H
H
Cs
Nox = –3 Nox = –3
Nox = –3
Cs
Cs
H
H
O
C
C
sp2
Nox = –3
H H O
N
Cs Cs C OH
H
C
HO
H
C
H
O
Cl
Éter
sp3
H
H
C
C3
C
C
FM = C18H17N7O5
A Todos os nitrogênios apresentam estado de oxidação –3.
Nox = –1
Funções orgânicas: ácido carboxílico, éter e haleto orgânico.
CP
C
CP
N
Nox = +4
CP
CP
N
H
FM = C6H5N5O2
A Carbonos primários (C) = 5
A Estados de oxidação do carbono: +4, +3, +2, e +1
C7
H
P
04 C
A substância reagente que contém nitrogênio é o NH4O3.
2
H
H
C3
C2
06 D
H
Nox = +1
Nox = +2
H
Hibridação: sp2
Nox = +1
3
123
H2N
N
Hibridação: sp3
Nox = –1
123
1442443
H
2
Hibridação: sp2
Nox = +3
123
Carbonos
O
Ácido carboxílico
Nox = +3
Haleto orgânico
1
Nox = +3
Nox = +1
H
Nox = +3
N
O
CP
OH
C1
Cl
s = 9.
A Carbonos secundários (C)
03 B
C2
sp2
O
H
Nox = +1
O
C
H
x + 6 = –1
x = +6 – 1
x = +5
4
C
1
C
C5
6
C
H
H
Número de ligações:
A Carbono 7: primário
A Carbonos 1, 2, 3, 5 e 6: secundários
A Carbono 4: terciário
Pré-Universitário – Livro 1
OH
Fenol
QUÍMICA 1
Hibridação:
Nox = +1
Nox = –1
A Carbonos híbridos sp2 : 1, 2, 3, 4, 5 e 6
A Carbono híbrido sp3 : 7
CH2Cl2
Números de oxidação:
A
A
A
A
Nox do C = x
Carbonos 2, 3, 5 e 6, com Nox = –1
Carbono 1, com Nox = +1
Carbono 4, com Nox = 0
Carbono 7, com Nox = –3
x + 2 · (+1) + 2 · (–1) = 0
x+2–2=0
x=0
O=C=O
07 C
ou
Nox = –2
CO2
Fe [Fe(CN) ]
3+
4 4–
6 3
Nox do C = x
x
x
–1
Fe(CN)
x – 6 = –4
x = +6 – 4
x = +2
Fe
x = +3
3+
4–
6
x + 2 · (–2) = 0
x–4=0
x = +4
Nox = –1
08 A
+1 x –2
x +1
HCO3–
NH+4
+1 + x – 6 = –1
x – 5 = –1
x = +5 –1
x = +4
x
–2
x
P2O4–
7
S2O72–
x + 4 = +1
x = –4 + 1
x = –3
2x – 14 = –2
2x = +14 –2
2x = +12
x = +6
–2
ClO–4
2x – 14 = –4
2x = +14 –4
2x = +10
x = +5
x–4=0
CCl4
x –2
x = +4
Nox do C = x
10 A
Os números de oxidação –3, 0, +3 e +5 correspondem às
espécies químicas NH3, N2, NO2– e NO3–, respectivamente,
conforme dado a seguir.
x +1
x – 8 = –1
x = +8 –1
x = +7
x + 4 · (–1) = 0
x
x –2
x –2
NH3
N2
NO–2
NO–3
x+3=0
2x = 0
x – 4 = –1
x – 6 = –1
x = –3
x=0
x = +4 – 1
x = +6 – 1
x = +3
x = +5
09 A
Nas substâncias compostas, o somatório dos Nox de
todos os átomos é igual a zero.
Nox = +1
Nox = –2
ou
CH2O
Nox do C = x
x + 2 · (+1) – 2 = 0
x+2–2=0
x+0=0
x=0
CH3OH
ou
CH4O
Nox = +1
Nox = –2
Nox do C = x
x + 4 · (+1) – 2 = 0
x+4–2=0
x+2=0
x = –2
Pré-Universitário – Livro 1
3












