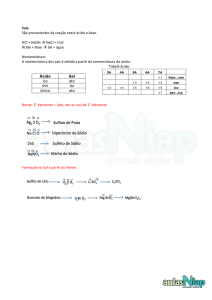
Ácidos
São substâncias que quando dissolvidas em água, originam H+ como único
tipo de cátion.
Classificação
1 – N º de hidrogênios ionizáveis – Monoácido, Diácido...
2 – Nº de Elementos Químicos – Binário, Ternário...
3 – Volatilidade
Fixos – Oxiciácidos HNO3 – Oxiácido, porém VOLÁTIL
Voláteis – Hidrácitos
4 - Força
Hidrácitos
Fortes – HBr, HCl, HI
Moderados – HF
Fracos – H2S , HCN
Oxiácidos
Oxigênios - Hidrogênios
≥2 – Forte
<2 - Fraco
Nomenclatura de Ácidos
Hidrácitos – Ácido Nome do Elemento + ídrico
Oxiciácidos – Descobrir o Nox: Somar tudo e igualar a 0
NO NOX : H = +1
O = -2
Ex: H2S03 x + 2 -6 = 0 x = 4
ÁCIDO SULFUROSO
Ex2 : H2CO3 X + 2 -6 = 0 X = 4 (Coincide com o número da
Família) – Ácido CarbonICO
Importante!! – Se o resultado do NOX coincidir com o número da
família, usamos o sufixo ICO.
Tabela (Oxiácidos)
NOX
+1, +2
+3, +4
+5, +6
17
NOMENCLATURA
Ácido Hipo ----------- Oso
Ácido ----------- Oso
Ácido --------------- Ico
Ácido Per -------------- Ico
Principais Famílias (Grupos A)
IV – C
V – N, P, As
VI – S, Se, Te
VII – Cl, Br, I