Hospital das Clínicas da Faculdade de Medicina de Ribeirão
Preto – USP
José Eduardo Bueno
Lucas José Bazzo Menon
Análises Laboratoriais Para Avaliação Da Função
Renal
Ribeirão Preto
2008
Hospital das Clínicas da Faculdade de Medicina de Ribeirão
Preto – USP
José Eduardo Bueno
Lucas José Bazzo Menon
Análises Laboratoriais Para Avaliação Da Função
Renal
Monografia apresentada ao programa de aprimoramento profissional/ SES elaborada no
Hospital das Clínicas da Faculdade de Medicina de Ribeirão Preto/USP/ Departamento de
Apoio Médico
Área: Análises Clínicas
Orientador: Gilmar Humberto Bueno
Ribeirão Preto
2008
AGRADECIMENTO
Agradecemos primeiramente a Deus, que ao nosso lado guiou-nos com sabedoria
para realização de um sonho que hoje se concretiza;
Aos nossos pais, através da confiança a nós concedida, apoio e carinho;
Aos nossos amigos, principalmente aos demais aprimorandos de análises clínicas
pela amizade concedida nestes anos...
Aos funcionários do Laboratório central do Hospital das Clinicas da Faculdade de
Medicina de Ribeirão Preto-USP, pela oportunidade do amadurecimento profissional, pelo
ambiente familiar concedido que sempre nos deram o suporte certo para nossa
adaptação e aprimoramento prático;
E especialmente ao Biologista responsável, Gilmar Humberto Bueno por sua
dedicação e amizade, sempre se sacrificando em prol dos Aprimorandos;
O nosso eterno,
“MUITO OBRIGADO”
Resumo
O presente trabalho tem como objetivo avaliar estatisticamente a retrospectiva da demanda de
exames do Laboratório de Nefrologia do Hospital das Clínicas de Ribeirão Preto-USP e apresentar de
forma clara e didática informações a respeito dos exames da avaliação da função renal. Apresenta também,
noções a respeito da fisiopatologia dos distúrbios freqüentes do sistema renal.
Sumário
1- Introdução.............................................................................................. 6
2- Objetivo................................................................................................. 7
3- Materiais e Procedimentos metodológicos............................................ 8
3.1- Tipo de estudo................................................................................... 8
3.2- O Hospital das Clínicas da Faculdade de Medicina de Ribeirão
Preto da Universidade de São Paulo...........................................................8
4- Revisão bibliográfica............................................................................ 11
4.1- Aspectos morfofuncionais do sistema renal............................. 12
4.1.1- Aspectos anatômicos.............................................................. 12
4.1.2- Aspectos fisiológicos............................................................. 16
5- Exames da avaliação da função renal.................................................... 21
5.1- Dismorfismo eritrocitário.......................................................... 21
5.1.2- Fisiopatologia da Hematúria.................................................. 23
5.1.3- Fatores pré-analíticos e coleta urinária.................................. 24
5.1.4- Método Laboratorial.............................................................. 25
5.1.5- Valores de Referência............................................................ 26
5.2- Depuração da Creatinina........................................................... 27
5.3- Microalbuminúria..................................................................... 28
5.4- Avaliação laboratorial da Nefrolitíase...................................... 30
5.4.1- Oxalato de Cálcio................................................................... 32
5.4.2- Fosfato de Cálcio................................................................... 32
5.4.3- Fosfato de amônio-Magnésio................................................. 32
5.4.4- Ácido Úrico........................................................................... 32
5.4.5- Cistina.................................................................................... 32
5.4.6- Testes Laboratoriais Urinários na Investigação da formação de
Cálculos............................................................................................ 32
6- Resultados e Discussão......................................................................... 33
7- Conclusão.............................................................................................. 39
8- Referências Bibliográficas.................................................................... 40
1.- Introdução
A nefrologia é uma área médica sempre em transformação Inovações terapêuticas e
disponibilidade de recursos tecnológicos vem em auxilio do acompanhamento do nefropata,
assim como na avaliação rotineira de pacientes assintomáticos.
Muitas vezes silenciosa, a doença renal se estabelece de várias formas e a necessidade
de uma área de apoio ao clínico se torna necessário. O laboratório clínico especializado na
área de nefrologia permite ao clínico obter resultados mais específicos e de forma mais
completa quanto ao quadro do paciente, permitindo uma avaliação segura do paciente.
6
2.-Objetivo
-Fazer um estudo estatístico dos exames realizados no Laboratório de Nefrologia do Hospital
das Clinicas de Ribeirão Preto-USP.
-Observar quais exames são mais solicitados e observar o crescimento da demanda de exames
no Laboratório de Nefrologia do Hospital.
7
3.-Materiais e Procedimentos Metodológicos
Materiais
Para esta monografia não são muitos os materiais:
- Banco de dados do Laboratório de Nefrologia do Hospital das Clinicas da Faculdade
de Medicina de Ribeirão Preto;
- Referencias bibliográficas citadas;
Método
-Fazer uma revisão literária sobre o conteúdo;
-Analisar o banco de dados do Laboratório de Nefrologia do HCFMRP;
-Fazer as conclusões necessárias para obter os resultados requeridos no objetivo.
3.1-Tipo de estudo
O presente trabalho trata-se de um estudo de avaliação, analítico, descritivo e
retrospectivo a partir de análise de documentos que registraram o processo laboratorial de
exames solicitados na nefrologia do Hospital das Clínicas da Faculdade de Medicina de
Ribeirão Preto da Universidade de São Paulo – Unidade Campus.
3.2-O Hospital das Clínicas da Faculdade de Medicina de Ribeirão Preto da
Universidade de São Paulo
O Hospital das Clínicas da Faculdade de Medicina de Ribeirão Preto da Universidade
de São Paulo (HCFMRP-USP) é uma entidade autárquica, com características de hospital-
8
escola e integrada ao Sistema Único de Saúde–SUS, em nível terciário, tendo como objetivos
básicos: ensino, pesquisa e assistência. Sua estrutura organizacional e atividades obedecem
aos preceitos do Decreto Estadual nº 13297, de 05/03/1979.
Para o desempenho de suas atividades institucionais, dispõe de duas unidades: uma
situada na área central da cidade de Ribeirão Preto, denominada Unidade de Emergência (UE)
e outra situada no Campus Universitário (Unidade Campus), além do Centro Regional de
Hemoterapia – Hemocentro (também no Campus). O Hospital é composto por: ambulatórios,
unidades de internação, laboratórios, administração, unidades de apoio, etc, e é estruturado de
forma a proporcionar ensino e treinamento a estudantes dos cursos de graduação e pósgraduação da Faculdade de Medicina de Ribeirão Preto da USP, Escola de Enfermagem de
Ribeirão Preto – USP, bem como aperfeiçoamento para profissionais relacionados com a
assistência médico-hospitalar. A área de atuação do Hospital concentra-se, basicamente, no
município de Ribeirão Preto, entretanto, ante as suas características de “Hospital Regional”,
são atendidos pacientes de várias cidades da região, chegando inclusive, a ultrapassar as
divisas e/ou limites do Estado de São Paulo e até mesmo do país. Segundo dados de 2003 o
Hospital das Clínicas dispõe de 847 leitos, sendo 685 na Unidade Campus. Possui 16 salas
cirúrgicas no Campus.
Na área de apoio diagnóstico dispõem de laboratórios nas mais diversas especialidades
e oferece, também, procedimentos de tecnologia de ponta, tais como: Lithotripsia, Cirurgia de
Epilepsia, Transplante de Rim, Transplante de Córnea, Transplante de Fígado, Transplante de
Medula Óssea, Fertilização Assistida, Diagnóstico por Tomografia Computadorizada e
Ressonância magnética, Serviço de Cardiologia e Seção de Pneumologia. O ambulatório do
Campus conta com, aproximadamente, 300 salas para atendimento a pacientes, congregando
consultórios médicos, salas de enfermagem/orientação, pequenas cirurgias, curativos, Serviço
Social, além de salas de medicação/repouso, coleta de material para exames laboratoriais,
9
vacinas, Radiologia, Central de Quimioterapia, Farmácia Ambulatorial e outros. Durante o
ano de 2003 foram realizados 582.949 consultas e procedimentos, 32.806 internações e
29.397 cirurgias (HCFMRP-USP, 2003).
10
4.-Revisão Bibliográfica
Todo alimento digerido pelo nosso sistema digestório é transportado através do sangue
e da linfa para todas as células do nosso corpo, assim como o oxigênio. Depois que os tecidos
utilizem os nutrientes e o oxigênio necessário para a sua manutenção, os detritos devem ser
eliminados, para que não comprometam o funcionamento do organismo com substâncias
tóxicas (AIRES, 1999).
O aparelho excretor tem justamente a função de eliminar todos os detritos do
organismo, bem como as substâncias em excesso, usando como via principal os rins. Entre as
funções do rim, cinco se destacam por suas importâncias:
-Manutenção do equilíbrio hídrico: função pela quais os rins mantêm constante a
quantidade de água do organismo.
-Manutenção do equilíbrio eletrolítico: papel mantido dentro de uma faixa
estreita de normalidade a concentração de diversos eletrólitos.
-Manutenção do equilíbrio ácido-básico: junto com os pulmões, os rins são
responsáveis pela manutenção do pH do liquido extracelular dentro de valores
muito estreitos.
-Excreção de catabólitos: é a função mais elementar dos rins sendo responsável
pela eliminação de uma serie de substancias resultantes do catabolismo orgânicos
de proteínas, lipídios e carboidratos.
-Função reguladora hormonal: os rins secretam diversas substâncias que agem
como hormônios reguladores do funcionamento do organismo.
11
Quando há insuficiência renal, a perda destas funções desencadeia sérios problemas
para o paciente. Entretanto, na maioria das vezes, a tempo de ocorrerem adaptações
sistemáticas pelo tecido renal ainda não lesado.
Tendo em vista a importância do sistema renal para o equilíbrio do meio interno, este
trabalho enfocará as principais estruturas anatômicas, macroscópicas e microscópicas, bem
como também as principais funções do sistema a fim de garantir o pleno funcionamento do
nosso organismo. (GUYTON, 2002).
4.1-Aspectos morfofuncionais do sistema renal
4.1.1-Aspectos Anatômicos
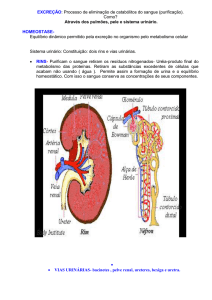
O Sistema renal é formado por dois órgãos denominados de rins, os quais realizam a
maior parte das funções de excreção, filtrando o sangue e recolhendo deste os resíduos
metabólicos de todas as células do nosso corpo.
Este órgão é dotado de um sistema de tubos condutores do produto final deste filtrado,
os quais chamam de vias urinárias, que são compostas por: pelve renal, ureteres, bexiga
urinária e uretra. A urina produzida pelos rins, é o veículo no qual este aparelho controla a
eliminação de água ,sais minerais,íons,resíduos metabólicos, enfim, substâncias que em
excesso causam um desequilíbrio fisiológico em nosso organismo. (DI DIO, 1999).
Os rins são estruturas retro-peritoniais, localizados na região abdominal, ao lado da
coluna vertebral, entre as duas ultimas vértebras torácicas e as três primeiras vértebras
lombares. São recobertos pelo peritônio e circundados por um tecido areolar frouxo, que é
uma delaminação especial da fáscia subserosa denominada fáscia renal (anterior e posterior) e
por uma massa de tecido adiposo denominada gordura perirrenal. O rim direito é um pouco
mais caudal que o esquerdo, provavelmente devido a sua relação superior com o fígado. Sua
12
coloração é um marrom escuro; possui um formato de grão de feijão; mede aproximadamente
12 cm de altura, de 5 a 7,5 cm de largura e 2,5 cm de espessura; seu peso varia entre 125 a
170 gramas no homem adulto, e 115 a 155 gramas na mulher adulta GRAY, 1988).
Apresenta um ápice, uma base, faces e margens distintas, sendo uma lateral convexa e
outra medial côncava. Nesta ultima encontramos uma profunda fissura longitudinal
denominada de hilo renal, região esta que permite a entrada e saída de estruturas dos rins
(veias, artérias, nervos, ureteres) denominada de pedículo renal. Superficialmente o rim é
revestido por uma túnica fibrosa denominada cápsula fibrosa, que confere uma proteção firme
e lisa ao órgão.
Embora os rins constituam menos de 0,5 % do total da massa do corpo, recebem de 20
a 25 % do débito cardíaco em repouso, por meio das artérias renais (direita e esquerda), que
são dois grandes troncos que se originam da artéria aorta abdominal, ao nível do disco
intervertebral entre a primeira e a segunda vértebra lombares. A artéria renal direita é mais
longa que a esquerda devido à posição da artéria aorta e seguem dorsalmente as veias
renais.Antes de atingir o hilo renal, cada artéria se divide 5 ramos, denominadas de artérias
segmentares, que suprem segmentos diferentes do órgão. O segmento superior do rim é
irrigado pela artéria segmentar superior, os segmentos anteriores são nutridos pelas artérias
segmentares ântero-superiores e antero-inferiores, o segmento inferior do rim é nutrido pela
artéria segmentar inferior e o segmento posterior do rim é irrigado pela artéria segmentar
posterior. Ao penetrarem no seio renal cada artéria do segmento da origem a diversos ramos
que entram no parênquima entre as colunas e os lobos renais, as denominadas artérias
interlobares, que seguem em direção as bases das pirâmides renais em formato de arco, entre
o córtex e medula renal, passando então a serem chamadas de artérias arqueadas. Daí segue
em direção ao córtex renal, entre os lóbulos renais, formando as artérias interlobulares, que
dão origem as arteríolas aferentes, que se divide em uma rede capilar enovelada denominada
13
glomérulo, que é a porção vascular do néfron, que será discutido adiante. Estes capilares
glomerulares se reúnem para formar a arteríola eferente, que após divisões formam a rede de
capilares peritubulares que circundam as partes tubulares do néfron no córtex renal e as
arteríolas retas que suprem as partes tubulares do néfron na medula renal. As redes de
capilares peritubulares se reúnem para formarem as vênulas peritubulares e em seguida as
veias interlobulares, que drenam o sangue para as veias arqueadas, que correm em direção as
colunas renais como veias interlobares que se une no seio renal formando as veias
comunicantes, que deixam o rim por meio das veias renais (direita e esquerda) sendo que a
veia renal direita é menor que a esquerda, devido à posição da veia cava inferior, onde o
sangue venoso é levado à circulação sistêmica (DÂNGELO; FATTINI, 2006)
Se fizermos um corte longitudinal em um rim, passando pelas suas bordas, iremos
observar as estruturas macroscópicas internas do rim. Ao observarmos uma de suas faces,
veremos uma camada fibrosa externa, apresentada em forma de casca, na qual denominamos
de córtex renal. Em direção a face medial, encontraremos a medula renal, estrutura
avermelhada escura em um formato triangular, com a sua base voltada para o córtex e seu
vértice voltado para o seu interior, denominada de pirâmide renal, intercalada por estruturas
em forma de colunas, na qual denominamos de colunas renais (DI DIO, 1999).
No ápice destas pirâmides encontramos a papila renal, estrutura com várias perfurações (como
chuveiro), denominada de área crivosa, que lança sua excreta em um sistema de cálices renais
(maiores e menores) que se unem formando a pelve renal, conjunto de tubos também
conhecido por sistema cálico-piélico, que apresenta continuidade em um tubo fino chamado
de ureter. Este sistema, juntamente com os vasos e nervos que tem acesso ao rim, encontramse em uma expansão do hilo renal denominada seio renal. O ureter mede aproximadamente 25
a 34 cm de comprimento, é composto de três camadas distintas: a mais externa é túnica
adventícia, composta por tecido conjuntivo, sendo parcialmente revestida de serosa nas
14
regiões onde o ureter está em contato com o peritônio; a túnica média composta por
musculatura lisa; e a túnica interna é composta por camada mucosa. Segue seu trajeto
retroperitonealmente até um saco musculomembranoso localizada na cavidade pélvica
denominada de bexiga urinária, um órgão especializado em armazenar urina, e quando esta se
encontra totalmente cheia, com as suas fibras musculares estiradas (músculo detrussor), estas
se contraem eliminando a urina armazenada por um outro tubo chamado de uretra, que se
estende do óstio interno da uretra no fundo da bexiga, até o óstio externo da uretra na glande
do pênis no sexo masculino, e no vestíbulo da vagina no sexo feminino (DI DIO, 1999;
GARDNER, 1998).
A bexiga urinária masculina se diferencia em muito da feminina, devido à presença da
próstata, inferiormente, e das vesículas seminais e ductos deferentes, lateralmente. Já a bexiga
urinária feminina ao invés de se relacionar posteriormente com o reto, como faz a masculina,
relaciona-se com o útero. A uretra masculina também se diferencia da feminina em relação ao
seu comprimento, sendo a feminina menor medindo cerca de 4 cm, e a masculina maior e
variando seu comprimento entre 17,5 a 20 cm, sofrendo denominações específicas devido ao
órgão que atravessa. A porção da uretra masculina que atravessa a próstata denomina-se
uretra prostática; a porção da uretra que atravessa o soalho da pelve e músculo esfíncter
externo da bexiga denomina-se uretra membranácea e finalmente a porção da uretra que
penetra no bulbo do pênis, onde se encontra o corpo esponjoso do pênis, denomina-se uretra
esponjosa. Outra diferença da uretra masculina para a feminina, é que na primeira além de
servir como via para eliminação de urina, também serve como via para eliminação de gametas
espermatozóides (MOORE, 2007)
Anatomicamente também é muito importante a relação da porção final do sistema
digestório (ânus), com o pudendo feminino (óstio da vagina e óstio externo da uretra) para os
estudos das patologias urinárias, pois esta proximidade é uma das principais causas das
15
infecções urinárias do sexo feminino, devido à higienização feita de forma incorreta nestes
órgãos.
4.1.2- Aspectos fisiológicos
O rim desenvolve um papel exócrino, que é em si a formação de urina, ora mais, ora
menos diluída, e também desenvolve suas funções endócrinas, através de células secretoras
específicas, das quais muitas ainda não são bem definidas; contudo a função homeostática do
Meio interno, sendo a função principal do rim, é a efetuada pela formação de urina na unidade
funcional básica do rim que é o néfron, um conjunto de estruturas vasculares e renais que
visam à formação de urina de acordo com o papel homeostático do qual o rim está incumbido
(GUYTON, 2002).
Como descrito anteriormente, a unidade morfofuncional básica do rim é o néfron.
Toda a urina resulta da filtragem do sangue que passa por estes néfrons, no qual se calcula
que existam cerca de 6 a 12x10 5
néfrons. Isto não significa que todos são funcionantes,
variando justamente de acordo com a ritmicidade da função renal, existindo néfrons ativos e
de repouso, o que significa uma reserva funcional para o rim, que provavelmente serão
utilizados em uma situação de sobrecarga renal (AIRES, 1999)
A unidade nefrônica urinária está constituída por diferentes elementos que
desenvolvem também papeis funcionais diferentes na formação da urina. Esta se inicia pela
cápsula de Bowman, na qual existem duas lâminas ou membranas, uma parietal mais externa
e outra interna, da qual está separada por um espaço capsular, onde se acumula o filtrado
glomerular (GUYTON, 2002).
A camada interior se adere firmemente à estrutura capilar vascular, o glomérulo,
através da membrana basal, de modo que o endotélio vascular, o epitélio da cápsula e a
16
mesma membrana basal formam o glomérulo renal.
Este glomérulo renal se origina a partir da artéria renal, proveniente a artéria aorta
abdominal, de modo que após várias ramificações deste vaso, como descrevemos
anteriormente, forma-se a arteríola aferente, de diâmetro relativamente largo e de grande
quantidade de musculatura lisa desenvolvida, originando uma estrutura secretora denominada
de polkissen ou aparelho justa glomerular, sensível às variações de fluxo sanguíneo e uma das
estruturas responsáveis pela secreção de renina. Logo após esta arteríola se introduz a cápsula
de Bowman e dá lugar a uma profusa rede de capilares, de aspecto enovelado, os glomérulos
renais, que possui uma elevada pressão hidrostática nestes capilares glomerulares, cerca de 60
mm Hg, o que resulta na rápida velocidade de filtração, o que diferencia grandemente com a
pressão hidrostática da rede capilar peritubular, que varia em cerca de 13 mm Hg, o que
facilita grandemente na rápida absorção de líquidos (AIRES, 1999)
Assim como a maioria dos capilares, os capilares glomerulares são relativamente
impermeáveis às proteínas, de modo que o filtrado glomerular é essencialmente desprovido de
proteínas e de elementos celulares, inclusive eritrócitos, sendo assim, as concentrações do
filtrado glomerular presente nos túbulos do néfron, incluindo as moléculas orgânicas e os sais,
assemelham-se às concentrações encontradas no plasma sanguíneo. Na saída do glomérulo, ao
invés de formar uma vênula, esta rede forma uma outra arteríola denominada arteríola
eferente, de diâmetro relativamente menor que a aferente, também com musculatura lisa
desenvolvida, porém com propriedade de se contrair sob influência de substancias vaso-ativas
ou sobre ação do sistema nervoso.
Da arteríola eferente surgem capilares pós-glomerulares envolvendo o néfron, que
podem ser corticais ou justamedulares. No caso de néfrons corticais, os capilares pós
glomerulares vão se dispor de maneira a formar uma rede capilar peritubular, envolvendo os
túbulos contornado proximal e distal. Caso sejam néfrons justamedulares, os capilares
17
formaram os chamados vasa recta, que como o nome diz, são vasos que se dirigem
paralelamente aos túbulos contornados. Só depois deste trajeto é que estes capilares
organizam-se em vênulas, que se confluem formando o sistema venoso renal, chegando à veia
renal que se desemboca na veia cava inferior (GUYTON, 2002).
Como foi comentado acima, existe um sistema de túbulos que se formam a partir do
estreitamento da cápsula de Bowman na qual denominamos de túbulo contornado proximal e
túbulo contornado distal. O túbulo contornado proximal é um túbulo de formato irregular,
situado totalmente no córtex renal, formado por células cilíndricas e prismáticas, exibindo em
seu pólo apical microvilosidades, as bordas de escova, aumentando a área e superfície tubular,
e com isto aumentando também a sua capacidade absorção, pois além de possuírem células
epiteliais com grande quantidade de mitocôndrias para sustentar os vigorosos processos de
transporte ativo, também possuem nas bordas de escova moléculas protéicas transportadoras,
que possibilitam o mecanismo de co-transporte de sódio ligado a múltiplos nutrientes
orgânicos, por exemplo, os aminoácidos e a glicose, e o mecanismo de contra transporte, que
reabsorvem sódio dos túbulos renais e secretam na luz do túbulo íons de hidrogênio e de
potássio. Os túbulos contornados proximais fazem a reabsorção maciça do filtrado
glomerular, liberando para a porção descendente da alça de Henle 40 % do volume que
penetrou na cápsula de Bowman.
Este túbulo se aprofunda em direção a medula, terminando seu trajeto na porção
descendente da alça de Henle, um tubo em forma de “U”, que pode ter uma alça curta se esta
pertencer a um néfron cortical, ou uma alça mais profunda se esta pertencer a um néfron justa
medular, que neste ultimo caso pode ser tão profundo que a alça se aproxima da papila renal
(AIRES, 1999).
No ramo descendente da alça de Henle, a membrana é bastante permeável à água e aos
íons de sódio e cloro. Já o mesmo não ocorre com relação à membrana do ramo ascendente,
18
que é impermeável à água e, além disso, apresenta um sistema de transporte ativo que
promove um bombeamento constante de íons sódio do interior para o exterior da alça,
carregando consigo íons cloreto. Devido a estas características, enquanto o filtrado glomerular
flui através do ramo ascendente da alça de Henle, uma grande quantidade de íons sódio é
bombeada ativamente do interior para o exterior da alça, carregando consigo íons cloreto. Este
fenômeno provoca um acúmulo de íons de sódio e de cloro no interstício medular renal,
aumentando assim sua concentração, e com isto a sua osmolaridade também é aumentada,
quando comparada aos outros compartimentos corporais. Essa osmolaridade elevada faz com
que uma considerável quantidade de água constantemente flua do interior para o exterior do
ramo descendente da alça de Henle, enquanto que, ao mesmo tempo, os íons de sódio e de
cloro fluem em sentido contrário, no mesmo ramo. Sendo assim a função da porção
ascendente da alça de Henle está relacionada com a reabsorção de sais, diluindo assim o
fluído luminal, pois o epitélio é impermeável à água (GUYTON, 2002).
O ramo ascendente da alça de Henle se dirige ao córtex e dá origem ao túbulo
contornado distal, de localização exclusiva cortical, com células cilíndricas basais sem a
presença da borda de escovas encontradas nos túbulos contornados proximais, ou na nova
nomenclatura, porção convoluta do túbulo distal.
Nas células epiteliais do túbulo contornado distal, forma-se a mácula densa estrutura
também capaz de secretar renina, que por razões anatômicas, aproximam a sua localização ao
glomérulo, porém diferentemente do aparelho justaglomerular, a mácula densa é sensível às
reduções de sódio, de modo que ao chegar menos sódio pelo fluído tubular, esta condição
excitaria a secreção de renina nas células que interagem a mácula densa. A partir daí, mácula
densa e aparelho justa glomerular, formariam o chamado sistema justaglomerular,
responsáveis pela secreção de renina que, devido a sua ação peptidásica, permite a sua cisão
ao angiotensionogênio hepático, formando assim a Angiotensina I, que oferece efeitos cardio-
19
depressores fracos, talvez decorrentes do efeito que reduz o fluxo sanguíneo coronário, este
sim, um efeito vigoroso exercido pela Angiotensina I.
Porém sobre efeito do E.C. A (Enzima Conversora de Angiotensina) a Angiotensina I
transforma-se em Angiotensina II, de amplas ações fisiológicas como: ação vasoconstritora,
que é de grande importância sua ação sobre a arteríola eferente; ação estimulante direta na
reabsorção de sódio na célula tubular proximal e distal, significando assim retenção
isosmótica de água e aumento do volume de líquido extracelular; ação estimulante da
secreção de Aldosterona, (mineralocorticóide) na zona glomerular do córtex da glândula
supra–renal, que reforça fortemente o efeito anti-nautriurético do rim, principalmente no
túbulo contornado distal, excretando pela urina mais potássio e íons H+, decorrente da
excessiva troca de sódio por estes íons; ação sobre as células mesangiais do glomérulo, que
passa e contrai diminuindo a área de filtração glomerular e a taxa de filtração glomerular;
estimula a sensação de sede no hipotálamo (núcleo sub-fornicial).
Foi descrito que preparados de rins hidronefróticos, que permitem a visualização in
vivo da microcirculação renal, mostraram que a infusão de Angiotensina II exerce ação
constritora tanto nas arteríolas aferentes quanto nas eferentes, e que a perfusão in vitro dos
néfrons justamedulares demonstrou a ação preferencial deste agonista nas arteríolas aferentes.
Nos trabalhos realizados por Feitosa e Carvalho (2000), foram observados que estudos
prospectivos e randomizados demonstram que o uso dos inibidores da enzima conversora de
Angiotensina (IECA) reduzem, de forma significativa, a morbimortalidade tanto nas formas
assintomáticas, como principalmente, nas formas mais severas de disfunção ventricular
esquerda, pois com esta inibição diminui-se a liberação das catecolaminas nas terminações
nervosas simpáticas. Porém no sabe-se que a IECA inibe somente formação da Angiotensina
II circulante, porém há evidencias da produção autócrina e parácrina da angiotensina II nos
tecidos, o chamado sistema renina-Angiotensina tecidual, especialmente o muscular cardíaco,
20
e esta produção não é bloqueada. (AIRES, 1999).
5.- Exames da avaliação da função renal
5.1-Dismorfismo eritrocitário
Hematúria é definida na literatura como a eliminação de um número anormal de
hemácias na urina e, devido à sua complexidade, apresenta diversas propostas de
classificação. Quanto à sua localização, as hematúrias podem ser classificadas em
glomerulares, de origem nefrológica, ou não-glomerulares, de origem urológica. (KESSON,
1978).
Quanto à intensidade do sangramento, são identificadas como macroscópicas, quando
a coloração da urina sugere a presença de sangue, ou microscópicas, quando as hemácias são
detectadas somente pelos sedimentos copia urinária. Quanto à freqüência, podem se
apresentar de forma permanente presença constante de hemácias nas discussões na literatura
sobre a validade de sua investigação, bem como a adoção de uma propedêutica mais adequada
para a localização desses sangramentos (PENIDO, 1995).
A investigação de hematúria requer anamnese e exame físico detalhados, bem como
utilização de exames complementares adequados, sejam laboratoriais ou de imagem, evitando
procedimentos agressivos, onerosos e muitas vezes desnecessários.
A hemorragia glomerular é classicamente caracterizada pela presença de proteinúria
e cilindros hemáticos. Entretanto, nem todos os pacientes portadores de glomerulonefrite
apresentam tais alterações. Atualmente, têm-se valorizado outros achados na sedimentoscopia
urinária, principalmente aqueles baseados na morfologia das hemácias, indicando com maior
precisão o local do sangramento: se glomerular ou não-glomerular (BRICH, 1983).
Nessa revisão, os autores avaliam a validade do estudo do dismorfismo eritrocitário
pela análise da sedimentoscopia urinária, enfatizando principalmente a definição, a
fisiopatologia, os métodos e os valores de referência adotados na literatura.
21
(As limitações de seu uso e comparações com demais marcadores de hemorragia glomerular
também foram sedimento urinário), isolada (episódio único de hematúria), ou recorrente,
quando há períodos de remissão do episódio hematúrico, com intervalos variáveis de meses
até anos.
Finalmente, quanto à repercussão clínica, são referidas ainda como sintomáticas ou
assintomáticas (BASTOS, 1998). As hematúrias isoladas e assintomáticas merecem especial
atenção pela freqüência cada vez maior entre os diagnósticos clínicos, causando grande
ansiedade no paciente e em seus familiares. Na prática diária, elas aparecem como a segunda
causa de consultas nefrológicas entre crianças e adolescentes. Vehaskari et a (1979)
encontraram prevalência entre 0,5% e 4% em crianças.
Nos adultos, foi de 20%, segundo estudos de Messing et al. (1995). Outros autores
encontraram prevalência de hematúria microscópica assintomática, na população geral, entre
0,5% e 22%, dependendo da idade da população estudada e do número de hemácias
considerado normal.
O achado de hemácias na urina ocorre freqüentemente de maneira ocasional,
principalmente quando se utiliza o exame físico-químico por fitas reagentes para detecção de
hemácias (hemoglobina) em exames de rotina. No entanto, isso não traduz necessariamente
um estado de doença. (BASTOS, 1998).
No final da década de 1970, Birch e Fairley (1979), analisando o sedimento urinário
em microscopia de contraste de fase, demonstraram uma possibilidade de distinção entre
hematúrias glomerulares e não-glomerulares, baseando-se não apenas no encontro de
proteinúria e cilindrúria, mas também na diferenciação morfológica das diversas populações
de hemácia na urina. Segundo esses autores, a hematúria não-glomerular caracterizar-se-ia por
hemácias urinárias isomórficas, com tamanho uniforme e morfologia semelhante às
encontradas na circulação sangüínea. Por outro lado, na hematúria glomerular, as hemácias se
22
apresentariam dismórficas, com alterações em forma, cor, volume e conteúdo de
hemoglobina, podendo-se encontrar diversas projeções em suas membranas celulares, bem
como heterogeneidade citoplasmática e forma bicôncava ou esférica.
5.1.1- Fisiopatologia da Hematúria
Muitos estudos tentaram explicar o mecanismo de surgimento de eritrócitos na urina,
com destaque para a lesão glomerular e as alterações na permeabilidade dos túbulos, ductos e
trato urinário restante. Geralmente, quando não-glomerulares, também chamadas de pósglomerulares ou extra glomerulares, as hemácias são provenientes dos túbulos, ductos ou de
todo o trato urinário restante, apresentando-se na forma isomórfica. (KESSON, 1978)
Quando se originam nos glomérulos, também chamadas de hemorragias glomerulares,
as hemácias variam em forma, dimensão e conteúdo de hemoglobina, apresentando-se
dismórficas (FASSET, 1982). Entretanto, há mais de duas décadas a literatura vem
procurando explicações para as alterações dismórficas dos eritrócitos de origem glomerular.
Inicialmente, procuraram-se explicações com base na lesão osmótica e química dos
eritrócitos.
Essa teoria fundamentava-se em danos na membrana celular das hemácias e na perda
de hemoglobina ao tramitarem pelos diversos segmentos do néfron, juntamente com
constantes mudanças de soluções de diversas concentrações iônicas e osmolaridades (JONES
1991).
Posteriormente, sugeriu-se ser o traumatismo mecânico o possível causador do
dismorfismo (KUBOTA, 1988). Ao atravessarem a membrana basal glomerular pelos hiatos
existentes entre seus capilares, os eritrócitos urinários sofreriam uma compressão importante,
com conseqüente deformação de sua membrana celular e redução de volume. Essas alterações
23
foram reproduzidas por Kubota et al. (1988), fazendo ensaios em que hemácias atravessavam
poros de 3µm sob pressão.
A liberação de mediadores químicos e de enzimas digestivas, após lesão celular, na
vigência de quadros infecciosos ou de processos inflamatórios glomerulares e as
eritrofagocitoses, pelas células tubulares renais, também foram apontadas como possíveis
fatores de deformidade das hemácias. Embora a teoria mecânica venha sendo mais aceita
atualmente na literatura, seria mais prudente acreditar na miscelânea de todos os fatores acima
como determinantes das alterações do dismorfismo eritrocitário (KINCAID-SMITH, 1982)
5.1.2- Fatores pré-analíticos e coleta urinária
Devido à importância de se realizar uma coleta adequada para garantir a
representatividade da amostra, vários estudos na literatura relacionaram alguns fatores préanalíticos capazes de interferir na avaliação do dismorfismo eritrocitário.
Após assepsia da região genital, coletar preferencialmente o jato médio da primeira
urina da manhã, ou de qualquer outra hora, desde que se respeite estase vesical de pelo menos
2 a 4 horas. Alguns autores relatam uma preferência pela primeira urina da manhã, que, por
ser mais ácida e mais concentrada, preservaria os cilindros, os elementos celulares e todos os
demais componentes do sedimento urinário. Forçar a diurese por ingestão de grande
quantidade de líquido não é aconselhado, segundo trabalho de Schuetz et al. (1985), pois as
hemácias seriam facilmente lisadas em urinas diluídas (densidade < 1.006). Embora não seja
critério de exclusão, a prática de exercícios físicos intensos prévios à coleta também seria
desaconselhada por alguns autores, pois a relação entre exercício físico e hematúria, descrita
por Collier desde 1907 (citado por Kesson et al. (30)), é confirmada por vários estudos na
24
literatura. Em casos de períodos menstruais ou trauma do trato urinário, sugere-se aguardar
alguns dias para a realização do exame (PENIDO, 1995).
Ainda se discute se o tempo entre a coleta da amostra e a realização do ensaio
laboratorial seria capaz de alterar a morfologia das hemácias. Stapleton et al. (1987)
aconselharam a realização do teste no máximo até 60 minutos após a coleta. Por outro lado,
existem trabalhos, como o de Rizzoni et al. (1983), que não encontraram mudanças nos
padrões dismórficos dos eritrócitos relacionadas com o horário da coleta e o tempo entre esta
e a análise. Mohammad et al. (1993), avaliando lâminas a fresco após 16 horas e lâminas
fixadas após 12 dias, observaram que a proporção de células dismórficas se manteve
inalterada.
Embora controverso, recomenda-se um tempo máximo de 2 a 4 horas entre a coleta e o
exame urinário, para não ocorrer interferência por alcalinização, proliferação bacteriana ou
outros fatores que possam alterar a morfologia das hemácias (PENIDO, 1995).
5.1.3- Método laboratorial
A microscopia por contraste de fase parece ser o melhor método de análise do
sedimento urinário, principalmente para o estudo do dismorfismo eritrocitário, dispensando o
uso de colorações especiais (TOMITA, 1992). As etapas de sua realização mostram-se
semelhantes entre as várias metodologias empregadas em trabalhos da literatura(ZAMAN et
al, 2000). Após a coleta, centrifugam-se 10ml de urina durante 5-10 minutos, numa
velocidade de 400g ou a 1.500rpm. Posteriormente, removem-se 9,5ml do líquido
sobrenadante gentilmente ressuspende-se o sedimento naquele 0,5ml de urina restante, de
onde se retira pequena alíquota para exame microscópico. Nessa alíquota identificam-se as
25
populações celulares, sendo necessária análise de pelo menos cem eritrócitos para avaliação
do dismorfismo (COHEN, 2003)
5.1.4- Valores de referência
Os valores laboratoriais utilizados para a definição de hematúria ainda são
controversos. Alguns autores consideram hematúria a presença de cinco ou mais hemácias por
campo microscópico de grande aumento (400x), após centrifugação da amostra urinária, em
pelo menos dois exames de urina distintos. Outros consideram hematúria um número superior
a dez hemácias por campo 400x. Existem trabalhos que preferem avaliar a presença de
hemácias por mililitro (ml) de urina após centrifugação, considerando hematúria valores
acima de 8 mil hemácias/ml de urina e hematúria macroscópica >106 hemácias/ml de
urina.(BASTOS 1998).
Habitualmente, o valor de 5 mil hemácias/ml de urina vem sendo adotado como limite
superior da normalidade por muitos laboratórios.
Na definição de dismorfismo eritrocitário, Birch e Fairley (1979) consideraram o
limite para caracterização de hemorragia glomerular a presença de quatro ou mais diferentes
populações de hemácias. Mesmo não definindo um valor percentual de dismorfismo limítrofe
de normalidade, esses autores já haviam observado que, quanto maior fosse esse percentual,
maior seria a probabilidade de lesão glomerular.
Vários trabalhos procuraram determinar esse valor de referência: alguns autores
adotam a presença de, no mínimo, 20% de dismorfismo como indicativo de hematúria
glomerular, tanto para crianças quanto para adultos. Outros encontraram bons resultados
utilizando um limite de 10%. Entretanto, outros artigos, como o de De Santo et al. (1987),
visando a aumentar a sensibilidade do teste, propõem elevação do valor de corte para 80%, o
26
mesmo recomendado pela Associação Americana de Urologia. Diante do exposto, fica claro
que ainda não existe um consenso na literatura sobre qual porcentagem de dismorfismo
eritrocitário deve ser adotada e se deve ser adotado algum percentual para definir hematúria
glomerular.(DINDA, 1997).
Quanto ao valor limítrofe para o encontro de acantócitos, Kohler et al. (1991)
relataram especificidade de 98% e sensibilidade de 52% para hematúria glomerular,
Considerando uma presença de pelo menos > 5% na urina. Recentemente, Catala et al (2002),
adotando esse mesmo limite, também evidenciaram bom resultados, com sensibilidade de
88% e especificidade de 100%. Para as células G1, os estudos iniciais de Tomita et al. (1992)
obtiveram sensibilidade de 89% e especificidade de 95% para lesão glomerular, considerando
o limite de > 1%. Kitamoto et al. (1993) e Lettgen e Wohlmuth (1995), propondo limite >
5%, obtiveram 100% de especificidade. Embora exista uma variação de 1% a 35% para o
limite de normalidade a maioria dos autores prefere adotar o valor de ≥ 5% de acantócitos ou
de células G1 como referência para caracterização da hematúria de origem glomerular,
obtendo melhores resultados em relação ao percentual de 80% de dismorfismo adotado por
estudos simpatizantes ao de Birch e Fairley (1979)
5.2-. Depuração de creatinina
A capacidade de filtração glomerular é a avaliada pela depuração de uma
substância. Essa função exprime o volume de plasma que passa pelos glomérulos, tornando-o
isento dessa substância, por unidade de tempo. Ela é expressa pelas unidades de volume (ml)
e tempo (minuto).
A creatinina não possui todas as características para ser considerada substância ideal
para a avaliação da filtração glomerular, mas apresenta algumas qualidades, como a de ser
27
uma substância endógena, não precisando ser infundida. Sua concentração plasmática é
constante. Possui uma estabilidade plasmática e urinária.
Habitualmente, considera-se de 70 a 120 mL/minuto/1,73m² o intervalo de
referência.(ANDRIOLO, 2006).
5.3-Microalbuminúria
A albumina é excretada na urina em quantidade contínua, e encontra-se aumentada em
alguns pacientes com diabetes mellitus. Foi verificado que, nesses pacientes, existe um
período latente entre o início da lesão renal e a doença renal manifesta. Durante essa fase, a
lesão glomerular se expressa por meio da excreção aumentada da albumina. Entretanto, essas
quantidades são muito pequenas para serem detectadas pelos testes laboratoriais padrões e
mesmo
nas
investigações
de
proteinúria
nas
24
horas.
Por
isso,
a
imunoturbidimetria/nefelometria, método mais sensível, é preferível para proceder à
investigação, visto que os testes tradicionais só resultam positivos em níveis de 150 a
200mg/L.
A microalbuminúria pode ser definida como uma persistente elevação da albumina
urinária, acima de 20 µg por minuto. Aparece antes da manifestação clínica da proteinúria,
detectável pelos métodos tradicionais, e tem se mostrado um marcador preditivo do aumento
de falência renal e mortalidade precoce dos pacientes diabéticos, em muitos e diferentes
estudos detalhados e rigorosos.
Estudos relatam a manifestação da microalbuminúria 5 anos antes da manifestação
clínica clássica do quadro de diabetes mellitus. Outros sugerem sua utilização na monitoração
do aparecimento de lesão renal em pacientes com hipertensão, lúpus eritematoso sistêmico e
durante a gravidez nas suspeitas de quadros de pré-eclâmpsia. (ONER, 1991)
28
A excreção de albumina é mais alta em fumantes do que em não-fumantes e diminui
30-50% durante a noite, possivelmente devido à pressão sangüínea e a taxas de filtração
glomerular mais baixas à noite.
Devem ser dosadas, no mínimo, 3 amostras em datas variadas no período de 1 mês, e
pelo menos 2 devem ser positivas para a confirmação do diagnóstico de microalbuminúria. A
coleta de múltiplas amostras se faz necessária, visto que a excreção pode variar de um dia
para o outro. A variação biológica entre as amostras, durante um período de 1 mês, segundo a
literatura, pode ser de 20 a 40%.
Fatores interferentes incluem exercício, infecção urinária, doença aguda e qualquer
outro fator que leve a resultados falso-positivos de proteína na urina. Alguns autores sugerem
que a coleta deve ser realizada à noite (urina nas 12 horas noturnas) para que ocorra em
repouso, evitando a interferência do exercício nos valores da albumina urinária.
A presença de microalbuminúria identifica os pacientes com maior risco de
desenvolvimento de nefropatia diabética. A incidência de nefropatia diabética é de
aproximadamente 30% para pacientes com diabetes mellitus insulino-dependente (DMID) e
varia entre 25% e 60% entre pacientes com diabetes mellitus Tipo II não-insulino-dependente
(RAMAN, 1996).
Pacientes com DMID, a microalbuminúria prediz o desenvolvimento de proteinúria
persistente em 80% e grave lesão renal subseqüente. Em contraste, a maioria dos pacientes
com excreção de albumina urinária menor do que 30 mg/dia permanece saudável. O risco de
progressão para doença renal em pacientes com microalbuminúria é 20 vezes mais alto do que
nos pacientes com excreção normal.
A hipertensão é o principal fator preditivo para o desenvolvimento de
microalbuminúria. Recentes estudos acompanharam pacientes que cursavam com
microalbuminúria, hipertensão, resistência periférica à insulina e hipertrofia renal e cardíaca.
29
O risco de macroalbuminúria (>300 mg/24 h) e de declínio da taxa de filtração glomerular é
de 80% em 10 anos, em comparação aos 5% de risco desse tipo de evolução verificados nos
pacientes que cursam com normoalbuminúria. Já nos pacientes diabéticos com
microalbuminúria, normotensos ou em tratamento precoce com anti-hipertensivos com
inibidores da enzima angiotensina convertase, observa-se um retardo no início da
macroalbuminúria e na diminuição da taxa de filtração glomerular.
5.4- Avaliação laboratorial da nefrolitíase
Litíase renal é uma doença manifestada pela formação de cálculo renal. A presença de
cálculos nos rins, ureteres ou bexiga, além de causar forte dor pode infringir sérios danos
teciduais. Cálculos são precipitações como agregados de vários componentes de baixa
solubilidade normais da urina. Podem ser formadas pela combinação de bactérias, células
epiteliais, sais minerais em uma matriz protéica e muco.
Muitas vezes a precipitação de compostos relativamente insolúveis é iniciada ou
agravada por infecção, desidratação, excessiva ingestão ou produção de compostos, obstrução
urinária e outros fatores. A maioria dos cálculos consiste de oxalato de cálcio (30 % do total),
fosfato de cálcio (10% do total) ou numa mistura deles (25% do total). O fosfato amônio magnesiano contribui com 25 por cento de todos os cálculos, sendo que o ácido úrico com 5
por cento e a cistina com 2 por cento.
Uma vez formado, o cálculo tende a crescer por agregação, a menos que seja
desalojado e desça através do trato urinário para ser excretado. Os cálculos maiores podem
permanecer no rim ou obstruir um ureter do qual deve ser removido por cirurgia.(ÂNGULO,
1999).
30
A passagem de cálculo para baixo dos ureteres produz dor excruciante aguda do tipo
em cólica, localizada no flanco e irradiando-se para a virilha. A hematúria macroscópica é um
achado urinário comum quando os sintomas de cálculos estão presentes. Se os cálculos
obstruírem a pelve renal ou o ureter, resultará em hidronefrose.
Várias investigações mostraram que uma matriz orgânica parece ser componente
essencial a todos os cálculos urinários. Esta matriz mucóide contém 69 por cento de proteínas,
14 por cento de carboidratos, 12 por cento de componentes inorgânicos e 10 por cento de
água. O precursor da matriz é uma proteína encontrada em pequenas quantidades na urina
humana, a uromucóide. O mecanismo exato de como a uromucóide é transformada em matriz
e como agrega compostos orgânicos e inorgânicos para a formação do cálculo, é
desconhecido. Certas deficiências nutricionais e vários estados patológicas parecem
desencadear este mecanismo. A recorrência de cálculos provavelmente envolve muitos
fatores, tais como Ingestão reduzida de líquidos (fluxo de urina), excreção de quantidades
excessivas de substâncias relativamente insolúveis (cálcio, ácido úrico, cistina ou xantina),
ausência de uma substância na urina,que sob condições normais inibe a precipitação de alguns
destes compostos insolúveis. Vários tipos de cálculos estão associados com desordens
específicas. São conhecidos vários tipos de cálculos segundo a composição:
5.4.1- Oxalato de cálcio
São provocados por urina concentrada, hipercalciúria, intoxicação pela vitamina D,
hiperparatireoidismo, sarcoidose), síndrome do leite-álcali, câncer, osteoporose, acidose
tubular renal, hipocitratúria, hiperuricosúria e hiperoxalúria.
5.4.2- Fosfato de cálcio
31
Ocorrem em urinas alcalinas na acidose tubular renal, ingestão de álcalis e infecção
por bactérias desdobradoras de uréia (ex.: Proteus).
5.4.3- Fosfato de amônio-magnésio (estruvita)
As infecções do trato urinário tratados com vários antibióticos são as principias
causas de formação de cálculos fosfato amônio -magnésio.
5.4.4- Ácido úrico
Estão associados à hiperuricosúria (hiperuricemia, gota, dieta rica em purinas),
desidratação e hiperacidez urinária (pH < 5,0).
5.4.5-Cistina.
São encontrados na hipercistinúria e formam-s e em pacientes com deficiência inata de
transporte de cistina pelas células dos túbulos renais.
5.4.6- Testes Laboratoriais urinários na Investigação da Formação De Cálculos
Exame qualitativo de urina (EQU) onde é comum o a presença de hematúria
macroscópica, pesquisa de cistina e urocultura. Dosagens em urina de 24 h de: sódio, cálcio,
fósforo, ácido úrico, oxalatos e depuração de creatinina. pH urinário é útil, pois urinas ácidas
tendem a favorecer a formação de cálculos de ácido úrico enquanto urinas alcalinas dissolveos. De modo oposto, os cálculos fosfato amônio–magnésio ocorrem em pacientes com
infecções recorrentes do trato urinário ou com urinas alcalinas persistentes.
32
6.- Resultados e Discussão
Os resultados são uma analise de dados de janeiro, fevereiro e março de 2008 de exames
realizados no Laboratório de Nefrologia do Hospital das Clinicas da Faculdade de Medicina
de Ribeirão Preto-USP.
450
393
400
421
350
exames
300
254
250
200
150
100
50
0
janeiro
f evereiro
março
Série1
Gráfico I – Quantidade de exames realizados no laboratório de nefrologia
33
total de exames(janeiro, fevereiro e março)
analise do calculo renal
clearence de creatinina
7
clearence de fosforo
23
20
84
7
creatinina liq.
7
creatinina urina
dismorfismo urinariio
272
9
fena
73
glicose liq.
microalbuminuria
67
2
10
32
56
osmolalidade diversos
osmolalidade serica
osmolalidade urinaria
ph urinario
81
284
3
31
potassio liq.
potassio urinario
sodio liq.
sodio urinario
Gráfico II - Quais exames realizados no laboratório de nefrologia
34
clearence de creatinina
120
99
101
f evereiro
março
100
80
72
60
40
20
0
janeiro
Gráfico III – valores referentes aos exames de Clearence de Creatinina
35
microalbuminuria
140
124
120
97
exam es
100
80
63
60
40
20
0
janeiro
fevereiro
março
Gráfico IV – valores referente aos exames de Microalbuminúria
36
exam es externos
2
ribeirao preto
barrinha
2
cassia dos coqueiros
7
serra azul
serrana
1
0
cajuru
1
Gráfico V – valores de exames realizados para fora do HC
37
ocorrencias
aparelho quebrado
4
exame não realizado no
soro
1
6
1
material mal colhido
5
solicitamos novo
material
2
8
não recebemos este
material
falta reativo
0
2
4
6
8
Gráfico VI – referente a ocorrências no laboratório de nefrologia
38
7- CONCUSÃO
Com este trabalho conclui-se que o Laboratório de Nefrologia do Hospital das Clinicas
da Faculdade de Medicina de Ribeirão Preto-USP tem uma demanda crescente, e que no
mesmo são realizados exames de grande importância para a complementação diagnostica,
principalmente pelo fato deste órgão institucional terciário ser de referencia nacional na área
de nefrologia.
39
8.- Referências Bibliográficas
1- AIRES, MARGARIDA DE MELLO. Fisiologia 3° ed. Guanabara koogan, 1999.
2- ANDRIOLO, A. Medicina Laboratorial. 1° ed. Manole 2006
3- ANGULO, J. C. et al. The value of comparative volumetric analysisof urinary and blood
erythrocytes to localize the source of hematuria. J Urol, v. 162, p. 119-26, 1999.
4-- BASTOS, M. G.; MARTINS, G. A.; PAULA, R. B. Diagnóstico diferencial na
hematúria. J Bras Nefrol, v. 20, p. 425-40,1998.
5- BIRCH, D. F.; FAIRLEY, K. F. Hematúria: glomerular or nonglomerular?
Lancet, v. 2, p. 845-6, 1979
6- CATALA, J. L. L.; FABREGAS, M. B. Acanthocyturia is more efficient in to
differentiate glomerular from non-glomerular hematuria then dysmorphic erythrocytes. Arch
Esp Urol, v. 55, p. 164-6, 2002
7- COHEN, R. A.; BROWN, R. S. Microscopic hematuria. N Engl J Med, v. 348, p. 2330-8,
2003.
8- DANGELO E FATTINI. Anatomia 3° ed Atheneu 2006
40
9- - DE SANTO, N. G. et al. Phase contrast microscopy of the urine sediment for the
diagnosis of glomerular and nonglomerular bleeding-data in children and adults with normal
creatinine clearance. Nephron, v. 45, p. 35-9, 1987
10- DI DIO, J. A. Tratado de anatomia sistêmica aplicada. 2° ed. Atheneu 1999.
11 - DINDA, A. K. et al. Diagnosis of glomerular haematuria: role of dysmorphic red cell, G1
cell and bright-field microscopy. Scand J Clin Lab Invest, v. 57, p. 203-8, 1997.
12- -FASSET, R. G. et al. Detection of glomerular bleeding by phasecontrast microscopy.
Lancet, v. 1, p. 1432-4, 1982.
13- GARDNER, G. Anatomia. 4° ed. Guanabara koogan, 1998
14- GUYTON, A. C. Tratado de fisiologia Médica. 10° ed. Guanabara koogan, 2002
15- JONES, B. F. Urine osmolality and urinary red cell morphology.Nephron, v. 59, p. 157,
1991.
16- KESSON, A. M. et al. Microscopic examination of urine. Lancet,v. 14, p. 809-12, 1978.
17- KITAMOTO, Y. et al. Differentiation of hematuria using a uniquelyshaped red cells.
Nephron, v. 64, p. 32-6, 1993
41
18- KINCAID-SMITH, P. Haematuria and exercise-related haematuria. Br Med J, v. 285, p.
1595-6, 1982.
19 - KOHLER, H. et al. Acanthocyturia: a characteristic marker for glomerular bleeding.
Kidney International, v. 40, p. 115-20, haematuria in children. Pediatr Nephrol, v. 9, p. 4357, 1995.
20- KUBOTA, H. et al. Mechanism of urinary erythrocyte deformity in patients with
glomerular disease. Nephron, v. 48, p. 338-9, 1988.
21- LETTGEN, B.; WOHLMUTH, A. Validity of G1-cells in the differentiation between
glomerular and non-glomerular
22- MESSING, E. M. et al. Hematuria home screening: repeat testing results. J Urol, v. 154,
p. 57-61, 1995.
23- - MOORE, K. L. Anatomia orientada para clínica. 5° ed. Guanabara koogan, 2007.
24- ONER, A. et al. Identification of the source of haematuria by automated measurement of
mean corpuscular volume of urinary red cells. Pediatr Nephrol, v. 5, p. 54-5, 1991.
25- PENIDO, M. G. M. G. Estudo da excreção urinária de cálcio, ácido úrico e citrato em
pré-escolares, escolares e adolescentes utilizando-se amostras colhidas em 24 horas, em
tempodeterminado e em micção matinal única com e sem jejum. 1995. Tese (doutoramento) –
Faculdade de Medicina, Universidade Federal de Minas Gerais, Belo Horizonte
42
26- RAMAN, G. V. et al. A blind controlled trial of phase-contrastby two observers for
evaluation the source of haematuria. Nephron, v. 44, p.304-8, 1996.
27 -RIZZONI, G. et al. Evaluation of glomerular and nonglomerular hematúria by phasecontrast microscopy. J Pediatr, v. 103, p.370-4, 1983.
28- SCHUETZ, E. et al. Effect of diuresis on urinary erythrocyte morphology in
glomerulonephritis. Klin Wschr, v. 63, p.575-7, 1985.
29- STAPLETON, F. B. Morphology of urinary red blood cells: a simple guide in localizing
the site of hematuria. Pediatr Clin North Am, v. 34, p. 561-9, 1987.
30- TOMITA, M. et al. A new morphological classification of urinary er ythrocytes for
differential diagnosis of glomerular hematuria. Clin Nephron, v. 37, p. 84-9, 1992.
31- VEHASKARI, V. M. et al. Microscopic hematuria in school children: epidemiology and
clinic-pathologic evaluation. J Pediatr, v. 95,p. 676-84, 1979.
32- ZAMAN, Z.; PROESMANS, W. Dysmorphic erythrocytes and G1 cells as markers of
glomerular hematuria. Pediatr Nephrol,
v. 14, p. 980-4, 2000.
43