Apostila de Física 06 – Calorimetria
1.0 Introdução
Calorimetria é a parte da Termologia que estuda fenômenos relacionados ao
calor.
O movimento dos átomos ou dos grupamentos atômicos gera a energia térmica,
que está relacionada à temperatura, radiação e ao calor.
Quando um corpo ganha ou perde energia térmica, são os movimentos dos
grupamentos atômicos/átomos que se movimentam com mais ou menos intensidade.
A energia térmica que passa de um corpo ao outro se chama calor (Q). Como as
pessoas associam massa ao peso, elas também confundem temperatura com calor. Um
corpo não tem mais calor que o outro, pois calor é uma forma de transferência de
energia sem transporte de massa.
Calor é um tipo de onda eletromagnética infravermelha, levando alguns
pesadores a classificá-la como uma subdivisão da energia radiante.
2.0 Tipos
2.1 Calor Sensível
O calor necessário para variar a temperatura de um corpo. É expresso por essas
equações:
Q m.c. T
Q C. T
Em que m é a massa, c é o calor específico, C é a capacidade térmica e
variação de temperatura.
Téa
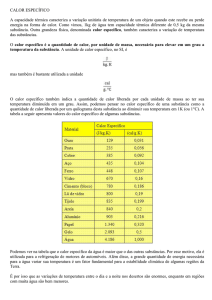
2.1.1 Calor Específico (c)
O calor específico é uma característica da substância, que está relacionada à
quantidade de calor por 1g de substância que consegue variar 1ºC na temperatura do
corpo. Ela é expressa por estas fórmulas:
c
C
m
Em que Q é o calor, m é a massa e
c
Q
T
m
c
Q
Tm
T é a variação de temperatura.
2.1.2 Capacidade Térmica (C)
A capacidade térmica é uma característica do corpo, que está relacionada à
quantidade de calor para variar 1°C na temperatura do corpo. Ela é representada por
essas fórmulas:
C
Q
T
C
m.c
Em que C é a capacidade térmica, Q é o calor, e
temperatura.
T é a variação de
2.2 Calor Latente
Determina a variação na estrutura física do corpo (quando varia o estado físico
do corpo). Ela é expressa por esta equação:
Q
m.L
Em que m é a massa e L é a constante calor latente.
3.0 Transferência de Calor
Quando dois corpos de temperaturas diferentes estão em contato em um sistema
isolado, eles tendem a atingir a mesma temperatura. Quem estiver com mais
temperatura irá “doar” esta energia para o outro corpo. Na forma algébrica, esta energia
cedida teria um saldo negativo, pois a temperatura iria do maior para o menor. Por causa
disso, a soma das quantidades de calor cedidas e recebidas deverá ser nula. Qualquer
resultado diferente indicará perda ou ganho de energia, o que contraria este princípio.
QC
QR
0
QC
QR
OBS.: A SEGUNDA EQUAÇÃO SÓ PODERÁ SER APLICADA SE AS QUANTIDADES DE
CALOR ESTEJAM EM FORMA DE MÓDULO.
4.0 Transmissão de Calor
É como o calor vai ser transferido de um corpo ao outro. Se o calor fosse um
ônibus, as transmissões de calor seriam as estradas, auto-estradas ou estradas de barro.
Existem três formas de transmissão de calor: Condução, Convecção
Radiação/Irradiação.
4.1 Condução
Ele ocorre somente em corpos sólidos. Ele é o único que possui expressão
matemática:
k .a. T
d
Q
t
Q
t
k .a. T
m.c
OU
d
t
d
k .a
d
m
V
Em que é o fluxo de calor, k é a condutividade térmica do material (uma
constante), a é a área do material, T é a variação de temperatura, t é a variação do
tempo, Q é o calor, d é a densidade, m é a massa, V é o volume e c é o calor específico.
4.2 Convecção
É um processo de transmissão de calor que ocorre apenas por fluídos (líquido de
gases).
4.3 Radiação/Irradiação
É o processo mais importante de propagação de calor, pois é por radiação que o
Sol emite o calor. Sua propagação é feita por ondas eletromagnéticas infravermelhas e
também ocorre no vácuo.
5.0 Observações Gerais
Observar quais medidas são usadas; o calor é medido em Joule ou em caloria, e
a densidade pode ser kg/m³ ou g/cm³.
1cal = 4,18J, ou 4J aproximadamente.
1m³ = 1.000L.
Não confundir C com c.
Não confundir T com t.
Entenda que T significa a subtração entre a temperatura final e a temperatura
inicial ( T TF TO ), e a temperatura final será a temperatura de equilíbrio térmico.
Num cálculo de transferência de calor em que o corpo muda de estado físico,
observar o calor latente e a temperatura final para que o corpo mude de estado físico, ou
seja, os pontos de fusão e ebulição. Por exemplo: se que eu quero aquecer uma pedra de
gelo à -10°C para 200°C, ele terá que, primeiro, aumentar a temperatura para 0°, mudar
de estado físico, aumentar de novo para 100°C, mudar de estado físico e, finalmente,
variar de 100°C para 200°C.
Muitos livros chamam a constante do calor latente (L) somente de calor latente.