Abundância
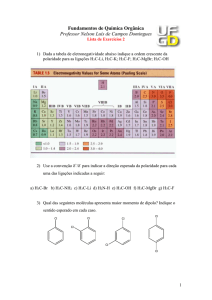
Propriedades Atômicas
Isótopos do hidrogênio
• É o átomo mais simples, formado apenas por 2 partículas
subatômicas: 1 próton e 1 elétron
• Configuração eletrônica: 1s1
• Existem três isótopos para o hidrogênio: Prótio 11H, deutério
2 H, e trítio 3 H.
1
1
Propriedades físicas
Nome
Símbolo
Massa molar,
Abundância*,
radioativo
•A abundância é a fração de átomos de cada isótopo, expressa em porcentagem.
Ponto de
Fusão, oC
Ponto de
Ebulição, oC
Densidade,
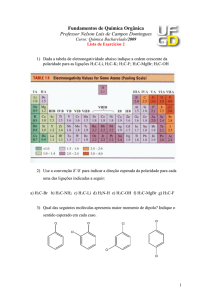
Propriedades Atômicas
Isótopos do hidrogênio
• T é radioativo com uma meia-vida de 12,3 anos que decai pela
perda de uma partícula e forma um isótopo do He.
• D e T são substituídos por H em compostos para fornecer um
marcador molecular. Por exemplo D2O.
• Apresentam mesmas propriedades químicas mas velocidades
de reação e constants de equilíbrio são diferentes.
Propriedades físicas
Nome
Símbolo
Massa molar,
Abundância*,
radioativo
•A abundância é a fração de átomos de cada isótopo, expressa em porcentagem.
Ponto de
Fusão, oC
Ponto de
Ebulição, oC
Densidade,
Posição na Tabela Periódica
•
•
é único.
tem uma configuração eletrônica 1s1, logo, ele é colocado acima
do Li na tabela periódica.
• é significativamente menos reativo do que os metais alcalinos.
1
H
Não é metal pois existe na forma de molécula diatômica H2.
Posição na Tabela Periódica
• pode ganhar um elétron para formar H-, o qual tem a configuração eletrônica
do He. Conseqüentemente, o H poderia ser colocado acima dos halogênios.
• Forma elementar a 25oC, 1 atm:
inodoro
H2
Gás insípido, incolor e
17
H
A afinidade eletrônica do H é mais baixa do que qualquer halogênio
Forma H- apenas com poucos metais altamente eletropositivos
Posição na Tabela Periódica
• Nível mais externo semi-preenchido
• Semelhanças no comportamento químico de LiH e LiMe, C-H, SiH4 e
CH3SiH3
• Poderia ser colocado acima do Grupo do carbono (grupo 14)
14
H
Mas ainda assim não reflete suas propriedades
químicas e físicas
Posição na Tabela Periódica
H
Posição na Tabela Periódica
orto- e para- Hidrogênio
• Molécula de H2
• O núcleo do átomo pode apresentar spin nuclear
• Diferenças nas energias internas resultam em diferentes
propriedades físicas (PE, calor específico, condutividade
térmica)
• Forma para-hidrogênio é a espécie de menor energia
• 0 absoluto = 100% nessa forma
• Altas temperatura contém cerca de 75% de orto-hidrogênio
orto- hidrogênio
Spins paralelos
para- hidrogênio
Spins opostos
H2 – apolar, com baixa polarizabilidade, dipolo elétrico instantâneo muito pequeno
(baixa força de atração de London)
Condensa somente a 20K (-253 oC)
Baixa solubilidade na maioria dos
líquidos, principalmente polares
Recordando....
Polarizabilidade
É a distorção da nuvem eletrônica de átomos e íons ocasionada
pela atração exercida pela proximidade de outro um núcleo.
Eletronegatividade
É o poder de atração dos elétrons por um átomo quando este é parte de uma
ligação.
H2 – apolar, com baixa polarizabilidade, dipolo elétrico instantâneo muito
pequeno (baixa força de atração de London)
Condensa somente a 20K (-253 oC)
Na forma líquida, tem baixíssima densidade: 0,07 g.cm-3 (distanciamento
entre as moléculas mesmo no estado líquido).
Essa característica faz do H2 um excelente candidato
a combustível (levíssimo).
Além de possuir a maior entalpia de combustão por grama dentre
todos os combustíveis conhecidos!
Massa Molar (g)
Hco (KJ.mol-1.g-1)
78
12
36
26
180
2
16
114
44
60
- 41,8
- 32,8
- 38,8
- 50,0
-15,6
- 143
- 55,6
- 48,0
- 50,4
- 10,5
• Pouco reativo em condições normais devido a cinética
• Unidos por ligação muito forte (energia de ligação 436 kJmol-1)
• Reações requerem elevada temperatura ou catalisadores (metais de
transição)
• Ex: processo Haber para obtenção de NH3, hidrogenação de
compostos orgânicos insaturados, fabricação de metanol pela
redução do CO
Métodos de Obtenção
Há pouco H2 livre na atmosfera, já que estas moléculas se movem com
grande velocidade e escapam da gravidade.
São necessários átomos mais pesados para ancorar os átomos de
Hidrogênio no planeta, na forma de compostos, como a água e
hidrocarbonetos.
Para empregos industriais, é necessário extraí-lo dos seus compostos.
• Subproduto do Refino de Petróleo
CH4 (g) + H2O (g) Ni CO (g) + 3 H2 (g)
1000oC
C (s) + H2O (g) CO (g) + H2 (g)
Fe
CO (g) + H2O (g)
CO2 (g) + H2 (g)
Reforma a vapor
Reação do gás de água
Reação de deslocamento
Métodos de Obtenção
Remoção do CO é difícil e por isso é convertido em CO2
CO2 é absorvido por solução de carbonato de potássio ou
etanolamina e posterior regeneração por aquecimento
K2CO3 + CO2 + H2O 2KHCO3
2HOCH2CH2NH2 + CO2 + H2O (HOCH2CH2NH2)2CO3
Métodos de Obtenção
• Eletrólise da água (99,9% de pureza)
2 H2O (l) 2 H2 (g) + O2 (g)
Potenciais padrão a 25 oC
E0 = E0 (cátodo) – E0 (ânodo)
E0 = - 0,83 - 0,40 = - 1,23 V
G>0: termodinamicamente desfavorável
A temperatura de operação oscila entre 70 e 90 ºC.
Voltagens por célula têm valores compreendidos entre 1,8 e 2,2 V.
Cátodos de aço e o ânodo é niquelado.
Os diafragmas separadores são constituídos com panos ou telas grossas.
• Em Laboratório: 1) reação entre um ácido forte (HCl) e um metal
Zn (s) + H3O+ (aq) Zn2+ (aq) + H2 (g) + 2H2O (l)
Eo = 0 - (- 0,76) = + 0,76
G<0: reação espontânea
• Em Laboratório: 2) reação entre a água e um metal alcalino
2 Na (s) + H2O (l) 2 Na+ (aq) + H2 (g) + 2 OH- (aq)
Eo = -0,42 - (- 2,71) = + 2,29
G<0: espontânea
https://www.youtube.com/watch?v=z1z0AVvY9yM
Principais Compostos
Pode formar tanto o cátion (H+) como o ânion (H-, hidreto)
Eletronegatividade intermediária permite a formação de ligação covalente
com muitos elementos. Com elementos metálicos fortemente eletropositivo
forma compostos iônicos.
H-: raio grande com pequena carga nuclear (1 próton).
O elétron é facilmente perdido, com baixa energia requerida.
Hidretos são, portanto, agentes redutores muito poderosos.
Ni
NaH (s) + H2O (l)
NaOH (aq) + H2 (g)
Principais Compostos
Classificação dos Compostos Binários de Hidrogênio (Hidretos)
Sc
Cd
Hg
Salino
Metálico
Intermediário
Molecular
Desconhecido
Principais Compostos
• Hidretos salinos: compostos iônicos formados com os metais do bloco s,
exceto Be e Mg.
2 K (s) + H2 (g) 2 KH (s)
- Sólido brancos, cristalinos, alto ponto de fusão
- Reagem com água liberando H2
NaH (s) + H2O (l) NaOH (aq) + H2 (g)
• Hidretos metálicos: sólidos condutores elétricos formados com metais do bloco d
podem ter composição variável (não estequiométrico).
- Sólidos pretos obtidos pelo aquecimento do metal com H2
- Liberam H2 em contato com ácidos (ou quando aquecidos)
ZrH1,3 ZrH1,75
Ambos os hidretos (salinos e metálicos) tem
alta densidade de entalpia, desejáveis em
combustíveis portáteis.
Podem ser utilizados para armazenamento e transporte
de H2.
Hidrogênio ocupam os interstícios
entre os átomos metálicos
Composição dos hidretos metálicos
• Hidretos Moleculares: compostos covalentes formados com elementos do bloco p.
CH4 – Tetraédrico
109,5o
Hidrocarbonetos: empregados como gases, líquidos e sólidos em combustíveis e
como matéria prima para diversos produtos industriais
Metano, etano, propano, butano: gases
Octano, benzeno: líquidos
Pentacontano (50), Hectano (100): sólidos
• Hidretos Moleculares: compostos covalentes formados com elementos do bloco p.
NH3 – Piramidal
107o
A orientação dos pares isolados como representado pela teoria VSEPR
16.000.000.000 Kg NH3/ano EUA
(80% fertilizante)
Aplicações Industriais
Importância industrial da amônia (NH3)
Processo Haber (Fritz Haber, 1868-1934)
N2 (g) + 3 H2 (g) 2 NH3 (g)
• Alta pressão: desloca o equilibrio para menor volume.
• Retirada da amônia formada
• Alta temperatura
• Hidretos Moleculares: compostos covalentes formados com elementos do bloco p.
H2O – Angular
104,5o
Ligações de Hidrogênio
109,5o
Pontos de ebulição dos compostos de hidrogênio binários do
bloco-p.
Ligação de Hidrogênio e o gelo
Flutuação na água
hidrogênio
oxigênio
dgelo < dágua
Células unitárias hexagonais resultando em
estruturas bastante abertas
mgelo/Vgelo < mágua/Vágua
Ligação de hidrogênio e estrutura das proteínas
• Hidretos Moleculares: compostos covalentes formados com elementos do bloco p.
ÁCIDOS
Ácido – doador de prótons
Base – receptor de prótons
- Força dos Hidrácidos, segundo a teoria de Brönsted-Lowry
Energia de ligação
HF < HCl < HBr < HI
1 - Quanto mais fraca a ligação H-A (devido à pouca sobreposição dos
orbitais 1s do H e p de A), mais forte é o ácido (na família/grupo)
2- Quanto mais polar a ligação H-A, mais forte é o ácido (no período)
Oxiácidos
G17:
HCl, HClO, HClO2, HClO3, HClO4
(igual para Br e I; HF somente)
G16:
H2S, H2SO3, H2SO4 (Se e Te)
G15:
NH3, HNO3, HNO2
PH3, H3PO3, H3PO4
G14:
CH4, H2CO3
SiH4, H4SiO4
Hidrogênio ligado ao Oxigênio = ligação com
grande diferença de polaridade
pKa = log1/Ka = - log Ka
1 - Quanto maior o número de átomos de oxigênio ligados ao átomo central,
mais forte é o ácido. Ou quanto maior o número de oxidação do átomo central,
mais forte é o ácido.
2 - Para o mesmo número de O ligados ao átomo central, quanto
maior a eletronegatividade do átomo halogênio, mais forte é o ácido.
Aplicações Industriais
Importância industrial dos ácidos: H2SO4
Produção de 40 milhões de ton/ano
S (s) + O2 (g) SO2 (g)
2 SO2 (g) + O2 (g) 2 SO3 (g)
SO3 (g) + H2O (l) H2SO4 (l)
Quando puro é incolor, inodoro e tem aspecto oleoso.É fumegante pois se decompõem em
H2O e SO3.
O maior emprego isolado do ácido sulfúrico é na fabricação de fertilizantes (65%). É ainda
utilizado na fabricação de couro, na purificação do petróleo e no tingimento dos tecidos. Na
indústria química, em geral, ele pode ser usado como agente ácido desidratante (para
processos químicos orgânicos e petroquímicos). Na indústria de papel e celulose o ácido
sulfúrico é utilizado na polpação e também possui aplicação na indústria têxtil e de fibras. Na
indústria de açúcar e álcool ele tem aplicação no preparo do caldo para decantação. A
indústria alimentícia utiliza-o para produção de ácido cítrico e láctico. O ácido sulfúrico
também é utilizado em processos de sulfonação orgânica, para detergentes e indústrias
farmacêuticas.
Aplicações Industriais
Reagente para reações químicas
Extração de metais:
Zn2+(aq) + H2 (g) Zn (s) + 2H3O+ (aq)
Gordura Saturada
H2 (g) + …C=C… (l) …CH-CH… (s)
Fertilizantes e Plásticos
N2 (g) + 3H2 (g) 2NH3 (g)
Combustível de foguete
Pesquisas
H2 como combustível do futuro
A empresa Ford lançou o primeiro motor de combustão interna alimentado por
hidrogênio. Redação do Site Inovação Tecnológica - 20/07/2006
O gás é tido como o combustível do futuro, graças à sua eficiência energética e à não emissão de
poluentes.
Virtualmente todos os componentes do motor tiveram que ser adaptados para funcionar com o
hidrogênio. O gás tem uma capacidade de lubrificação muito menor do que a gasolina ou o diesel, o que
exigiu a fabricação de peças com ligas especialmente reforçadas.
Hoje, os maiores impeditivos ao uso generalizado do hidrogênio como combustível são sua "fabricação" e
seu armazenamento. A extração do hidrogênio da água consome muita energia. E estudos mostraram a
inviabilidade de seu armazenamento em tanques como os utilizados para o gás natural.
Ao invés disso, ele deverá ser armazenado em forma sólida - uma reação química se encarregará de
retirar os átomos de hidrogênio do composto sólido.
Nessa nova tecnologia, o hidrogênio é armazenado como hidreto metálico. O hidrogênio é liberado
quando o hidreto metálico é submetido ao calor. Embora esse projeto tenha bom potencial, ainda há
vários desafios a serem vencidos. Um dos principais é que os hidretos metálicos complexos, como o
hidreto de magnésio, precisam de temperaturas muito altas para se decompor, gerando uma ineficiência
devido à necessidade de utilização de uma parte do hidrogênio para liberação de todo o hidrogênio
armazenado.
http://www.inovacaotecnologica.com.br/noticias/noticia.php?artigo=010170060720
Explosão do hidrogênio no vôo inaugural do Hindenburg
http://www.youtube.com/watch?v=6rdmpx39PRk
Pesquisas
Hidrogênio ocupam os
interstícios entre os átomos
metálicos
L. Schlapbach, A. Züttel, “Hydrogen-storage
materials for mobile applications”, Nature, 414
(2001) 353.
Pesquisas
Pesquisas
No estado fundamental
No estado excitado
G > 0
Bibliografia
•
Atkins, P., Jones, L., Princípios de Química - Questionando a Vida Moderna e o Meio
Ambiente, 3 ed., Porto Alegre: Bookman, 2006.
•
Shriver, D. F., Atkins, P., Química Inorgânica, Ed Artmed, 2003 .
•
Lee, J. D., Química Inorgânica Não Tão Concisa. Edgard Blucher Ltda, 3a ed., São
Paulo, 1980
•
Brent, R., The Golden book of Chemistry Experiments, Golden Press, New
York,1960
•
Cronyn, M.W., The proper Place for Hydrogen in the Periodic Table, J. Chem. Ed.,
2003, 80, 947-951.