Aprendizagem em Física
19 de maio de 2009
Energia, entropia e ...
Aprendizagem em Física – 19/05/2008
Referências básicas
Arnold B. Arons – Teaching Introductory Physics
Parte III – Capítulo 4 – Energy
Outras leituras sugeridas:
Alonso & Finn, Física: um curso universitário, vol. 1, cap. 9, Ed. Edgard Blücher, SP
H. M. Nussenzveig, Curso de Física Básica, vol. 2, cap. 10, Ed. Edgard Blücher, SP
Enrico Fermi, Thermodynamics, Dover Publications, NY
1
Capítulo 4 – Energia
4.1 – Mudança no mundo ao nosso redor
4.2 – Revisão de impulso, momento e colisões
4.3 – Aceleração horizontal de uma partícula sob ação de forças constantes
4.4 – Deslocamento vertical de uma partícula sob ação de forças constantes
4.5 – Deslocamento de uma partícula sob ação de forças variáveis
4.6 – Deslocamento de uma partícula contra a força restauradora de uma mola
4.7 – Vocabulário: trabalho e energia cinética
4.8 – Energia potencial
4.9 – Unidades e dimensões
4.10 – Colisões perfeitamente inelásticas
4.11 – Usando o novo vocabulário
4.12 – Modelos para a natureza do calor
4.13 – O ataque de Rumford ao modelo do calórico
4.14 – A relação quantitativa entre trabalho e calor
4.15 – O enunciado de Joule do princípio da conservação da energia
4.16 – Corpos extensos e sistemas, em oposição a massas pontuais
4.17 – Calor, trabalho e mudança de estado: a primeira lei da termodinâmica
4.18 – As variedades de energia interna
4.19 – Lidando com corpos extensos
4.20 – Massa e mola sem atrito
4.21 – Pulando verticalmente para cima
4.22 – Trabalho e calor na presença do atrito de deslizamento
4.23 – Status lógico das leis de conservação
Sistema de partículas: modelo de descrição do mundo
microscópico
calor e temperatura (conceitos básicos)
a física associada: termodinâmica, teoria cinética, hidrodinâmica, ...
as idéias e sua operação: conservação de energia, energia interna de um
sistema, a degradação da energia, entropia e desordem, ...
aplicações sociais e tecnológicas
questão preliminar (epistemológica?)
todo = soma das partes
sistema = “soma” das propriedades dos constituintes
2
Sistema de partículas
uma partícula: leis de Newton
sistema de partículas: “soma” de partículas
momento linear
N
r N r
r
P = ∑ p i = ∑ mi v i
r
dpi r res
= Fi
dtr
dP d N r N r ext N r int r ext
= ∑ pi = ∑ Fi + ∑ Fi = Fres
dt dt i=1 i=1
i=1
r
dP r ext
= Fres
dt
momento angular
r
N r
N
r
r r d li = rτires
L O = ∑ li( O ) = ∑ mi r i × v i dt
i=1
i=1
r
dL d N r N r ext N r int r ext
= ∑ li = ∑ τi + ∑ τi = τres
dt dt i=1 i=1
i=1
r
dL r ext
= τres
dt
i=1
i=1
energia
N
N
r
1
T = ∑ t i = ∑ mi v i2
2
i=1
i=1
interações internas?
A variação da energia cinética de um sistema de partículas é
igual ao trabalho realizado sobre o sistema pelas forças internas
e externas.
para uma partícula de um sistema,
somando para o sistema,
∆Eicin = W RES = WiINT + WiEXT
∆ECIN = W INT + W EXT
Ao contrário do que acontece com a resultante das forças internas e
dos torques das forças internas, o trabalho realizado pelas forças
internas não é necessariamente nulo; consideremos um sistema de
duas partículas, duas massas ligadas por uma mola:
W INT = ∑ WiINT = W1INT + W 2INT
i
r
r
W1INT = ∫ F1( 2 ) ⋅ d r1
r
r
r
r
W 2INT = ∫ F2(1) ⋅ d r2 = − ∫ F1( 2 ) ⋅ d r2
r
d r1
r
d r2
r
r
r
W INT = ∫ F1( 2 ) ⋅ (d r1 − d r2 )
3
O trabalho das forças internas PODE ALTERAR a energia
cinética de um sistema de partículas
∆ECIN = W INT + W EXT
para o sistema de partículas,
O trabalho realizado pelas forças internas não é necessariamente nulo; para
um sistema de duas partículas,
r
r
r
r
W INT = ∫ F1( 2 ) ⋅ (d r1 − d r2 ) = ∫ F
1( 2 )
r
⋅ d r1( 2 )
A idealização de sistemas físicos como corpos rígidos permite uma situação
em que o trabalho realizado pelas forças internas é sempre nulo.
Se todas as forças internas forem conservativas, podemos
imaginar uma função – a energia potencial interna do sistema:
r
r
int
∆EPOT
= − W INT = − ∫ F ⋅ d r1( 2 )
1( 2 )
Para um sistema de partículas, então, há uma grandeza – que
costumamos denominar energia própria do sistema (Alonso &
Finn, vol. 1, seção 9.6)
TOTAL
U = ECIN
+ EINT
POT
Da relação entre trabalho e energia cinética para um sistema de partículas,
∆ECIN = W INT + W EXT
podemos escrever
int
EXT
∆ECIN = W INT + W EXT = −∆EINT
POT + Wnc + W
ou seja, a variação na energia própria do sistema é causada pelas forças
externas ou por forças internas não conservativas:
(
)
int
EXT
∆U = ∆ ECIN + EINT
POT = Wnc + W
soma para cada
partícula
soma para cada
par de partículas
4
Conservação da energia para um sistema de partículas
Na maior parte dos casos conhecidos, a força interna entre cada par
de partículas atua sobre a linha que une as duas partículas,
dependendo então apenas da distância entre elas (é o caso da força
elástica de uma mola). Então, não há forças internas não
conservativas e
(
)
int
EXT
∆U = ∆ ECIN + EINT
= W EXT
POT = Wnc + W
int
EXT
∆ECIN = W INT + W EXT = −∆EINT
POT + Wnc + W
e a variação da energia própria de um sistema de partículas é
igual ao trabalho feito sobre o sistema pelas forças externas
LEI DA CONSERVAÇÃO DA ENERGIA
A ENERGIA PRÓPRIA DE UM SISTEMA ISOLADO DE
PARTÍCULAS PERMANECE CONSTANTE
CALOR - TERMODINÂMICA
4.12 – Modelos para a natureza do calor
4.13 – O ataque de Rumford ao modelo do calórico
4.14 – A relação quantitativa entre trabalho e calor
4.15 – O enunciado de Joule do princípio da conservação da energia
4.16 – Corpos extensos e sistemas, em oposição a massas pontuais
Joule
eixo girante
(pesos)
isolamento
térmico
termômetro
pás
energia mecânica transformada em aumento de temperatura
5
CALOR - TERMODINÂMICA
4.12 – Modelos para a natureza do calor
4.13 – O ataque de Rumford ao modelo do calórico
4.14 – A relação quantitativa entre trabalho e calor
4.15 – O enunciado de Joule do princípio da conservação da energia
4.16 – Corpos extensos e sistemas, em oposição a massas pontuais
Joule
“A opinião predominante até agora tem sido que [calor] é uma substância
possuindo, como toda a matéria, impenetrabilidade e extensão. Mostramos
porém que calor pode ser convertido em força viva [energia cinética] e em
atração através do espaço [energia potencial]. Fica perfeitamente claro,
portanto, que a menos que a matéria possa ser transformada em atração
através do espaço [energia potencial], que é uma idéia tão absurda que não
pode ser levada em conta nem por alguns instantes, a hipótese de que o calor
é uma substância deve ser abandonada. Calor deve portanto consistir de ou
força viva [energia cinética] ou atração através do espaço [energia potencial]...
Estou inclinado a acreditar que estas duas hipóteses são válidas – que... o
calor sensível corresponde à força viva [energia cinética] das partículas dos
corpos em que é induzido; e que em outras [instâncias], particularmente no
caso do calor latente, os fenômenos são produzidos pela separação das
partículas, de forma a fazê-las atrairem-se de uma distância maior.”
CALOR - TERMODINÂMICA
4.12 – Modelos para a natureza do calor
4.13 – O ataque de Rumford ao modelo do calórico
4.14 – A relação quantitativa entre trabalho e calor
4.15 – O enunciado de Joule do princípio da conservação da energia
4.16 – Corpos extensos e sistemas, em oposição a massas pontuais
Joule
“(...) observamos no movimento ... uma contínua conversão de calor em força
viva [energia cinética], que pode ser convertida novamente em calor ou
empregada em produzir uma atração através do espaço [energia potencial],
como quando um homem sobe uma montanha. De fato, os fenômenos da
natureza, sejam mecânicos, químicos ou vitais, consistem quase inteiramente
de uma contínua conversão de atração através do espaço [energia potencial],
força viva [energia cinética] e calor entre si. Portanto é assim que a ordem é
mantida no universo – nada se dessaruma, nada perde-se para sempre, mas
toda a maquinária, complicada que seja, trabalha suave e harmoniosamente
(...) e tudo pode parecer complicado (...) na aparente confusão (...) de uma
imensa variedade de causas, efeitos, conversões, arranjos, e ainda a mais
perfeita regularidade é preservada.”
6
CALOR - TERMODINÂMICA
Sistemas com muitas partículas são complicados: necessita-se do
desenvolvimento de outros métodos (não “mecânicos”) para análise
- métodos estatísticos
Estrutura interna do sistema ignorada
Utilização de valores medidos experimentalmente (de forma global) para U e W
Primeira aproximação:
a temperatura T de um sistema está relacionada com a energia cinética média
das partículas que compõem o sistema, no referencial do CM.
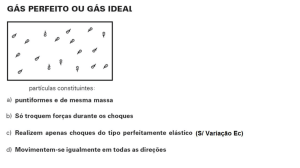
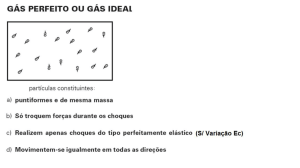
teoria cinética da pressão – para gases ideais:
2
ECIN
3
PV = nRT
PV =
T=
2
ECIN
3nR
Joules / partícula
gases ideais – não há interações mútuas: U=Ecin
CALOR - TERMODINÂMICA
A PRIMEIRA LEI DA TERMODINÂMICA
Trabalho realizado pelo sistema sobre o meio externo:
dh
r
F
r r
W = ∫ F ⋅ d r = ∫ pAdh = ∫ p dV
trabalho sobre o meio externo é positivo quanto o sistema faz
trabalho sobre o meio externo (“dá” energia)
Calor: valor médio da energia trocada com as vizinhanças (trocas de
energia que ocorrem por conta da interação das moléculas do gás
com a parede, sem realização de trabalho mecânico)
Q é o calor recebido pelo sistema do meio externo – quando o
sistema recebe energia, Q é positivo
7
CALOR - TERMODINÂMICA
A PRIMEIRA LEI DA TERMODINÂMICA
Lei da conservação da energia: a variação na energia de um sistema
corresponde ao trabalho realizado pelas forças externas (interações
com as vizinhanças)
U é a energia interna (“energia própria”, ou no caso dos gases
ideais, energia cinética das moléculas de gás)
W é o trabalho realizado pelo sistema sobre o meio externo
Q é o calor recebido pelo sistema do meio externo (energia
trocada por intermédio de trabalho não mensurável
mecanicamente)
∆U = Q − W
CALOR - TERMODINÂMICA
A energia interna é uma função de estado
E (experiência de Joule) só depende da temperatura do gás ideal: U=U(T)
dU = nc v dT
W é o trabalho realizado pelo sistema sobre o meio externo
Q é o calor recebido pelo sistema do meio externo
não são funções de estado
∆U = Q − W
8
CALOR - TERMODINÂMICA
A SEGUNDA LEI DA TERMODINÂMICA
A observação de processos cíclicos na natureza (motores, por exemplo)
levou à conclusão que nenhum motor consegue transformar integralmente
calor em energia mecânica.
A segunda lei da termodinâmica tem várias formulações.
Entropia: uma nova função de estado
que surge a partir da propriedade de um ciclo reversível (ciclo=processo de
transformações de uma substância termodinâmica que tem como estado final o
mesmo estado inicial; reversível=que pode ser realizado com o sentido invertido)
Pode-se demonstrar (teorema de Clausius) que para um ciclo reversível
∫
d' Q
=0
T
∫
d' Q
<0
T
e para um ciclo irreversível:
Aprendizagem em Física – 08/04/2008
CALOR - TERMODINÂMICA
A SEGUNDA LEI DA TERMODINÂMICA
∫
d' Q
≤0
T
Entropia: uma nova função de estado
dS =
d ' QR
T
a linguagem
provavelmente é
aramaico...
9
CALOR - TERMODINÂMICA
A SEGUNDA LEI DA TERMODINÂMICA
Exemplo 1: transformação adiabática reversível
uma transformação em que não há troca de calor com o meio externo
dS =
d ' QR
=0
T
∆S ADIAB,REV = 0
Exemplo 2: transição de fase
uma transformação em que a substância muda de fase – vaporização, fusão
a pressão e a temperatura permanecem constantes
∆S = ∫
d ' QR 1
= Q
T
T
calor latente: L (quantidade de calor por unidade de massa para efetuar a
mudança de fase)
mL
∆S =
T
>0
CALOR - TERMODINÂMICA
A SEGUNDA LEI DA TERMODINÂMICA
Exemplo 3: expansão livre de um gás (recipiente adiabático)
estado inicial:
P, V, T
experiência de Joule:
estado final: Pf , Vf > V, Tf
d' W = 0
Tf = T
dU = 0
d ' QR = dU + d ' W = 0
processo reversível isotérmico entre os estados inicial e final:
dU = nc v dT = 0
d ' W = PdV = nRT
dV
V
d ' Q = d ' W = nRT
dV
V
IMAGINADO
d ' QR nRdV
=
dS =
T
V
f
f
d ' QR
nRdV
V
∆S = ∫
=∫
= nR ln f > 0
T
V
Vi
i
i
10
CALOR - TERMODINÂMICA
A SEGUNDA LEI DA TERMODINÂMICA
∆S ADIAB,REV = 0
Exemplo 1: transformação adiabática reversível
Exemplo 2: transição de fase
∆S =
mL
>0
T
Exemplo 3: expansão livre de um gás (recipiente adiabático)
∆S = nR ln
Vf
>0
Vi
Princípio do aumento da entropia:
a entropia de um sistema termicamente isolado nunca pode decrescer; não se altera
quando ocorrem processos reversíveis, mas aumenta quando ocorrem processos
irreversíveis.
e a visão microscópica?
pirataria: A Seta do Tempo, em
www.if.ufrj.br/~carlos/palestras/setadotempo.pdf
11
e a visão microscópica?
e a visão microscópica?
12
e a visão microscópica?
13
14
Tarefas para a próxima aula:
Fazer os exercícios (1 de Almir a Magali, 2 de Nelson a Wanderlei):
1) Um recipiente de paredes adiabáticas contém 2 litros de água a 30o C. Coloca-se
nele um bloco de 500g de gelo. (a) Calcule a temperatura do sistema. Considere
80cal/g para o calor latente de fusão do gelo. (b) Calcule a variação da entropia do
sistema.
2) Uma chaleira contém 1 litro de água em ebulição. Despeja-se toda a água numa
piscina, que está à temperatura ambiente de 20º C. (a) De quanto variou a entropia
da água da chaleira? (b) De quanto variou a entropia do universo?
Leitura para a próxima aula
APRENDIZAGEM E COMPREENSÃO DE CONCEITOS CHAVE EM ELETRICIDADE
Reinders Duit & Christoph von Rhöneck
Section C2, Learning and understanding key concepts of electricity from: Connecting
Research in Physics Education with Teacher Education
An I.C.P.E. Book © International Commission on Physics Education 1997,1998
15