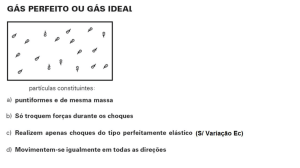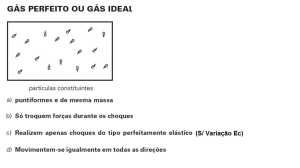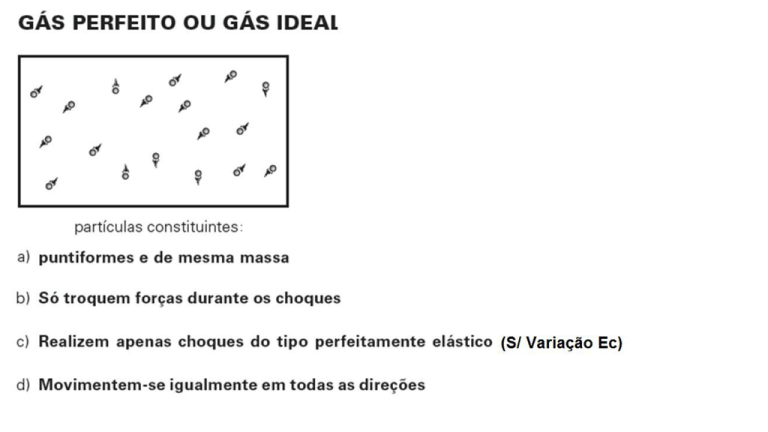
Variáveis de Estado
• Pressão (P)
= Quantidade de choques entre as partículas e as paredes do recipiente.
• Volume (V)
= Espaço ocupado pela amostra.
• Temperatura (T)
= Energia Cinética média das partículas.
A transformação isobárica poderá ser identificada quando o
êmbolo se movimentar lentamente ou com velocidade constante
(equilíbrio com a pressão externa).
Equação Geral do Gases
Equação Geral do Gases
Equação Clapeyron
Unidades
Trabalho Realizado pela Força da Pressão Exercida por um Gás
Expansão do Gás:
τ>0
O gás realiza trabalho
O gás cede energia para o
meio sob a forma de
trabalho (não calor!)
Trabalho Realizado pela Força da Pressão Exercida por um Gás
Compressão do
Gás:
τ<0
Um trabalho é realizado
sobre o gás
O gás recebe energia do meio
sob a forma de trabalho
(não calor!)
Trabalho Realizado pela Força da Pressão Exercida por um Gás
Atenção!
Se o volume de o gás
não varia:
τ=0
Trabalho Realizado numa Transformação Cíclica
τ = τ1 + τ2
Trabalho Realizado numa Transformação Cíclica
τ1 > 0 (Expansão)
τ2 < 0 (Compressão)
Trabalho Realizado numa Transformação Cíclica
τ = τ1 + τ2
Termodinâmica
Energia Interna de um Gás Ideal (U)
Temperatura (T): Energia Cinética
Média das partículas
Energia Interna (U): É a soma das energias
cinéticas das partículas.
Energia Interna de um Gás Ideal (U)
Energia Interna (U): É a soma das energias
cinéticas das partículas.
Gás Monoatômico:
3
3
𝑈 = 𝑃𝑉 = 𝑛𝑅𝑇
2
2
Gás Diatômico:
Temperatura(T): Energia Cinética
Média das partículas
5
5
𝑈 = 𝑃𝑉 = 𝑛𝑅𝑇
2
2
No SI: U é medida em Joule (J)
Variação da Energia Interna de um Gás Ideal (U)
• Gás aquece: ΔU > 0
• Gás esfria: ΔU < 0
• Gás mantém a temperatura
constante: ΔU = 0
A energia interna pode ser considerada o “reservatório de energia do gás”
Calor Trocado por um gás (Q)
• Gás recebe calor: Q > 0
• Gás cede calor:
Q<0
• Gás não troca calor com o
ambiente externo: Q =0
Resumo
Transformações gasosas
• Isobárica: pressão constante
• Isovolumétrica: volume constante
• Isotérmica: temperatura constante
• Adiabática: o gás não troca calor com o ambiente externo
Resumo
ΔU = Q - τ
Primeiro Princípio da Termodinâmica
Q = 100 J
ΔU = 100 J
Ops! Expansão do Gás
τ = 30J
ΔU = 100 J – 30 J = 70 J
ΔU = Q - τ
Máquinas Térmicas (Motor)
Máquinas Térmicas (Motor)
| Q1 | = | Ʈ | + | Q2 |
Energia Térmica => Energia Mecânica
Máquinas Térmicas (Refrigerador)
Máquinas Térmicas (Refrigerador)
| Q2 | = | Ʈ | + | Q1 |
Energia Mecânica => Energia Térmica
Máquinas Térmicas – Rendimento(n)
| Q1 | = | Ʈ | + | Q2 |
Logo:
| Ʈ | = |Q1 | - | Q2 |
Ʈ
Q1 −Q2
n=
=
Q1
Q1
Máquinas Térmicas com Máximo Rendimento – Ciclo de Carnot
ΔU = Q – τ
ΔU 1/2 = 0
0 = Q 1/2 -τ
τ = Q 1/2 > 0
τ = Q 3/4 < 0
Ciclo de Carnot – Rendimento(n)
(T1)
| Q1 | = | Ʈ | + | Q2 |
Logo:
| Ʈ | = |Q1 | - | Q2 |
(T2)
Ʈ
Q1 −Q2
n=
=
=
Q1
Q1
T1 −T2
T1
2º Princípio da Termodinâmica
É impossível realizar um processo cujo único efeito seja
remover calor de um reservatório térmico e produzir uma
quantidade equivalente de trabalho
3º Princípio da Termodinâmica
Indica que não pode haver um motor com n = 100%