Dissertação,
AVALIAÇÃO DA ESCALA LIKERT DE DISPNEIA COMO
PREDITORA DE EVENTOS CARADIOVASCULARES EM
PACIENTES COM INSUFICIÊNCIA CARDÍACA
Cristina Klein Weber
INSTITUTO DE CARDIOLOGIA DO RIO GRANDE DO SUL
FUNDAÇÃO UNIVERSITÁRIA DE CARDIOLOGIA
Programa de Pós-Graduação em Ciências da Saúde
Área de Concentração: Cardiologia
AVALIAÇÃO DA ESCALA LIKERT DE DISPNEIA COMO
PREDITORA DE EVENTOS CARADIOVASCULARES EM
PACIENTES COM INSUFICIÊNCIA CARDÍACA
Autora: Cristina Klein Weber
Orientador: DrTiago Luiz Luz Leiria
Co-orientadora: Drª Mª Antonieta P. de Moraes
Dissertação submetida como requisito
para obtenção do grau de Mestre ao
Programa
Ciências
de
da
Concentração:
Pós-Graduação
em
Saúde,
de
Área
Cardiologia,
da
Fundação Universitária de Cardiologia /
Instituto de Cardiologia do Rio Grande
do Sul.
Porto Alegre, 2013
Catalogação na fonte
W373e
Weber, Cristina Klein
Avaliação da escala Likert de dispneia como preditora de eventos
cardiovasculares em pacientes com insuficiência cardíaca / Cristina Klein
Weber ; orientador Tiago Luiz Luz Leiria; co-orientadora Maria Antonieta
Pereira de Moraes. – Porto Alegre: 2013.
95 f.; il.
Dissertação (Mestrado) – Instituto de Cardiologia do Rio Grande
do Sul / Fundação Universitária de Cardiologia – Programa de PósGraduação em Ciências da Saúde: Cardiologia, 2013.
1. Insuficiência cardíaca. 2. Dispneia. 3. Escala Likert. I. Leiria,
Tiago Luiz Luz. II. Moraes, Maria Antonieta Pereira de. III. Título.
CDU: 616.1/2
Bibliotecária responsável: Marina Miranda Fagundes
CRB 10/2173
Dedico esta dissertação aos meus pais Pedro e Inês
pelos ensinamentos e apoio incondicional e a minha
irmã Daiana pelo incentivo e exemplo de
profissionalismo.
iii
AGRADECIMENTOS
Agradeço primeiramente a Deus, pelo dom da vida, por ter me dado
persistência para não esmorecer nesta caminhada, pela oportunidade de
conhecer e conviver com profissionais competentes e por ter escolhido a
cardiologia como especialização.
Aos meus pais, Pedro e Inês, agradeço pelo amor e apoio constantes,
pelo exemplo e pelas oportunidades concedidas.
A minha irmã Daiana, pelo carinho, parceria, exemplo de dedicação e
amor à profissão.
A esta instituição, agradeço pelo conhecimento transmitido através de
seus mestres.
Aos meus orientadores Dr Tiago Leiria e EnfªDrª Mª Antonieta pelo
incentivo à pesquisa, competência e incentivo na realização deste trabalho.
Aos colegas do IC/FUC, especialmente da Hemodinâmica, que
compartilham das conquistas e dificuldades desta profissão, mas que,
certamente foram fundamentais para o meu crescimento profissional.
Aos demais funcionários que de alguma forma auxiliaram na
realização deste trabalho.
À todos, muito obrigada.
iv
SUMÁRIO
1.
BASE TEÓRICA
01
1.1 CARACTERÍSTICAS CLÍNICAS
03
1.2 ETIOLOGIA
03
1.3 FISIOPATOLOGIA
04
1.4 MANIFESTAÇÕES CLÍNICAS
05
1.4.1 Dispneia
2.
05
1.4.1.1 Dispneia como preditora de congestão pulmonar
07
1.4.1.2 Escalas de avaliação / aferição da dispneia
10
EXAMES COMPLEMENTARES
16
2.1 PEPTÍDEOS NATRIURÉTICOS
16
2.2 ULTRASSONOGRAFIA PULMONAR
18
2.3 ECOCARDIOGRAMA
19
2.4 TESTE DE CAMINHADA DE SEIS MINUTOS
20
3.
ATUAÇÃO DA ENFERMAGEM NA IC
23
4.
RELEVÂNCIA DO ESTUDO
27
5.
HIPÓTESE
28
5.1 HIPÓTESE CONCEITUAL
6.
28
OBJETIVOS
29
6.1 GERAL
29
6.2 ESPECÍFICOS
29
7.
REFERÊNCIAS
30
8.
ARTIGO EM PORTUGUÊS
40
9.
ARTIGO EM INGLÊS
62
10.
ANEXOS
82
v
APÊNDICE A
82
APÊNDICE B
83
APÊNDICE C
85
APÊNDICE D
86
APÊNDICE E
87
vi
LISTA DE ABREVIATURAS
ACC
American CollegeofCardiology
ACCF
American CollegeofCardiology Foundation
ACCP
American College of Chest Physicians
AHA
American Heart Association
CDI
Desfibrilador Implantável
DCV
Doenças cardiovasculares
E/E’
Relação entre o pico do fluxo diastólico
transmitral com a velocidade precoce diastólica
do anel mitral
EAV
Escala análogo-visual
FC
Frequência Cardíaca
FEVE
Fração de Ejeção do Ventrículo Esquerdo
IAM
Infarto Agudo do miocárdio
IC
Insuficiência cardíaca
NT-proBNP
Porção N-terminal do pro-hormônio peptídeo
natriurético do tipo B
NYHA
New York Heart Association
PCP
PressãoCapilarPulmonar
RXT
Radiografia de tórax
SUS
Sistema Único de Saúde
TC6
Teste de caminhada de 6 minutos
US
Ultrassonografia
vii
1
1. BASE TEÓRICA
A insuficiência cardíaca (IC) consiste em um grave defeito funcional da
bomba cardíaca, que provoca a incapacidade do coração atender as
necessidades metabólicas do organismo(1,2). É uma síndrome clínica na qual
ocorre uma desordem estrutural e funcional do coração. Esta desorganização
prejudica a capacidade do ventrículo ejetar ou se encher de sangue a pressões
de enchimento fisiológicas, limitando a capacidade do paciente para exercer ou
realizar as atividades da vida diária sem sintomas de dispneia ou fadiga(3).
É uma doença crônica e progressiva que se manifesta por um conjunto
de sinais e sintomas de congestão pulmonar e sistêmica caracterizando-se
como a fase final de todas as doenças cardiovasculares (DCV)(1,4,5). Em
muitos casos, é bem tolerada, porém, quando a patologia progride, a doença
torna-se limitante, reduzindo significativamente a qualidade de vida dos
pacientes podendo evoluir para o óbito(6).
Esta patologia tem se mostrado uma importante questão de saúde
pública,
pois está
entre
as
principais causas de
hospitalizações e
morbimortalidade em adultos com mais de 65 anos nos países ocidentais(7-9).
Nos países em desenvolvimento, como o Brasil, a IC é a primeira causa de
internação hospitalar, pelo Sistema Único de Saúde (SUS), por doenças
cardiovasculares na população com mais de 65 anos(10). A IC é também
responsável por elevadas taxas de morbimortalidade e altos custos em todo o
mundo.
Esta síndrome afeta entre 1,5% a 2% da população mundial(11). Nos
Estados Unidos, mais de 1.000.000 de pacientes são hospitalizados por ano
2
com IC; taxas semelhantes de internações são apresentadas em países
representantes da Sociedade Europeia de Cardiologia(4). No Brasil, parece
estar havendo um aumento da mortalidade devido a essa patologia(12,13).
Estudo realizado com 263 pacientes internados em uma instituição
hospitalar de uma cidade brasileira para compensação da IC através de
medicamentos demonstrou que durante o primeiro ano de seguimento, um
terço dos pacientes foi a óbito e foi necessário atendimento de emergência no
pronto-socorro para a metade dos pacientes que haviam tido alta hospitalar.
Estes dados demonstram que a IC continua evoluindo com altas taxas de
mortalidade e de re-hospitalizações(12).
Este
cenário
de
frequentes
internações
hospitalares
com
morbimortalidade elevada, se deve à instabilidade clínica dos pacientes pela
própria progressão da doença, às falhas de acesso aos serviços de saúde, à
falta de acompanhamento contínuo, como também porque o diagnóstico dos
principais sintomas da IC, como dispneia e congestão pulmonar estão limitados
a subjetividade da doença, às dificuldades físicas e muitas vezes cognitivas
dos pacientes(14-17).
Entretanto, dados internacionais apontam que muitas das readmissões
poderiam ser evitadas se houvesse um planejamento da alta hospitalar e da
reabilitação
adequada
pelos
profissionais
de
saúde,
bem
como
o
reconhecimento precoce das manifestações clínicas e de descompensação da
doença por parte dos pacientes(18).
3
1.1 CARACTERÍSTICAS CLÍNICAS
Clinicamente, esta síndrome caracteriza-se por períodos de remissão e
exacerbação; as taxas de re-internações hospitalares variam até 25% dentro
de seis meses após uma alta hospitalar. Estes eventos ocorrem possivelmente
devido a deterioração da função ventricular, mas também podem ser
ocasionados por outros fatores potencialmente evitáveis como a falta de
adesão ao tratamento médico, a hipertensão arterial não controlada, o infarto
do miocárdio, as arritmias cardíacas, os fatores iatrogênicos e as infecções,
principalmente pulmonares(19,20).
1.2 ETIOLOGIA
A IC pode ter etiologia hereditária ou adquirida, pode ter inicio
progressivo (sobrecarga de pressão ou volume) ou abrupto (infarto agudo do
miocárdio). Nestes casos, o coração torna-se incapaz de gerar o débito
cardíaco necessário e consequentemente, o suprimento de oxigênio para os
órgãos e tecidos torna-se insuficiente, ou possível somente através de
pressões sistólicas muito elevadas(21,22).
A etiologia subjacente à IC tem significativas implicações prognósticas e
terapêuticas para a doença. Suas causas podem ser as principais
determinantes para a sobrevida em longo prazo nesta população de pacientes.
Cardiopatas com IC de etiologia isquêmica, em geral tem um pior prognóstico
quando comparados com os pacientes portadores de IC não isquêmica, pois
4
episódios de isquemia podem desempenhar um importante papel como gatilho
para a descompensação(3).
1.3 FISIOPATOLOGIA
Devido à redução da função cardíaca, alguns mecanismos adaptativos
são estimulados no intuito de corrigir a disfunção ventricular. Nos casos de
danos ventriculares menores, estes mecanismos conseguem melhorar a
função e muitas vezes normalizá-las; já nos comprometimentos maiores, a
contínua estimulação pode levar a deterioração da função cardíaca devido a
constante dilatação ventricular (remodelação), o que piora muito o prognóstico
do paciente e leva a modificações importantes nas funções renal, metabólica,
muscular esquelética e autonômica(23-25).
Inicialmente, ocorre um aumento dos níveis de neuro-hormônios como o
fator natriurético atrial que além de induzir a vasodilatação arterial melhora a
função cardíaca. Este estímulo neuro-hormonal é suficiente para normalizar o
funcionamento cardíaco nos casos de danos menores; porém, a deterioração
cardíaca mais extensa provoca a estimulação neuro-hormonal vasoconstritora
(noradrenalina, adrenalina, arginina, vasopressina, renina), induzindo assim o
aumento da resistência e piora da função cardíaca, o que causa um
agravamento progressivo do trabalho muscular cardíaco(23).
Para que ocorra a compensação cardíaca, também ocorre a hipertrofia
miocárdica, fator que contribui para o aumento do número de miócitos,
induzindo assim a proliferação instersticial, aumento da região fibrótica e
consequentemente causando efeitos deletérios ao coração(21,23).
5
Nos casos mais graves da doença, também ocorre o aumento dos níveis
de eritropoetina, o que pode causar a elevação das taxas de hematócrito.
Ainda, podem ser encontradas elevações das citoquinas, níveis elevados do
fator de necrose tumoral, interleucina-6 e endotelinas(23).
1.4 MANIFESTAÇÕES CLÍNICAS
As manifestações clínicas da IC contribuem na identificação e diagnóstico
desta síndrome, pois os sintomas evidenciam a incapacidade do coração em
manter as necessidades circulatórias do organismo adequadamente. Os
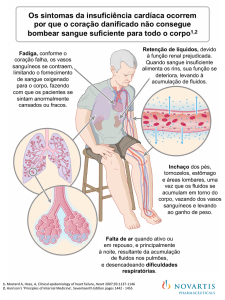
principais sintomas da IC são dispneia, intolerância ao exercício e a fadiga,
porém, estes sintomas podem estar associados a outras doenças pulmonares,
a história prévia de IC a presença de ortopneia e dispneia paroxística noturna
são evidências específicas que facilitam o diagnóstico(11). Outros sintomas
incluem a dor torácica, palpitações, o cansaço, a distensão da veia jugular e os
sintomas digestivos, como anorexia, distensão abdominal e diarreia (em casos
de isquemia ou congestão visceral(2,11).
1.4.1 Dispneia
A dispneia é definida como a sensação de desconforto respiratório,
sendo uma experiência subjetiva, qualitativamente distinta com intensidade
variável. A quantificação de uma sensação subjetiva como a "falta de ar" se faz
de forma extremamente difícil, acarretando uma falta de consenso sobre a
melhor forma de avaliá-la e quantificá-la(1,17,26).
6
A percepção de dispneia é considerada análoga à percepção da dor e
tem uma dimensão sensorial (intensidade) e afetiva (desprazer); desta forma
processos corticais similares parecem ser a base da experiência de dispneia
em dor; ambos os sintomas podem resultar em sofrimento humano. Devido a
isto, alguns peritos realizaram uma declaração de consenso seguindo a política
estabelecida pelo American College of Chest Physicians(ACCP) com base no
entendimento de que os pacientes com câncer de pulmão avançado ou doença
cardíaca não estão sendo tratados de forma coerente e eficaz para o alívio da
dispneia(27).
Esta declaração de consenso teve por objetivo influenciar a prática
clínica e fornecer sugestões para a gestão de dispneia em pacientes com
câncer de pulmão avançado ou doença cardíaca, pois, embora ainda existam
incertezas e questionamentos a respeito dos mecanismos exatos que causam
dispneia, é um sintoma angustiante que requer atenção, consideração,
tratamento e cuidados de saúde proveniente dos prestadores de serviço.
Ainda, através desta declaração, ficou estabelecido que os profissionais de
saúde estivessem eticamente obrigados a tratar dispneia como parte de um
plano de assistência integral, solicitando aos pacientes a classificação da
intensidade de sua falta de ar bem como os tratamentos médicos específicos
devem ser cumpridos com o objetivo de amenizar a dispneia(27,28).
A quantificação de uma sensação subjetiva como a falta de ar se faz de
forma
extremamente
difícil.
Com
isso,
muitos
instrumentos
foram
desenvolvidos com o objetivo de graduar a dispneia. Os primeiros tentaram
padronizar o relato do sintoma correlacionando-o com o seu impacto nas
atividades diárias(29-31). Apesar das inúmeras modificações propostas, todos
7
esses mecanismos de quantificação compartilham de características comuns:
avaliam a dispneia num quadro crônico e utilizam atividades diárias para avaliar
o esforço. Entretanto o uso dessas atividades diárias não considera as
diferenças de esforço extra que é necessário para o cumprimento dessas
atividades(29).
1.4.1.1Dispneia como preditora de congestão pulmonar
A dispneia é a principal causa de hospitalizações em pacientes com IC
aguda e é frequentemente associada com sinais de sobrecarga de fluidos,
principalmente pulmonar e /ou congestão periférica. O alívio deste sintoma
ocorre em uma percentagem relativamente pequena (40-60%) dos pacientes
nos primeiros dias após a admissão hospitalar, pois a rápida melhora clínica
dos pacientes dispneicos com IC é um objetivo que ainda não é plenamente
alcançado pela terapêutica(32).
A American Thoracic Society define dispneia como uma experiência
subjetiva
de
desconforto
respiratório
que
consiste
em
sensações
qualitativamente distintas que variam em intensidade. Este sintoma ocorre a
partir de múltiplas interações fisiológicas, psicológicas, sociais e ambientais o
que pode induzir as respostas fisiológicas secundárias(13).
A intensidade da dispneia e da angústia experimentada pelo paciente
inicialmente observa-se somente pelo esforço, entretanto, com o avanço da
doença,
a
dispneia
ocorre
progressivamente
com
atividades
menos
extenuantes até o repouso, variando durante a exacerbação da IC. Enquanto
alguns pacientes apresentam níveis aumentados de dispneia e desconforto
8
durante um curto período de tempo, outros permanecem sem estas
alterações(33).
A sintomatologia da dispneia ainda não foi precisamente compreendida
a partir de uma perspectiva fisiopatológica e psicossocial devido a dificuldade
de aferição da dispneia. Outros fatores complicadores incluem as diferenças
entre experiências subjetivas de pacientes dispneicos dependendo da doença
de base (pulmonar ou cardíaca). Bem como, a dispneia induzida por esforço
em pacientes com IC crônica, podem diferir daquela causada em pacientes
com IC aguda(34). Nestes casos, a dispneia provavelmente ocorre devido a
congestão pulmonar, pelo aumento da pressão dos capilares pulmonares
(PCP) como resultado da disfunção sistólica e/ou diastólica do ventrículo
esquerdo ou das anormalidades valvulares.
Estes aumentos de PCP indicam congestão hemodinâmica que podem
ou não causar dispneia. Pacientes com PCP cronicamente elevadas, podem
não apresentar sintomas graves ou congestão pulmonar visualizada nos raiosX; enquanto que pacientes com IC em fase inicial e elevação da PCP podem
ter
graves
sintomas
pulmonares
e
edema.
Portanto,
a
congestão
hemodinâmica torna-se clinicamente manifesta dependendo do grau e da taxa
em que a PCP sobe dos mecanismos compensatórios (como a eficiência da
drenagem linfática pulmonar), da permeabilidade da membrana alvéolo-capilar
e
da
presença
ou
ausência
da
doença
pulmonar
subjacente(34).
Ocasionalmente, esses pacientes podem cursar com astenia concomitante à
dispneia. Porém, esses dois sintomas na maioria das vezes não são bem
diferenciados tanto pelo avaliador quanto pelos pacientes(35).
9
A presença de congestão pulmonar é resultante da elevação das
pressões de enchimento do átrio e ventrículo esquerdo. Esse é um evento
clínico frequente e requer, na maioria das vezes, ajustes repetidos da
medicação. Caso não haja controle dos sinais de congestão a hospitalização
do paciente pode ser necessária para estabilizar o quadro(2).
A congestão veno-capilar pulmonar caracteriza-se pelo acúmulo renal de
sódio que acarreta em retenção hídrica, o que ocasiona a sobrecarga de
volume nos espaços intersticiais dos pulmões. Posteriormente, os alvéolos
pulmonares começam a encher-se com o fluido, o que se manifesta
clinicamente pelo sintoma de dispneia(16, 36).
A dispneia e a fadiga podem limitar a capacidade de realização de
esforço físico levando a congestão pulmonar e sistêmica e ao aumento da
resistência vascular periférica(37). A presença da dispneia de esforço limitante
associada à congestão pulmonar é um dos sinais iniciais da disfunção
diastólica, evidenciada pela presença da quarta bulha proeminente. Na
disfunção sistólica, ocorre predomínio da fadiga muscular secundária a
hipoperfusão tecidual, evidenciada pela presença da terceira bulha e desvio do
ictus cordis(38).
Além disso, a IC causa alterações funcionais, metabólicas e histológicas
na musculatura inspiratória. Em 30 a 50% dos pacientes ocorre fraqueza
destes músculos, ocasionando consequentemente redução da capacidade
funcional, piora no prognóstico clínico e redução da qualidade de vida destes
indivíduos. Ainda, existe relação entre o sistema de controle autonômico destes
pacientes com a intolerância ao exercício e a fraqueza da musculatura
10
inspiratória, o que segundo estudos realizados previamente poderiam ser
melhorados com treinamento físico(39).
Outros aspectos também evidenciados de forma subjetiva, como a
severidade e a sensação dos pacientes, são alvos importantes para a
intervenção que não podem ser mensurados por radiografia, exames
laboratoriais ou outros dados clínicos(40).
Desta forma, o exame físico detalhado tem grande relevância clínica,
uma vez que consegue achar sinais e sintomas característicos da doença,
além de contribuir com o prognóstico médico e o planejamento de intervenções
para minimizar os sintomas.
Apesar de a dispneia ser um alvo importante para o tratamento da IC, a
melhor forma de mensurá-la ainda é dúbia(34), para que seja corretamente
aferida, é necessário inicialmente distinguir dispneia usual de dispneia atual.
Dispneia usual relaciona-se àquela apresentada nas atividades cotidianas,
como por exemplo, para subir escadas. Enquanto que dispneia atual refere-se
a um momento preciso, como após os exercícios(15).
1.4.1.2 Escalas de avaliação/ Aferição da dispneia
Diferentes instrumentos foram criados e têm sido utilizados para a
aferição da dispneia, entre eles a escala Likert de 5 pontos, ondeos pacientes
podem demonstrar o grau de concordância ou discordância com os dados
apresentados. Trata-se de uma escala psicométrica utilizada em pesquisas
quantitativas que tem por objetivo registrar o nível de concordância ou
discordância sobre algum assunto. Pode ser apresentada de forma ordinal ou
11
intervalar atingindo graus relativos (hierarquia) e não de quantidade. Mais
comumente apresenta-se em cinco níveis, mas pode ser utilizada em 4 a 10
níveis.Na dispneia, esta escala é usada como forma de verificar a mudança da
linha de base em que o paciente se encontra em dois momentos e posições
diferentes(3,16,17,26).
A
escala
análogo-visual
(EAV),
proposta
para
uma
avaliação
simplificada, na qual, utiliza-se uma linha vertical ou horizontal de 100mm, na
qual o paciente sinaliza o ponto correspondente a sua falta de ar. Nas
extremidades desta linha existem frases que variam de “ausência de falta de
ar” a “falta de ar extrema” para facilitar o entendimento de que a linha deve ser
pensada em graduações. Este método foi validado em muitos estudos, sendo
considerada uma das melhores escalas de dispneia já desenvolvidas para
avaliação de pacientes em associação com exercício físico(29).
A escala Likert de 5 pontos, escala psicométrica, não foi elaborada
especificamente para a aferição da dispneia, porém tem seu uso descrito nessa
situação(2). Essa escala pode ser utilizada como forma de verificar a
mudanças na intensidade do sintoma em dois momentos. A escala de
Likertvaria de ausência de dispneia (pontuação zero) a falta de ar considerada
muito forte (pontuação 5)(3-5,7).
Estudos que compararam as múltiplas ferramentas para avaliação da
dispneia demonstraram que a EAV, apesar de apresentar grande variabilidade
de resposta, provou ser a medida mais reprodutível e sensível para detectar
mudanças na sensação de falta de ar, enquanto a escala de Borg(60) tem
maior sensibilidade para detectar alterações na sensação de fadiga e a escala
Likert possuiu a mais fácil aplicação e interpretação(4,29,41).
12
Estudo de corte observacional multicêntrico internacional avaliou a
dispneia através da escala Likert. Entretanto, a abordagem teve por objetivo
observar a presença de ortopneia após intervenção terapêutica, não
caracterizando a dispneia como preditora de eventos clínicos como reinternação(5). Outro estudo publicado recentemente mostrou que as melhores
medidas de dispneia envolvem avaliar a qualidade de vida dos pacientes,
porém, os questionários são demorados e exigem mais experiência dos
pesquisadores, fatores que justificam a aplicação das escalas Likert Análogovisual. Estes autores ainda salientam que estas duas escalas já foram
estabelecidas em vários estudos como instrumentos válidos, confiáveis e fáceis
de utilizar na prática clínica(8).
Desta forma, não existe consenso ou padrão ouro sobre qual
instrumento deve ser utilizado. Embora a escala análogo-visual pareça ter
maior sensibilidade, a escala Likert é de fácil aplicabilidade principalmente em
estudos clínicos(34,42,43).
Neste contexto, a utilização de escalas objetivas para a mensuração da
dispneia e da congestão pulmonar, como uma ferramenta prognóstica, podem
auxiliar na tomada de decisão da equipe de saúde frente a pacientes
acometidos por esta síndrome, contribuindo com a redução das taxas de
descompensação, das re-internações hospitalares e melhorando a qualidade
de vida destes pacientes.
13
1.5 DIAGNÓSTICO E CLASSIFICAÇÃO
Os sinais e sintomas clínicos possuem fundamental importância para a
suspeição e o diagnóstico clínico da IC, o qual pode ser realizado a partir dos
critérios de Boston e de Framigham.
O diagnóstico realizado através dos critérios de Framingham apresenta
algumas
características
clínicas
como
critérios
maiores
e
menores;
necessitando da presença simultânea de pelo menos dois critérios maiores ou
um critério maior em conjunto com dois critérios menores(11)(QUADRO 1).
Critérios maiores:
a) Dispneia paroxística noturna;
b) Turgência de jugular;
c) Crepitações pulmonares;
d) Cardiomegalia (à radiografia de tórax);
e) Edema agudo de pulmão;
f) Terceira bulha (galope);
g) Aumento da pressão venosa central (>16cm H 2O no átrio direito);
h) Reflexo hepatojugular;
i) Perda de peso> 4,5Kg em 5 dias em resposta ao tratamento..
Critérios menores:
a) Edema de tornozelos bilateral;
b) Tosse noturna;
c) Dispneia a esforços ordinários;
d) Hepatomegalia;
e) Derrame pleural;
f) Diminuição da capacidade funcional em um terço da máxima registrada
previamente;
g) Taquicardia (FC> 120bpm).
QUADRO 1: Critérios de Framingham para o diagnóstico da IC(32).
14
Através dos critérios de Boston, o diagnóstico é dado como definitivo,
com uma pontuação entre 8 e 12 pontos, “possível”, com uma pontuação entre
5 e 7 pontos e “improvável” se a pontuação for de 4 ou menos (QUADRO 2).
Critério
Pontos
Categoria I: história
Dispneia em repouso
4
Ortopnéia
4
Dispneia paroxística noturna
3
Dispneia ao caminhar no plano
2
Dispneia ao subir escadas
1
Categoria II: exame físico
Frequência cardíaca (FC) (1 ponto se FC 91 a 110bpm; 2 pontos se 1 ou 2
FC>110bpm)
Turgência de jugular (2 pontos se >6cm H 2O; 3 pontos se > 6cm H2O 2 ou 3
mais hepatomegalia ou edema )
Crepitantes pulmonares (1 ponto se restrito às bases; 2 pontos se 1 ou 2
mais do que apenas nas bases)
Sibilos
3
Terceira bulha cardíaca
3
Categoria III: radiografia de tórax
Edema pulmonar alveolar
4
Edema pulmonar intersticial
3
Derrame pleural bilateral
3
Índice cardiotorácico> 0,50
3
Redistribuição de fluxo para lobos superiores
2
QUADRO 2: Critérios de Boston para o diagnóstico da IC(32).
O diagnóstico entre IC com fração de ejeção do ventrículo esquerdo
(FEVE) preservada ou não, é feito através da presença de quatro
15
características: presença de sinais e sintomas de IC; FEVE ≥ 50%, VE não
dilatado (volume telediastólico<97ml/m2) e evidência de pressão de enchimento
do VE elevada(44).
Com o intuito de melhor descrever a IC, algumas classificações foram
criadas conforme seu estágio clínico. A IC aguda pode surgir a partir de
diversas etiologias e pode incluir várias comorbidades, pois se manifesta após
uma súbita alteração estrutural e funcional cardíaca. Já a IC crônica é uma
síndrome clínica complexa, resultante da disfunção cardíaca que prejudica a
capacidade de enchimento e ejeção ventricular, produzindo as manifestações
clínicas da doença(9).
A forma clássica e muito questionada da IC classifica os pacientes em
dois grupos: os que apresentam IC diastólica (ICD) ou com fração de ejeção
preservada e os portadores de IC sistólica (ICS) ou com fração de ejeção
reduzida(9,44). ICD tem se mostrado predominantemente em pacientes do
sexo feminino, mais idosos, com diversas comorbidades associadas a
hipertensão, diabetes e obesidade(9).
A classificação da IC crônica proposta pela New York Heart Association
(NYHA) categorizada conforme a intensidade dos sintomas estratifica em
quatro classes conforme o grau de limitação imposto pela doença para
atividades cotidianas(11,13,45). Em 2001, foi publicada a classificação da IC
proposta pela American Heart Association (AHA) e American College of
Cardiology (ACC), outra classificação, com acréscimo dos fatores de risco para
a IC(13,46).
16
Estágios da IC pela ACCF/ AHA
Classificação funcional pela NYHA
A Com alto risco de IC mas sem Nenhum
sintomas estruturais de IC.
B Doença cardíaca estrutural mas
I
Sem
limitações
para
ausência
de
sinais
e/ou
atividades físicas. Atividades
sintomas de IC.
físicas comuns não causam
sintomas de IC.
C Cardiopatia
I
estrutural
com
Sem
limitações
para
sintomas prévios ou atuais de
atividades físicas. Atividades
IC.
físicas comuns não causam
sintomas de IC.
II
Discreta
limitação
à
atividade física. Confortáveis
em repouso, mas atividade
física resulta em sintomas de
IC.
III
Marcada
limitação
à
atividade física. Confortável
em repouso, mas atividades
menores que as rotineiras
(pequenos esforços) causam
sintomas.
D IC refratária necessitando de
IV
Incapaz de realizar qualquer
intervenções especializadas
atividade
física
sem
sintomas de IC. Sintomas de
IC em repouso.
QUADRO 3: Comparação entre os estágios da IC conforme a ACCF/AHA e a Classificação
funcional pela NYHA(47).
2. EXAMES COMPLEMENTARES
2.1 PEPTÍDEOS NATRIURÉTICOS (BNP)
Os exames laboratoriais também auxiliam não só no diagnóstico, mas
também no controle prognóstico da patologia. As gasometrias arteriais
permitem analisar a oxigenação e a função respiratória dos pacientes; as
troponinas são utilizadas como critérios de exclusão para as síndromes
coronarianas agudas e os peptídeos natriuréticos (BNP e NT-proBNP) podem
excluir o diagnóstico de IC(13,32,34).
17
O Peptídeo Natriurético Atrial (BNP) é liberado na tentativa de
compensar os sistemas vasoconstritores ativados quando o coração sofre uma
agressão crônica ou aguda. As principais ações desse sistema são a promoção
de diurese e a vasodilatação(48,49). Estudos demonstraram que o uso da
medida sérica do BNP auxilia no diagnóstico diferencial de dispneia de causa
cardíaca e não cardíaca em nível emergencial(47,50).
A dosagem desse peptídeo também tem importância na avaliação do
tratamento e prognóstico dos pacientes com IC congestiva(49,50). Estudo
prospectivo realizado em um departamento de emergência incluindo 70
pacientes com queixas de dispneia em repouso teve por objetivo avaliar a
utilidade do BNP. Ao término do trabalho, os autores observaram que em
pacientes com dispneia intensa e um diagnóstico duvidoso de IC, os índices de
BNP < 900pg/ml ajudam a excluir a presença de IC, enquanto que níveis
>5500pg/ml identificam pacientes com risco aumentado de óbito(51).
Meta-análise que incluiu pacientes com quadro clínico de dispneia aguda
em emergências buscou investigar se a aferição do BNP reduziria as
admissões, o tempo de permanência e a sobrevida em curto prazo, comparado
com cuidados médicos habituais, sem BNP. Os achados mostraram que o
tempo de permanência hospitalar destes pacientes diminuiu por cerca de um
dia, porém, não foram conclusivas as avaliações a respeito das taxas de
mortalidade(52).
Estudo transversal contemporâneo realizado em um ambulatório de IC
com 63 pacientes teve por objetivo comparar a avaliação clínica de congestão
realizada por uma enfermeira com a avaliação do cardiologista (durante a
mesma visita) e correlacioná-los aos níveis de BNP. Ao término do estudo, foi
18
estabelecido que avaliações dos enfermeiros pudessem ter um desempenho
semelhante às dos cardiologistas para a detecção clínica de congestão e
avaliação hemodinâmica do pacientes com IC(53).
2.2 ULTRASSONOGRAFIA PULMONAR
Além disso, a ultrassonografia pulmonar também pode ser um indicador
da presença de edema pulmonar assintomático, auxiliando na profilaxia e
otimização do tratamento clínico(54, 55). Através desse método diagnóstico
não invasivo, pode-se mensurar a quantidade de líquido pulmonar existente;
desta forma, a presença das linhas B de Kerley são um indicador de congestão
pulmonar e está correlacionada diretamente com os níveis de NT-proBNP(17).
Assim, pacientes com maiores graus de congestão pulmonar possuem níveis
mais
elevados
de
peptídeos
natriuréticos,
sendo
esses
diretamente
correlacionados a um pior prognóstico(11,20,44).
Porém, existem poucos estudos que avaliam a dispneia e a congestão
pulmonar por medidas de água livre nos pulmões. A escassa literatura
existente avalia pacientes com IC em unidades de urgência / emergência e não
a nível ambulatorial.
Embora se saiba que o BNP não é considerado padrão ouro para
avaliação da congestão pulmonar e o método mais apropriado para esta
aferição é hemodinamicamente invasivo, por avaliar a pressão pulmonar no
átrio esquerdo, o que é impraticável ambulatorialmente, serão considerados
congestos os pacientes atendidos no ambulatório com níveis de NT-proBNP>
1000pg/mL. Estes valores baseiam-se em estudos que evidenciaram um
19
aumento da morbidade e mortalidade em pacientes com IC e valores
superiores deste marcador(56-58).
Bem como, vão ao encontro do ponto de corte utilizado em ensaios
clínicos randomizados que guiaram o tratamento ambulatorial da IC(59, 60).
2.3 ECOCARDIOGRAMA
A realização do eco cardiograma também merece consideração não só
no diagnóstico como também no prognóstico e para definir a terapêutica que
deverá ser utilizada(13,32,34). Este exame possibilita informações anatômicas
e fisiológicas importantes como a quantificação da função sistólica ventricular
esquerda (fração de ejeção), fundamental na definição do tratamento, bem
como para a diferenciação entre IC sistólica e diastólica(13,32).
Tal método permite ainda avaliar a pressão atrial esquerda, quando
avaliado em associação ao fluxo valvar trans mitral não tissular (E/E’)(13). Esta
relação E/E’ obtida ao estudo ecocardiográfico, considerando-se como ponto
de corte o valor E/E’≥15 como indicativo de congestão hemodinâmica,
correspondente
a
uma
pressão
de
enchimento
ventricular
esquerdo
elevado(61,62). Ainda, o eco cardiograma pode mensurar de forma não
invasiva as pressões sistólica e diastólica, o débito cardíaco, a pressão venosa
sistêmica, a pressão média da artéria pulmonar e a resistência vascular
pulmonar e sistêmica(13,32).
Outros métodos de imagem também podem ser usados na avaliação do
paciente com IC principalmente nos casos em que as informações fornecidas
pela eco cardiografia não tenham sido suficientes. Estes exames incluem eco
20
cardiografia de estresse, a ressonância magnética cardíaca, a imagem por
medicina nuclear e a tomografia computadorizada cardíaca(13,34).
2.4 TESTE DE CAMINHADA DE SEIS MINUTOS
Além disso, aos pacientes clinicamente estáveis e sem contraindicações
ao exercício físico, é indicado o teste de esforço ergoespirométrico ou o teste
de caminhada de seis minutos(34). Por ser amplamente disponível, seguro e
de fácil execução(8,63) o teste de caminhada está sendo cada vez mais
utilizado para avaliar a capacidade funcional dos pacientes com IC como uma
alternativa ao teste de esforço cardiopulmonar(8).
O teste de caminhada de seis minutos é utilizado para medir a
capacidade funcional em pacientes com variabilidade das condições clínicas e
tenta reproduzir as atividades da vida diária(8,63). Isto ocorre porque até o
término do teste, o consumo de oxigênio aumenta minuto a minuto, desta
forma, diz-se que é um teste de capacidade funcional máxima, pois é realizado
acima do limiar ventilatório(63). Geralmente, é bem tolerado pelos pacientes e
a distância percorrida durante o teste é uma preditora independente de
mortalidade e re-internações por IC. Através do aumento da distância
percorrida durante os seis minutos do teste também é possível avaliar a
resposta às intervenções terapêuticas realizadas(8). Porém, alguns fatores
podem influenciar no desempenho do teste, tais como a altura, idade, sexo,
comorbidades e motivação aos pacientes pelo operador do teste(63).
Como alternativa para avaliar a capacidade física ao exercício
submáximo, os pacientes são submetidos ao teste de caminhada de 6 minutos
21
(TC6). O teste é realizado em um corredor plano com 30 metros de
comprimento, no qual é avaliada a distância máxima que o paciente conseguiu
andar durante o tempo de 6 minutos. Nas ocasiões em que o paciente não
completa o TC6, deve-se reportar o motivo da interrupção, o tempo tolerado e a
distância percorrida. Todos os pacientes que realizam o teste devem ter os
sinais vitais (frequência cardíaca, frequência respiratória e saturação de
oxigênio) avaliados antes e imediatamente após o seu término.
O teste de caminhada também se mostra uma alternativa segura e
adequada à prescrição de exercícios físicos em pacientes com IC não
avançada(8), já que a prática desses pode reduzir a fraqueza muscular
inspiratória e consequentemente a dispneia(39).
Os sintomas experimentados por pacientes com IC frequentemente
levam à redução das atividades físicas e a falta de condicionamento físico; o
que faz com que ocorra intolerância ao exercício e piora dos sintomas. Os
sintomas como fadiga e dispneia são atribuídas à falha da bomba cardíaca e
consequente acúmulo de resíduos da produção anaeróbia devido ao aporte
insuficiente de oxigênio, bem como o aumento das pressões do átrio esquerdo
e congestão pulmonar(64).
Porém, além desta fisiopatologia tradicionalmente atribuída como
causadora dos sintomas da IC, o cansaço e a dispneia também pode ocorrer
em parte devido a incapacidade do exercício muscular na utilização de oxigênio
em vez da falta de fornecimento de oxigênio secundário para a falha da bomba
cardíaca como se pensava anteriormente. Fatores estes que podem explicar a
melhoria da ação da musculatura esquelética e o impacto do exercício físico na
redução de sintomas como fadiga e dispneia nos pacientes com IC(64).
22
Estudo prospectivo longitudinal controlado realizado com 60 pacientes
idosos portadores de IC congestiva teve por objetivo determinar os efeitos de
um programa de exercícios físicos sobre a capacidade física e qualidade de
vida nestes pacientes. Para realização do mesmo, foram aplicados exercícios e
treinamento de resistência durante 12 meses. Os resultados obtidos neste
estudo mostraram aumento significativo da resistência muscular e melhora em
menos de 3 meses do teste de caminhada de seis minutos bem como da
qualidade de vida dos pacientes(65).
23
3.
ATUAÇÃO DA ENFERMAGEM NA IC
Nas últimas décadas diversas abordagens multidisciplinares na avaliação,
no acompanhamento e no seguimento de pacientes com IC têm sido
estudadas, mostrando benefícios para a melhora da qualidade de vida e
consequentemente redução das readmissões(66).
No Brasil, ainda são incipientes os estudos de efetividade da avaliação
multidisciplinar ou de enfermagem para avaliar os desfechos clínicos nesta
população de pacientes. É sabido que a forma mais comum de instabilidade
clínica são quadros congestivos presentes em 80-90% dos pacientes que se
apresentam nos serviços de emergência(67). Uma avaliação clínica criteriosa e
especializada permite que os pacientes sejam precocemente manejados para
reduzir a congestão pulmonar e sistêmica.
Um estudo recente avaliou o papel da enfermeira e as responsabilidades
educacionais e exigências de treinamento referentes à IC, pois, pode haver
variações nas responsabilidades em diferentes contextos dos cuidados à
saúde, no entanto, os princípios são semelhantes e incluem anamnese,
avaliação clínica e conduta apropriada sobre o manejo das condições clínicas
dos pacientes(18).
Estes autores citam ainda que a readmissão poderia ter sido evitada em
40-59% dos pacientes se a alta hospitalar tivesse sido mais cuidadosamente
planejada, se a reabilitação tivesse sido mais adequada, se problemas de má
adesão medicamentosa tivessem sido identificados e se os pacientes tivessem
sido instruídos a procurar atendimento médico aos primeiros sintomas. Sendo
assim, foram necessárias formas inovadoras de gerir este grupo de pacientes,
24
tanto para reduzir custos como para melhorar a prestação do cuidado na qual
demonstrou-se que as enfermeiras especialistas em IC têm um impacto
substancial em limitar as dispendiosas admissões além de auxiliar na melhora
da qualidade de vida destes pacientes(18).
A quantificação objetiva dos sintomas IC, principalmente o de dispneia, é
limitada por uma subjetividade na descrição da sensação referida pelo
paciente. Os fatores responsáveis por esse fenômeno são diversos, estando
entre eles a variabilidade da percepção entre os diferentes pacientes, o tempo
de instauração do sintoma, a presença ou não de patologias associadas, a
cognição, entre outros(10,14-16).
Um estudo gaúcho comparou a avaliação clínica sistemática para
congestão estimada em pacientes com IC entre enfermeira e cardiologista,
correlacionando com níveis de NT-ProBNT, marcador sanguíneo de congestão.
Os resultados evidenciaram uma correlação das pontuações obtidas pelos
escores clínicos de congestão entre enfermeira e cardiologista de 0,45 com
p<0,0001 e 0,51 com p<0,0001 respectivamente. Esses achados inferem que
enfermeiras e equipes multidisciplinares quando treinados na avaliação clínica
e no reconhecimento de quadros congestivos podem impactar diretamente na
melhora da qualidade de vida e otimização do tratamento com segurança.
Estratégias de educação, avaliação e intervenções de enfermeiros para
alcançar e manter a estabilidade clínica da doença possui comprovado impacto
na redução da mortalidade e na melhora da qualidade de vida dos pacientes
portadores de IC, principalmente no que se refere ao manejo não
farmacológico(1,20,26).
25
Estudo clínico cego realizado com portadores de IC, residentes em
Curitiba e região metropolitana, teve por objetivo analisar o impacto das
consultas de enfermagem na frequência das admissões hospitalares. Os
resultados mostraram que a frequência das readmissões foi reduzida através
das orientações sobre o tratamento complexo que envolve a IC emitidas nas
consultas de enfermagem(45).
Este processo educacional de conscientização dos pacientes sobre a
importância do autocuidado inclui principalmente o processo de tomada de
decisão que os pacientes usam para a restrição de sódio e líquidos, para o
excesso
de
peso
e
para
a
monitorização
dos
sinais
de
descompensação(11,20). Entretanto, estudos comprovam ainda que, embora a
educação sistemática para o autocuidado seja reforçada pelas equipes
multiprofissionais, nem sempre são compreendidas ou realizadas pelos
pacientes devido a má adesão às orientações para mudanças no estilo de
vida(1,11).
Ensaio clínico randomizado que incluiu 111 pacientes com IC
descompensada, objetivou verificar o conhecimento dos pacientes três meses
após serem reforçadas as orientações a respeito da doença em consultas
ambulatoriais. Os resultados mostraram que embora a educação tenha
melhorado o conhecimento e o autocuidado referente a IC, não foram
suficientes para reduzir as re-internações e melhorar a adesão ao
tratamento(2).
Desta forma, a qualidade de vida dos pacientes cardiopatas é atingida
diretamente pela autolimitação causada pela doença, bem como pelas
mudanças impostas ao estilo de vida destes doentes. Sendo assim, a avaliação
26
da qualidade de vida dos pacientes cardiopatas é indispensável para o manejo
da doença pela equipe de saúde, bem como das orientações necessárias para
a realização de um autocuidado que minimize os efeitos dos sintomas
infundidos pela patologia(68).
27
4. RELEVÂNCIA DO ESTUDO
Este estudo torna-se relevante para a prática clínica uma vez que
existem poucos estudos que avaliam a dispneia e a congestão pulmonar por
medidas de água livre nos pulmões. A escassa literatura existente avalia
pacientes com IC em unidades de urgência / emergência e não a nível
ambulatorial.
Desta forma, faz-se necessário avaliar se a dispneia pode definir
objetivamente a congestão pulmonar e predizer a ocorrência de eventos em
pacientes com IC, correlacionando de maneira objetiva com o número de linhas
B pulmonares e com os níveis séricos da Porção N-terminal do pró-hormônio
Peptídeo Natriurético do Tipo B (NT-proBNP), a fim de desenvolver estratégias
de medidas de saúde dirigidas a esta população de pacientes.
28
5.
HIPÓTESE
5.1 HIPÓTESE CONCEITUAL
Níveis de dispneia estimados pelas escalas podem definir objetivamente
congestão pulmonar e predizer a ocorrência de eventos em pacientes com IC
através da associação entre água livre no pulmão (congestão mensurada pela
ultrassonografia pulmonar) e níveis séricos de NT-proBNP com os níveis de
dispneia estimada pelas escalas análogo visual e a escala Likert.
29
6. OBJETIVOS
6.1 GERAL
Avaliar se a dispneia pode definir objetivamente a congestão pulmonar e
predizer a ocorrência de eventos em pacientes com IC.
6.2 ESPECÍFICOS
1.
Verificar se existe a associação entre água livre no pulmão (congestão
mensurada pela ultrassonografia pulmonar) com os níveis de dispneia
estimados pelas escalas análogas visuais e a escala Likert.
2.
Verificar se existe a associação entre níveis séricos de NT-proBNP com
os níveis de dispneia estimados pelas escalas análogas visuais e a escala
Likert.
3.
Verificar se pacientes com maiores pontuações em escalas objetivas de
mensuração de dispneia possuem uma maior ocorrência de eventos adversos
quando estratificados por fatores como fração de ejeção ventricular, idade,
classe funcional e NT-proBNP.
30
7.
REFERÊNCIAS
1.
Rabelo ER, Aliti GB, Goldraich L, Domingues FB, Clausell N, Rohde LE.
Non-pharmacological management of patients hospitalized with heart failure at
a teaching hospital. Arquivos Brasileiros de Cardiologia.2006;87(3):352-8.
2.
Domingues FB, Clausell N, Aliti GB, Dominguez DR, Rabelo ER.
Education and telephone monitoring by nurses of patients with heart failure:
randomized clinical trial. Arquivos Brasileiros de Cardiologia. 2011;96(3):233-9.
3.
Socrates T, Mebazaa A. How to measure dyspnea in acute heart failure?
Ther Umsch. 2009;66(9):639-42.
4.
Mebazaa A, Pang PS, Tavares M, Collins SP, Storrow AB, Laribi S, et al.
The impact of early standard therapy on dyspnoea in patients with acute heart
failure: the URGENT-dyspnoea study. Eur Heart J. 2010;31(7):832-41.
5.
Martinez JAB, Padua AId, Terra Filho J. Dispnéia; Dyspnea. Medicina
(Ribeirão Preto). 2004;37(3/4):199-207.
6.
Aliti GB, Linhares JCC, Linch GFdC, Ruschel KB, Rabelo ER. Sinais e
sintomas de pacientes com insuficiência cardíaca descompensada: inferência
dos diagnósticos de enfermagem prioritários. Revista Gaúcha de Enfermagem.
2011;32(3):590-5.
7.
Camargo LA, Pereira CA. Dyspnea in COPD: beyond the modified
Medical Research Council scale. J Bras Pneumol. 2010;36(5):571-8.
8.
Carvalho EEV, Costa DC, Crescêncio JC, Santi GLD, Papa V, Marques
F, et al. Insuficiência cardíaca: comparação entre o teste de caminhada de seis
31
minutos e o teste cardiopulmonar. Arquivos Brasileiros de Cardiologia.
2011;97(1):59-64.
9.
Nieminen MS, Harjola VP. Definition and Epidemiology of Acute Heart
Failure Syndromes. The American Journal of Cardiology. 2005;96(6):5-10.
10.
Nogueira ID, Servantes DM, Nogueira PA, Pelcerman A, Salvetti XM,
Salles F, et al. Correlation between quality of life and functional capacity in
cardiac failure. Arq Bras Cardiol. 2010;95(2):238-43.
11.
Linhares JC, Aliti GB, Castro RA, Rabelo ER. Prescribing and conducting
non-pharmacological management of patients with decompensated heart failure
admitted to a university hospital emergency. Rev Lat Am Enfermagem.
2010;18(6):1145-51.
12.
Barretto ACP, Del Carlo CH, Cardoso JN, Morgado PC, Munhoz RT, Eid
MO, et al. Re-hospitalizações e morte por insuficiência cardíaca: índices ainda
alarmantes. Arquivos Brasileiros de Cardiologia. 2008;91(5):335-41.
13.
Bocchi EA, Braga FGM, Ferreira SMA, Rohde LEP, Oliveira WAd,
Almeida DRd, et al. III Diretriz Brasileira de Insuficiência Cardíaca Crônica.
Arquivos Brasileiros de Cardiologia. 2009;93(1):3-70.
14.
Wang CS, FitzGerald JM, Schulzer M, Mak E, Ayas NT.Does this
dyspneic patient in the emergency department have congestive heart failure?
JAMA. 2005;294(15):1944-56.
15.
Vader JM, Drazner MH. Clinical assessment of heart failure: utility of
symptoms, signs, and daily weights. 2009;5(2):149-60.
16.
Stevenson LW, Perloff JK. The limited reliability of physical signs for
estimating hemodynamics in chronic heart failure. JAMA.1989; 261(6):884-8.
32
17.
Picano E, Gargani L, Gheorghiade M. Why, when, and how to assess
pulmonary congestion in heart failure: pathophysiological, clinical, and
methodological implications. Heart Fail Rev. 2010;15(1):63-72.
18.
Blue L, McMurray J. How much responsibility should heart failure nurses
take? European Journal of Heart Failure. 2005;7(3):351-61.
19.
Felker GM, Adams KF, Jr., Konstam MA, O'Connor CM, Gheorghiade M.
The problem of decompensated heart failure: nomenclature, classification, and
risk stratification. Am Heart J. 2003;145(2 Suppl):S18-25.
20.
Rabelo ER, Aliti GB, Domingues FB, Ruschel KB, de Oliveira Brun A.
What to teach to patients with heart failure and why: the role of nurses in heart
failure clinics. Rev Lat Am Enfermagem. 2007;15(1):165-70.
21.
Diwan A, Tran T, Misra A, Mann DL. Inflammatory mediators and the
failing heart: a translational approach. Curr Mol Med. 2003;3(2):161-82.
22.
Klabunde RE. Heart failure. Cardiovascular physiology concepts.
Lippincott Willians & Wilkins. 2 ed. 2012.
23.
Oliveira Jr MT, Follador W, Martins MLO, Canaviera R, Tsuji RLG,
Scipioni A, et al. Cost analysis of the treatment of acute decompensated heart
failure:
levosimendan
versus
dobutamine.
Arquivos
Brasileiros
de
Cardiologia.85:9-14.
24.
DL M. Heart failure and cor pulmonale. In: Loscalzo J, ed. Herrison's
cardiovascular medicine. New York: McGraw-Hill Medical. 2010. p. 178-97.
25.
McMurray JJ. Clinical practice. Systolic heart failure. N Engl J Med.
2010;362(3):228-38.
26.
Pang PS, Cleland JGF, Teerlink JR, Collins SP, Lindsell CJ, Sopko G, et
al. A proposal to standardize dyspnoea measurement in clinical trials of acute
33
heart failure syndromes: the need for a uniform approach. European Heart
Journal.29(6):816-24.
27.
Mahler DA, Selecky PA, Harrod CG, Benditt JO, Carrieri-Kohlman V,
Curtis JR, et al. American College of Chest Physicians consensus statement on
the management of dyspnea in patients with advanced lung or heart disease.
Chest. 2010;137(3):674-91.
28.
Russell SD, McNeer FR, Higginbotham MB. Exertional dyspnea in heart
failure: a symptom unrelated to pulmonary function at rest or during exercise.
Duke University Clinical Cardiology Studies (DUCCS) Exercise Group. Am
Heart J. 1998;135(3):398-405.
29.
Teerlink JR. Dyspnea as an end point in clinical trials of therapies for
acute decompensated heart failure. Am Heart J. 2003;145(2Suppl):S26-S33.
30.
Fletcher CM. The clinical diagnosis of pulmonary emphysema; an
experimental study. Proceed R Soc Med. 1952;45(9):577.
31.
Fletcher CM, Elmes PC, Fairbairn AS, Wood CH. The significance of
respiratory symptoms and the diagnosis of chronic bronchitis in a working
population. Br Med J. 1959;2(5147):257-66.
32.
Montera MW, Almeida RA, Tinoco EM, Rocha RM, Moura LZ, Réa-Neto
A, et al. Sociedade Brasileira de Cardiologia. II Diretriz Brasileira de
Insuficiência Cardíaca Aguda. Arq Bras Cardiol. 2009; 93(3supl.3):1-65.
33.
Feenstra J, Grobbee DE, Jonkman FA, Hoes AW, Stricker BH.
Prevention of relapse in patients with congestive heart failure: the role of
precipitating factors. Heart. 1998;80(5):432-6.
34
34.
Bocchi EA M-BF, Bacal F, Ferraz AS, Albuquerque D, Rodrigues D, et al.
Sociedade Brasileira de Cardiologia. Atualização da Diretriz Brasileira de
Insuficiência Cardíaca Crônica. 2012:1-33.
35.
Fontes-Carvalho R, Leite-Moreira A. Insuficiência cardíaca com fração
de ejeção preservada: combater equívocos para uma nova abordagem.
Arquivos Brasileiros de Cardiologia. 2011;96:504-14.
36.
Michalsen A, Konig G, Thimme W. Preventable causative factors leading
to hospital admission with decompensated heart failure. Heart. 1998;80(5):43741.
37.
Lopes RD, Batista Júnior ML, Rosa JC, Lira FSd, Martins Jr E, Shimura
AY, et al. Changes in the production of IL-10 and TNF-alpha; in skeletal muscle
of rats with heart failure secondary to acute myocardial infarction. Arq Bras
Cardiol. 2010;94(3):313-20.
38.
Schmidt A. Insuficiência cardíaca diastólica e sistólica em pacientes
hipertensos:
diagnóstico
e
tratamento
diferenciais.
Rev
Bras
Hipert
2001;8(4):440-4.
39.
Ribeiro JP, Chiappa GR, Callegaro CC. The contribution of inspiratory
muscles function to exercise limitation in heart failure: pathophysiological
mechanisms. Rev Bras Fisioter. 2012;16(4):261-7.
40.
Holland R, Rechel B, Stepien K, Harvey I, Brooksby I. Patients' self-
assessed functional status in heart failure by New York Heart Association class:
a prognostic predictor of hospitalizations, quality of life and death. J Card Fail.
2010;16(2):150-6.
41.
Grant S, Aitchison T, Henderson E, Christie J, Zare S, McMurray J, et al.
A comparison of the reproducibility and the sensitivity to change of visual
35
analogue scales, Borg scales, and Likert scales in normal subjects during
submaximal exercise. Chest. 1999;116(5):1208-17.
42.
Colucci WS, Elkayam U, Horton DP, Abraham WT, Bourge RC, Johnson
AD, et al. Intravenous nesiritide, a natriuretic peptide, in the treatment of
decompensated congestive heart failure. Nesiritide Study Group. N Engl J Med.
2000;343(4):246-53.
43.
Louis A, Cleland JG, Crabbe S, Ford S, Thackray S, Houghton T, et al.
Clinical Trials Update: CAPRICORN, COPERNICUS, MIRACLE, STAF, RITZ-2,
RECOVER and RENAISSANCE and cachexia and cholesterol in heart failure.
Highlights of the Scientific Sessions of the American College of Cardiology,
2001. Eur J Heart Fail. 2001;3(3):381-7.
44.
Tavazzi L, Maggioni AP, Lucci D, Cacciatore G, Ansalone G, Oliva F, et
al. Nationwide survey on acute heart failure in cardiology ward services in Italy.
Eur Heart J. 2006;27(10):1207-15.
45.
Bento VFR, Brofman PRS. Impact of the nursing consultation on the
frequency of hospitalizations in patients with heart failure in Curitiba, Parana
State. Arquivos Brasileiros de Cardiologia.92:490-6.
46.
Hunt SA, Baker DW, Chin MH, Cinquegrani MP, Feldman AM, Francis
GS, et al. ACC/AHA guidelines for the evaluation and management of chronic
heart failure in the adult: executive summary. A report of the American College
of Cardiology/ American Heart Association Task Force on Practice Guidelines
(Committee to revise the 1995 Guidelines for the Evaluation and Management
of Heart Failure). Journal of the American College of Cardiology.38(7):2101.
47.
Yancy CW, Jessup M, Bozkurt B, Butler J, Casey DE, Drazner MH, et al.
2013 ACCF/AHA Guideline for the Management of Heart Failure: Executive
36
Summary:
A
Report
of
the
American
College
of
Cardiology
Foundation/American Heart Association Task Force on Practice Guidelines.
Circulation. 2013:CIR.0b013e31829e8807.
48.
Villacorta Júnior H, Mesquita ET. Clinical applications of B-type
natriuretic peptide assays. Arquivos Brasileiros de Cardiologia.86:251-5.
49.
Castro LRA, Alencar MCN, Barbosa MM, Nunes MdCP, Cardoso JR,
Ribeiro ALP. Nível de NT-proBNP em pacientes com síndrome coronariana
aguda sem supradesnivelamento do segmento ST. Arquivos Brasileiros de
Cardiologia. 2011;97:456-61.
50.
Fernandes F, Mady C. Qual o valor do BNP na prática clínica em
pacientes com insuficiência cardíaca? Revista da Associação Médica
Brasileira. 2003;49(2):117-36.
51.
Pascual Figal DA, Cerdán Sánchez MC, Noguera Velasco JA, Casas
Pina T, Muñoz Gimeno L, García Rodríguez R, et al. Usefulness of NTproBNP
in the Emergency Management of Patients With Severe Dyspnea and an
Uncertain Heart Failure Diagnosis. Revista Española de Cardiología (English
Edition). 2005;58(10):1155-61.
52.
Lam LL, Cameron PA, Schneider HG, Abramson MJ, Müller C, Krum H.
Meta-analysis: effect of B-type natriuretic peptide testing on clinical outcomes in
patients with acute dyspnea in the emergency setting. Ann of intern medicine.
2010;153(11):728-35.
53.
Sauer J, Rabelo ER, Castro RA, Goldraich L, Rohde LE, Clausell N, et
al. Nurses' performance in classifying heart failure patients based on physical
exam: comparison with cardiologist's physical exam and levels of N-terminal
pro-B-type natriuretic peptide. J Clin Nurs. 2010;19(23-24):3381-9.
37
54.
Frassi F, Pingitore A, Cialoni D, Picano E. Chest sonography detects
lung water accumulation in healthy elite apnea divers. J Am Soc Echocardiogr.
2008;21(10):1150-5.
55.
Fagenholz PJ, Gutman JA, Murray AF, Noble VE, Thomas SH, Harris
NS. Chest ultrasonography for the diagnosis and monitoring of high-altitude
pulmonary edema. Chest. 2007;131(4):1013-8.
56.
Masson S, Latini R, Anand IS, Vago T, Angelici L, Barlera S, et al. Direct
comparison of B-type natriuretic peptide (BNP) and amino-terminal proBNP in a
large population of patients with chronic and symptomatic heart failure: the
Valsartan Heart Failure (Val-HeFT) data. Clin Chem. 2006;52(8):1528-38.
57.
Masson S, Latini R, Anand IS, Barlera S, Angelici L, Vago T, et al.
Prognostic value of changes in N-terminal pro-brain natriuretic peptide in ValHeFT (Valsartan Heart Failure Trial). J Am Coll Cardiol. 2008;52(12):997-1003.
58.
Cleland JG, McMurray JJ, Kjekshus J, Cornel JH, Dunselman P,
Fonseca C, et al. Plasma concentration of amino-terminal pro-brain natriuretic
peptide in chronic heart failure: prediction of cardiovascular events and
interaction with the effects of rosuvastatin: a report from CORONA (Controlled
Rosuvastatin Multinational Trial in Heart Failure). J Am Coll Cardiol.
2009;54(20):1850-9.
59.
Januzzi JL, Jr., Rehman SU, Mohammed AA, Bhardwaj A, Barajas L,
Barajas J, et al. Use of amino-terminal pro-B-type natriuretic peptide to guide
outpatient therapy of patients with chronic left ventricular systolic dysfunction. J
Am Coll Cardiol. 2011;58(18):1881-9.
60.
Martinez-Rumayor AA, Vazquez J, Rehman SU, Januzzi JL. Relative
value of amino-terminal pro-B-type natriuretic peptide testing and radiographic
38
standards for the diagnostic evaluation of heart failure in acutely dyspneic
subjects. Biomarkers. 2010;15(2):175-82.
61.
Ommen SR, Nishimura RA, Appleton CP, Miller FA, Oh JK, Redfield MM,
et al. Clinical utility of Doppler echocardiography and tissue Doppler imaging in
the estimation of left ventricular filling pressures: A comparative simultaneous
Doppler-catheterization study. Circulation. 2000;102(15):1788-94.
62.
Nagueh SF, Middleton KJ, Kopelen HA, Zoghbi WA, Quinones MA.
Doppler tissue imaging: a noninvasive technique for evaluation of left ventricular
relaxation
and
estimation
of
filling
pressures.
J
Am
Coll
Cardiol.
1997;30(6):1527-33.
63.
Pepera GK, Sandercock GR, Sloan R, Cleland JJF, Ingle L, Clark AL.
Influence of step length on 6-minute walk test performance in patients with
chronic heart failure. Physiotherapy. 2011;98(4):330-4.
64.
Pozehl B, Duncan K, Hertzog M. The effects of exercise training on
fatigue and dyspnea in heart failure. Eur J Cardiovasc Nurs. 2008;7(2):127-32.
65.
Pihl E, Cider A, Stromberg A, Fridlund B, Martensson J. Exercise in
elderly patients with chronic heart failure in primary care: effects on physical
capacity
and
health-related
quality
of
life.
Eur
J
Cardiovasc
Nurs.
2011;10(3):150-8.
66.
Holland R, Battersby J, Harvey I, Lenaghan E, Smith J, Hay L.
Systematic review of multidisciplinary interventions in heart failure. Heart.
2005;91(7):899-906.
67.
Miranda CH CR, Filho AP. Abordagem da descompensação aguda da
insuficiência cardíaca crônica. Medicina. 2003:179-86.
39
68.
Saccomann ICR, Cintra FA, Gallani MCBJ. Qualidade de Vida
relacionada à Saúde em Idosos com Insuficiência Cardíaca: avaliação com
instrumento específico. Acta Paul Enferm. 2011;24(2):179-84.
40
8.
ARTIGO EM PORTUGUÊS
A ESCALA LIKERT DE CINCO PONTOS PARA DISPNEIA PODE AVALIAR
ADEQUADAMENTE O GRAU DE CONGESTÃO PULMONAR E PREVER
EVENTOS ADVERSOS EM PACIENTES COM IC AVALIADOS
AMBULATORIALMENTE
Título abreviado: quantificação da dispneia
Cristina K Weber RN, Marcelo H Miglioranza MD, Mª Antonieta P de Moraes
RN PhD, Roberto T Sant'anna MD, Marciane M Rover MD, Renato A K Kalil
MD PhD FACC, Tiago Luiz L Leiria MD PhD
AUTOR PARA CORRESPONDÊNCIA:
Tiago Luiz Luz Leiria MD PhD
Avenida Princesa Isabel, 395. Telefone (51)32303860.
Bairro Santana,
90620-001 - Porto Alegre, RS - Brasil
e-mail: [email protected]
41
RESUMO
Objetivo: Determinar se a dispneia classificada de acordo com a escala Likert
de 5 pontos (5PLS) pode definir objetivamente congestão pulmonar e predizer
a ocorrência de eventos cardiovasculares em pacientes ambulatoriais com
insuficiência cardíaca (IC) crônica. Métodos: Estudo de coorte prospectivo que
incluiu pacientes com IC moderada a grave. A 5PLS foi aplicada durante as
visitas ambulatoriais regulares ao longo das avaliações clínicas. Ultrassom de
pulmão com número de linhas B ≥ 15 e níveis de NT-proBNP> 1000pg/mL foi
utilizado como referência para congestão pulmonar. A cada 30 dias, durante o
acompanhamento, os pacientes foram avaliados para identificar os desfechos
clínicos adversos. Resultados: Foram incluídos 58 pacientes, 65,5 % do sexo
masculino, idade 43,5±11 anos, com fração de ejeção do ventrículo esquerdo
(FEVE) de 27±6% e 29,3% de etiologia isquêmica de IC. A congestão pulmonar
esteve presente em 58% dos pacientes. Um maior grau de dispneia (3 ou 4
pontos na 5PLS) foi correlacionada significativamente com um número maior
de linhas B (P=0,016). Pacientes estratificados em Likert 3-4 estavam em um
risco aumentado para a admissão, quando comparados àqueles do grupo 1-2
após o ajuste pela idade, FEVE, classe funcional (New York Heart Association),
e níveis de NT -proBNP>1000pg/ml (HR= 4,9, IC 95% 1,33-18,64, P=0,017).
Conclusão: Os escores basais mais elevados sobre 5PLS foram relacionados
para congestão pulmonar e associada independentemente com eventos
cardiovasculares durante o acompanhamento. Esta ferramenta clínica simples
pode ajudar a identificar os pacientes que são mais propensos a descompensar
e cujo tratamento deve ser intensificado.
Palavras-chave: Insuficiência cardíaca, dispneia, escala Likert
42
INTRODUÇÃO
A dispneia é definida como uma experiência subjetiva do desconforto
respiratório que consiste em sensações qualitativamente distintas que variam
em intensidade. Esta condição é causada por interações entre vários fatores
fisiológicos, psicológicos, sociais, ambientais e podem induzir respostas
secundárias fisiológicas e comportamentais 1. A quantificação objetiva da
dispneia na insuficiência cardíaca (IC) é limitada pela subjetividade em relatar
este sintoma comum. Não há consenso sobre qual é a melhor maneira de
medir e quantificar a sensação subjetiva de "falta de ar”, tornando esta tarefa
extremamente difícil para os pacientes e profissionais da área da saúde 2.
A escala de Likert de 5 pontos (5PLS) é um instrumento psicométrico
para o medição e classificação de dispneia1,3,4. Alguns autores recomendam o
uso desta escala para avaliação de pacientes com IC descompensada5-7;
outros afirmam que a melhor maneira de medir a dispneia envolve a avaliação
da qualidade de vida, no entanto, os questionários utilizados para este tipo de
avaliação são morosos e requerem mais investigadores experientes e bem
treinados e, geralmente, não são adequados para a prática clínica diária. Todos
esses fatos justificam o uso de instrumentos mais simples que mensurem
corretamente o grau de dispneia8-10.
A avaliação do número de linhas B pela Ultrassonografia pulmonar
durante a avaliação dos pacientes tem sido proposta como uma ferramenta
simples,
não
invasiva,
e
semi-quantitativa
para
avaliar
água
extravascularpulmonar11,12. Estudo recente13 em pacientes ambulatoriais com
insuficiência cardíaca crônica demonstrou o valor fiável deste método não
43
invasivo para identificar clinicamente edema silencioso e prever resultados
pulmonares adversos14. A porção amino-terminal de Peptídeo Natriurético Tipo
B (NT- proBNP) é um poderoso preditor neuro-hormonal e prognóstico de
elevação das pressões de enchimento do ventrículo esquerdo em IC, em que
os níveis mais altos são correlacionados com maiores graus de congestão
pulmonar15-17.
Até o momento, não encontramos estudos que avaliaram a intensidade
da dispneia quantificada pela 5PLS estimando congestão pulmonar significativa
em pacientes ambulatoriais com IC crônica 18.
O objetivo do nosso estudo foi determinar se a dispneia classificada de
acordo com a 5PLS pode definir objetivamente congestão pulmonar
significativa e predizer a ocorrência de eventos cardiovasculares em pacientes
ambulatoriais com insuficiência cardíaca crônica, em comparação com o
ultrassom de pulmão, NT-proBNP e classe funcional.
MATERIAIS E MÉTODOS
Delineamento do estudo e população
Estudo de coorte prospectivo no qual foram incluídos pacientes com IC
sistólica (pré-transplante) em acompanhamento ambulatorial no Instituto de
Cardiologia do Rio Grande do Sul, Brasil, entre novembro de 2011 e janeiro de
2012. Os critérios de inclusão foram: idade >18 anos; IC sistólica com
diagnóstico de falhas por mais de seis meses, independentemente da causa
definida pelo critério de Framingham19 e satisfazendo a diretriz da Sociedade
44
Europeia de Cardiologia20, moderada a IC sistólica grave (fração de ejeção <
45%), ausência de diagnóstico prévio de fibrose pulmonar, ausência de doença
cardíaca congênita, e ausência de recentes admissões (6 meses anteriores).
A
avaliação
clínica,
análise
de
NT-proBNP,
US
pulmonar,
ecocardiograma e raio X de tórax (RX) foram realizadas de forma independente
por diferentes médicos clínicos (índice de avaliação) dentro de um intervalo
máximo de tempo de 5 horas entre o primeiro e o exame anterior. Depois de
uma breve explicação dada por uma enfermeira, todos os pacientes
preenchiam uma 5PLS imediatamente antes e depois de submetidos a um
teste de caminhada de 6 minutos (TC6) de acordo com a metodologia
padronizada.
Escala Likert de 5 pontos para dispnéia
A 5PLS para dispneia é um instrumento psicométrico auto aplicado para
a medição e classificação da experiência de desconforto para respirar, validado
para uso em pacientes com IC agudamente descompensada 1-4. Esta escala
pode ser usada para verificar mudanças na intensidade da falta de ar entre dois
momentos diferentes. A escala varia da ausência de dispneia (1 ponto), falta de
ar leve (2 pontos), falta de ar moderada (3 pontos), falta de ar (4 pontos) e a
pior falta de ar possível (pontuação de 5). Todos os pacientes preencheram a
5PLS, depois de uma breve explicação fornecida por uma enfermeira, sem
qualquer interferência.
45
Ultrassom de pulmão, NT-proBNP e avaliação clínica
A ultrassonografia pulmonar foi usada para avaliar a presença de linhas
B12,21. Uma linha B foi definida como um discreto laser como artefato de
reverberação hiperecoico vertical que surge a partir da linha A pleural e se
estende para a parte inferior da tela sem desbotar e move-se de forma
síncrona com pulmão em deslizamento22. Foram analisados os hemitórax
anterior e lateral, digitalização ao longo do parasternal, hemiclavicular, axilar
anterior e das linhas axilar média, como previamente descrito22. Um total de 28
locais no peito foram digitalizados, e o número total de linhas B foram gravadas
por um investigador independente. Um número de linhas B≥15 foi considerado
como um ponto de corte para a congestão pulmonar significativa13.
A análise de NT-proBNP foi realizada utilizando o analisadorElecsys®
2010(Roche Diagnostics, Mannheim, Alemanha). Foi utilizado como ponto de
corte para IC descompensada níveis de NT-ProBNP>1000pg/mL17,23.
Considerações Éticas
O estudo foi conduzido de acordo com as Diretrizes e Normas
Regulamentadoras de Pesquisas Envolvendo Seres Humanos, sendo aprovado
pelo Comitê de Ética e Pesquisa da Instituição (UP 4720.12). Todos os
pacientes foram convidados a participar do projeto previamente e assinaram o
Termo de Consentimento Livre e Esclarecido.
46
Análise estatística
Os dados foram analisados com o auxílio do programa IBM SPSS
statistics versão 19.0 (Chicago, IL, EUA). As variáveis contínuas são expressas
como média ± desvio padrão ou mediana (com 25, Percentil 75), conforme o
caso. Usamos teste t de Student para variáveis contínuas com distribuição
simétrica e qui-quadrado ou teste exato de Fisher para as variáveis
categóricas. Para variáveis assimétricas, os teste de Mann-Whitney e ANOVA
foram utilizados para repetir medidas. A correlação entre o escore 5PLS e o
número de linhas B foi avaliada com uma análise do coeficiente de correlação
não-paramétrico de Spearman. A análise multivariada foi utilizada para verificar
a diferença entre os diferentes pontos da Likert. Foram utilizadas pontuações e
modelos de regressão logística.
As análises foram separadas realizadas para variáveis individuais para
permitir o maior tamanho amostral possível. Modelos graduais foram
executados com todos os potenciais fatores de risco identificados na análise
univariada. Finalmente, o modelo foi executado usando um backward
(probabilidade) método que inclua variáveis, tendo como critérios de entrada
um valor de P de 0,05 e uma remoção valor de 0,20 na análise de regressão
anterior.
Incidência cumulativa de internação durante o seguimento foi analisada
individualmente e em conjunto com o Cox proporcional do modelo de regressão
de risco. Análise de sobrevida de Kaplan-Meier com teste de log-rank foi
também utilizada. Um valor bicaudal P<0,05 foi considerado como sendo
estatisticamente significativo.
47
RESULTADOS
Os 58 pacientes incluídos tiveram idade media de 49±11 anos, 47,2 %
eram portadores de cardiomiopatia dilatada idiopática, com FE de 27±4% e o
volume do átrio esquerdo indexado pela área de superfície do corpo foi de
53,8±27 mL/m². Sendo acompanhados por um período de 106±12 dias
(intervalo interquartil: 89-115 dias). Estas e demais características basais estão
listadas na Tabela 1.
Congestão pulmonar foi diagnosticada em 44,8 % dos indivíduos com
base no nível de NT-proBNP>1000pg/mL. Cinquenta e oito por cento dos
pacientes tiveram congestão pulmonar diagnosticada por ultrassom de pulmão
(número de linhas B ≥ 15).
Quando 5PLS para dispneia foi aplicada durante o repouso, 44,8 % dos
pacientes tiveram uma pontuação de um, 32,7 % tiveram uma pontuação de
dois, 17,2 % tiveram uma pontuação de três e 5,17 % tiveram uma pontuação
de quatro. Nenhum dos pacientes teve cinco pontos na escala quando a
mesma foi realizada durante o repouso.
A classe funcional média foi maior para aqueles que tiveram pontuações
mais altas na 5PLS para dispneia (P<0,001). A média de NYHA foi de 3,67
para Likert = 4, 3 para Likert = 3, 2 para Likert = 2 e 1,87 para Likert = 1. Não
houve diferenças significativas nos níveis de NT-proBNP médios entre grupos
com diferentes percepções de dispneia (P = 0,16). Após o teste de caminhada
de 6 minutos, houve um aumento significativo na média da Escala de Likert
48
para escore de dispneia em comparação com o resultado médio em repouso
(P<0,0001) (Figura 1).
Quando divididos com base na pontuação na escala de Likert de 5
pontos para a dispneia, pacientes que tiveram uma pontuação de 4 tinham
maior número de linhas B identificadas por ultrassonografia pulmonar do que o
outros grupos (P = 0,016) (Figura 2).
Os
eventos
adversos
ocorreram
em
15
pacientes
durante
o
acompanhamento. Doze deles foram hospitalizados com congestão pulmonar,
dois foram hospitalizadas com infarto agudo do miocárdio (IAM) e um deles
recebeu um choque do desfibrilador cardíaco implantado(CDI), devido à
taquicardia ventricular.
A sobrevida livre de eventos adversos foi maior para os pacientes com
escores mais baixos na escala Likert de 5 pontos para dispneia (Long-rank
P<0,001). Pacientes com escores de Likert de 3 ou 4 estavam em um risco
aumentado de admissão na emergência durante o acompanhamento do que os
pacientes com pontuação de 1 ou 2, quando ajustados para fatores como
idade, fração de ejeção do ventrículo esquerdo (FE), classe funcional pela New
York Heart Association (NYHA) e níveis de NTproBNP>1000 pg/ml (HR=4,9, IC
de 95% 1,33-18,64 , P= 0,017) (Figura 3).
DISCUSSÃO
Nossos resultados demonstram que existe uma relação objetiva entre o
escore na escala de Likert de 5 pontos para a dispneia, que avalia a gravidade
dos sintomas percebidos pelo paciente, níveis mais elevados de água extra
49
vascular pulmonar avaliada por US pulmonar, elevada pressão de enchimento
do VD e NT-proBNP. No entanto, um estudo prévio realizado para investigar as
relações entre a história do paciente, resultados de exames físicos, radiografia
torácica e pressão capilar pulmonar em 42 pacientes com insuficiência
cardíaca encaminhados para avaliação para transplante cardíaco mostrou que
a avaliação clínica, raio-X e avaliação hemodinâmica falharam porque eles
produziram resultados conflitantes19.
Os autores justificam esta afirmação com base no fato de que os
pacientes com um elevada pressão capilar pulmonar podem não mostrar
congestão durante um exame clínico ou radiológico, e a ausência de congestão
no raio-X está associada com uma melhor capacidade pulmonar. A
discordância entre os exames clínicos, radiológicos e os resultados
hemodinâmicos tem implicações para a o manejo de pacientes com IC e
poderia levar a diagnósticos imprecisos e tratamento inadequado24.
Ecocardiografia pode também ser usada para mensurar as pressões
não-invasivas de enchimento do VE12: a proporção da velocidade de fluxo
inicial diastólica mitral e velocidade de fluxo diastólico precoce do anel mitral
(E/e') é um dos parâmetros mais frequentemente usados para avaliar as
pressões do VE13,14. Ambos, Peptídeos natriuréticos e E/e' identificam
congestão hemodinâmica em pacientes com IC sistólica e diastólica, uma
condição que precede a congestão pulmonar. Além disso, a congestão
pulmonar é geralmente, mas nem sempre, relacionada com a pressão de
enchimento elevada do VE, o que pode explicar a ausência de correlação com
o NT-proBNP48.
50
IC provoca alterações funcionais, metabólicas e histológicas nos
músculos inspiratórios. Em 30 a 50 % dos pacientes, estes músculos são
fracos, com uma consequente redução na capacidade funcional, um pior
prognóstico clínico e uma menor qualidade de vida para estes indivíduos. Além
disso, existe uma relação entre os sistemas de controle autonômicos desses
pacientes, intolerância ao exercício e fraqueza dos músculos inspiratórios, que,
de acordo com estudos previamente realizados, podem ser melhoradas com
exercício físico25. Este fenômeno desempenha um papel importante na
sensação de falta de ar durante e após o exercício.
Acredita-se que a Likert de 5 pontos pode transformar a sensação de
dispneia (dados subjetivos) em dados objetivos, porque, na nossa população
de pacientes, foi capaz de demonstrar uma excelente relação entre os escores
de Likert e os achados da ultrassonografia pulmonar utilizada para quantificar o
volume de fluido livre nos pulmões deste grupo de doentes com insuficiência
cardíaca avançada. No entanto, essa relação não foi observada quando a
escala foi utilizada após o exercício.
Esta descoberta pode ser devido ao componente muscular da dispneia,
que desempenha um papel importante na população de pacientes com
doenças crônicas, especialmente depois atividade física. Deste modo, a
gravidade da dispneia medida pela escala Likert é apenas diretamente
correlacionada com congestão pulmonar quando utilizada para avaliar
pacientes em repouso.
Talvez a descoberta mais notável do nosso estudo é que os pacientes
com grau 3 ou 4 dispneia (definido pela escala de Likert de 5 pontos para
dispneia como moderada e forte, respectivamente) tiveram um número maior
51
de internações hospitalares. Esta associação permaneceu estatisticamente
significativa mesmo após o controle de fatores clínicos que já são conhecidos
para prever resultados adversos, tais como o nível de NYHA, FE e NT-proBNP.
Em nossa opinião, dispneia deve ser medida objetivamente quando se
toma a história do paciente durante o exame clínico inicial, pois é o sintoma
mais comum e significativo da angústia em pacientes com IC. Este sintoma é
ainda um importante alvo terapêutico, e sua medição deve influenciar o
tratamento7,8. Apesar do reduzido número de pacientes que receberam a dose
alvo de medicação para IC, semelhante ao relatado na literatura, não foi
encontrada relação com a ocorrência de eventos adversos.
Outra observação importante é que, mesmo para os pacientes que se
encontram na mesma classe funcional (NYHA III, por exemplo), a escala de
Likert pode ajudar a diferenciá-los por informar objetivamente a intensidade da
dispneia no mesmo nível de esforço. E esta distinção pode prever de forma
independente os resultados clínicos durante o acompanhamento, como
demonstrados na análise multivariada.
Pacientes com insuficiência cardíaca geralmente apresentam sinais e
sintomas de hipertensão pulmonar congestão sistêmica quando eles são
admitidos no hospital. No entanto, as altas pressões de enchimento ventricular
podem estar presentes muito antes do desenvolvimento da congestão
pulmonar clínica que resulta em internação hospitalar. Assim, é necessário
administrar e reavaliar congestão pulmonar e sistêmica em cada consulta 26.
A escala de Likert de 5 pontos para a dispneia utilizada no estudo é fácil
de aplicar e pode ser usada por qualquer profissional de saúde (enfermeiro,
médico, fisioterapeuta, etc) nos ambulatórios de insuficiência cardíaca. Esta
52
pontuação simples para a avaliação da dispneia tem uma correlação objetiva
com congestão pulmonar e tem implicações prognósticas.
Algumas limitações devem ser citadas na interpretação dos resultados,
como a inclusão apenas de pacientes com disfunção sistólica moderada a
grave, e a falta de um padrão de ouro para verificar a presença ou ausência de
congestão pulmonar no ambiente ambulatorial. No entanto, a adoção do nível
de NT-proBNP e da relação E/E' ao invés de medidas invasivas tornou possível
a realização do estudo durante as visitas ambulatoriais de rotina com os
pacientes em estado clínico estável. A mudança na pontuação 5PLS após o
TC6 não foi testada em comparação com outras metodologias para determinar
se foi correlacionada com o aumento de água extra vascular pulmonar após o
teste de exercício.
CONCLUSÕES
Em nossa coorte de pacientes com insuficiência cardíaca, o uso da
escala de Likert de 5 pontos para dispneia foi capaz de predizer eventos
clínicos adversos, mesmo quando controlados para potenciais preconceitos
(NYHA, FE, idade e NT-proBNP). A escala é capaz de quantificar
objetivamente congestão pulmonar. Pontuações mais altas na escala Likert de
5 pontos para dispneia foram associados com desfechos clínicos desfavoráveis
em pacientes com IC.
53
Profissionais da saúde podem lançar mão desse instrumento para
auxiliar na sua avaliação clínica e minimizar as taxa de reinternações
hospitalares.
REFERÊNCIAS
1. Parshall MB, Schwartzstein RM, Adams L, Banzett RB, Manning HL,
Bourbeau J, et al. An official American Thoracic Society statement: update on
the mechanisms, assessment, and management of dyspnea. American journal
of respiratory and critical care medicine. 2012 Feb;185(4):435–52.
2. Pang PS, Cleland JGF, Teerlink JR, Collins SP, Lindsell CJ, Sopko G, et al.
A proposal to standardize dyspnoea measurement in clinical trials of acute
heart failure syndromes: the need for a uniform approach. European Heart
Journal . 2008 Mar;29 (6):816–24.
3. Likert R. A technique for the measurement of attitudes.Archives of
Psychology.1932; 140:1-55.
4. Pang PS, Cleland JGF, Teerlink JR, Collins SP, Lindsell CJ, Sopko G, et al.
A proposal to standardize dyspnoea measurement in clinical trials of acute
heart failure syndromes: the need for a uniform approach. European heart
journal. 2008 Mar;29(6):816–24.
5. Smithline H a, Caglar S, Blank FSJ. Assessing validity by comparing
transition
and
static
measures
of
dyspnea
in
patients
with
acute
decompensated heart failure.Congestive heart failure (Greenwich, Conn.).
2010;16(5):202–7.
54
6. Smithline HA, Caglar S, Blank FSJ. Physician vs Patient Assessment of
Dyspnea During Acute Decompensated Heart Failure. Congestive Heart
Failure. Blackwell Publishing Ltd; 2010 Mar;16(2):60–4.
7. Teerlink JR. Dyspnea as an end point in clinical trials of therapies for acute
decompensated
heart
failure.
Am
Heart
Journal.
2003;145(2,
Supplement):S26–33.
8. Hogg KJ, McMurray JJ V. Evaluating dyspnoea in acute heart failure:
progress at last! European heart journal. 2010 Apr;31(7):771–2.
9. Mebazaa A, Pang PS, Tavares M, Collins SP, Storrow AB, Laribi S, et al. The
impact of early standard therapy on dyspnoea in patients with acute heart
failure: the URGENT-dyspnoea study. European Heart Journal.2010 Apr;31
(7):832– 41.
10. Socrates T, Mebazaa A. How to measure dyspnea in acute heart failure?
TherapeutischeUmschau. 2009 Sep;66(9):639–42.
11. Picano E, Gargani AL, Gheorghiade AM. Why, when, and how to assess
pulmonary congestion in heart failure: pathophysiological, clinical, and
methodological implications. 2010;63–72.
12. Gargani L, Frassi F, Soldati G, Tesorio P, Gheorghiade M, Picano E.
Ultrasound lung comets for the differential diagnosis of acute cardiogenic
dyspnoea: A comparison with natriuretic peptides. European Journal of Heart
Failure. 2008 Jan;10(1):70–7.
13. Miglioranza MH, Gargani L, Sant’anna RT, Rover MM, Martins VM,
Mantovani A, et al. Lung Ultrasound for the Evaluation of Pulmonary
Congestion in Outpatients: A Comparison With Clinical Assessment, Natriuretic
Peptides, and Echocardiography. JACC.Cardiovascular imaging [Internet]. 2013
55
Sep
26
[cited
2013
Oct
10];
Available
from:
http://www.ncbi.nlm.nih.gov/pubmed/24094830
14. M.H. Miglioranza, L. Gargani, R.T. Sant’anna, M. Rover, V.M. Martins, L.P.
Badano, R. Sicari, E. Picano, R.A.K. Kalil TLL. Pulmonary congestion evaluated
by lung ultrasound predicts admission in patients with heart failure. European
Heart Journal [Internet]. 2013 Sep 3;34(suppl 1):1–150. Available from:
http://eurheartj.oxfordjournals.org/cgi/doi/10.1093/eurheartj/eht307
15. McCullough PA, Nowak RM, McCord J, Hollander JE, Herrmann HC, Steg
PG, et al. B-Type Natriuretic Peptide and Clinical Judgment in Emergency
Diagnosis of Heart Failure: Analysis From Breathing Not Properly (BNP)
Multinational Study .Circulation . 2002 Jul;106 (4 ):416–22.
16. Cowie MR, Mendez GF. BNP and congestive heart failure.Progress in
cardiovascular diseases. 2002;44(4):293–321.
17. Feldman AM, Mann DL, She L, Bristow MR, Maisel AS, McNamara DM, et
al. Prognostic Significance of Biomarkers in Predicting Outcome in Patients
With Coronary Artery Disease and Left Ventricular Dysfunction: Results of the
Biomarker Substudy of the Surgical Treatment for Ischemic Heart Failure Trials
. Circulation: Heart Failure . 2013 May;6 (3 ):461–72.
18. Manson WC, Bonz JW, Carmody K, Osborne M, Moore CL. Identification of
Sonographic B-Lines with Linear Transducer Predicts Elevated B-Type
Natriuretic Peptide Level. Western Journal of Emergency Medicine . 2011;12(1).
19. McKee PA, Castelli WP, McNamara PM, Kannel WB. The Natural History of
Congestive Heart Failure: The Framingham Study. New England Journal of
Medicine
[Internet].
Massachusetts
Medical
Society;
1971
Dec
56
23;285(26):1441–6.
Available
from:
http://dx.doi.org/10.1056/NEJM197112232852601
20. McMurray JJ V, Adamopoulos S, Anker SD, Auricchio A, Bohm M, Dickstein
K, et al. ESC Guidelines for the diagnosis and treatment of acute and chronic
heart failure 2012: The Task Force for the Diagnosis and Treatment of Acute
and Chronic Heart Failure 2012 of the European Society of Cardiology.
Developed in collaboration with the Heart Failure Association (HFA) of the
ESC.European
heart
journal
[Internet].
2012
16];33(14):1787–847.
Jul
[cited
2013
Sep
Availablefrom:
http://www.ncbi.nlm.nih.gov/pubmed/22611136
21. Maines M, Catanzariti D, Angheben C, Valsecchi S, Comisso J, Vergara G.
Intrathoracic impedance and ultrasound lung comets in heart failure
deterioration monitoring. Pacing and clinical electrophysiology: PACE. 2011
Aug;34(8):968–74.
22. Volpicelli G, Elbarbary M, Blaivas M, Lichtenstein D a, Mathis G, Kirkpatrick
AW, et al. International evidence-based recommendations for point-of-care lung
ultrasound. Intensive care medicine [Internet]. 2012 Apr [cited 2013 Sep
21];38(4):577–91.
Available
from:http://www.ncbi.nlm.nih.gov/pubmed/22392031
23. Masson S, Latini R, Anand IS, Barlera S, Angelici L, Vago T, et al.
Prognostic value of changes in N-terminal pro-brain natriuretic peptide in ValHeFT (Valsartan Heart Failure Trial). Journal of the American College of
Cardiology. 2008 Sep;52(12):997–1003.
24. Chakko S, Woska D, Martinez H, de Marchena E, Futterman L, Kessler KM,
et al. Clinical, radiographic, and hemodynamic correlations in chronic
57
congestive heart failure: conflicting results may lead to inappropriate care. The
American journal of medicine. 1991 Mar;90(3):353–9.
25. Ribeiro JP, Chiappa GR, Neder JA, Frankenstein L. Respiratory muscle
function and exercise intolerance in heart failure. Current heart failure reports.
2009 Jun;6(2):95–101.
26. Gheorghiade M, Filippatos G, De Luca L, Burnett J. Congestion in acute
heart failure syndromes: an essential target of evaluation and treatment. The
American journalof medicine. 2006 Dec;119(12 Suppl 1):S3–S10.
58
TABELAS
Tabela 1. Características clínicas e basais da população. n = 58
Características
Idade
n (%)
49 ± 11
Raça branca
46 (79)
Gênero masculino
38 (65)
Índice de massa corporal
28 ± 4
Frequencia cardíaca (batimentos por minuto)
74 ± 12
Pressão arterial sistólica (mmHg)
112 ± 17
Pressão arterial diastólica (mmHg)
71 ± 11
Doença arterial coronariana
16 (27)
Infarto do miocárdio
15 (26)
Hipertensão
24 (41)
Dislipidemia
26 (49)
DPOC
1(2)
Diabete mellitus
12 (20)
Minnesota
43 ± 22
Etiologia da cardiopatia
Idiopática
29 (50)
Isquêmica
17 (29)
Classe funcional NYHA
2,2 ± 0,9
II
24 (41)
III
13 (22)
IV
6 (10)
Fração de ejeção do ventrículo esquerdo (%)
27 ± 0,9
Volume do átrio esquerdo (mL/m²)
54 ± 27
Eletrocardiograma
Ritmo sinusal
46 (79)
Fibrilação atrial
10 (17)
Marcapasso
QRS≥150 ms
Creatinina
2 (3)
35 (60)
0,9 ± 0,3
59
Insuficiência renal crônica
7 (12)
Uréia
48 ± 27
Potássio
4,4 ± 0,5
Sódio
139 ± 4
Hematócrito / Hemoglobina
40 ± 4 / 13 ± 1,4
ß-bloqueadores
56 (96)
Dose alvo
22 (38)
IECA
Dose alvo
Receptores bloqueadores da Angiotensina II
Dose alvo
38 (65)
12 (20)
15 (26)
9 (15)
Antagonistas da Aldosterona
42 (72)
Diuréticos
42 (72)
Digoxina
34 (58)
Antagonistas do Cálcio
3 (5)
Nitratos
10 (17)
Hidralazina
4 (0,7)
Estatinas
27 (46)
Aspirina
24 (41)
Cumarínicos
10 (17)
Amiodarona
8 (14)
Marcapasso / CDI
9 (15)
TRC
4 (7)
Dados são apresentados como a média ± desvio padrão ou n (%). DPOC: doença pulmonar obstrutiva
crônica; NYHA: New York Heart Association; IECA: inibidor enzima conversora da angiotensina; CDI:
Desfibrilador Cardio Implantável; TRC: terapia de ressincronização cardíaca
60
FIGURAS E LEGENDAS
P<0.001
Likert-5 points dyspnea scale
5
4
3
2
1
B
A
ef
or
e
ft
er
0
6 minute walk test
Figura 1. Escala Likert de cinco pontos para dispneia antes e após o esforço.
Means (error bars: 1 SEM)
P = 0,016
70
60
50
40
30
20
10
1
2
3
4
Likert dyspnea scale
Figura 2. Numero de linhas B estimadas por ultrassonografia pulmonar em pacientes com
diferentes escores de dispnea mensurados por Escala Likert de 5 pontos. ANOVA: P=0.016; os
testes T de Student–Newman–Keuls foram testados para todas as comparações pareadas e
mostraram uma diferença entre aqueles que tiveram uma pontuação de 4 na escala e aqueles
com outros escores(P <0,05).
61
Figura 3. Curva de sobrevida de Kaplan-Meier para pacientes admitidos na emergência
estratificados em dois grupos com base na escala Likert de 5 pontos: pacientes com pontuação
1-2 e 3-4.
62
9. ARTIGO EM INGLÊS
A FIVE-POINT LIKERT SCALE FOR DYSPNEA CAN PROPERLY ASSESS
THE DEGREE OF PULMONARY CONGESTION AND PREDICT ADVERSE
EVENTS IN HEART FAILURE OUTPATIENTS
Short Title: Quantifying dyspnea
Cristina K Weber RN, Marcelo H Miglioranza MD, Maria A P de Moraes RN
PhD, MSc, Roberto T Sant'anna MD, Marciane M Rover MD, Renato A K Kalil
MD PhD FACC, Tiago Luiz L Leiria MD PhD
CORRESPONDING AUTHOR
Tiago Luiz Luz Leiria MD PhD
Avenida Princesa Isabel, 395. Phone (51)32303860. Fax (51)32175595. Bairro
Santana,90620-001 - Porto Alegre, RS - Brazil
e-mail: [email protected]
63
ABSTRACT
Objectives: Proper assessment of dyspnea is important in patients with heart
failure(HF). Our aim was to evaluate the use of a 5-point Likert scale(5PLS) for
dyspnea to assess the degree of pulmonary congestion and to determine the
prognostic value of this scale for predicting adverse events in HF outpatients.
Methods: Prospective study of outpatients with moderate to severe HF. The
5PLS was applied during regular outpatient visits along clinical assessments.
Lung ultrasound with B-lines number≥15 and NT-proBNP level>1000pg/mL
were used as reference for pulmonary congestion. Every 30 days during followup, patients were assessed to identify adverse clinical outcomes. Results: We
included 58 patients (65.5% male, age 43.5 +11 years), with a mean left
ventricular ejection fraction(LVEF) of 27.6% and an ischemic etiology of HF in
29.3%. Pulmonary congestion diagnosed by lung ultrasound (total number of Blines ≥15) was present in 58% of patients. A higher degree of dyspnea (3 or 4
points on the 5PLS) was significantly correlated with a higher number of Blines(P=0.016). Patients stratified into Likert 3-4 were at an increased risk for
admission when compared to those in class 1-2 after adjusting by age, LVEF,
New
York
Heart
Association
functional
class
and
levels
of
NT-
proBNP>1000pg/ml (HR=4.9, 95%CI 1.33 to 18.64,P=0.017). Conclusion: In
our series, higher baseline scores on 5PLS were related to pulmonary
congestion and independently associated with adverse events during follow-up.
This simple clinical tool can help identify patients who are more likely to
decompensate and whose treatment should be intensified.
Keywords: Heart failure; Dyspnea; Likert scale.
64
INTRODUCTION
Dyspnea is defined as a subjective experience of breathing discomfort
that consists of qualitatively distinct sensations that vary in intensity. This
condition is caused by interactions among multiple physiological, psychological,
social and environmental factors and may induce secondary physiological and
behavioral responses1. The objective quantification of dyspnea in heart failure
(HF) patients is limited by the subjectivity in reporting this common symptom.
There is no consensus on which is the best way to measure and quantify the
subjective sensation of "shortness of breath, thus making this task extremely
difficult for patients and healthcare professionals 2.
The 5-point Likert scale (5PLS) for dyspnea is a psychometric instrument
for the measurement and grading of dyspnea1,3,4. Some authors recommend
the use of this scale to assess patients with acute decompensated HF 5-7. Others
state that the best way to measure dyspnea involves evaluating the quality of
life; however, the questionnaires used for this type of assessment are lengthy
and require more experienced and well-trained researchers and usually are not
well suited for daily clinical practice. All these facts justify the use of simpler
instruments to properly grade dyspnea 8-10.
Lung ultrasound (LUS) throught B-line evaluation (formerly ultrasound
lung comets) has been proposed as a simple, noninvasive, and semi-quatitative
tool to assess extravascular lung water 11-12. Recent study13 in chronic heart
failure outpatients demonstrated the reliable value of this noninvasive method to
identify clinically silent pulmonary edema and predict adverse outcomes 14. The
amino-terminal portion of B-type natriuretic peptide (NT-proBNP) is a powerful
65
neurohormonal predictor of prognosis and elevated left ventricular filling
pressures in HF, in which higher levels are correlated with greater degrees of
pulmonary congestion15-17.
To date, no study has evaluated the intensity of dyspnea quantified by
5PLS in estimate significant pulmonary congestion in chronic HF outpatients18.
The aim of this study was to determine whether dyspnea graded using 5PLS
can objectively define significant pulmonary congestion and predict the
occurrence of adverse events in chronic heart failure outpatients, in comparison
with lung ultrasound, NT-proBNP and NYHA functional class.
MATERIALS AND METHODS
Study design and population
This study is a prospective cohort study in which patients were included
patients with systolic HF who were followed in a pretransplant outpatient clinic
at the Cardiology Institute of Rio Grande do Sul, Brazil, between November
2011 and January 2012. Inclusion criteria were: 1) Age >18 years; 2) LV
systolic heart failure diagnosis for more than 6 months regardless of cause as
defined by the Framingham criteria(19) and satisfying the European Society of
Cardiology guideline(20) 2) moderate to severe systolic HF (ejection fraction
<45%), 3) no prior diagnosis of pulmonary fibrosis, 4) the absence of congenital
heart disease, and 5) No recent admission due to decompensated HF in the
previous 6 months.
66
Clinical assessment, NT-proBNP analysis, LUS, echocardiography and
chest Xray (CXR) were independently performed by different physicians at the
clinical appointment (index evaluation) within a maximum 5-h time delay
between the first and last examination. Following a brief explanation provided
by a nurse, all patients filled out a 5PLS immediately before and after
underwent a 6-minute walk test (6mWT) in accordance with standardized
methodology.
Likert-5 points dyspnea scale
The 5PLS for dyspnea is a self-applied psychometric instrument for the
measurement and grading the experience of breathing discomfort, validated to
use in acute decompensated HF patients 1-4 This scale can be used to verify
changes in the intensity of the shortness of breath between two different time
points. The scale ranges from the absence of dyspnea (a score of 1), mild
shortness of breath (a score of 2), moderate shortness of breath (a score of 3),
severe shortness of breath (a score of 4) and worst possible shortness of breath
(a score of 5). All patients filled out the 5PLS, after a brief explanation provided
by a nurse, without any interference.
Lung ultrasound, NT-proBNP and clinical assessment
LUS was used to assess the presence of B-lines12,21. A B-line was
defined as discrete laser-like vertical hyperechoic reverberation artifact that
arises from the pleural line extend to the bottom of the screen without fading,
67
and moves synchronously with lung sliding 22. We analyzed the anterior and
lateral hemithoraces, scanning along the parasternal, midclavicular, anterior
axillary and mid-axillary lines, as previously described22. A total of 28 chest sites
were
scanned,
and
the
total
number
of
B-lines
was
recorded
by
aindependenteinvestigator. A B-lines number ≥ 15 was considered as a cut-off
for significant pulmonar congestion13.
The NT-proBNP analysis was performed using the Elecsys 2010
analyzer (Roche Diagnostics, Mannheim, Germany). A NT-proBNP level >1000
pg/mL was used as the cut-off for decompensated HF17,23.
Ethics
The study was conducted according to the Guidelines and Standards
Regulating Research Involving Human Beings, and it was approved by the
Ethics and Research Committee of the Institution (UP 4720.12). All patients
were previously invited to participate in the project and signed the Free and
Informed Consent.
Statistical analysis
The data were analyzed with the help of program IBM SPSS statistics,
version 19.0 (Chicago, IL, USA). Continuous variables are expressed as mean
± standard deviation or as median (with 25th, 75th percentiles), as appropriate.
We used student´s t-test for continuous variables with symmetric distribution
and chi-square or Fisher exact test for categorical variables. For asymmetrical
68
variables, the Mann-Whitney test and ANOVA were used for repeat measures.
The correlation between the 5PLS score and the number of B-lines was
assessed with a non-parametric Spearman’s correlation coefficient analysis.
Multivariate analysis was used to verify the difference between the
different 5PLS scores, and logistic regression models were used. First, separate
analyses were performed for individual variables to allow for the largest possible
sample size. Second, stepwise models were run using all of the potential risk
factors identified in the univariate analysis. Finally, a model was run using a
backward stepwise (likelihood) method that included variables having as entry
criteria a P-value of 0.05 and a removal value of 0.20 in the prior regression
analysis. Cumulative incidence of hospital admission during follow-up was
analyzed individually and altogether with the Cox proportional hazard
regression model. Kaplan-Meier survival analysis with log-rank test was also
used. A two-tailed P value <0.05 was considered to be statistically significant.
RESULTS
The main characteristics of the patients are listed in Table 1. The mean
age was 49 ± 11 years, and 47.2% of patients had idiopathic dilated
cardiomyopathy. The mean left ventricular (LV) ejection fraction (EF)
determined by the bi-planar Simpson method was 27+4%, and the left atrial
volume indexed by the body surface area was 53.8 ± 27mL/m2. Patients were
followed-up for a median period of 106+12 days (interquartile range: 89-115
days).
69
Significant pulmonary congestion (SPC) was diagnosed in 44.8% of
subjects based on the NT-proBNP level >1000pg/mL. Fifty eight percent of
patients had SPC diagnosed by lung ultrasound (B-lines number ≥15).
When 5PLS for dyspnea was applied during rest, 44.8% of patients had a
score of 1, 32.7% had a score of 2, 17.2% had a score of 3 and 5.17% had a
score of 4. None of the patients had a score of 5 points on the scale when it
was performed during rest.
The mean NYHA functional class was higher for those who had higher
scores on the 5PLS for dyspnea (P<0.001). The mean NYHA was 3.67 for
Likert=4, 3 for Likert=3, 2 for Likert=2 and 1.87 for Likert=1. There were no
significant differences in the mean NT-proBNP levels between groups with
different perceptions of dyspnea (P = 0.16). After the 6-minute walk test, there
was a significant increase in the mean 5-point Likert scale for dyspnea score
compared with the mean score at rest (P<0.0001) (Figure 1).
When divided up based on the score on the 5-point Likert scale for
dyspnea, patients who had a score of 4 had more B lines identified by lung
ultrasound than the other groups (P = 0.016) (Figure 2).
Adverse events occurred in 15 patients during follow-up. Twelve of them
were hospitalized with pulmonary congestion, two were hospitalized with acute
myocardial infarction (AMI), and one had an implanted cardiac defibrillator (ICD)
shock due to ventricular tachycardia.
Survival free of adverse events was higher for patients with lower scores
on the 5-point Likert scale for dyspnea (Log-rank P<0.001). Patients with Likert
scores of 3 or 4 were at an increased risk of emergency room admission during
follow-up than those with scores of 1 or 2 when adjusted for factors such as
70
age, left ventricle ejection fraction (EF), New York Heart Association (NYHA)
functional class and level of NTproBNP> 1000 pg/ml (HR = 4.9, 95% CI 1.33 to
18.64, P = 0.017) (Figure 3).
DISCUSSION
Our results demonstrate that there is an objective relationship between
the score on the 5-point Likert scale for dyspnea, which assesses the severity of
symptoms perceived by the patient, and higher levels of extravascular lung
water assessed by LUS and elevated LV filling pressure NT-proBNP. However,
a previous study performed to investigate the relationships between patient
history, physical examination results, chest X-ray findings and pulmonary
capillary pressure in 42 patients with HF referred for assessment for a heart
transplant showed that the clinical, X-ray and hemodynamic assessments failed
because they yielded conflicting results 19. These authors justified this statement
based on the fact that patients with an elevated pulmonary capillary pressure
may show no congestion during a clinical or radiological exam, and the absence
of congestion on the X-ray is associated with a better pulmonary capacity.
Discordance among clinical, radiological and hemodynamic results has
implications for the management of patients with HF and could lead to
inaccurate diagnoses and inadequate treatment 24. Echocardiography can be
also used to non-invasively measure left ventricular (LV) filling pressures 12: the
ratio of early diastolic mitral inflow velocity to early diastolic velocity of the mitral
annulus (E/e’) is one of the most frequently used parameters to assess LV
pressures13,14. Both natriuretic peptides and E/e’ identify hemodynamic
71
congestion in systolic and diastolic HF patients, a condition that precedes
pulmonary congestion. Furthermore, pulmonary congestion is usually, but not
always, related to high LV filling pressure, which may explain the absence of
correlation with NT-proBNP48.
HF causes functional, metabolic and histological changes in the
inspiratory muscles. In 30 to 50% of patients, these muscles are weak, with a
consequent reduction in functional capacity, a worse clinical prognosis and a
lower quality of life for these individuals. Furthermore, there is a relationship
between the autonomic control systems of these patients and intolerance to
exercise and weakness of the inspiratory muscles, which, according to
previously performed studies, can be improved with physical training 25. This
phenomenon plays an important role in the sensation of shortness of breath
during and after exercise.
It is believed that the 5PLS can transform the sensation of dyspnea
(subjective data) into objective data because in our patient population, we were
able to demonstrate an excellent relationship between the Likert scores and the
pulmonary ultrasound findings used to quantify the amount of free fluid in the
lungs of this cohort of patients with advanced heart failure. However, this
relationship was not observed when the scale was used after exercise. This
finding may be due to the muscle component of dyspnea, which plays a major
role in the population of chronically ill patients, especially after physical activity.
Thus, the severity of dyspnea measured by the Likert scale is only directly
correlated with pulmonary congestion when used to assess patients at rest.
Perhaps the most striking finding of our study is that patients who had
grade 3 or 4 dyspnea (defined by the 5-point Likert scale for dyspnea as
72
moderate and strong, respectively) had a greater number of hospital
admissions. This correlation remained statistically significant even after
controlling for clinical factors that are already known to predict adverse
outcomes, such as the NYHA, EF and NT-proBNP level. In our view, dyspnea
must be measured objectively when taking the patient’s history during the initial
clinical exam because dyspnea is the most common and significant symptom of
distress in patients with HF. This symptom is still an important therapeutic
target, and its measurement should influence treatment 7,8. Despite the reduced
number of patients receiving the target dose for HF medication, similar to
reported in literature, no relation was found with adverse events occurrence.
Another important observation is that even for patients that are in the
same functional class (e.g. NYHA III),Likert scale can help to differentiate them
by graduating objectively the intensity of dyspnea on the same level of effort.
And this distinction can independently predict clinical outcomes during followup, as demonstrated by multivariate analysis.
Patients with heart failure generally present signs and symptoms of
pulmonary systemic congestion when they are admitted to the hospital.
However, high left ventricular filling pressures may be present long before the
development of clinical pulmonary congestion that results in hospital admission.
Thus, it is necessary to manage and reassess pulmonary and systemic
congestion at each clinical encounter26.
The 5-point Likert scale for dyspnea used in the study is easy to apply
and can be used by any healthcare professional (nurse, physician, physician
assistant, respiratory therapist, etc.) in heart failure outpatient clinics. This
73
simple score for the assessment of dyspnea has an objective correlation with
pulmonary congestion and has prognostic implications.
One limitation of this study is the small size of the sample, which included
only patients with moderate to severe systolic dysfunction. This limitation should
be taken into account when interpreting the results. Moreover, the lack of a gold
standard to verify the presence or absence of pulmonary congestion in the
outpatient environment is a further limitation of the study. However, the adoption
of the NT-proBNP level and E/E’ relationship rather than invasive measures
made it possible to perform the study during routine outpatient visits with the
patients in stable clinical condition. The change in 5PLS score after 6MWT was
not tested in comparison to other methodologies to determine if it was
correlated to increased extravascular lung water after exercise test.
In our cohort of heart failure patients, the use of the 5-point Likert scale
for dyspnea was able to predict adverse clinical events, even when controlling
for potential biases (NYHA, EF, age and NT-proBNP). Higher scores on the 5point Likert scale for dyspnea were associated with unfavorable clinical
outcomes in patients with HF. The scale is capable of quantifying pulmonary
congestion objectively. Healthcare professionals can use this instrument to
better assess patients and improve their care, thereby potentially reducing the
rate of hospital admissions.
REFERENCES
1. Parshall MB, Schwartzstein RM, Adams L, Banzett RB, Manning HL,
Bourbeau J, et al. An official American Thoracic Society statement: update on
74
the mechanisms, assessment, and management of dyspnea. American journal
of respiratory and critical care medicine. 2012 Feb;185(4):435–52.
2. Pang PS, Cleland JGF, Teerlink JR, Collins SP, Lindsell CJ, Sopko G, et al.
A proposal to standardize dyspnoea measurement in clinical trials of acute
heart failure syndromes: the need for a uniform approach. European Heart
Journal . 2008 Mar;29 (6 ):816–24.
3. R. L. A technique for the measurement of attitudes.Archives of Psychology.
1932;22 140:55.
4. Pang PS, Cleland JGF, Teerlink JR, Collins SP, Lindsell CJ, Sopko G, et al.
A proposal to standardize dyspnoea measurement in clinical trials of acute
heart failure syndromes: the need for a uniform approach. European heart
journal. 2008 Mar;29(6):816–24.
5. Smithline H a, Caglar S, Blank FSJ. Assessing validity by comparing
transition
and
static
measures
of
dyspnea
in
patients
with
acute
decompensated heart failure.Congestive heart failure (Greenwich, Conn.).
2010;16(5):202–7.
6. Smithline HA, Caglar S, Blank FSJ. Physician vs Patient Assessment of
Dyspnea During Acute Decompensated Heart Failure. Congestive Heart
Failure. Blackwell Publishing Ltd; 2010 Mar;16(2):60–4.
7. Teerlink JR. Dyspnea as an end point in clinical trials of therapies for acute
decompensated
heart
failure.
American
Heart
Journal.
2003;145(2,
Supplement):S26–33.
8. Hogg KJ, McMurray JJ V. Evaluating dyspnoea in acute heart failure:
progress at last! European heart journal. 2010 Apr;31(7):771–2.
9. Mebazaa A, Pang PS, Tavares M, Collins SP, Storrow AB, Laribi S, et al. The
75
impact of early standard therapy on dyspnoea in patients with acute heart
failure: the URGENT-dyspnoea study. European Heart Journal . 2010 Apr;31 (7
):832–41.
10. Socrates T, Mebazaa A. How to measure dyspnea in acute heart failure?
TherapeutischeUmschau. 2009 Sep;66(9):639–42.
11. Picano E, Gargani AL, Gheorghiade AM. Why , when , and how to assess
pulmonary congestion in heart failure : pathophysiological , clinical , and
methodological implications. 2010;63–72.
12. Gargani L, Frassi F, Soldati G, Tesorio P, Gheorghiade M, Picano E.
Ultrasound lung comets for the differential diagnosis of acute cardiogenic
dyspnoea: A comparison with natriuretic peptides. European Journal of Heart
Failure. 2008 Jan;10 (1 ):70–7.
13. Miglioranza MH, Gargani L, Sant’anna RT, Rover MM, Martins VM,
Mantovani A, et al. Lung Ultrasound for the Evaluation of Pulmonary
Congestion in Outpatients: A Comparison With Clinical Assessment, Natriuretic
Peptides, and Echocardiography. JACC.Cardiovascular imaging [Internet]. 2013
Sep
26
[cited
2013
Oct
10];
Available
from:
http://www.ncbi.nlm.nih.gov/pubmed/24094830
14. M.H. Miglioranza, L. Gargani, R.T. Sant’anna, M. Rover, V.M. Martins, L.P.
Badano, R. Sicari, E. Picano, R.A.K. Kalil TLL. Pulmonary congestion evaluated
by lung ultrasound predicts admission in patients with heart failure. European
Heart Journal [Internet]. 2013 Sep 3;34(suppl 1):1–150. Available from:
http://eurheartj.oxfordjournals.org/cgi/doi/10.1093/eurheartj/eht307
15. McCullough PA, Nowak RM, McCord J, Hollander JE, Herrmann HC, Steg
PG, et al. B-Type Natriuretic Peptide and Clinical Judgment in Emergency
76
Diagnosis of Heart Failure: Analysis From Breathing Not Properly (BNP)
Multinational Study .Circulation . 2002 Jul;106 (4 ):416–22.
16. Cowie MR, Mendez GF. BNP and congestive heart failure.Progress in
cardiovascular diseases. 2002;44(4):293–321.
17. Feldman AM, Mann DL, She L, Bristow MR, Maisel AS, McNamara DM, et
al. Prognostic Significance of Biomarkers in Predicting Outcome in Patients
With Coronary Artery Disease and Left Ventricular Dysfunction: Results of the
Biomarker Substudy of the Surgical Treatment for Ischemic Heart Failure Trials.
Circulation: Heart Failure . 2013 May;6 (3 ):461–72.
18. Manson WC, Bonz JW, Carmody K, Osborne M, Moore CL. Identification of
Sonographic B-Lines with Linear Transducer Predicts Elevated B-Type
Natriuretic Peptide Level. Western Journal of Emergency Medicine . 2011;12(1).
19. McKee PA, Castelli WP, McNamara PM, Kannel WB. The Natural History of
Congestive Heart Failure: The Framingham Study. New England Journal of
Medicine
[Internet].
Massachusetts
23;285(26):1441–6.
Medical
Society;
1971
Available
Dec
from:
http://dx.doi.org/10.1056/NEJM197112232852601
20. McMurray JJ V, Adamopoulos S, Anker SD, Auricchio A, Bohm M, Dickstein
K, et al. ESC Guidelines for the diagnosis and treatment of acute and chronic
heart failure 2012: The Task Force for the Diagnosis and Treatment of Acute
and Chronic Heart Failure 2012 of the European Society of Cardiology.
Developed in collaboration with the Heart Failure Association (HFA) of the
ESC.European
heart
16];33(14):1787–847.
journal
[Internet].
2012
Available
http://www.ncbi.nlm.nih.gov/pubmed/22611136
Jul
[cited
2013
Sep
from:
77
21. Maines M, Catanzariti D, Angheben C, Valsecchi S, Comisso J, Vergara G.
Intrathoracic impedance and ultrasound lung comets in heart failure
deterioration monitoring. Pacing and clinical electrophysiology : PACE. 2011
Aug;34(8):968–74.
22. Volpicelli G, Elbarbary M, Blaivas M, Lichtenstein D a, Mathis G, Kirkpatrick
AW, et al. International evidence-based recommendations for point-of-care lung
ultrasound. Intensive care medicine [Internet]. 2012 Apr [cited 2013 Sep
21];38(4):577–91.
Available
from:
http://www.ncbi.nlm.nih.gov/pubmed/22392031
23. Masson S, Latini R, Anand IS, Barlera S, Angelici L, Vago T, et al.
Prognostic value of changes in N-terminal pro-brain natriuretic peptide in ValHeFT (Valsartan Heart Failure Trial). Journal of the American College of
Cardiology. 2008 Sep;52(12):997–1003.
24. Chakko S, Woska D, Martinez H, de Marchena E, Futterman L, Kessler KM,
et al. Clinical, radiographic, and hemodynamic correlations in chronic
congestive heart failure: conflicting results may lead to inappropriate care. The
American journal of medicine. 1991 Mar;90(3):353–9.
25. Ribeiro JP, Chiappa GR, Neder JA, Frankenstein L. Respiratory muscle
function and exercise intolerance in heart failure. Current heart failure reports.
2009 Jun;6(2):95–101.
26. Gheorghiade M, Filippatos G, De Luca L, Burnett J. Congestion in acute
heart failure syndromes: an essential target of evaluation and treatment. The
American journal of medicine. 2006 Dec;119(12 Suppl 1):S3–S10.
78
TABLE LEGEND
Table 1. Primary patient characteristics. n = 58
Characteristic
Age
Caucasian
Male
Body mass index
Heart rate (beats per minute)
Systolic arterial pressure (mmHg)
Diastolic arterial pressure (mmHg)
Coronary artery disease
Myocardium Infarction
Hypertension
Dyslipidemia
COPD
Diabetes mellitus
Minnesota
Cardiomyopathy etiology
Idiopathic
Post-ischemic
NYHA
II
III
IV
Left ventricle ejection fraction (%)
Left atrium volume (mL/m²)
Electrocardiogram
Sinus rhythm
Atrial fibrillation
Pace
QRS≥150 ms
Creatinine / DCE
Chronic renal failure
Urea
Potassium
Sodium
Hematocrit / Hemoglobin
ß-blockers
target dose
ACE-inhibitors
target dose
Angiotensin II receptor blockers
target dose
Aldosterone antagonist
Diuretics
Digoxin
Calcium-antagonists
Nitrates
n (%)
49 ± 11
46 (79)
38 (65)
28 ± 4
74 ± 12
112 ± 17
71 ± 11
16 (27)
15 (26)
24 (41)
26 (49)
1 (2)
12 (20)
43 ± 22
29 (50)
17 (29)
2,2 ± 0,9
24 (41)
13 (22)
6 (10)
27 ± 0,9
54 ± 27
46 (79)
10 (17)
2 (3)
35 (60)
0,9 ± 0,3/ 109 ± 40
7 (12)
48 ± 27
4,4 ± 0,5
139 ± 4
40 ± 4 / 13 ± 1,4
56 (96)
22 (38)
38 (65)
12 (20)
15 (26)
9 (15)
42 (72)
42 (72)
34 (58)
3 (5)
10 (17)
79
Hydralazine
Statin
Aspirin
Coumarin
Amiodarone
Pace / ICD
CRT
4 (0,7)
27 (46)
24 (41)
10 (17)
8 (14)
9 (15)
4 (7)
Data are presented as the mean±standard deviation or n (%). COPD: Chronic obstructive pulmonary
disease; NYHA: New York Heart Association functional class; ACE: Angiotensin converting enzyme; ICD:
Implantable cardioverter defibrillator; CRT: Cardiac resynchronization therapy
FIGURE AND LEGENDS
P<0.001
Likert-5 points dyspnea scale
5
4
3
2
1
B
A
fte
ef
or
e
r
0
6 minute walk test
Figure 1. Five-point Likert scale for dyspnea before and after effort.
80
Means (error bars: 1 SEM)
P = 0,016
70
60
50
40
30
20
10
1
2
3
4
Likert dyspnea scale
Figure 2.Number of B-lines estimated by lung ultrasound in patients with different dyspnea
scores measured by the 5-point Likert scale for dyspnea. ANOVA: P=0.016; the Student–
Newman–Keuls test for all pairwise comparisons showed a difference between those who had a
score of 4 on the 5-point Likert scale for dyspnea and those with other scores (P<0.05).
81
Figure 3. Kaplan-Meier 1-cumulative survival curve for emergency room admission for patients
stratified into two groups based on the 5-point Likert scale for dyspnea: patients with scores of
1-2 and those with scores of 3-4.
82
10.
ANEXOS
APÊNDICE A
CONSENTIMENTO INFORMADO
AUTORIZAÇÃO PARA PARTICIPAR DE UM PROJETO DE PESQUISA
1.NOME DO ESTUDO: Dispneia pode definir objetivamente congestão pulmonar e
predizer a ocorrência de eventos em pacientes com insuficiência cardíaca?
2.INSTITUIÇÃO: Instituto de Cardiologia do Rio Grande do Sul
3.PESQUISADOR RESPONSÁVEL: Dr. Tiago Leiria, Enfª Cristina Klein Weber
4.OBJETIVO DESTE ESTUDO: Avaliar se a dispnéia pode definir objetivamente a
congestão pulmonar e predizer a ocorrência de eventos em pacientes com
insuficiência cardíaca.
5.PROCEDIMENTOS: Serão realizados uma entrevista para coleta de dados clínicos
através de um questionário padronizado, coleta de exames de sangue (os mesmos
que já seriam realizados de rotina na consulta ambulatorial), raio X do Pulmão,
ultrassonografia do tórax e do coração e teste de caminhada. A sua participação é
voluntária e não implica ônus ou gratificação.
6.RISCOS: Não existem riscos.
7.BENEFÍCIOS DESTE ESTUDO: A avaliação da congestão pulmonar (água no
pulmão) por este novo método simples e rápido poderá, no futuro, facilitar o tratamento
de pacientes em acompanhamento ambulatorial por Insuficiência Cardíaca.
8.COBERTURA: Não há cobertura financeira para qualquer perda ou inconveniente
decorrentes da participação neste estudo.
9.DIREITO DE DESISTÊNCIA: Você poderá desistir de participar a qualquer
momento.
10.SIGILO: Todas as informações obtidas através deste estudo podem ser publicados
com finalidade científica, mantendo-se o sigilo pessoal, ou seja, suas respostas
estarão no estudo como números em um universo de mais de 50 pacientes. Será
mantido sigilo de sues dados e seu nome não constará em
nenhuma publicação.
11.CONSENTIMENTO: Declaro ter lido - ou me foram lidas - as informações acima
antes de assinar este formulário. Foi me dada ampla oportunidade de fazer perguntas,
esclarecendo plenamente minhas dúvidas.
Telefone dos pesquisadores - Cristina Weber: (51)95045342; Tiago Leiria:
(51)85744494
Por este instrumento, tomo parte, voluntariamente, no presente estudo.
Nome do Paciente:____________________________________
Assinatura do paciente:________________________________
CPF:_________________-_______
Assinatura do pesquisador:_____________________________
Assinatura de Testemunha:_____________________________
Porto Alegre, ____ de ____________de 201_.
83
APÊNDICE B
84
85
APÊNDICE C
86
APÊNDICE D
87
APÊNDICE E