Ernest Rutherford (1871-1937)
“Em 1908, Rutherford recebeu o Prêmio Nobel de Química. No discurso de aceitação, ‘A Natureza
Química das Partículas Alfa Originárias de Substâncias Radioativas’, descreveu a contagem de partículas
alfa isoladas através do método de cintilação, ou seja, ele contava os átomos um a um, olhando, por um
microscópio de baixa potência, os reflexos no sulfeto de zinco provocados pela chegada de partículas alfa.
Contando átomos, Rutherford e Geiger conseguiram um meio de determinar o número de Avogadro, a carga
do elétron e outras constantes universais que também puderam ser descobertas mediante experiências
inteiramente diferentes como, por exemplo, o estudo da radiação de corpos negros.”
“Rutherford enfrentou outro problema que aparentemente era muito mais simples do que a contagem
de átomos: a descrição e explicação dos fenômenos que acompanhavam a passagem das partículas alfa
através da matéria. Atacou o problema com a ajuda de vários alunos... Ernest Marsden, um estudante da
Nova Zelândia que veio trabalhar com Rutherford, casualmente observou que as partículas alfa, em vez de
seguirem direta ou quase diretamente, eram defletidas pela matéria e se desviavam em ângulos
consideráveis. Quando Marsden descreveu essa observação a Rutherford, o professor fez com que ele
repetisse a experiência. Os grandes desvios surpreenderam Rutherford. Passaram-se várias semanas. Certo
dia, Rutherford anunciou que agora sabia por que as partículas de Marsden tinham-se desviado em ângulos
largos. E, além disso, sabia qual era a estrutura de átomo.”
“A atração eletrostática entre o núcleo carregado positivamente e os elétrons carregados
negativamente estabilizava o átomo. Rutherford afirmou explicitamente que não estava preocupado com a
estabilidade do sistema, um ponto vulnerável que levava a grandes dificuldades.”
“Em ‘A Estrutura do Átomo’, Rutherford tratava da dispersão de partículas alfa e beta e das
conclusões que podem ser extraídas no que diz respeito à localização de cargas positivas. Deu então atenção
especial à passagem de partículas alfa no hidrogênio e às colisões com o que hoje chamamos de prótons ou
núcleos de hidrogênio. Em outra ocasião, tratando das dimensões e constituição do núcleo, observou que
Bohr tinha aduzido argumentos para atribuir uma origem nuclear aos elétrons emitidos no decaimento
radioativo, assim diferenciando elétrons atômicos de elétrons nucleares.”
“O modelo atômico, depois de formulado por Rutherford, foi mais aperfeiçoado por Bohr do que
pelo próprio Rutherford. Este, por seu lado, prosseguiu com o estudo dos raios beta e gama, chegando a
resultados válidos, mas não revolucionários. Nesse meio tempo, a Inglaterra entrara na guerra e a população
do laboratório de Manchester diminuiu. Rutherford também foi-se envolvendo cada vez mais no trabalho
para o Almirantado e com a defesa do Império.”
“A atitude de Rutherford em relação a físicos teóricos era bastante peculiar. Ele mesmo não era um
teórico e caçoava das teorias e de teóricos... Estava sempre muito atento a resultados teóricos e traduzia-os
em termos concretos, que eram os de sua preferência: chegava ao ponto de dizer, de modo brincalhão, que as
partículas alfa eram vermelhas, como todos sabiam.
Bohr, que o respeitava muito, tinha sido seu
protegido e os dois, sem sombra de dúvida, devem ter debatido juntos sobre questões de física, mas os meios
que utilizavam para comunicar-se, dadas as diferenças que os caracterizavam, permanecem um mistério.”
“Embora Rutherford fosse um excelente professor para cientistas pesquisadores que tivessem a sorte
de trabalhar ao seu lado, suas aulas não eram proeminentes. Ele se embaralhava no assunto ou facilmente
caía em digressões, tendendo a falar a respeito de algum de seus temas preferidos. Certa vez, durante uma
palestra, ao deparar-se-lhe uma integral que devia ter-se cancelado, mas o motivo lhe escapara, ele afirmou,
com a maior seriedade, que essa integral se havia neutralizado porque a diferencial era infinitesimal.”
Niels Bohr (1885-1962)
“Bohr, em 1911, foi trabalhar com J.J. Thomsom no Laboratório Cavendish. Thomson recebeu-o
cortesmente e ouviu as explicações a respeito de seu trabalho, mas não teve tempo para ler a tese,... em razão
do próprio esquema de trabalho de Thomson e do número de estudantes que tinha sob sua orientação.”
“Em Cambridge, Bohr conheceu Rutherford e ficou tão impressionado com ele que, ainda em 1911,
deslocou-se para Manchester para frequentar um curso experimental sobre medições radioativas dado no
laboratório de Rutherford. Enquanto esperava pela chegada de uma fonte radioativa, trabalhou em um tema
que estava na moda em Manchester: a passagem das partículas alfa através da matéria. Conseguiu alguns
resultados interessantes e o assunto continuou a ser um de seus preferidos até o fim da vida.”
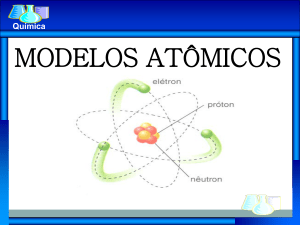
“Rutherford havia aperfeiçoado um modelo atômico que podia explicar os grandes desvios
ocasionalmente experimentados por partículas alfa ao passarem através da matéria. Para esclarecer esse
fenômeno, Rutherford tinha analisado... um modelo nuclear. Bohr levou esse modelo muito a sério, a
despeito da dificuldade apresentada por sua instabilidade mecânica e elétrica. Essa dificuldade tinha alguns
aspectos interessantes. Sabia-se ou supunha-se que todos os átomos de uma substância eram iguais, mas no
modelo nada havia que pudesse garantir essa igualdade; especificamente, não havia nada que pudesse
determinar o raio atômico. Portanto, para que o modelo sobrevivesse, fazia-se necessário achar uma solução
radical que permitisse tanto a estabilidade quanto um raio fixo.”
“As hipóteses postuladas por Bohr, sobre os estados estacionários, contradizem a física clássica... O
fio de Ariadne que Bohr usou para sair do labirinto é a exigência de que, para grandes órbitas, a teoria
clássica e a hipótese de Bohr dão o mesmo resultado. Segundo as próprias palavras de Bohr: ‘Mostraremos
que as condições a serem usadas para determinar os valores de energia nos estados estacionários são de tal
tipo que as frequências calculadas (E1 – E2 = hv) no limite em que os movimentos em estados estacionários
sucessivos diferem comparativamente muito pouco um do outro tenderão a coincidir com as frequências que
se esperam da teoria ordinária da radiação do movimento do sistema nos estados estacionários.’”
“Bohr e seu instituto de Copenhague também desempenharam uma função nobre e necessária que
resultou das consequências da guerra. O conflito tinha deixado uma herança de ódio e alguns desejos
infantis, mas perigosos, de vingança e retaliação. Esses sentimentos também envolveram alguns cientistas.
Aqueles que haviam prestado apoio aos aliados queriam excluir os colegas alemães da vida científica
internacional; por outro lado, os alemães agiam, injustificadamente, como vítimas. Tal tipo de
comportamento predominava mais no mundo científico oficial, composto de cientistas mais velhos e quase
sempre já fora de atividade, do que entre os cientistas mais jovens, que se dedicavam a suas pesquisas. Bohr
tentou combater os excessos e restabelecer o bom relacionamento entre as facções. Sua personalidade e o
fato de ser cidadão de um país neutro ajudaram-no nessa tarefa.”
“A atividade científica de Bohr assumiu uma forma peculiar. Seus hábitos de trabalho quase sempre
consistiam em pensar em voz alta e levar adiante intermináveis discussões, para as quais precisava de um
parceiro. Era uma espécie de método socrático pelo qual desenvolvia suas ideias falando.”
“Com bastante frequência, eu era apenas sua plateia durante o processo de pensar em voz alta... A
meu ver, foi o mais profundo pensador que já conheci. Seus conceitos eram de um tipo relativamente
filosófico. Nem sempre eu os entendia, embora fizesse o possível. Minha própria linha de raciocínio me
levava a dar ênfase a conceitos que pudessem ser expressos em forma de equações e grande parte dos
conceitos de Bohr era de caráter mais genérico e até certo ponto mais afastados da matemática.” (Dirac)
“Em virtude de sua maneira peculiar de escrever, o próprio Bohr não publicou muita coisa; não
obstante, era o centro de toda a atividade da época. Além disso, viajava com frequência e era convidado a
expor suas ideias em vários centros científicos da Europa e dos Estados Unidos.”