TRATAMENTO DE EFLUENTE HOSPITALAR POR MÉTODOS OXIDATIVOS
AVANÇADOS
1
Thiago Lopes da Silva, 2 Célia Regina Granhen Tavares, 3 Elenice Tavares Abreu
1
Bolsista de iniciação Científica IC-Balcão/CNPq/UEM, discente do curso de Engenharia Química/UEM
Professora Doutora da Universidade Estadual de Maringá (UEM)/PR
3.
Pesquisadora Doutora do Departamento de Engenharia Química da Universidade Estadual de Maringá
(UEM)/PR
2
1,2,3
Departamento de Engenharia Química da Universidade Estadual de Maringá. Avenida Colombo 5790, bloco D-90,
Campus Universitário Maringá, Maringá - Paraná - Brasil, CEP: 87020-900, fone: (44)3261-4778
e-mail: [email protected]
RESUMO – Neste trabalho avaliou-se a remoção de fenóis em efluente hospitalar por
processos avançados de oxidação Fenton (Fe2+/H2O2) e foto-Fenton (Fe2+/H2O2/UV). O tempo
reacional e concentração de reagentes foram determinados para a otimização do processo. Os
resultados obtidos mostraram que o processo foto-Fenton apresentou uma maior eficiência em
comparação com o processo Fenton, com valores que alcançaram até 98,7%. As
determinações das concentrações de fenóis totais foram realizadas em oito amostras
compostas do efluente hospitalar coletados no Hospital Universitário de Maringá (HUM), em
2007 e 2008. Para determinar o tempo reacional para os processos, foram retiradas amostras
nos tempos de 60, 90 e 120 minutos e determinada a concentração de fenóis totais para cada
amostra, obtendo-se valores de fenóis totais em função do tempo de reação. As concentrações
de fenóis totais, determinados nas amostras do efluente, variaram entre 6,6 e 12,9 mg/L,
valores estes acima do permitido (0,5 mg/L) pela Resolução n° 357/05 do CONAMA. Os
resultados apresentados mostram que as eficiências de remoção de fenóis totais foram
maiores no tempo reacional de 120 minutos, em comparação com os tempos de 60 e 90
minutos estudados. As degradações dos compostos fenólicos, pelos processos oxidativos
avançados, do efluente do HUM variaram entre 43,5 e 98,7%.
Palavras-Chave: Fenton, foto-Fenton, fenóis.
INTRODUÇÃO
A dificuldade de biodegradabilidade de medicamentos, metais pesados, produtos químicos e
as misturas destes, tornam o efluente hospitalar
bastante agressivo para o meio ambiente. O
grande volume gerado destes efluentes tóxicos é
um outro agravante para o meio em que são lançados.
De acordo com EMMANUEL et al. (2002)
um dos principais problemas ambientais, causados pela disposição de efluentes hospitalares, é o
seu lançamento nas redes coletoras de esgoto,
do mesmo modo que os efluentes domésticos,
sem nenhum tratamento prévio.
De acordo com SAPIA e MORITA (2003),
o fenol, entre outros compostos químicos, tem
sido detectado no lodo das estações de tratamento de esgotos domésticos. Estes poluentes podem
inibir a digestão aeróbia ou anaeróbia e ainda gerar lodo com características perigosas, que pode
torná-lo inconveniente ao uso na agricultura ou se
for disposto inadequadamente, pode contaminar o
solo e a água subterrânea.
Segundo ABREU (2008), o despejo de efluentes com altas concentrações de compostos
fenólicos, nas redes coletoras de esgoto doméstico, pode causar sérios danos ao ambiente, pois,
considerando-se que a maioria dos sistemas convencionais de tratamento de esgotos é projetada
somente para a remoção de matéria orgânica e
organismos patogênicos, os compostos fenólicos
passarão intactos por estes processos de tratamento.
Desta forma, torna-se necessário a aplicação de tratamento específico para a remoção
de fenóis totais presentes nos efluentes hospitalares.
Nos últimos 20 anos, os Processos Oxidativos Avançados (POA) têm merecido destaque
devido à sua alta eficiência na degradação de inúmeros compostos orgânicos e custo operacional baixo. Têm se mostrado como uma alternativa
no tratamento de águas superficiais e subterrâneas, bem como de águas residuárias e solos
VIII Congresso Brasileiro de Engenharia Química em Iniciação Científica
27 a 30 de julho de 2009
Uberlândia, Minas Gerais, Brasil
contaminados. Nos Processos Oxidativos Avançados, há a mineralização da grande maioria dos
contaminantes orgânicos, isto é, o composto não
é apenas transferido de fase, mas destruído e
transformado em dióxido de carbono, água e ânions inorgânicos (não tóxicos, ou de menor potencial tóxico). (TEIXEIRA & JARDIM, 2004).
Os processos oxidativos avançados envolvem a geração e uso de espécies transitórias
como o radical hidroxila (•OH), sendo o radical
responsável alta capacidade oxidante para degradar compostos orgânicos.
A reação Fenton utiliza íons ferrosos
2+
(Fe ) provenientes de um sal ferroso e peróxido
de hidrogênio (H2O2) para produzir radical hidroxila (•OH), conforme a equação 1, a seguir. - (TEIXEIRA & JARDIM, 2004).
Fe2+ + H2O2 Fe3+ + •OH + OH-
Equação 1
Com a combinação da radiação ultravioleta (UV), o reagente Fenton tem seu poder oxidan2+
te aumentado, sendo o processo H2O2/Fe /UV
denominado foto-Fenton.
O reagente Fenton é um dos principais
exemplos de processos oxidativos avançados,
apresentando como vantagens a alta eficiência, a
simplicidade na destruição de contaminantes e a
estabilidade no tratamento de uma ampla faixa de
substâncias (MALIK & SAHA, 2003).
O reagente Fenton tem sido utilizado com
sucesso na degradação de diversos tipos de efluentes, como clorofenóis, surfactantes, na oxidação de resíduo de aterro lixiviação, na degradação de corantes, etc. (TEIXEIRA & JARDIM,
2004).
De um modo geral, não há trabalhos na literatura, que levasse em conta a degradação de
fenóis totais presentes nos efluentes hospitalares.
No entanto, as indicações que o processo Fenton
e foto-Fenton são capazes de tratar tais tipos de
compostos justificaram o uso destes processos
no tratamento do efluente estudado.
MATERIAIS E MÉTODOS
As determinações das concentrações de
fenóis totais foram realizadas em oito amostras
compostas do efluente hospitalar, coletadas em
2007 e 2008.
As coletas foram feitas nos períodos de
maior circulação de pessoas no hospital, das
8:00h às 17:30h. A cada 30 minutos retirava-se
uma amostra de 200 ml. O efluente era armazenado em galões dentro de caixa térmica refrigerada com gelo. As amostras então eram encaminhadas para análises no Laboratório de Gestão,
Controle e Preservação Ambiental (LGCPA) do
Departamento de Engenharia Química da Universidade Estadual de Maringá.
A concentração de Fenóis Totais foi determinada pelo método colorimétrico de Folin-
Ciocaulteu, proposto por SCALBERT et al. (1989).
Este método baseia-se na oxidação de fenóis por
reagente Folin-Ciocaulteu, resultando na formação de um complexo azul proporcional à concentração de fenóis. A leitura do complexo colorido
foi monitorada utilizando-se espectrofotômetro
marca HACH modelo DR/2010, a um comprimento de onda de 760nm.
Para remoção de fenóis foram utilizados
os processos Fenton e Foto-Fenton.
Numa primeira etapa, foram realizados
experimentos preliminares, com o objetivo de avaliar a influência do tempo reacional bem como da
concentração de reagentes na eficiência de remoção de fenóis totais pela oxidação pelo reagente Fenton. Foram
testadas as
razões
[DQO]:[H2O2] = 1:4 (m/m), variando as razões
mássicas de ferro [Fe] em relação a DQO de 0,1;
0,2; 0,3; 0,4; 0,5 e 0,6. Para a determinação do
tempo reacional do processo de oxidação, realizou-se nesta etapa análises de fenóis totais, durante o experimento, nos tempos de 60, 120 e
180 minutos.
Para determinar o tempo reacional, tanto
para o processo Fenton, como para o processo
Foto-Fenton em amostras subseqüentes, foram
retiradas amostras nos tempos de 60, 90 e 120
minutos e determinada a concentração de Fenóis
Totais para cada amostra, obtendo-se valores de
fenóis totais em função do tempo de reação.
No sistema de tratamento Fenton, o experimento foi realizado em Jar-test (Jar-test Milan101), à temperatura ambiente, sob agitação constante de aproximadamente 150 rpm. Foram utilizados volumes de 150 mL de efluente bruto, em
Becker de vidro com volume útil de 250 mL.
O sistema de tratamento Foto-Fenton
consistiu de um reator de mistura perfeita, um
reator de vidro em espiral, lâmpada ultravioleta,
bomba peristáltica e tubos. No reator fotoquímico,
o efluente circulava através de um tubo de vidro
em espiral de 9,0 mm de diametro em torno de
uma lâmpada UV (15 W; λ = 380 nm) de 43,5 cm
de comprimento e 2,6 cm de diâmetro. O experimento foi conduzido à temperatura ambiente.
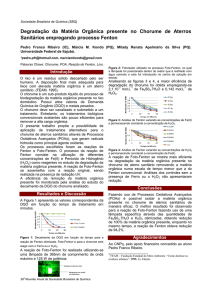
A Figura 1, a seguir, reproduz o reator utilizado nos experimentos foto-Fenton. Em detalhe
o reator de vidro espiral em torno da lâmpada emissora de radiações ultravioleta.
Concentrações de Fenóis Totais das
am ostras do HUM
15
12,93
FT (mg/L)
10,80
8,72
10
9,96
9,17
8,12
6,90 6,61
5
0
1
2
3
4
5
Am ostras
6
7
8
Figura 2 – Concentração de Fenóis Totais das
amostras coletadas no HUM
Figura 1 – Reator utilizado no tratamento oxidativo foto-Fenton – Projetado e executado no
Departamento de Engenharia Química /UEM
A quantidade de reagentes requerida foi
determinada de acordo com a Demanda Química
de Oxigênio (DQO) inicial do efluente. A partir da
DQO do efluente eram calculadas as quantidades
de solução de íons ferrosos e peróxido de hidrogênio. Tanto no processo Fenton quanto no fotoFenton, primeiro adicionou-se a quantidade de
ferro ao efluente a ser oxidado e posteriormente
foi feita a adição de peróxido de hidrogênio (H2O2)
em três partes iguais com intervalos de 10 minutos. As soluções de ferro sob a forma de FeSO4·7H2O eram preparadas e padronizadas diariamente antes do uso. O peróxido de hidrogênio
(H2O2) era utilizado diretamente do frasco, sem
diluição.
Segundo TEIXEIRA & JARDIM, a reação
Fenton é fortemente dependente do pH da solução. De fato, somente em condições ácidas o oxidante reativo predominante é o •OH.
O pH do efluente, antes de se iniciarem
as reações fenton e foto-Fenton, era ajustado para 3 com solução de ácido sulfúrico (H2SO4). Para
parar a reação era utilizada solução de hidróxido
de sódio (NaOH) e o pH era ajustado para um
valor acima de 8.
RESULTADOS E DISCUSSÃO
Nas análises do efluente do Hospital Universitário de Maringá (HUM) foi constada a presença de compostos fenólicos em concentrações
elevadas.
As concentrações de fenóis totais, determinados nas amostras do efluente do HUM, variaram entre 6,6 e 12,9 mg/L. Estes resultados mostram valores muito acima do permitido (0,5 mg/L)
para lançamento nas redes coletoras de esgoto e
pela Resolução n° 357/05 do CONAMA. Os resultados das determinações das concentrações de
fenóis totais, das coletas efetuadas para o estudo
realizado, são apresentados na Figura 2.
Primeiramente foram realizados testes para
determinar as melhores condições de tratamento
para os processos oxidativos Fenton e fotoFenton. Os parâmetros de tratamento foram determinados a partir de ensaios realizados com o
processo Fenton.
A partir destes testes preliminares foi possível avaliar a influência do tempo reacional e da
razão mássica de ferro e determinar as condições, baseadas na eficiência de remoção de fenóis totais, a serem utilizadas nos experimentos,
Fenton e foto-Fenton, posteriores.
Para a avaliação da razão mássica de ferro
a ser utilizada, foram testadas as razões mássicas de [DQO]:[H2O2] = 1:4, com variações na razão dede [Fe] de 0,1; 0,2; 0,3; 0,4; 0,5 e 0,6, pH=3
e tempos de 60, 120 e 180 minutos. Os resultados são apresentados a seguir, na Tabela 1. Nesta amostra a concentração de fenóis totais (FT)
inicial era de 9,17 mg/L.
Tabela 1 – Concentração de FT, durante o tratamento Fenton, para várias razões mássicas
de ferro para os tempos reacionais de 60, 120
e 180 min.
Razão
Tempo Reacional (minutos)
Mássica
0
60
120
180
de Ferro
9,17*
8,41*
8,2*
5,40*
0,1
9,17*
6,41*
6,11*
4,01*
0,2
9,17*
6,56*
6,35*
4,41*
0,3
9,17*
7,36*
7,17*
5,42*
0,4
9,17*
9,20*
8,72*
6,51*
0,5
9,17* 10,86* 9,44*
7,92*
0,6
*Medida da concentração de fenóis totais
durante o progresso do tratamento, unidade:
mg/L.
Em todos os tempos reacionais os resultados apresentados na Tabela 1 indicaram uma
maior eficiência na remoção de Fenóis Totais para a razão mássica de ferro de 0,2.
Devido o interesse em utilizar concentrações menores, justificada pelo menor consumo de
reagentes, foi realizado outro teste para as razões
mássicas de ferro de 0,1 e 0,2 na amostra de
concentração de fenóis totais inicial de 12,9 mg/L.
A Tabela 2, a seguir, relaciona os resultados das
concentrações de fenóis totais com a razão de
ferro utilizada e o tempo reacional.
Os resultados apresentados na Tabela 2
mostram que a remoção de fenóis totais (FT) nos
tempos de 60 e 120 min foram maiores para a
razão mássica de ferro de 0,1. Para o tempo de
120 minutos a razão mássica de ferro de 0,1 apresentou remoção de FT igual a 77,5% enquanto
que na razão de 0,2 a remoção foi de 57,4%.
A diferença nos resultados do primeiro teste (Tabela1), que apresentou uma maior eficiência
na remoção de FT para a razão de ferro de 0,2; e
o segundo (Tabela 2), no qual a maior eficiência
foi observada para a razão de 0,1; pode estar relacionada a diferente composição de compostos
fenólicos presentes nas amostras.
Os resultados obtidos no segundo experimento, no qual a razão mássica de ferro de 0,1 se
mostrou mais eficiente na remoção de FT, e a
possibilidade de um consumo menor de reagentes foram determinantes para a escolha da proporção de ferro de 0,1 nos experimentos posteriores. Além do mais, a eficiência alcançada no segundo teste para a razão de 0,1; que foi de
77,5%, foi maior que a alcançada para a razão de
ferro de 0,2 no primeiro teste (Tabela 1); que para
um tempo de 120 minutos alcançou 33,4% de
remoção de FT.
Com o propósito de comparar a eficiência
de remoção de fenóis totais entre os métodos
Fenton e foto-Fenton, a amostra de concentração
inicial de fenóis totais de 12,93 mg/L, foi submetida aos dois métodos de oxidação. Os resultados
obtidos são mostrados na Figura 4.
FT (mg/L)
Tabela 2 – Teste com tratamento Fenton para a
avaliação da melhor proporção de ferro para
ser utilizada nos tratamentos Fenton e fotoFenton
Tempo Reacional (min)
Razão Mássica
de Ferro
Início
60
120
0,1
12,9*
10,3*
2,9*
0,2
12,9*
11,4*
5,5*
* Medida da concentração de fenóis totais
durante o progresso do tratamento, unidade:
mg/L.
Com paração entre os processos
Fenton e foto-Fenton
14
12
10
8
6
4
2
0
12,93
Fenton
fofo-Fenton
10,3
6,42
2,91
0,17
0
60
tempo (min)
120
Figura 3 – Comparação na remoção de Fenóis
Totais entre os métodos de oxidação Fenton e
foto-Fenton
O efluente submetido às mesmas condições de oxidação (razão mássica de ferro de 0,1)
indicou que o efeito da degradação de fenóis totais foi maior quando houve a associação de raios
UV no experimento (processo oxidativo fotoFenton). As remoções alcançadas de FT entre os
métodos, para o tempo de 120 minutos, foram de
77,5% para o processo Fenton e 98,7% para o
processo foto-Fenton. Portanto o processo fotoFenton, que gerou uma maior remoção, foi o tratamento utilizado nas análises posteriores do efluente hospitalar.
Em análises subseqüentes, as amostras foram submetidas ao processo oxidativo fotoFenton, com razão mássica de ferro de 0,1. A
evolução das concentrações de fenóis totais durante o tratamento realizado nas coletas posteriores são apresentadas na Tabela 3, a seguir.
Tabela 3 – Concentração de Fenóis Totais (FT)
após o tratamento foto-Fenton
Coletas tratadas pelo método
foto-Fenton
DQO
689
484
827
1026
(mg/L)
Tempo
Concentração de FT (mg/L)
Início
9,96
8,47
6,90
6,61
60 min
9,27
0,81
8,44
4,31
90 min
7,66
0,64
4,05
3,08
120 min
5,63
1,07
1,10
2,53
Os resultados apresentados na Tabela 3
demonstram que o melhor tempo reacional para a
remoção de FT foi de 120 minutos, quando comparados aos tempos de 60 e 90 minutos. A exceção foi a segunda amostra (de concentração inicial de FT de 8,47 mg/L – Tabela 3), cujo melhor
tempo foi de 90 minutos.
As eficiências nas degradações dos compostos fenólicos para o tempo de 120 minutos,
segundo os resultados apresentados na Tabela 3,
variaram entre 43,5% e 87,4%. Vários fatores podem ter influenciado na variação das eficiências
de remoção de FT, tais como; cor, turbidez e ou-
tros compostos químicos presentes nas amostras
submetidas ao tratamento proposto. Desta forma,
torna-se necessário o estudo da influência de alguns parâmetros, no processo de oxidação dos
efluentes do HUM.
A adição seqüencial de H2O2, em três partes iguais em intervalos se 10 minutos, se deve a
possibilidade de aumento excessivo de temperatura durante a adição do reagente no efluente.
Entretanto, nas amostras analisadas, a adição de
peróxido de hidrogênio não provocou um aumento
de temperatura significativo. Durante o monitoramento do processo não foi observado variações
de temperatura maiores que 3°C.
CONCLUSÃO
A alta concentração de fenóis, presente no
efluente do hospital, é um fator preocupante devido aos riscos que esses compostos oferecem,
quando dispostos no ambiente. Os resultados das
amostras analisadas revelaram valores acima do
permitido, indicando assim a necessidade da aplicação de tratamento específico para a remoção
de fenóis totais presentes nos efluentes hospitalares.
O processo oxidativo foto-Fenton apresentou uma maior eficiência na diminuição da concentração de fenóis do efluente quando comparado com o tratamento pelo processo Fenton. Com
relação ao tempo reacional, os resultados obtidos
com 120 minutos de tratamento apresentaram
melhores resultados quando comparados com os
tempos de 60 e 90 minutos.
A eficiência na remoção de FT observada
no tratamento pelo método de oxidação fotoFenton, para o tempo de 120 minutos, variou entre 43,5 e 87,4% nos experimentos apresentados
na Tabela 3, e chegou a 98,7% no experimento
apresentado na Figura 3. Essa grande variação
demonstra que outros fatores podem ter influenciado o processo oxidativo, tais como, cor, turbidez
e outros compostos químicos presentes nas amostras analisadas. Desta forma, torna-se necessário o estudo da influência de alguns outros parâmetros no processo de oxidação dos efluentes
analisados do HUM.
Os resultados obtidos dos experimentos
com processo oxidativo foto-Fenton, apesar de
preliminares, indicam uma forma potencial para
tratamento de efluentes que contêm altas concentrações de fenóis.
REFERÊNCIAS BIBLIOGRÁFICAS
ABREU, E. T. (2008 Abreu, E. T. Tese de
Doutorado: Proposta de Gerenciamento de
efluente de Serviços de Saúde gerados no
Hospital Universitário Regional de Maringá
(HUM), Universidade Estadual de Maringá,
2008.
CONAMA - Conselho Nacional do Meio Ambiente
- Resolução no 05, de 05 de agosto de 1993.
Dispõe sobre os resíduos sólidos gerados
em portos, aeroportos, terminais rodoviários
e ferroviários e estabelecimentos prestadores
de serviços de saúde.
EMMANUEL, E.; PERRODIN, Y BLANCHARD, JM.; KECK, G. e VERMANDE, P. (2002);
Effects of hospital wastewater on aquatic
ecosystem - XXVIII Congreso Interamericano
de Ingeniería Sanitaria y Ambiental Cancún,
México, 27 al 31 de octubre, 2002.
SAPIA, P. M.; MORITA, D. M. (2003). Critérios de
recebimento de Efluentes não Domésticos
em Sistemas Públicos de Esgotos: Uma
Análise Crítica e Ambiental.
TEIXEIRA, C. P. A. B.; JARDIM, W. F. (2004).
Processos Oxidativos Avançados – Conceitos Teóricos, Caderno Temático, Volume 3 UNICAMP/ Universidade Estadual de Campinas; IQ – Instituto de Química.
SCALBERT, A., MONTIES, B., JANIN G. (1989).
“Tannin in wood: comparison of different
estimation methods”, Journal of Agricultural
and Food Chemistry, 37, pp.1324-1329,
1989.
MALIK, P. K.; SAHA, S.K. (2003). Oxidation pf
direct dyes with hydrogen peroxide using
ferrous ion as catalyst, Sep. Purif. Technologie, Madrid, España, 2003.
AGRADECIMENTOS
À Orientadora Prof. Dra Célia Regina
Granhen Tavares, a pesquisadora Dra. Elenice
Tavares Abreu, ao CNPq pelo apoio financeiro ao
projeto, e a todos aqueles que de alguma forma
tornaram possível a realização deste trabalho.