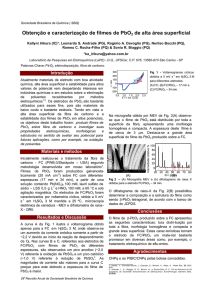
EFEITO DOS PARÂMETROS OPERACIONAIS NO PROCESSO DE
ELETROOXIDAÇÃO DE SOLUÇÕES DE CORANTE VERMELHO ASTRAZON
COM ELETRODOS TUBULARES DE PbO2
Bárbara Bernardim de Souza (ICV - UNICENTRO), João Benhur Mokochinski (ICV UNICENTRO), Carlos Alberto Policiano de Almeida (Co-Orientador),Mauro Chierici
Lopes (Orientador) e-mail: [email protected]
Universidade Estadual do Centro – Oeste / Centro de Ciências Exatas – Guarapuava
– PR
Palavras-chave: PbO2, Vermelho Astrazon, Corantes, Eletrooxidação
Resumo:
A proposta do presente trabalho é o estudo de descoloração de soluções do
corante Vermelho Astrazon (AA) através do processo de eletrooxidação utilizando
como anodo eletrodos tubulares de PbO2 com hastes de grafite. Investigou-se o
efeito de parâmetros operacionais na eficiência da remoção da cor, taIS como
densidade de corrente, pH e presença de eletrólitos condutores.
Introdução
Durante o processo de tingimento na indústria têxtil são gerados efluentes
indesejáveis, alertando as autoridades a tomarem medidas que limitam a
concentração de corantes nesses efluentes. Ainda que alguns corantes não sejam
as substâncias mais prejudiciais ao meio ambiente, eles são indesejáveis porque
dificultam a penetração de luz solar na água atingindo a vida aquática. Vários são
os processos propostos para remoção desses poluentes, dentre eles o de
eletrooxidação com eletrodos de PbO2. Estes eletrodos são adequados para esse
fim uma vez que apresentam boa atividade na geração eletroquímica de oxidantes,
além de serem relativamente estáveis em elevados potenciais e em diferentes meios
[1]. Um método para preparação desse eletrodo é a deposição de PbO 2 sobre
substrato de titânio platinizado formando um eletrodo similar aos eletrodos
dimensionalmente estáveis usados na indústria de cloro-soda. Esse processo,
entretanto, gera eletrodos com baixa porosidade e área superficial diminuindo assim
a eficiência eletroquímica do processo, além de requerer um revestimento de platina
o que o deixa com alto custo de preparação. Dependendo das condições de
utilização a fina camada depositada sobre o substrato se solta determinando o fim
da vida útil do eletrodo. Propôs-se neste trabalho a utilização de eletrodos tubulares
de PbO2. A utilização do chumbo metálico como coletor de corrente se mostra
eficiente na remoção do corante, entretanto causa a formação de Pb 2+ solúvel
durante o processo de oxidação, contaminando o efluente tratado. Devido a isso foi
testada a eficiência de eletrodos tubulares com hastes de grafite para evitar a
formação de espécies solúveis de chumbo. Nestes eletrodos o PbO 2 é formado por
um método similar ao utilizado na indústria de baterias chumbo-ácido garantindo alta
porosidade e área superficial. Para tal processo eletroquímico se tornar viável em
termos de eficiência, a solução eletrolítica precisa apresentar um nível de
condutividade iônica adequada [3].
Materiais e Métodos
Os eletrodos de PbO2 foram preparados a partir de pasta de óxido de chumbo
com H2SO4 para formar sulfato tribásico de chumbo em um processo similar ao que
é utilizado na indústria de baterias [4]. O material é colocado em tubos cilíndricos
porosos de polipropileno utilizados em baterias tubulares e o coletor de corrente
usado foi uma haste de grafite. Os eletrodos de PbO2 são formados pela oxidação
anódica do sulfato tribásico de chumbo passando uma corrente de 10 mA por 48
horas em ácido sulfúrico 0,86 M.
As soluções de corantes de Vermelho Astrazon foram preparadas com
concentração de 0,1 g.L-1 adicionado cloreto de potássio 2 g.L-1 ou nitrato de sódio 2
g.L-1.
Termostatizou-se a cela de trabalho com 25°C sob agitação constante.
Durante o processo retiraram-se alíquotas de 100 μL em intervalos regulares de
tempo para análise UV-VIS.
Resultados e Discussão
Diferentes correntes (50-170 mA e 60-150 mA) são aplicadas para investigar
a degradação eletrocatalítica do corante na presença de KCl (2 g.L -1) e de NaNO3 (2
g.L-1) em solução. O gráfico 1 mostra que a melhor eficiência de descoloração
ocorreu em meio de KCl.
(a)
(b)
Gráfico 1: % de descoloração em função do tempo para (a )meio de cloreto e (b) de nitrato
A eficiência de descoloração na presença de cloreto se deve à formação de
hipoclorito pela oxidação do cloreto a cloro e posterior reação com a água [2]. Na
ausência de cloreto, a oxidação pode ocorrer pela formação de radicais hidroxila
devido ao processo de oxidação da água. Os resultados podem ser igualmente
explicados por dois aspectos: i) a velocidade de oxidação é maior com o hipoclorito
do que com os radicais hidroxila; ou ii) a atividade eletrocatalítica do eletrodo de
PbO2 é maior para a formação de cloro do que para a formação de radicais hidroxila.
Para determinar qual dos dois fatores está de fato agindo são necessários novos
experimentos, contudo dados da literatura indicam que a segunda hipótese é mais
provável, uma vez que os radicais hidroxila são tidos como um dos mais poderosos
oxidantes que existe.
Fez-se soluções de pH inicial variando de 2 até 8 ( 2, 3, 6 e 8) para testar o
efeito do pH no processo. Observa-se no gráfico 2 que na presença de cloreto não
foi verificada uma influência significativa do pH, enquanto que na ausência de cloreto
o processo é favorecido por pH inicial mais baixo. Estas observações sugerem que
na ausência de cloreto verifica-se a formação de hidroxilas.
(a)
(b)
Gráfico 2: Efeito do pH na eficiência de descoloração em presença de (a ) cloreto e (b) nitrato
Conclusões
A eficiência de oxidação depende do tipo do eletrólito utilizado e da corrente
aplicada. A melhor atividade eletrocatalítica do dióxido de chumbo é observada na
presença de KCl. O potencial não se altera durante a oxidação. A eficiência de
descoloração atinge um valor máximo, a partir do qual, é ineficaz o aumento da
energia despendida no processo. Um melhor conhecimento do mecanismo de
oxidação e a otimização do eletrodo pode proporcionar um método viável para a
despoluição de águas contaminadas com corantes.
Referências
[1] ANDRADE, L. S. Produção e caracterização de eletrodos de Ti-Pt/ PbO2
dopados e seu uso no tratamento eletroquímico de elfluentes simulados.
[2] H.S. AAWD, N. ABO GALWA. Electrochemical degradation of Acid Blue
and Basic Brown dyes on Pb/PbO2 electrode in the presence of different
conductive electrolyte and effect of various operating factors. Disponível em
www.elsevier.com/locate/chemosphere. Chemosphere 61 (2006) 1327-1335
[3] ANDRADE, L. S. et. al. On the performance of Fe and Fe,F doped Ti–
Pt/PbO2 electrodes in the electrooxidation of the Blue Reactive 19 dye in
simulated textile wastewater. Tese de Doutorado, Universidade Federal de
São Carlos, 2006.
[4] BODE, Hans. Lead-acid batteries. Traduzido por: R.J. BRODD e KARL V.
Kordesch. Princeton: John Wiley & Sons. 1997. 387p.