QB75B – Práticas de Físico-Química – 2017
Prof. Dr. João Batista Floriano
Prof. Dr. Luiz Marcos L. Faria
Experimento nº 6: Tensão superficial e determinação
da CMC de um surfactante
Objetivo: Determinar a tensão superficial de água e butanol através do Método do anel
(método de Du Nöuy); determinar a concentração micelar crítica (cmc) de um tensoativo
aniônico.
Introdução:
A tensão superficial surge nos líquidos como resultado do desequilíbrio entre as
forças que agem sobre as moléculas da superfície em relação àquelas que se encontram
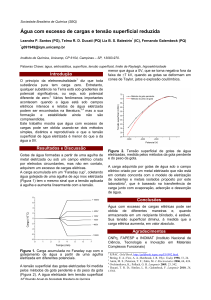
no interior da solução 1. A figura 1 mostra a tendência das moléculas da superfície a
migrarem para o interior do líquido, o que faz com que as superfícies líquidas apresentem
tendência em reduzir sua área a um valor mínimo.
Figura 1: Diagrama esquemático comparando as forças atrativas entre moléculas na superfície e no
interior de um líquido. Fonte: Shaw et al (1992)2
Ao trabalho necessário para se aumentar a área superficial de um líquido dá-se
o nome de tensão superficial1, que pode ser expressa matematicamente como:
𝑑𝑤 = 𝛾𝑑𝜎
QB75B – Práticas de Físico-Química – 2017
Prof. Dr. João Batista Floriano
Prof. Dr. Luiz Marcos L. Faria
Sendo que dw é a quantidade de trabalho efetuado para aumentar a área numa
quantidade infinitesimal dσ e γ é a constante de proporcionalidade chamada tensão
superficial. Esta grandeza é dependente da temperatura e seu valor indica quão forte são
as interações intermoleculares presentes no liquido. No caso de soluções, seu valor pode
aumentar ou diminuir com a concentração do soluto, dependendo da natureza das
interações soluto-solvente.
O conhecimento e o controle da tensão superficial de soluções aquosas de
tensoativos são fundamentais em diversas aplicações de produtos industrializados, sendo
as principais aplicações o aumento da molhabilidade de uma substância, melhor dispersão
de partículas e maior poder de limpeza, por exemplo3.
A tensão superficial pode ser medida por diferentes técnicas, como a da
determinação do diâmetro de gotas, do anel de Du Nöuy e da ascensão capilar. O primeiro
baseia-se na contagem do número de gotas gerado por um determinado volume de uma
solução da amostra (o qual é medido a partir de uma bureta) e sua relação com o número
de gotas gerado por este volume de solução3.
Esta metodologia baseia-se no princípio de que a força exercida pelo peso de
uma gota (m∙g) na ponta de uma bureta é máxima no momento exatamente anterior ao
seu desprendimento da ponta. Neste momento, o peso da gota é equilibrado pela tensão
superficial do líquido (γ) multiplicada pelo perímetro (2.π.r) da ponta da bureta. Assim,
a tensão superficial de um líquido pode ser calculada pela medida da massa (m) de uma
gota deste líquido, de acordo com a Equação 13:
γ=
𝑚∙𝑔
2𝜋∙𝑟∙𝑓
Equação 1
Sendo que m é a massa média de uma gota, g é a aceleração da gravidade e r é o raio da
ponta da bureta. O termo f é um fator de correção necessário devido ao fato da gota não
se separar da ponta da bureta na forma completamente esférica.
Um estudo pioneiro publicado no Journal of the American Chemical Society, em
1918, sugere que o fator de correção f depende da razão r/V1/3, sendo V é o volume médio
de uma gota. O valor de f pode ser então determinado através de interpolação gráfica com
QB75B – Práticas de Físico-Química – 2017
Prof. Dr. João Batista Floriano
Prof. Dr. Luiz Marcos L. Faria
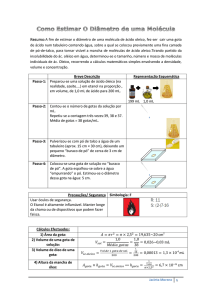
valores de (r/V1/3) 4. O gráfico que correlaciona os valores destes dois parâmetros é
mostrado na figura 2.
Figura 2: Dependência entre o fator de correção (f) e a razão r/V1/3.
Fonte: BEHRING, J. L. et al. (2004)1.
Outra metodologia que pode ser empregada para a determinação da tensão
superficial é através do anel de Du Nöuy. Neste método, o líquido está contido um
recipiente que é elevado até que se registre a quebra do filme de líquido formado no
interior do anel. A tensão marcada no equipamento no exato momento da ruptura
corresponde à tensão superficial do líquido.
Nesta aula prática, são propostas as medições dos valores de tensão superficial
de duas substâncias puras (água destilada e butanol) à temperatura ambiente (pelo método
do anel de Du Nöuy) e também a determinação da concentração micelar crítica (cmc) do
surfactante dodecilbenzenosulfonato de sódio (DBSNa) (pelo método da gota).
QB75B – Práticas de Físico-Química – 2017
Prof. Dr. João Batista Floriano
Prof. Dr. Luiz Marcos L. Faria
Procedimento:
(LER TODO O PROCEDIMENTO ANTES DE INICIAR O
EXPERIMENTO)
Parte 1 – Método da gota – Determinação da cmc do dodecilbenzenosulfonato de
sódio.
Materiais e Reagentes
Água destilada
1 béquer de 100 mL
Solução DBSNa 30 mmol∙L
10 balões volumétricos de 25 mL
Copos de plástico pequenos (café)
Bureta de 10 mL
Filme de PVC
1 pipeta graduada de 10 mL
Espátula
1 pipeta graduada de 1 mL
Bastão de vidro
1 pipeta de Pasteur
Termômetro
-1
- Determinação do raio do tubo (r):
1. Anotar a temperatura de uma porção de água destilada em intervalos de tempo
regulares e reportar esses valores no relatório;
2. Aferir a massa de um copo plástico na balança analítica e anotar o valor;
3. Colocar um pouco de água destilada na bureta. Inclinar a bureta e preencher
lentamente para evitar a formação de bolhas. Certificar-se de que não há bolhas
de ar no interior da bureta!
4. Transferir aproximadamente 2,0 mL de água para o copo, gota a gota, deixando
que as gotas se formem lentamente. Indica-se regular a torneira da bureta para
que o desprendimento das gotas se dê a cada 3 segundos, aproximadamente.
Contar quantas gotas de água correspondem ao volume exato adicionado e anotar
os valores (número de gotas e volume);
5. Cobrir o copo com o filme de PVC para evitar perdas de água por evaporação;
QB75B – Práticas de Físico-Química – 2017
Prof. Dr. João Batista Floriano
Prof. Dr. Luiz Marcos L. Faria
6. Meça a massa do copo com a água (sem o filme de PVC). Não demore para não
perder água por evaporação.
7. Realizar este procedimento em duplicata e calcular a massa média de uma gota,
m, e a estimativa do desvio padrão associado a estes valores.
8. Determinar o raio do tubo através da Equação 2 (empírica)1:
𝑟 = −0,02815 cm + (3,81292 cm · g −1 ) ∙ 𝑚
Equação 2
- Determinação da cmc do DBSNa:
1. Preparar 10 soluções de DBSNa, nas concentrações de 25, 18, 12, 10, 8, 6, 4, 2, 1
e 0,5 mmol∙L-1 diluindo a solução de 30 mmol∙L-1 que já se encontra preparada.
Utilizar balões volumétricos de 25 mL; Aferir os meniscos dos balões
adicionando água destilada lentamente e escorrendo pela borda interna do
balão, para minimizar a formação de espuma;
2.
Preencher a bureta com a solução 0,5 mmol∙L-1 ;
3. Aferir a massa de um copo plástico e anotar o valor;
4. Transferir aproximadamente 2,0 mL de solução para o copo gota a gota.
Novamente, cuidar para que as gotas se desprendam lentamente e numa taxa
constante. Contar quantas gotas de água correspondem ao volume exato
adicionado e anotar os valores (número de gotas e volume);
5. Cobrir o copo com o filme de PVC para evitar perdas por evaporação;
6. Aferir a massa do copo com a solução e anotar os valores;
7. Calcular a massa de uma gota.
8. Realizar este procedimento em duplicata e ao fim do processo, calcular a massa
média de uma gota (e o desvio padrão associado), o volume médio de uma
gota (e o desvio padrão associado);
9. A partir do valor do raio do tubo (r) previamente calculado (Equação 2), calcular
o valor de r/V1/3 e encontre o fator de correção f, através do gráfico da figura 2;
10. Calcular o valor da tensão superficial (γ) através da Equação 1.
11. Repetir todo o procedimento para as demais soluções, das mais diluídas para as
mais concentradas.
QB75B – Práticas de Físico-Química – 2017
Prof. Dr. João Batista Floriano
Prof. Dr. Luiz Marcos L. Faria
Orientações para o relatório:
1) Reporte a temperatura em que as tensões superficiais foram determinadas no texto
e também nas tabelas e gráficos;
2) Faça um gráfico da tensão superficial em função da concentração da solução de
tensoativo e discuta o comportamento das moléculas de tensoativo no sistema,
relacionando-o a cada região do gráfico;
3) A partir do gráfico, identifique o ponto correspondente à cmc do DBSNa;
4) Compare o valor da cmc obtida com o da literatura;
5) Avalie e a metodologia executada em relação a: reprodutibilidade, possíveis
fontes de erro e incerteza.
Parte 2 – Método do anel de Du Nöuy – Determinação da tensão superficial de água
e butanol.
Materiais e Reagentes
Termômetro
Tensiômetro
Água destilada
Bico de Bunsen
Butanol
1. Anotar a temperatura de uma porção de água destilada;
2. Medir, em triplicata, a tensão superficial da água destilada no tensiômetro
disponível no laboratório seguindo as instruções detalhadas:
a. Enxaguar o anel de platina-irídio com água destilada;
b. Limpar o anel de platina-irídio na chama do bico de bunsen. Cuidado ao
manusear o anel, nunca tocar diretamente nele e não deformá-lo;
c. Preencher o recipiente de vidro com aproximadamente 75 mL de água
destilada a ser medida;
d. Encaixar o anel no braço do tensiômetro e travá-lo;
QB75B – Práticas de Físico-Química – 2017
Prof. Dr. João Batista Floriano
Prof. Dr. Luiz Marcos L. Faria
e. Posicionar o recipiente de vidro na base móvel do tensiômetro. Neste
momento a base deve estar com a distensão máxima na direção vertical
(controlada pelo botão logo abaixo da mesma!). Elevar a base até o anel
estar mergulhado aproximadamente 0,5 cm no líquido;
f. Destravar o braço de torção e, utilizando o botão à direta do tensiômetro
(sentido antihorário), alinhar a marca do espelho com a referência do
braço de torção. Com o auxílio do botão localizado logo abaixo da escala
na frente do aparelho, posicione o vernier (escala móvel) para a leitura do
zero na escala mais externa;
g. Desça a base móvel lentamente sempre mantendo alinhada a marca do
espelho com a referência do braço de torção. A superfície do líquido se
distenderá, porém o alinhamento deverá ser mantido. Continue os dois
movimentos simultâneos (descida da base e ajuste do braço com o botão
do lado direito) até a ruptura do filme do líquido no anel. A leitura da
escala no momento da quebra do filme fornecerá o valor de tensão
superficial.
3. Repetir o procedimento para o butanol;
Orientações para o relatório:
1) Reporte a temperatura em que as tensões superficiais foram determinadas no texto
e também nas tabelas e gráficos;
2) Calcular um valor médio de tensão superficial para a água e outro para o butanol,
utilizando todos os dados coletados, e também o respectivo desvio-padrão de cada
valor médio;
3) Compare os valores médios de tensão superficial obtidos para a água e o butanol
com os apresentados na literatura;
4) Avalie a metodologia executada comparando-a com o método da contagem de
gotas.
QB75B – Práticas de Físico-Química – 2017
Prof. Dr. João Batista Floriano
Prof. Dr. Luiz Marcos L. Faria
Referências
[1] BEHRING, J. L. et al. Adaptação no método do peso da gota para determinação da
tensão superficial: Um método simplificado para a quantificação da CMC de
surfactantes no ensino da química. Química Nova, v. 27, n. 3, p. 492–495, 2004.
[2] SHAW, Duncan J. Introduction to colloid and surface chemistry. 4 ed.
:Butterworth-Heinemann, 1992.
[3] NETO, É. T.; MALTA, M. M.; DOS SANTOS, R. G. Medidas de tensão superficial
pelo método de contagem de gotas: Descrição do método e experimentos com
tensoativos não-iônicos etoxilados. Química Nova, v. 32, n. 1, p. 223–227, 2009.
[4] HARKINS, W. D.; BROWN, F. E. The determination of surface tension (free
surface energy), and the weight of falling drops: the surface tension of water and
benzene by the capillary height method. Journal of the American Chemical Society,
v. 41, n. 4, p. 499–524, 1918.