Qui.
Este conteúdo pertence ao Descomplica. Está vedada a
cópia ou a reprodução não autorizada previamente e por
escrito. Todos os direitos reservados.
Semana 5
Allan Rodrigues
Gabriel Pereira
(Victor Pontes)
CRONOGRAMA
06/03
Ligações Químicas:
Ligações Químicas:
Teoria do octeto,
ligação covalente
ligação iônica e
ligação metálica
15:00
07/03
19:15
Geometria
molecular,
polaridade e forças
intermoleculares
13:30
13/03
Número de
Funções
oxidação
inorgânicas: óxidos
(compostos
orgânicos e
inorgânicos)
15:00
14/03
Funções
inorgânicas: Bases
13:30
19:15
20/03
21/03
Funções
Funções
inorgânicas: Ácidos
inorgânicas: Sais
15:00
19:15
Teorias ácido-base
13:30
27/03
Reações químicas:
Adição, Decomposição,
Simples troca e Dupla
troca, condições para
ocorrencia de reações
15:00
28/03
Balanceamento
redox
13:30
Balanceamento
de equações por
tentativa e reações
redox
19:15
Funções
inorgânicas:
bases
01. Resumo
04. Questão 02. Exercícios
contexto
05. Gabarito
para aula
03. Exercícios
para casa
14
mar
RESUMO
moléculas daquela base se dissociam. É um poder
Bases
baixo de ionização.
São substâncias de sabor adstringente, que tornam
uma solução alcalina ou básica e têm aplicações
Porém, nem sempre sabemos o valor de α. Desta
como produtos de limpeza, antiácidos etc. O lei-
forma, temos as seguintes regras:
te de magnésio e a produção de sabões são exemplos de aplicação comercial das bases. O pH ideal
✓✓ Bases formadas com os metais alcalinos (grupo I
da água que tomamos, ou qualquer líquido, deve ser
ou família IA) e metais alcalinos terrosos (família IIA
levemente alcalino pela proximidade com o valor de
ou grupo II) são fortes, com exceção dos metais Be
pH do sangue. Nos refrigerantes de cola, o pH está
e Mg, formadores de bases fracas.
entre 2-3, pense nisso antes de tomar algum tipo de
✓✓ As demais bases são fracas, inclusive NH4OH.
Segunda Arrhenius, bases são substâncias que, ao
Solubilidade das bases
se dissolverem e dissociarem-se em água, liberam
✓✓ Bases formadas pelos elementos do grupo I e
OH- como único ânion. Este, em geral, vem associa-
NH4OH são solúveis em água.
do a um cátion metálico (metais alcalinos, alcalinos
✓✓ Bases formadas pelos átomos do grupo II são
terrosos, metais de transição, Al etc) ou ao íon amô-
pouco solúveis
nio (NH , o único cátion com mais de um elemento,
✓✓ As demais são insolúveis
4+
N e H).
Exemplos:
Veja alguns exemplos de bases, que podem ser re-
Solúveis: NaOH, LiOH, KOH, RbOH, FrOH
conhecidas pela presença do grupo ‘OH’.
Pouco solúveis: Mg(OH)2, Ca(OH)2, Be(OH)2
Insolúveis: Fe(OH)2
NaOH, Ba(OH)2, Al(OH)3, LiOH , NH4OH e AgOH
Atenção: Bases fracas se dissociam pouco; Bases
Repare que, ao montar a fórmula de uma base, o nú-
insolúveis não se dissolvem muito. Existe diferen-
mero de hidroxilas (‘OH’) é equivalente ao valor nu-
ça entre dissolução e dissociação. Uma substância
mérico do nox do cátion. Assim, perceba acima que
pode se dissolver e não se dissociar, por exemplo.
a base com Al3+ tem 3 hidroxilas, a base do Na+ tem
Força tem a ver com dissociação, e solubilidade, dis-
1OH e a base do NH tem 1 hidroxila.
solução.
Força das bases
A força de uma base, assim como em um ácido,
Classificação com relação à
quantidade de hidroxilas
pode ser medida pelo seu grau de dissociação, que
✓✓ Monobases: bases com uma hidroxila. NaOH ou
indica o poder de liberação de OH- em solução. As-
LiOH são exemplos.
sim, temos as seguintes classificações:
✓✓ Dibases: bases com duas hidroxilas. Ca(OH)2 ou
4+
Mg(OH)2 são exemplos.
α < 5%: bases fracas
✓✓ Tribases: bases com três hidroxilas. Al(OH)3 ou
5% < α < 50%: bases moderadas
Fe(OH)3 são exemplos.
α > 50%: bases fortes
✓✓ Tetrabases:
bases
com
quatro
hidroxilas.
Pb(OH)4 ou Sn(OH)4 são exemplos.
α indica a relação entre o número de moléculas dissociadas e o número total de moléculas do ácido. O
resultado é multiplicado por cem para a expressão
Reações das bases
do valor em porcentagem. Exemplo: Se 1 mol de uma
✓✓ Salificação: a reação do ácido com um base pro-
base genérica XOH é adicionada em uma solução e
duz sal e água. O processo pode ser chamado de
apenas 0,01 mol se dissociam, o grau de dissociação
neutralização ou salificação.
é de 1%. Ou, podemos entender que 1 em cada 100
Qui. 143
refrigerante, seja light ou normal.
Exemplo: NaOH (base) + HCl (ácido) ⇆ NaCl
reagem com ácidos graxos (ácidos carboxílicos de
(sal) + H2O
cadeia longa) ou gorduras (triglicerídeos) para formar sais orgânicos, os sabões.
✓✓ Saponificação: Bases, em geral NaOH ou KOH,
1.
(FATEC) Leia atentamente a seguinte notícia publicada em jornal:
ALUNOS TOMAM SODA CÁUSTICA DURANTE AULA E PASSAM MAL.
Dezesseis alunos de uma escola particular de Sorocaba, interior de São Paulo, foram internados após tomar soda cáustica durante uma aula de química. Os alunos participavam de um exercício chamado “teste do sabor”: já
haviam provado limão, vinagre e leite de magnésia e insistiram em provar a
soda cáustica, produto utilizado na limpeza doméstica. Em pouco tempo, os
alunos já começaram a sentir os primeiros sintomas: ardência na língua e no
estômago, e foram encaminhados ao Hospital Modelo da cidade.
(Adaptado do “Diário do Grande ABC OnLine”, 19/09/2005.)
Sobre essa notícia, julgue os itens seguintes:
a) Os produtos ingeridos pelos alunos (limão, vinagre, leite de magnésia e soda
cáustica) são todos ácidos e, por isso, corrosivos.
b) Tanto o leite de magnésia como a soda cáustica são compostos ácidos.
c) A soda cáustica (NaOH) é uma base forte; o leite de magnésia (suspensão de
Mg(OH)2) é uma base fraca. Isto ajuda a entender por que o leite de magnésia
pode ser ingerido, mas a soda cáustica não.
d) a soda cáustica tem sabor azedo e é um base muito comum na produção de
enxofre
e) O pH do suco gástrico é próximo do pH do sangue.
2.
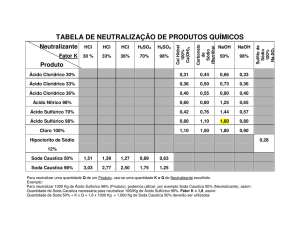
(UNIUBE-MG-adaptado) Na natureza não são encontradas jazidas de ácido sulfúrico, ácido nítrico, ácido clorídrico, soda cáustica, cal extinta etc. Todos são
fabricados industrialmente.
Cite respectivamente as fórmulas das substâncias básicas mencionadas no texto.
Qui. 144
EXERCÍCIOS PARA AULA!
3.
(UFRN) Leia as informações contidas na tirinha abaixo.
Uma substância que pode ser incluída no cardápio de antiácidos por ter propriedades básicas é
a) NaF.
b) CaCl2.
c) Mg(OH)2.
d) CH3COOH.
e) H2SO4
utilizados como encanamento na construção civil. Ao final da sua vida útil, uma
das formas de descarte desses tubos pode ser a incineração. Nesse processo
libera-se HCℓ (g), cloreto de hidrogênio, dentre outras substâncias. Assim, é necessário um tratamento para evitar o problema da emissão desse poluente.
Entre as alternativas possíveis para o tratamento, é apropriado canalizar e borbulhar os gases provenientes da incineração em
a) água dura.
b) água de cal.
c) água salobra.
d) água destilada.
e) água desmineralizada.
EXERCÍCIOS PARA CASA!
1.
(UEPG-PR) Com relação às propriedades das bases de Arrhenius, é incorreto
afirmar:
a) O hidróxido de amônio é uma base não metálica, bastante solúvel em água.
b) Os metais alcalinos formam monobases com alto grau de dissociação.
c) As bases formadas pelos metais alcalinos terrosos são fracas, visto que são
moleculares por natureza.
d) Os hidróxidos dos metais alcalinos terrosos são pouco solúveis em água.
e) Uma base é tanto mais forte quanto maior for o seu grau de ionização.
Qui. 145
4.
(ENEM) Os tubos de PVC, material organoclorado sintético, são normalmente
2.
(Fatec) A cor das flores de diversas plantas ocorre devido à presença de substâncias, como as antocianinas, que atuam como indicadores ácido-base. Assim,
conforme o pH do solo, a cor das flores pode variar. É o caso das hortênsias, que
apresentam cor azul em solos ácidos e rosa em solos alcalinos.
Caso uma pessoa queira cultivar hortênsias de cor rosa, em um jardim cujo solo
seja ácido, ela deverá corrigir o pH e, para isso, poderá misturar à terra, em
quantidade adequada,
a) cal hidratada.
b) sal de cozinha.
c) vinagre de vinho.
d) azeite de oliva.
e) etanol hidratado.
(ENEM-adaptada) Leia o texto a seguir e responda às questões 7 e 8.
O suco extraído do repolho roxo pode ser utilizado como indicador do caráter
turando-se um pouco de suco de repolho e da solução, a mistura passa a apresentar diferentes cores, segundo sua natureza ácida ou básica, de acordo com
a escala abaixo.
Algumas soluções foram testadas com esse indicador, produzindo os seguintes
resultados: Considere a faixa de pH entre 0-7 ácido e entre 7-14 básica.
3.
De acordo com esses resultados, as soluções I, II, III e IV têm, respectivamente,
caráter:
a) ácido, básico, básico, ácido.
b) ácido, básico, ácido, básico.
c) básico, ácido, básico, ácido.
d) ácido, ácido, básico, básico.
e) básico, básico, ácido, ácido.
4.
Utilizando-se o indicador citado em sucos de abacaxi e de limão, pode-se esperar como resultado as cores:
a) rosa ou amarelo.
b) vermelho ou roxo.
c) verde ou vermelho.
d) rosa ou vermelho.
e) roxo ou azul.
Qui. 146
ácido (pH entre 0 e 7) ou básico (pH entre 7 e 14) de diferentes soluções. Mis-
5.
(Unicamp-adaptada) Da caverna ao arranha-céu, o homem percorreu um longo caminho. Da aldeia, passou à cidade horizontal, e desta, à verticalização. O
crescente domínio dos materiais e, portanto, o conhecimento de processos químicos teve papel fundamental nesse desenvolvimento. Uma descoberta muito
antiga e muito significativa foi o uso de Ca(OH)2 para a preparação da argamassa. O Ca(OH)2 tem sido muito usado, também, na pintura de paredes, processo
conhecido como caiação, onde, reagindo com um dos constituintes minoritários
do ar, forma carbonato de cálcio de cor branca.
Dê o nome comum (comercial) ou o nome científico do Ca(OH)2. represente sua
reação de dissociação iônica e indique suas solubilidade e força básica.
QUESTÃO CONTEXTO!
O amoníaco, nome comercial do hidróxido de amônio, é amplamente empregado na produção de ácido nítrico para produção de fertilizantes e explosivos.
água:
NH3 + H2O → NH4+ + OHEscreva a fórmula molecular do amoníaco, indique suas força básica e solubilidade e monte sua reação de com o H3PO4.
GABARITO
01.
Exercícios para aula!
03.
Questão contexto
1.c
NH4OH. Base solúvel e fraca. 3NH4OH + H3PO4 ⇆
2.
(NH4)3PO4 + 3H2O
NaOH e Ca(OH)2
3.c
4.b
5.
Nome científico: hidróxido de cálcio. No-
mes comerciais: cal hidratada, cal extinta e cal apagada. Base forte e pouco solúvel.
02.
Exercícios para casa!
1.c
2.a
3.d
4.b
Qui. 147
Ele é formado a partir da seguinte reação, com borbulhamento de amônia em