Aplicação da “Química Verde” na Demonstração da Lei de Hess
Caroline Figueiredo GALVÃO1 ([email protected]), Thiago de Assis MARTINS1,
Elizabeth RODRIGUES2, Antônio Cláudio Lima Moreira BASTOS2.
1
Faculdade de Química/UFPA – IC, 2 Faculdade de Química/UFPA.
INTRODUÇÃO
A química verde tem como principal foco o desenvolvimento de tecnologias e
processos não poluentes e a regulamentação da aplicabilidade dos mesmos. Além dos
benefícios ambientais a Quimica Verde gera um impacto econômico positivo graças à
diminuição de gastos com o armazenamento e tratamento de resíduos, a
descontaminação, pagamento de indenizações, entre outros. Atualmente, não só as
indústrias como também as instituições de ensino e pesquisa na área de química
perceberam que o mercado necessita de profissionais capazes de buscar o
desenvolvimento e a implementação de técnicas que visem reduzir as taxas de poluição
e, conseqüentemente, de custos. Neste trabalho a Quimica Verde será aplicada
mediante a demonstração da Lei de Hess a apartir de produtos do cotidiano, como a
soda cáustica e o ácido muriático comerciais em substituição aos reagentes analitivos
(hidróxido de sódio (NaOH) P.A. e o ácido cloridrico (HCl) P.A.), os quais apresentam
como vantagem: baixa toxicidade, baixo custo, fácil aquisição.
MATERIAIS E MÉTODOS
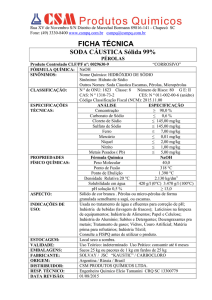
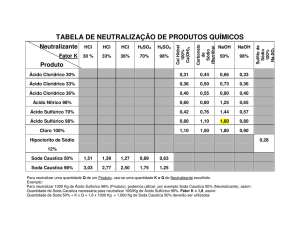
Utilizou-se reagentes comerciais (soda cáustica e ácido muriático), nos quais foi
necessário determinar o teor de hidróxido de sódio e o teor de ácido clorídrico por meio
de volumetria. As concentrações utilizadas foram: soda cáustica (NaOH 0,5M) e acido
muriático (HCl 0,25 e 0,5M). Quanto aos materiais, foram utilizados três erlenmeyrs de
250 ml como calorímetros e termômetro (0 – 100°C). O experimento permitiu calcular
os três calores de reação envolvidos: (1) calor de dissolução – soda cáustica sólida
dissolvida em água; (2) calor de dissociação – soda cáustica sólida dissolvida em ácido
muriático 0,25M; (3) calor de reação – reação entre soda cáustica 0,5M e ácido
muriático 0,5M.
RESULTADOS E DISCUSSÃO
De acordo com a ANVISA (Agência de Vigilância Sanitária) é recomendado 96% p/p
de NaOH na soda cáustica e 10 a 12% de ácido cloridrico no ácido muriático. A partir
da utilização de métodos volumétricos, foram encontrados os valores percentuais de
pureza para os reagentes comerciais utilizados: %NaOH na soda caustica igual a 88,11%
e %HCl no ácido muriático igual a 15%. Em seguida, foram calculados os valores de ∆H
para as três reações a partir da soma dos calores absorvidos pelo frasco (Qf) e pela
solução (Qs). Os valores de ∆H obtidos foram: 1) ∆H1 molar igual a 679,73 cal; 2) ∆H2
molar igual a 836,21 cal ; 3) ∆H3 molar igual a 198,22 cal. A diferença percentual
entre o valor da etapa 2 e a somatória das etapas 1 e 3 (referente a Lei de Hess ∆H2 =
∆H1 + ∆H3) encontrado foi de 4,99%, o que comprova que a soma das entalpias das
etapas intermediárias desta reação é praticamente igual a entalpia da reação global do
processo.
CONCLUSÕES
O experimento comprovou que com a utilização de produtos de uso cotidiano, e
portanto de menor toxidade em comparação aos reagentes analíticos, é possível
demonstrar a Lei de Hess (a variação de entalpia de uma reação química depende
apenas dos estados inicial e final, não importando o caminho da reação). Outra
contribuição deste trabalho foi constatar que os produtos comerciais utilizados não
estão de acordo com os teores preconizados pela ANVISA.
REFERÊNCIAS
- ATKINS, P.W. Físico-Química 1. 2ª edição. Rio de Janeiro- RJ: Editora LCT, 1999.
-MASTERTON, W.L, Princípios de Química. 6ª Edição. Rio de Janeiro – RJ: Editora
Guanabara, 1990. 681p.
- PRADO, A.G.S. Química verde, os desafios da química do novo milênio.
Disponivel
em:
http://www.scielo.br/scielo.php?script=sci_arttext&pid=S0100-
40422003000500018&lng=en&nrm=iso&tlng=pt. Acesso em: 10 julho de 2009.
- RANGEL, R.N. Práticas de Físico-Química. 2ª Edição. São Paulo – SP: Editora
Edgar Blucher, 1997. 265p