Maria Cecília Nieves Teixeira Maiorano
Residente de Clínica Médica da Escola Paulista de Medicina
Doenças Neuromusculares em UTI
As doenças neuromusculares são de extrema importância no contexto da terapia
intensiva. Existem evidências de disfunção neuromuscular em aproximadamente 50% dos
pacientes de UTI que permaneceram sob ventilação mecânica prolongada, que desenvolveram
sepse ou disfunção de múltiplos órgãos. Atualmente a fraqueza muscular devido a condições
adquiridas na UTI como a polineuropatia e a miopatia do doente crítico são duas a três vezes
mais comuns do que patologias neurológicas primárias como Guillain-Barré, Miasthenia gravis,
miopatias ou doenças do neurônio motor. A disfunção neuromuscular aumenta
significativamente o tempo de ventilação mecânica e de hospitalização. Juntamente com a
síndrome do desconforto respiratório do adulto, o traumatismo craniano e o pós-operatório
de drenagem de hemorragias intracranianas, lidera entre as causas mais freqüentes de
ventilação mecânica prolongada. Além disso, apresenta impacto significativo sobre aqueles
que sobrevivem à doença crítica pois déficits neurológicos sensitivos ou motores residuais são
achados comuns em sobreviventes levando à incapacidade crônica. Testes eletrofisiológicos
podem demonstrar disfunção neuromuscular residual por anos após a apresentação inicial.
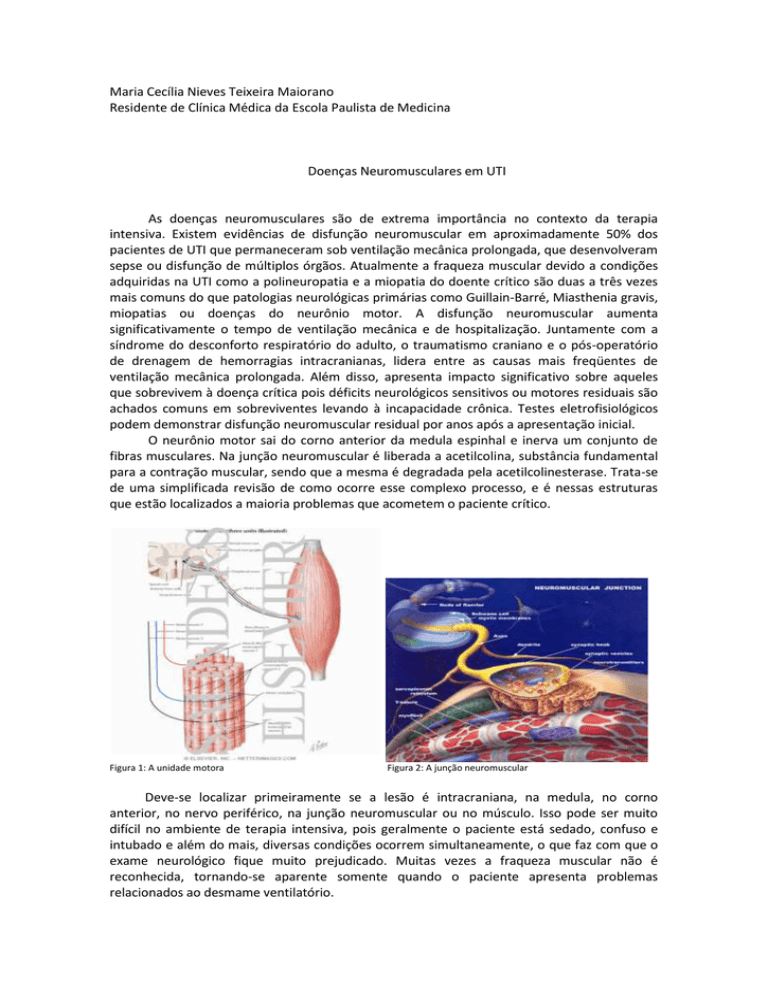
O neurônio motor sai do corno anterior da medula espinhal e inerva um conjunto de
fibras musculares. Na junção neuromuscular é liberada a acetilcolina, substância fundamental
para a contração muscular, sendo que a mesma é degradada pela acetilcolinesterase. Trata-se
de uma simplificada revisão de como ocorre esse complexo processo, e é nessas estruturas
que estão localizados a maioria problemas que acometem o paciente crítico.
Figura 1: A unidade motora
Figura 2: A junção neuromuscular
Deve-se localizar primeiramente se a lesão é intracraniana, na medula, no corno
anterior, no nervo periférico, na junção neuromuscular ou no músculo. Isso pode ser muito
difícil no ambiente de terapia intensiva, pois geralmente o paciente está sedado, confuso e
intubado e além do mais, diversas condições ocorrem simultaneamente, o que faz com que o
exame neurológico fique muito prejudicado. Muitas vezes a fraqueza muscular não é
reconhecida, tornando-se aparente somente quando o paciente apresenta problemas
relacionados ao desmame ventilatório.
É importante também avaliar o contexto em que o paciente está inserido para
podermos conduzir da melhor forma um caso de fraqueza muscular no ambiente de terapia
intensiva. Deve-se diferenciar doenças pré-existentes de doenças de início recente. Existem
doenças neurológicas primárias como Guillain-Barré que podem necessitar de internação em
terapia intensiva na apresentação do quadro. A Miasthenia Gravis pode necessitar de cuidados
intensivos durante períodos de exacerbação. Existem também diversas doenças clínicas
sistêmicas que podem ter a fraqueza muscular como uma de suas manifestações. Um contexto
clínico completamente diferente é aquele de um paciente que se interna por uma doença não
neurológica como uma infecção, por exemplo, permanece um longo período na terapia
intensiva, desenvolve a síndrome da resposta inflamatória sistêmica, sepse e disfunção de
múltiplos órgãos, e a partir de então desenvolve um quadro de fraqueza muscular e
dificuldade de desmame ventilatório. Nesse caso é mais provável que se trate de uma
neuropatia ou miopatia do doente crítico do que de uma patologia neurológica primária.
Outro ponto a ser considerado são as medicações que o paciente vinha utilizando,
principalmente quando se trata de bloqueadores neuromusculares, corticóides,
antirretrovirais, estatinas e fibratos. Alguns dados da história e do exame físico podem
direcionar a pesquisa de doenças sistêmicas, doenças neurológicas primárias ou doenças
adquiridas na UTI.
O paciente na UTI pode desenvolver diversas mononeuropatias ou plexopatias
relacionadas à isquemia, decúbito prolongado, síndrome compartimental ou hematomas. A
fraqueza pode ser conseqüência de um processo intracraniano, que na presença de mínima
suspeita deve ser descartado com exame de imagem.
Mielites transversas ou mielopatias podem ser idiopáticas ou infecciosas, causadas por
Coxsackievirus, herpes, citomegalovirus, Mycoplasma e Legionella. Pode ocorrer também
acometimento medular devido à isquemia. Distúrbios do corno anterior são bem menos
freqüentes em nosso meio.
Entre as polineuropatias ressalta-se a polineuropatia do doente crítico e Guillain-Barré.
Dentre os distúrbios da junção neuromuscular, os mais freqüentes na terapia intensiva são a
miasthenia gravis e o bloqueio neuromuscular prolongado. Dentre as miopatias estão a
miopatia do doente crítico, a rabdomiólise, miopatia induzida pelo corticóide e as miopatias
inflamatórias (dermatomiosite e polimiosite). Existem diversas outras causas que estão
agrupadas nas tabelas abaixo.
Córtex e tronco cerebral
Epilepsia: status epilepticus
Vascular: infarto ou hemorragia
Infecção: encefalites, poliomielite
Inflamatório: encefalomielite,
esclerose múltipla
Metabólico: mielinólise pontina
Hipóxia: Encefalopatia
Doenças da substância branca:
leucoencefalopatia
Encefalite auto-imune:
paraneoplásica, Hashimoto
Medula espinhal
Trauma, cirurgia
Compressão: neoplasia,
hematoma, infecção
Mielite transversa aguda
Infarto
Doença do neurônio motor
Radiculopatias
Polirradiculite HIV
Polineuropatias agudas
Polineuropatia aguda inflamatória
desmielinizante
Neuropatia aguda axonal motora e
sensitiva
Neuropatia aguda axonal motora
Neuropatias do frênico
Polineuropatia do doente crítico
Outras: tóxicas, vasculite, difteria,
porfiria, HIV
Polineuropatias crônicas
Polineuropatia crônica inflamatória
desmielinizante
Polineuropatia diabética
Distúrbios da condução
neuromuscular
Miasthenia gravis
Eaton-Lambert
Síndromes miastênicas congênitas
Bloqueadores neuromusculares
Outros: botulismo, acidente
ofídico, organofosforados,
distúrbios eletrolíticos
Miopatias congênitas
Distrofia miotônica
Distrofia Muscular de Duchenne
Paralisia periódica
Miopatias adquiridas
Miopatias inflamatórias: polimiosite,
dermatomiosite
Miopatia do doente crítico
Miopatia caquética
Miopatia necrotizante aguda
Outras: HIV, hipocalemia,
hipofosfatemia, corticóide,
rabdomiólise
Exames laboratoriais podem auxiliar no diagnóstico diferencial de fraqueza muscular,
podendo ser úteis dosagens de eletrólitos (hipermagnesemia, hipocalcemia, hipofosfatemia e
hipocalemia podem levar à fraqueza muscular), função tireoidiana, CPK, provas reumatológicas
(vasculites podem ser causas de neuropatias), anticorpo anti-HIV e análise do líquido
cefalorraquidiano, se Guillain-Barré for uma das hipóteses.
A presença de algum achado sugestivo de lesão no sistema nervoso central, como
déficits assimétricos, estado mental alterado ou paralisia de nervos cranianos deve resultar em
investigação com tomografia computadorizada (TC) ou ressonância nuclear magnética (RNM)
do crânio. Nível sensitivo, sinal de Babinki, perda de controle de esfícteres e paresia com
predomínio braquial falam a favor de lesão medular, e nesse caso deve ser realizada uma
RNM. Em doenças neuromusculares encontra-se hipotonia e hipo ou arreflexia, sendo que
doenças da junção neuromuscular e dos músculos produzem síndromes motoras puras,
enquanto que a maioria das neuropatias periféricas apresenta acometimento tanto motor
quanto sensitivo.
Estudos eletrofisiológicos são muito úteis no diagnóstico de doença neuromuscular.
Pode ser realizado estudo da condução nervosa sensitivo-motora convencional e
eletromiografia. Existem testes específicos para avaliar a junção neuromuscular, como a
estimulação nervosa repetida, EMG fibra única, estimulação train-of-4 que é usada para ajuste
de dose de bloqueadores neuromusculares. A eletromiografia respiratória (condução do nervo
frênico e EMG do diafragma) pode ser muito útil quando há acometimento da musculatura
respiratória. Técnicas especiais como a estimulação muscular direta são muito úteis para
diferenciar a miopatia da polineuropatia do doente crítico, visto que os estudos
eletrofisiológicos convencionais podem não ser tão esclarecedores.
A biópsia do músculo e do nervo são exames invasivos e não devem ser realizados de
rotina. A biópsia muscular pode ser útil quando se suspeita de uma miopatia inflamatória,
quando há suspeita de alguma lesão neuromuscular subjacente na ausência de fatores de risco
para miopatia do doente crítico ou quando não há melhora do quadro em três a quatro
semanas. A biópsia do nervo só deve ser realizada em situações muito específicas.
Figura 3: Estimulação muscular direta na neuropatia e na miopatia
Figura 4: Condução do nervo frênico e EMG do diafragma
Feita essa introdução de como é feita a abordagem inicial do paciente com fraqueza
muscular segue-se uma descrição das principais doenças que cursam com fraqueza
muscular no ambiente de terapia intensiva.
A polineuropatia do doente crítico acomete 70-80% dos pacientes com sepse ou
disfunção de múltiplos órgãos e 58% dos pacientes que têm permanência longa na UTI. É
uma axonopatia distal que afeta tanto axônios motores quanto sensitivos. Especula-se que
talvez o sistema nervoso periférico seja mais um órgão afetado pela disfunção de múltiplos
órgãos sendo a polineuropatia do doente crítico uma conseqüência desse processo. Uma
possível hipótese é de que alterações na microcirculação presentes na sepse e na
disfunção de múltiplos órgãos levariam a uma alteração da permeabilidade com edema
neuronal, hipóxia e conseqüente prejuízo de sua função. Existe correlação com níveis
elevados de glicose e níveis reduzidos de albumina. O quadro clínico catacteriza-se por
dificuldade de desmame e fraqueza predominantemente distal e em membros inferiores.
A alteração de sensibilidade ocorre em metade dos pacientes e os nervos cranianos e
musculatura facial são caracteristicamente poupados. A presença de encefalopatia, o uso
de bloqueadores neuromusculares e sedativos torna difícil o reconhecimento do início do
quadro, sendo que muitas vezes a neuropatia somente se torna aparente quando ocorre
dificuldade de desmame.
Os estudos eletrofisiológicos são compatíveis com degeneração axonal primária,
polineuropatia axonal motora e sensitiva. Não ocorre diminuição da velocidade de
condução ou bloqueios na condução nervosa, e se esses achados estiverem presentes
deve-se pesquisar outras causas, por exemplo Guillain-Barré, que junto com a miopatia do
doente crítico é o principal diagnóstico diferencial. A biópsia muscular apresenta achados
compatíveis com atrofia neurogênica.
Critérios diagnósticos
1. Paciente com doença crítica (sepse, SIRS, DMO)
2. Dificuldade no desmame após a exclusão de causas
cardíacas e pulmonares
3. Fraqueza nos membros
4. Evidência eletrofisiológica de polineuropatia axonal
motora e sensorial
O tratamento é baseado no suporte clínico intensivo. Deve-se evitar e tratar SIRS,
sepse e disfunção de múltiplos órgãos, priorizar o controle glicêmico, evitar bloqueadores
neuromusculares e corticóides. O manejo da dificuldade do desmame é essencial
juntamente com fisioterapia, reabilitação e manutenção do estado nutricional.
Ainda não há tratamento específico, já foram feitos estudos com imunoglobulina
intravenosa, anticorpos monoclonais e policlonais contra endotoxinas bacterianas,
anticorpos monoclonais contra TNF-α, antagonista do receptor da IL-1, N-acetilcisteína,
técnicas de hemofiltração e plasmaférese. Nenhuma dessas terapias foi efetiva até o
momento. Justamente por não haver tratamento específico fica clara a necessidade de
prevenção, com controle dos fatores de risco.
O prognóstico é variável e depende muito da gravidade da patologia de base.
Ocorre melhora em semanas nos casos mais leves e em meses nos casos mais graves,
podendo ocorrer seqüelas graves e permanentes. Os parâmetros relacionados com pior
recuperação são uma maior permanência na UTI, sepse de longa duração e maior perda de
peso.
Outras polineuropatias podem acometer o paciente em ambiente de terapia
intensiva. Pacientes com insuficiência renal crônica em estágio terminal podem apresentar
uma polineuropatia que é exacerbada pela síndrome da resposta inflamatória sistêmica e
pela sepse. O mesmo ocorre com pacientes portadores de insuficiência hepática. Outros
pacientes que podem se apresentar com polineuropatias são os transplantados, grande
queimados e os portadores da síndrome da imunodeficiência adquirida.
Quanto à miopatia do doente crítico, trata-se de uma miopatia primária, ou seja,
não é secundária à denervação muscular e sua verdadeira incidência é desconhecida
devido à dificuldade no diagnóstico e à sua similaridade com a polineuropatia do doente
crítico. É uma condição heterogênea, com vários subtipos. Além do mais, diferentes vias
patogênicas podem convergir para produzir miopatia em um paciente crítico.
São fatores associados ao seu desenvolvimento: Crise de asma, exacerbação de DPOC,
transplante de órgãos, SDRA, PNM, sepse, uso de altas doses de corticóide e bloqueadores
neuromusculares.
Critérios diagnósticos
1. Amplitudes SNAP >80% do limite inferior da normalidade
2. EMG com curta duração, baixa amplitude de MUPs com
recrutamento total normal ou precoce com ou sem potenciais de
fibrilação
3. Ausência de resposta decremental com estimulação nervosa repetida
4. Achados histopatológicos musculares de miopatia com perda de
miosina
5. Amplitudes CMAP<80% do limite inferior da normalidade em 2 ou
mais nervos sem bloqueio da condução
6. Aumento de CPK
7. Demonstração de inexcitabilidade muscular
*Para o diagnóstico definitivo os 5 primeiros critérios devem estar presentes
Esses critérios diagnósticos são extremamente questionáveis, visto que os critérios
eletromiográficos maiores exigem colaboração do paciente e portanto não podem ser
realizados em pacientes inconscientes. Os potenciais de ação dos nervos sensoriais podem
estar alterados na presença de miopatia visto que polineuropatia e miopatia podem
coexistir. Além disso, os níveis de CPK podem ser normais, aliás, eles somente se alteram
quando ocorre necrose muscular significativa.
Alguns subtipos de miopatia foram descritos, como a miopatia caquética que ocorre
em pacientes críticos devido ao hipercatabolismo, desnutrição, pós-operatório de cirurgia
bariátrica e caracteriza-se por atrofia de fibras musculares do tipo II ou até mesmo biópsia
muscular normal. É um diagnóstico de exclusão. A miopatia com perda de filamentos
grossos (miosina) é uma miopatia quadriplégica aguda que geralmente se desenvolve em
pacientes asmáticos que necessitam de ventilação mecânica, bloqueador neuromuscular e
corticóide. A miopatia necrotizante aguda tem um mau prognóstico, pode ser uma
progressão da rabdomiólise. Ocorre aumento de CPK e mioglobinúria e em casos mais
graves pode não ocorrer recuperação. A diferenciação entre esses subtipos pela biópsia
muscular somente é útil em termos prognósticos ou quando o diagnóstico irá alterar a
conduta.
Existem ainda outras formas de acometimento muscular na UTI como é o caso da
piomiosite, micrometástases sépticas, rabdomiólise e miopatia em doenças sistêmicas,
como é o caso das doenças reumatológicas e síndrome da imunodeficiência adquirida.
O tratamento da miopatia de doente crítico visa descontinuar ou reduzir dose de
corticóide assim que possível, evitar bloqueadores neuromusculares, tratar
agressivamente a doença de base, prevenir outras complicações, promover controle
glicêmico e enfatizar a reabilitação.
O prognóstico como já foi mencionado anteriormente, depende do subtipo, mas a
recuperação geralmente ocorre em semanas a meses.
Os bloqueadores neuromusculares são utilizados em terapia intensiva para facilitar
a intubação orotraqueal, facilitar a ventilação mecânica e o controle da hipertensão
intracraniana, porém podem ter sérios efeitos na junção neuromuscular principalmente
quando utilizados por mais de 24h, geralmente por mais que seis dias. Pode ocorrer um
bloqueio neuromuscular prolongado, que se caracteriza por uma tetraparesia flácida
arreflexa e dificuldade de desmame, ptose e oftalmoparesia. Os níveis de CK geralmente
estão normais. Esse bloqueio pode persistir por horas a semanas após a retirada da
medicação (até 42 dias já foram descritos na literatura) e ocorre reversão temporária com
o uso de neostigmina, que pode auxiliar na diferenciação de outras causas que cursam
com tetraparesia. Os pacientes com disfunção renal, hepática, acidose metabólica e
hipermagnesemia estão mais propensos a essa condição. Deve-se por essas razões evitar
pancurônio e vecurônio (preferir atracúrio) em pacientes com disfunção renal e hepática,
realizar interrupções diárias da medicação e monitorar o grau de bloqueio com
estimulação nervosa periférica.
Figura 5: Monitor de função neuromuscular
O corticóide tem um efeito catabólico direto no músculo esquelético, podendo
induzir miopatia, principalmente se utilizados em conjunto com outras condições
predisponetes, como é o caso da sepse e do bloqueio neuromucular. Os bloqueadores
musculares podem causar uma degeneração axonal e denervação atrófica do músculo e tal
efeito é potencializado pelo aumento de permeabilidade induzido pela sepse na
microvasculatura. Além disso com o uso simultâneo de corticóides e bloqueadores
neuromusculares parece ocorrer um up-regulation dos receptores de corticóide no
músculo, facilitando a indução de miopatia. Existe grande variação com relação à dose e
tempo de tratamento e início de fraqueza muscular, mas geralmente ocorre após o uso de
altas doses por períodos longos, sendo que o risco é maior com o uso de dexametasona e
triancinolona do que com prednisona e metilprednisolona. Na miopatia induzida por
corticóide as enzimas musculares estão normais, a EMG geralmente é normal, e a biópsia
muscular pode mostrar atrofia de fibras tipo II. É um diagnóstico de exclusão e a melhora
costuma ocorrer em 3 a 4 semanas após a redução da dose.
Figura 6: efeito sinérgico da sepse, BNM e corticóides no músculo e no nervo
Em muitos casos pode ocorrer miopatia em conjunto com a polineuropatia
(polineuromiopatia do doente crítico), que tem uma incidência aproximada de 30-60% de
pacientes em UTI. Os fatores de risco para o desenvolvimento dessa entidade são a maior
gravidade da doença de base e a presença de SIRS. A sepse pode ser o mecanismo patológico
comum para o desenvolvimento de polineuropatia e miopatia. A presença de achados que
sugiram combinação de neuropatia com miopatia podem necessitar de biópsia muscular para
confirmação.
Figura 7: Polineuromiopatia do doente crítico
A encefalopatia séptica é uma complicação precoce que ocorre em 50-70% dos
pacientes sépticos. Caracteriza-se alteração do nível de consciência e dellirium, mas ode
ocorrer também rigidez, tremores e convulsões. É um diagnóstico de exclusão e deve-se tratar
a patologia de base; não há um tratamento específico. Pode ocorrer recuperação rápida e
completa, dependendo logicamente da gravidade do quadro clínico inicial.
Deve-se estar atento às medicações utilizadas, as quais podem contribuir para a
fraqueza muscular no paciente crítico. Entre as drogas que podem afetar a junção
neuromuscular podemos citar antibióticos, antiarrítmicos, beta-bloqueadores, bloqueadores
dos canais de cálcio, imunossupressores, antirretrovirais, corticóides, estatinas e diuréticos.
Agora serão explanadas as doenças neurológicas que cursam com fraqueza muscular e
que mais comumente podem necessitar de internação em UTI.
Guillain-Barré é a doença neuromuscular primária que mais comumente leva à
admissão em UTI. Comumente o paciente tem um antecedente de infecção de vias aéreas ou
diarréia precedendo o início do quadro em duas a três semanas. Mais raramente outros
antecedentes como cirurgia, imunizações, trauma ou transplante de medula óssea. Trata-se de
uma polineuropatia aguda imunomediada; um agente infeccioso deflagra uma resposta imune,
ocorre uma reação cruzada, com ataque aos nervos periféricos por um mecanismo de
mimetismo molecular. Manifesta-se como uma paralisia flácida rapidamente ascendente,
simétrica, com hiporreflexia ou arreflexia, ocorre acometimento de nervos cranianos e
disautonomia é uma achado freqüente. Cerca de 30% dos pacientes requerem ventilação
mecânica devido a acometimento da musculatura respiratória. Entre os achados laboratoriais,
o mais importante é a dissociação albumino-citológica, presente em 80 a 90% dos casos.
Estudos de condução nervosa e EMG são importantes pois além de confirmarem o diagnóstico
fornecem dados prognósticos.
Critérios diagnósticos
Fraqueza progressiva em mais de um membro, podendo resultar em
tetraplegia, alteração de musculatura respiratória, bulbar, facial e
oftalmoplegia
Arreflexia
Alguns dados favorecem o diagnóstico, são eles: progressão dos sintomas de dias até 4
semanas, simetria relativa, acometimento sensitivo discreto, envolvimento de nervos
cranianos, disfunção autonômica, ausência de febre, dissociação albumino-citológica e
anormalidades eletrofisiológicas compatíveis. Por outro lado, se houver nível sensitivo,
assimetria importante e persistente, disfunção vesical e intestinal graves e persistentes e mais
de 50 células brancas no líquido cefalorraquidiano, o diagnóstico torna-se menos provável.
Deve ser feito o diagnóstico diferencial com outras polineuropatias, e outras doenças
que cursam com acometimento medular, além de doenças que afetem o músculo e a junção
neuromuscular. Existem variantes da síndrome de Guillain-Barré, sendo a
poliradiculoneuropatia desmielinizante aguda inflamatória a forma mais comum. A síndrome
de Miller Fisher caracteriza-se por oftalmoplegia, ataxia e arreflexia. A neuropatia axonal
aguda motora (geralmente ocorre após uma infecção por Campylobacter jejuni) e a neuropatia
axonal aguda sensitivo-motora são formas axonais primárias de Guillain-Barré. Existem outras
variantes bem mais raras como a faríngea-cervical-braquial, uma síndrome que se manifesta
somente com paraparesia, a pandisautonomia aguda, e uma forma puramente sensitiva.
O tratamento de suporte é focado em monitorização respiratória, sendo que pacientes
com capacidade vital forçada<20ml/kg, Pimáx<30cmH2O, Pemáx<40cmH2O provavelmente
necessitarão de intubação orotraqueal. Deve-se adotar um protocolo de desmame e testes
funcionais seriados devem ser realizados. Se há previsão de ventilação mecânica prolongada, a
traqueostomia deve ser realizada precocemente. São preditores de falência respiratória:
tempo do início dos sintomas até a admissão menor que 7 dias, inabilidade para tossir e se
levantar, inabilidade de levantar os cotovelos e a cabeça e aumento de enzimas hepáticas.
Deve-se realizar também monitorização cardíaca e hemodinâmica intensiva pois esses
pacientes freqüentemente desenvolvem disfunção autonômica. Deve-se manter sempre o
volume intravascular, principalmente durante ventilação com pressão positiva, evitar drogas
hipotensoras e succinilcolina (pelo risco de arritmias por hipercalemia). Arritmias ocorrem
freqüentemente durante aspiração, merecendo especial atenção.
Se houver grandes variações da pressão arterial esses pacientes devem ser
monitorizados com pressão arterial invasiva. Se ocorrer hipotensão utilizar fluidos, usar
vasopressores de curta ação em baixas doses, com cautela e monitorização. Quanto às
arritmias, a taquicardia sinusal é extremamente freqüente e não requer tratamento, outras
arritmias devem ser tratadas. Deve-se evitar complicações através de profilaxia mecânica e
farmacológica de tromboembolismo venosos. Ausculta abdominal deve ser realizada
diariamente e deve-se ter cuidado com o uso de opióides. Eritromicina e neostigmina podem
ser úteis em caso de íleo. Na presença de retenção vesical a sondagem vesical precisa ser
realizada.
Em caso de dor deve-se administrar gabapentina ou carbamazepina. Deve ser realizado
um programa de reabilitação. Existe também o tratamento específico que pode ser realizado
com plasmaférese ou imunoglobulina intravenosa. O tratamento modificador da doença agiliza
a melhora da força muscular, reduz a necessidade de VM e melhora a recuperação. A
plasmaférese deve ser realizada na dose de 4 a 6 trocas em 8-10 dias, num total de 200250ml/kg. Pode causar hipotensão, sepse e distúrbios eletrolíticos, além de complicações com
o acesso central. A imunoglobulina intravenosa é realizada na dose de 0,4g/kg por 5 dias e
tem como possíveis complicações a meningite asséptica, rash, IRA e hiperviscosidade
(podendo causar AVC). Deve ser iniciada em até 30 dias do início dos sintomas. Comparando a
plasmaférese com a imunoglobulina, ambas foram efetivas e a associação não demonstrou
benefício. Corticóides não mostraram benefício. Quanto às imunizações, os riscos precisam ser
avaliados individualmente. Após 1 ano do quadro de GB, geralmente não precisam ser evitadas
e evitar doses futuras é sugerido se a síndrome se desenvolveu dentro de 6 meses da aplicação
da vacina.
Outras causas de neuropatia são a compressão (pelo decúbito, hematomas etc) e
medicamentos como quimioterápicos, amiodarona e metronidazol.
A Miasthenia Gravis é uma doença relativamente rara mas é a doença mais comum da
transmissão neuromuscular.É uma desordem auto-imune onde ocorre a produção de
anticorpos contra o receptor nicotínico da acetilcolina (embora 15% dos pacientes sejam
soronegativos). Manifesta-se com fraqueza flutuante, de grau variável, da musculatura ocular,
bulbar, membros e musculatura respiratória. Para o diagnóstico pode ser realizado o teste do
edrofônio (embora essa medicação tenha sido deixada de ser produzida em 2008, e em breve
esse recurso não estará mais disponível), o Ice pack test, que tem como objetivo avaliar a
melhora da ptose palpebral com a aplicação de gelo sobre as pálpebras e dosagem de
anticorpos séricos. Testes eletrofisiológicos também são úteis, mostrando um potencial de
ação decremental. O diagnóstico diferencial deve ser realizado com doença do neurônio
motor, Eaton-Lambert, botulismo, doenças que cursam com fadiga generalizada, miasthenia
induzida pela D-penicilamina e síndromes miastênicas congênitas. O tratamento crônico
baseia-se em anticolinesterásicos, imunossupressão e timectomia em alguns casos. A principal
causa de admissão na UTI é devido à crise miastênica que pode ser precipitada por infecções,
medicamentos ou má aderência ao tratamento. Deve ser diferenciada da crise colinérgica
causada pelo excesso de medicação e caracterizada por fasciculação, miose, sialorréia,
lacrimejamento, diarréia e vômitos. Um possível efeito colateral do excesso de
anticolinesterásicos é a fraqueza muscular. Nesse contexto pode ser difícil distinguir o excesso
de medicação de uma piora da Miasthenia Gravis. A crise colinérgica é extremamente rara com
doses abaixo de 120mg de piridostigmina a cada 3h. Não se deve atribuir a piora da fraqueza à
crise colinérgica a menos que se saiba que o paciente estava utilizando doses elevadas de
anticolinesterásico. Mesmo na presença de sintomas colinérgicos, deve-se assumir que está
ocorrendo uma piora da MG e o tratamento deve ser iniciado. Já a crise miastênica é uma
condição de alto risco, com fraqueza intensa, a ponto de necessitar IOT ou atrasar a extubação
após cirurgia. Pode ocorrer espontaneamente, mesmo sem os precipitantes citados
anteriormente. Os pacientes nessa condição devem ser internados em UTI e monitorizados
com CVF a cada 2h. A IOT eletiva deve ser realizada se a CVF estiver menor que 15ml/kg. A
gasometria não é um bom parâmetro e sinais clínicos de desconforto respiratório podem estar
ausentes. Deve-se realizar adequado manejo do excesso de secreção com aspiração e
fisioterapia, sendo que atropina pode ser útil para reduzir o volume de secreção. O desmame
deve ser iniciado após início de plasmaférese ou IVIG e após ter atingido as doses alvo de
anticolinesterásicos e corticóides. O paciente deve apresentar melhora de força da
musculatura respiratória; apresentar CVF>15ml/kg, ter a capacidade de sustentar a cabeça e
doença parenquimatosa pulmonar importante não pode estar presente. A estratégia de
desmame visa prevenir a fadiga e permitir descanso da musculatura entre as tentativas. A
piridostigmina está disponível na forma intravenosa, podendo ser utilizada nessa situação. A
plasmaférese deve ser realizada. São 5 trocas (3 a 5L de plasma cada) em 7 a 14 dias. A
imunoglobulina intravenosa também é uma opção disponível e a dose é de 2g/kg em 2 a 5
dias, sendo que o tratamento mais longo é preferível em pacientes com disfunção renal,
cardíaca e idosos. Os efeitos colaterais relativos à taxa de infusão são cefaléia e retenção
hídrica principalmente. Deve ser iniciado corticóide em altas doses. Não há superioridade da
plasmaférese sobre a imunoglobulina, embora especula-se que a plasmaférese inicie sua ação
mais rápido, e por isso muitas a utilizam como primeira opção. É importante evitar as drogas
que exacerbam a miastenia.
O Botulismo é uma síndrome neuroparalítica que resulta da ação da toxina produzida
pelo Clostridium botulinim. Existem 5 formas de aquisição da doença: pela ingestão de
alimento contaminado com a toxina, ingestão de esporos (forma infantil), infecção de uma
ferida pelo C. botulinum, produção da toxina no trato gastrointestinal (semelhante à forma
infantil, mas que ocorre em adultos) ou inalação. Será comentada a forma clínica resultante da
ingestão de alimentos contaminados com a toxina. Ocorre uma anormalidade na junção
neuromuscular com impedimento da liberação de acetilcolina. Os sintomas se iniciam após 1236h do alimento contaminado e ocorre um pródromo, caracterizado por náuseas, vômitos, dor
abdominal e diarréia. Após iniciam-se os seguintes sintomas: visão borrada, diplopia,
nistagmo, ptose, disfagia, disartria, fraqueza facial e boca seca. A fraqueza muscular é
caracteristicamente descendente, pode ocorrer retenção vesical, íleo paralítico e dificuldade
respiratória. Os reflexos profundos estão preservados e pupilas ficam dilatadas com paralisia
de acomodação. Não ocorre febre, o déficit neurológico é caracteristicamente simétrico. O
paciente permanece responsivo, a freqüência cardíaca é normal ou baixa e a pressão arterial é
normal. Não ocorrem déficits sensitivos. O diagnóstico diferencial se faz com Miasthenia
gravis, Eaton-Lambert, Guillain-Barré, poliomielite, AVC e intoxicação por metais pesados. Para
se realizar o diagnóstico deve ser encontrada a toxina no sangue, fezes, vômito ou alimentos
suspeitos. Quanto ao tratamento, os pacientes merecem hospitalização e monitorização
respiratória. A alimentação deve ser realizada de forma contínua por sonda nasogástrica em
pequenos volumes. Se ocorrer íleo grave, nutrição parenteral pode ser necessária. A antitoxina
deve ser administrada o mais precocemente possível, de preferência dentro de 24 horas após
o início dos sintomas. Os antibióticos são recomendados em casos de contaminação de feridas,
não tendo benefício comprovado em casos de ingestão de alimentos contaminados com a
toxina botulínica. Nesses casos a penicilina G e o metronidazol são os agentes de escolha e os
aminoglicosídeos são contra-indicados. O prognóstico é variável, sendo que essa doença pode
ser fatal. Resolução completa dos sintomas ocorre nos primeiros três meses nos casos leves e
nos casos graves podem permanecer déficits neurológicos, seqüelas da ventilação mecânica
prolongada e infecções nosocomiais por vários anos.
Como as doenças neurológicas podem freqüentemente acometer a musculatura
respiratória, deve-se ter conhecimento a respeito das repercussões desse fato. Os músculos
inspiratórios quando acometidos podem levar à ventilação inadequada. A disfunção dos
músculos bulbares leva à hipoventilação noturna e o acometimento dos músculos inspiratórios
e expiratórios resulta em disfunção bulbar e tosse ineficaz. O diagnóstico de acometimento da
musculatura respiratória muitas vezes é difícil, pois o RX de tórax é normal, a dispnéia pode
estar ausente e a gasometria só se altera em estágios finais. Os pacientes com possibilidade de
acometimento da musculatura respiratória devem receber monitorização respiratória
intensiva, incluindo FR, CVF, Pimáx e PEmáx. Além disso esses pacientes estão sob risco de
desenvolver pneumonia aspirativa devido à diminuição de força da parede torácica, abdominal
e orofaríngea.
A presença de um ou mais dos itens da tabela abaixo indica provável
necessidade de VM.
Capacidade vital<20ml/kg
PImáx<-30cmH2O
PEmáx<40cmH2O
Progressão rápida da fraqueza
(<7dias)
Inabilidade de levantar a cabeça
Disfunção bulbar
Fraqueza facial bilateral
Disfunção autonômica
importante
Quanto ao uso da ventilação mecânica não invasiva, pequenos estudos sugerem que
pode haver diminuição da necessidade de IOT, menor permanência na UTI e menor
mortalidade. Alguns dados como disfunção bulbar grave, obstrução de vias aéreas superiores,
retenção de secreção, tosse ineficaz e paciente não cooperativo indicam maior probabilidade
de insucesso. A ventilação invasiva está indicada em pacientes que irão necessitar de
ventilação mecânica prolongada e em casos de contra-indicação à VNI. Devem ser realizadas
com freqüência manobras para facilitar a tosse e é importante corrigir as causas potenciais de
dependência do ventilador nos casos de VM prolongada antes de iniciar o desmame. Durante
o desmame procurar aumentar gradualmente o tempo de respiração espontânea. A
traqueostomia pode ser necessária para aumentar o conforto e facilitar a comunicação e uma
vez que haja previsão de VM prolongada a mesma deve ser indicada precocemente.
Referências:
Up to Date 2009
Intensive Care Med 2007; 33:1876–1891
Current Opinion in Critical Care 2005, 11:381—390
Pract Neurol 2008; 8: 280–295
Crit Care Clin 2008; 24: 165-177.
Respiratory Care 2006; 51: 1024-1041
Muscle Nerve 2005; 32: 140–163
Critical Care 2007;11:1-11
Chest 2007; 131:1541-1549
Crit Care Med 2006; 34: 2835-2841
Neurocritical Care 2005; 3: 195-212
Current Opinion in Critical Care 2005, 11:126—132
Clinical Neurology and Neurosurgery 2006; 108: 621-627
Current Opinion in Neurology 2001; 14: 649-653
Current Opinion in Critical Care 2002; 8: 302-310
Arch Neurol 1999; 56:527-528
Intensive Care Med 2003; 29: 1411-1413
Neuromuscular Disorders 1998; 8: 186-192
J Neurol 2001; 248: 929-934.
Minerva Anestesiologica 2006; 72:401-6
Neurology 2006; 76: 1421-1425
Minerva Anestesiol 2008; 74: 319-323
Respiratory Care 2006; 51: 1042-1052
Current Opinion in Neurology 2001; 14: 583-589












