UNIVERSIDADE FEDERAL DE GOIÁS
PROGRAMA DE PÓS-GRADUAÇÃO EM MEDICINA TROPICAL
E SAÚDE PÚBLICA
NEUSA MARIANA COSTA DIAS
Avaliação do perfil celular esplênico na lagochilascariose experimental
Dissertação de Mestrado
Goiânia-GO, 2012
ii
Termo de Ciência e de Autorização para Disponibilizar as Teses e
Dissertações Eletrônicas (TEDE) na Biblioteca Digital da UFG
Na qualidade de titular dos direitos de autor, autorizo a Universidade Federal de
Goiás–UFG a disponibilizar gratuitamente através da Biblioteca Digital de Teses e
Dissertações – BDTD/UFG, sem ressarcimento dos direitos autorais, de acordo com a Lei nº
9610/98, o documento conforme permissões assinaladas abaixo, para fins de leitura,
impressão e/ou download, a título de divulgação da produção científica brasileira, a partir
desta data.
1. Identificação do material bibliográfico:
[ X ] Dissertação
2. Identificação da Tese ou Dissertação
Autor(a):
Neusa Mariana Costa Dias
E-mail:
[email protected]
Seu e-mail pode ser disponibilizado na página?
Vínculo Empregatício do autor
Agência de fomento:
País:
Título:
[ ] Tese
[X] Sim
[ ] Não
Bolsista
Conselho Nacional de Desenvolvimento Científico e
Tecnológico
Sigla:
CNPQ
Brasil
UF:
GO
CNPJ:
Avaliação do perfil celular esplênico na lagochilascariose experimental
Palavras-chave:
Lagochilascaris minor, Helmintose, Resposta imune, Linfócitos
Título em outra língua:
Evaluation of the cell profile in the spleen during
lagochilascariosis
Palavras-chave em outra língua:
experimental
Lagochilascaris minor, helminths, immune response, lymphocytes
Área de concentração:
Imunologia
Data defesa: (16/02/2012)
Programa de Pós-Graduação:
Programa de Pós-graduação em Medicina Tropical e Saúde
Pública da UFG
Orientador(a):
Mara Silvia Carvalhaes
E-mail:
[email protected];
[email protected]
Co-orientador(a):
Mônica Spadafora Ferreira
E-mail:
[email protected]
3. Informações de acesso ao documento:
Liberação para disponibilização?1
[ x ] total
[ ] parcial
Em caso de disponibilização parcial, assinale as permissões:
[ ] Capítulos. Especifique: __________________________________________________
[ ] Outras restrições: _____________________________________________________
Havendo concordância com a disponibilização eletrônica, torna-se imprescindível o
envio do(s) arquivo(s) em formato digital PDF ou DOC da tese ou dissertação.
O Sistema da Biblioteca Digital de Teses e Dissertações garante aos autores, que os arquivos
contendo eletronicamente as teses e ou dissertações, antes de sua disponibilização,
receberão procedimentos de segurança, criptografia (para não permitir cópia e extração de
conteúdo, permitindo apenas impressão fraca) usando o padrão do Acrobat.
________________________________________
Assinatura do(a) autor(a)
1
Data:
____
/
____
/
__
Em caso de restrição, esta poderá ser mantida por até um ano a partir da data de defesa. A extensão deste
prazo suscita justificativa junto à coordenação do curso. Todo resumo e metadados ficarão sempre
disponibilizados.
iii
NEUSA MARIANA COSTA DIAS
Avaliação do perfil celular esplênico na lagochilascariose experimental
Dissertação de Mestrado apresentada ao
Programa de Pós-Graduação em Medicina
Tropical e Saúde Pública da Universidade
Federal de Goiás para obtenção do Título
de Mestre em Medicina Tropical e Saúde
Pública na área de concentração em
Imunologia.
Orientadora:
Profª. Dra. Mara Silvia Carvalhaes
Co-Orientadora:
Profª. Dra. Mônica Spadafora Ferreira
Goiânia-GO, 2012
iv
v
Programa de Pós-Graduação em Medicina Tropical e Saúde Pública
da Universidade Federal de Goiás
BANCA EXAMINADORA DA DISSERTAÇÃO DE MESTRADO
Aluno (a): Neusa Mariana Costa Dias
Orientador (a): Profª. Dra. Mara Silvia Carvalhaes
Co-orientador (a): Profª. Dra. Mônica Spadafora Ferreira
MEMBROS TITULARES:
1. Profª. Dra. Mara Silvia Carvalhaes
2. Profº. Dra. Lucimeire Antonelli da Silveira
3. Profº. Dr. Marco Tulio Antonio Garcia Zapata
Data: 16/02/2012
vi
Dedicatória
Ao meu maravilhoso e amado Pai: João Dias Silva!
Homem no qual admiro imensamente. Através de suas incalculáveis virtudes, sempre mostrou-me o
caminho da vida com prontidão.
Este homem alegre, mas também às vezes, silencioso e pensativo, homem de fé e de grande luta,
sensível e generoso.
Obrigada papai, por espalhar em meu caminhar muitas esperanças, sonhos, certezas e confianças.
Obrigada por estar presente em todos os momentos da minha vida.
Meu grande amigo e conselheiro.
Meu pai, meu eterno mestre. Te amo!
vii
"A excelência pode ser obtida se você se importa mais do que os
outros julgam ser necessário; se arrisca mais do que os outros
julgam ser seguro, sonha mais do que os outros julgam ser prático,
e espera mais do que os outros julgam ser possível."
Vince Lombardi
viii
Agradecimentos
Agradeço a Deus pelo dom da vida, pela inspiração e pela sua indispensável misericórdia.
À minha orientadora Profª Drª Mara Silvia Carvalhaes, pela disponibilidade e orientação
neste trabalho.
À minha co-orientadora Profª Drª Mônica Spadafora Ferreira, pela fundamental
colaboração e correções neste trabalho.
Às pessoas que mais amo. Minha mãe Vitória Costa, sempre presente em minha vida e no
meu coração, obrigada pelo seu amor. Meu pai João Dias, pelo exemplo de vida, apoio e incentivo
para o meu crescimento intelectual e profissional. Obrigada pela educação e carinho. As palavras não
são suficientes para demonstrar meu amor incondicional por vocês.
À minha querida irmã Ana Raquel, pela presença amiga e pelas manifestações de carinho em
todos os momentos.
Aos meus avós, tios e tias, primos e primas, que direta ou indiretamente contribuíram na
minha trajetória. Minha gratidão e eterna saudade da minha avó e madrinha Neuza Araújo Costa (in
memoriam).
Ao meu namorado Wellington Rosa, pelo enorme carinho e por cada palavra de incentivo.
À minha querida amiga Vânia Beatriz, pela amizade, disposição em me ajudar e por fazer
esses anos mais alegres.
Aos meus amigos Juliana Medeiros e Diego Eterno, pela amizade, consideração e carinho.
Ao meu amigo Deniel Alencar, pela amizade, colaboração e apoio.
ix
Aos meus colegas de outros laboratórios: Regiane Morillas, Aline Barbaresco, Lucas
Sampaio, Aline Araújo, Yanna Lima, Emerith Mayra, Camila Tavares, Letícia de Almeida pela
amizade e convivência.
Aos professores do IPTSP/UFG: Profo Clecildo Barreto, Profª Lara Stefania, e Profª
Mariane Martins, pela atenção e contribuição para a minha formação.
Ao Profº Drº Marco Tulio Zapata, um grande ser humano e profissional. Agradeço pelo
apoio e disponibilidade em participar da Banca Examinadora.
Aos professores da minha banca de qualificação, pelas valiosas sugestões e contribuições
científicas: Profª Ana Paula Kipnis, Profª Liliana Borges, Profo Marco Tulio Zapata, Profo José
Clecildo Barreto, Profª Eugênia Emília e Profª Irmtraut Araci.
Ao Profº Drº Ruy Lino Júnior, pela colaboração neste trabalho e permissão pelas vezes que
utilizei o seu laboratório.
Aos meus professores do curso de Biomedicina, PUC-GO, em especial à Profª Maria Paula
Perillo, pelos essenciais ensinamentos.
Aos funcionários do IPTSP/UFG: Sr. Fernando, Marco Vitor, Alex Borges, Abigair, Kariny
e José Clementino, pela atenção e competência. E em especial à Valéria, pela amizade e compreensão.
Ao CNPQ, pela bolsa de estudos concedida.
Por fim, um sincero agradecimento a todas as pessoas que me ajudaram de alguma forma a
realizar esta etapa.
x
“Vim, vi, venci.”
Júlio César (Orador Romano)
xi
SUMÁRIO
LISTA DE TABELAS E FIGURAS
xiii
LISTA DE SIGLAS E ABREVIATURAS
xvi
RESUMO
xix
ABSTRACT
xx
INTRODUÇÃO
1
1 – Lagochilascaris minor
1
1.1 – Ciclo evolutivo natural
2
1.2 – Ciclo evolutivo experimental
4
2 – Lagochilascariose humana e animal
6
2.1 – Patogenia
8
2.2 – Manifestações clínicas
10
3 – Respostas imune aos helmintos
11
JUSTIFICATIVA
25
OBJETIVOS
26
1 – Objetivo Geral
26
2 – Objetivos Específicos
26
MATERIAIS E MÉTODOS
27
1 – Animais e Infecção
27
1.1 – Obtenção de ovos de Lagochilascaris minor
27
1.2 – Infecção experimental
27
2 – Imunoistoquímica (IIQ)
28
3 – Quantificação dos subtipos celulares
29
4 – Análise Estatística
31
xii
RESULTADOS
32
1 – Análise imunoistoquímica do baço de camundongos infectados com 32
Lagochilascaris minor
1.1 – Análise quantitativa das células esplênicas F4/80+
34
1.2 – Análise quantitativa das células esplênicas CD4+
36
1.3 – Análise quantitativa das células esplênicas CD8+
38
1.4 – Análise quantitativa das células esplênicas CD19+
40
DISCUSSÃO
41
CONCLUSÕES
49
CONSIDERAÇÕES FINAIS
50
REFERÊNCIAS BIBLIOGRÁFICAS
52
ANEXOS
Anexo 1 – Aprovação do Comitê de Ética em Pesquisa Animal do Instituto 63
Butantan de São Paulo
Anexo 2 – Manuscrito
64
Anexo 3 – Regras para publicação de trabalho
84
xiii
LISTA DE FIGURAS E TABELAS
Figura 1: Ciclo da transmissão da lagochilascariose, adaptado de: Stanford
4
University 2006.
Figura 2: Ocorrência de casos de lagochilascariose no Brasil, adaptado de:
7
Palheta-Neto et al. 2002.
Figura 3: Resposta imune aos helmintos adapatado de: Maizels et al. 2009.
13
Figura 4: Esquema ilustrativo de imunoistoquímica, adaptado de: LAPAC 2011.
29
Figura 5: Fotografia de um campo de imunoistoquímica representando a
30
quantificação celular nas 30 intersecções da grade. As setas indicam células
esplênicas marcadas nas intersecções (aumento de 400X).
Figura 6: Imunoistoquímica do baço de camundongos BALB/c infectados, sem
32
anticorpo de marcação (CN, controle negativo) e com os anticorpos antimarcadores celulares F4/80, CD4, CD8 e CD19. As setas apontam para marcação
celular localizada na polpa vermelha para o marcador F4/80 e na região folicular
da polpa branca do baço para os marcadores CD4, CD8 e CD19; aumento de
100X (Reações padronizadas pela Profa. Dra. Monica Spadafora-Ferreira,
Instituto Butantan de São Paulo).
Figura 7: Determinação por imunoistoquímica de células F4/80+ no baço dos
34
camundongos BALB/c e C57BL/6 não infectados (controles- linha fina) ou
infectados com 1.000 ovos de Lagochilascaris minor por via oral (infectadosnegrito), em diferentes dias após a infecção. Os resultados foram expressos em
mediana do número de células por campo, com coluna indicando desvio médio, e
barra determinando o valor mínimo e máximo de células marcadas (* p< 0,05,
Teste Mann Whitney). IC: Índice de células F4/80+, considerando a média
aritmética do número de células marcadas por campo nos animais infectados
(Мcel+Inf), dividida pela média aritmética do número de células marcadas nos
controles não infectados (Мcel+Cont), nos diferentes dias após a infecção.
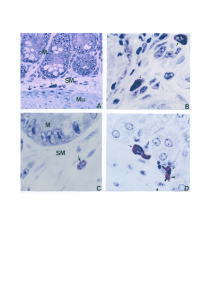
Figura 8: Imunoistoquímica com presença de células esplênicas F4/80+.
Camundongo BALB/c não infectado (controle) com quantidade discreta de
células marcadas (A); camundongo BALB/c aos 100 dias após a infecção com
quantidade moderada de células F4/80+ (B); camundongo C57BL/6 não
34
xiv
infectado (controle) com quantidade acentuada de células marcadas (C);
camundongo C57BL/6 aos 100 dias de infecção com quantidade moderada de
células F4/80+ (D); aumento de 400X.
Figura 9: Determinação por imunoistoquímica de células CD4+ no baço dos
36
camundongos BALB/c e C57BL/6 não infectados (controles- linha fina) ou
infectados com 1.000 ovos de Lagochilascaris minor por via oral (infectadosnegrito), em diferentes dias após a infecção. Os resultados foram expressos em
mediana do número de células por campo, com coluna indicando desvio médio, e
barra determinando o valor mínimo e máximo de células marcadas (* p< 0,05,
Teste Mann Whitney). IC: Índice de células CD4+, considerando a média
aritmética do número de células marcadas por campo nos animais infectados
(Мcel+Inf), dividida pela média aritmética do número de células marcadas nos
controles não infectados (Мcel+Cont), nos diferentes dias após a infecção.
Figura 10: Imunoistoquímica com presença de células esplênicas CD4+. 36
Camundongo BALB/c não infectado (controle) com quantidade discreta de células
marcadas (A); camundongo BALB/c aos 100 dias após a infecção com quantidade
moderada de células CD4+ (B); camundongo C57BL/6 não infectado (controle)
com quantidade moderada de células marcadas (C); camundongo C57BL/6 aos
100 dias de infecção com quantidade moderada de células CD4+ (D); aumento de
400X.
Figura 11: Determinação por imunoistoquímica de células CD8+ no baço dos
38
camundongos BALB/c e C57BL/6 não infectados (controles- linha fina) ou
infectados com 1.000 ovos de Lagochilascaris minor por via oral (infectadosnegrito), em diferentes dias após a infecção. Os resultados foram expressos em
mediana do número de células por campo, com coluna indicando desvio médio, e
barra determinando o valor mínimo e máximo de células marcadas (* p< 0,05,
Teste Mann Whitney). IC: Índice de células CD8+, considerando a média
aritmética do número de células marcadas por campo nos animais infectados
(Мcel+Inf), dividida pela média aritmética do número de células marcadas nos
controles não infectados (Мcel+Cont), nos diferentes dias após a infecção.
Figura 12: Imunoistoquímica com presença de células esplênicas CD8+.
Camundongo BALB/c não infectado (controle) com quantidade discreta de
células marcadas (A); camundongo BALB/c aos 35 dias após a infecção com
38
xv
quantidade discreta de células CD8+ (B); camundongo C57BL/6 não infectado
(controle) com quantidade discreta de células marcadas (C); camundongo
C57BL/6 aos 35 dias de infecção com quantidade moderada de células CD8+
(D); aumento de 400X.
Figura 13: Determinação por imunoistoquímica de células CD19+ no baço dos
40
camundongos BALB/c e C57BL/6 não infectados (controles- linha fina) ou
infectados com 1.000 ovos de Lagochilascaris minor por via oral (infectadosnegrito), em diferentes dias após a infecção. Os resultados foram expressos em
mediana do número de células por campo, com coluna indicando desvio médio, e
barra determinando o valor mínimo e máximo de células marcadas (* p< 0,05,
Teste Mann Whitney). IC: Índice de células CD19+, considerando a média
aritmética do número de células marcadas por campo nos animais infectados
(Мcel+Inf), dividida pela média aritmética do número de células marcadas nos
controles não infectados (Мcel+Cont), nos diferentes dias após a infecção.
Figura 14: Imunoistoquímica com presença de células esplênicas CD19+.
40
Camundongo BALB/c não infectado (controle) com quantidade discreta de
células marcadas (A); camundongo BALB/c aos 150 dias após a infecção com
quantidade moderada de células CD19+ (B); camundongo C57BL/6 não
infectado (controle) com quantidade acentuada de células marcadas (C);
camundongo C57BL/6 aos 150 dias de infecção com quantidade acentuada de
células CD19+ (D); aumento de 400X.
Figura 15: Esquema representativo da interação das populações celulares
50
F4/80+, CD4+, CD8+, CD19+ durante a lagochilascariose experimental. Os
camundongos da linhagem BALB/c apresentaram aumento preferencial de
células CD4+ e CD19+. Já os camundongos da linhagem C57BL/6 mostraram
aumento preferencial de células CD8+.
Tabela 1: Classificação dos campos de imunoistoquímica para os marcadores
F4/80, CD4, CD8, CD19 de acordo com a quantidade de células marcadas.
31
xvi
LISTA DE SIGLAS E ABREVIATURAS
AAMs
do inglês, Alternatively activated macrophages
ADCC
do inglês, Antibody-Dependent Cell-Mediated Cytotoxicity
APCs
do inglês, Antigen-presenting cells
B0
Células B naives
Bm
Células B de memória
Breg
Linfócitos B reguladores
btk
do inglês, Bruton tyrosin kinase
CAMs
do inglês, Classically activated macrophages
CD
do inglês, Cluster of differentiation
CO2
ConA
Gás carbônico
CR3
do inglês, Complement receptor 3
DAI
Dias após infecção
DCs
do inglês, Cells dendritic
EB
Extrato bruto
EBL3
Extrato bruto de larvas L3
EBVA
Extrato bruto de parasitos adultos
ECP
Proteína catiônica eosinofílica
EPO
do inglês, Eosinophil peroxidase
FCB
do inglês, Follicular B cells
FcR
Receptor de Fc
FcRε
Receptor para Fc de IgE
GM-CSF
do inglês, Granulocyte-macrophage colony-stimulating factor
h
Hora
H2O2
Água oxigenada
IC
Índice de células
IFNγ
Interferon-γ
IFT
Imunofenotípica
Ig
Imunoglobulina
IIQ
Imunoistoquímica
IL
Interleucina
IL-4Rα
Receptor α para IL-4
Concanavalina A
xvii
iNOS
do inglês, NO synthase inducible
IPTSP
Instituto de Patologia e Saúde Tropical
IVT
Ivermectina
L2
Larvas de segundo estádio
L3
Larvas de terceiro estádio
L4
Larvas de quarto estádio
LN
Linfonodo
LPS
Lipolissacarídeo
MBP-1
do inglês, Major basic protein
Mcel+
Média de células positivas
MHC
do inglês, Major histocompatibility complex
min
Minuto
ml
Mililitro
MMM
do inglês, Marginal metalophils macrophages
MZ
do inglês, Marginal zone
MZB
do inglês, MZ B cells
MZM
do inglês, MZ macrophages
n
Número
NK
do inglês, Natural killer
NKT
do inglês, T Natural killer
iNKT
NKT invariantes
NO
do inglês, Nitric oxide
Nuócitos
Células auxiliares inatas
PA
Parasito adulto
PAMPs
do inglês, Pathogen-associated molecular pattern
PBMC
do inglês, Peripheral blood mononuclear cell
PBS
do inglês, Phosphate buffered salin
PBSLD
PBS-leite desnatado
PMNB
Polimorfonuclear basófilo
PMNE
Polimorfonuclear eosinófilo
PMNN
Polimorfonuclear neutrófilo
RNS
do inglês, Reactive nitrogen species
ROS
do inglês, Reactive oxygen species
SE
Secretado e excretado
SEA
do inglês, Secreted egg antigen
xviii
SFB
Soro fetal bovino
SNC
Sistema nervoso central
sp
Espécie
t.a.
Temperatura ambiente
Tc
T citolítico
TCR
do inglês, T cell receptor
TD
Timo dependente
TGFβ
do inglês, Transforming growth factor-beta
Th
do inglês, T helper
Th0
T naive
ThF
Th folicular
TI
Timo independente
TLR
do inglês, Toll-like receptors
TNFα
do inglês, Tumor necrosis factor-alpha
Tregs
do inglês, T regulators
TSLP
do inglês, Thymic stromal lymphopoietin
X
Vezes
µl
Microlitro
xix
RESUMO
A lagoquilascariose é uma parasitose emergente cujo agente etiológico é
Lagochilascaris minor. O modelo experimental em camundongos tem sido utilizado no
estudo da resposta imune durante a infecção por L. minor. No presente trabalho,
avaliaram-se as populações de células esplênicas por imunoistoquímica em
camundongos susceptíveis (C57BL/6) e resistentes (BALB/c), experimentalmente
infectados por L. minor. A manutenção do ciclo experimental, infecção dos animais,
padronização e execução das reações imunoistoquímicas, cortes em criostato,
padronização das contagens de células, bem como as fotografias para estas contagens,
foram feitas pelos bolsistas do laboratório de Imunoquímica do IPTSP/UFG (Lucas
Rangel, Mariana F.S. Prudente, Thayssa Dourado e Leticia de Almeida Leandro) e pelos
alunos da Profa. Monica Spadafora-Ferreira, no Instituto Butantan de São Paulo. Esta
dissertação refere-se a contagem das células marcadas nas fotografias das lâminas das
reações de imunoistoquímica. Camundongos BALB/c exibiram aumento do índice de
células esplênicas: F4/80+ aos 100 dias pós-infecção; CD4+ aos 100 e 250 dias após a
infecção; células CD8+ aos 35 e 100 dias pós-infecção; CD19+ aos 100, 150 e 250 dias
pós-infecção. Nos camundongos C57BL/6 infectados observou-se aumento do índice de
células esplênicas: F4/80+ aos 250 dias de infecção; CD4+ aos 150 dias; CD8+ aos 35,
150 e 250 dias; CD19+ aos 150 e 250 dias após infecção. Esses resultados indicam
participação dessas células no controle da infecção experimental por L. minor.
Palavras-chave: Lagochilascaris minor, helmintose, resposta imune, linfócitos
xx
ABSTRACT
Lagochilascariosis is an emerging parasitic disease whose etiologic agent is
Lagochilascaris minor. The experimental model in mice has been used to study the
immune response during infection by L. minor. In this study, we evaluated spleen cell
populations in susceptible (BALB/c) and resistant (C57BL/6) mice experimentally
infected with L. minor. The maintenance of the experimental cycle, infection of the
animals, standardization and execution of the immunohistochemistry reactions, cuts in
cryostat, standardization of the countings of cells, as well as photographs for these
countings, had been made by the scholarship students of the laboratory of
Imunoquímica of the IPTSP/UFG (Lucas Rangel, Mariana F.S. Prudente, Thayssa
Dourado and Leticia de Almeida Leandro) and students of the Profa. Mônica SpadaforaFerreira in the Butantan Institute of São Paulo. This dissertation concerns the counting
of the photos of the cells marked in the specimes of immunohistochemistry reactions.
BALB /c mice exhibited increased the index of spleen cells: F4/80+ at 100 days postinfection; CD4 + cells to 100 and 250 days after infection; CD8 + cells at 35 and 100
days post-infection; CD19 + cells at 100, 150 and 250 days post-infection. In C57BL /
6 mice infected showed an increase the index of spleen cells: of F4/80 + to 250 days of
infection, increase in CD4 + cells at 150 days, an increase of CD8 + cells at 35, 150 and
250 days and increased CD19 + cells to 150 and 250 days after infection. These results
indicate involvement of these cells in the control of experimental infection by L. minor.
Keywords: Lagochilascaris minor, helminths, immune response, lymphocytes
1
INTRODUÇÃO
A Lagochilascariose é uma infecção cujo agente etiológico é um nematódeo do
gênero Lagochilascaris. A doença humana é considerada uma helmintose emergente
neotropical, associada à Lagochilascaris minor (Paçô & Campos 1998; Guimarães et al.
2010). A infecção aparece em indivíduos de ambos os sexos, residentes em áreas rurais,
que utilizam carne de animais silvestres como alimento (Palheta-Neto et al. 2002). O
Brasil lidera a casuística mundial desta antropozoonose com aproximadamente 90% dos
casos mundiais descritos (Paçô & Campos 1998).
1 – Lagochilacaris minor
Parasitas do gênero Lagochilascaris são classificados como membros da
subfamília Ascaridinae, portanto pertencentes a família Ascarididae, ordem Secernentea
e classe Nematoda (Yamaguti 1961; Sprenti 1971; Palheta-Neto 2002). São conhecidas
cinco espécies do gênero Lagochilascaris: Lagochilascaris minor, Lagochilascaris
major, Lagochilascaris buckleyi, Lagochilascaris turgida e Lagochilascaris sprenti
(Leiper 1909; Fraiha et al. 1989; Prudente et al. 2009a).
L. minor foi originalmente descrito pelo helmintologista da Escola de Medicina
de Londres, Robert T. Leiper (1909), a partir de espécimes coletados de abscessos
subcutâneos de dois pacientes de Trinidad-Tobago. Ao descrever o parasita, o autor
chamou a atenção para a morfologia peculiar do helminto: boca com três lábios bem
desenvolvidos, separados por interlábios, o que confere a extremidade cefálica um
aspecto bem característico, que lembra o lábio leporino (lagos=lebre) (Leão & Neto
1997; Paço & Campos 1998).
L. minor é a espécie mais importante do gênero, visto que foram registrados
mais de 100 casos de parasitismo humano causados por L. minor (Palheta-Neto 2002).
O nematódeo provoca uma infecção com lesões granulomatosas crônicas, que aparecem
sob a forma de nódulos, pseudocistos ou abscessos, frequentemente localizados na
região do pescoço, mastóide ou ouvido médio (Guimarães et al. 2010; Roig et al. 2010).
No interior dos abscessos encontram-se parasitos adultos (PA), ovos e larvas, indicando
auto-infecção e favorecendo o desenvolvimento de doença crônica. Algumas vezes o
parasita invade o tecido pulmonar e o sistema nervoso central (SNC), levando à morte
do hospedeiro (Fraiha et al. 1989; Freitas et al. 2008).
2
A extraordinária capacidade de L. minor para migrar entre diferentes tecidos
humanos também foi observada em modelos experimentais, utilizando-se camundongos
e gatos (Sakamoto & Cabrera 2002; Semerene et al. 2004; Freitas et al. 2008; Prudente
et al. 2009b).
Assim, a reprodução completa do ciclo biológico de L. minor utilizando
hospedeiros experimentais tem permitido o estudo detalhado da biologia do parasita e
da relação parasita-hospedeiro (Barbosa & Campos 2001).
1.1 – Ciclo evolutivo natural
O ciclo de vida natural de L. minor e o mecanismo de infecção não estão bem
esclarecidos, pois os hospedeiros naturais do parasita, sejam eles definitivos ou
paratênicos, ainda não são bem conhecidos, apesar das várias hipóteses e achados já
descritos. Leiper, em 1909, sugeriu que algum animal silvestre ou doméstico serviria
como hospedeiro definitivo natural de L. minor, sendo o homem apenas hospedeiro
acidental deste helminto, visto que a infecção humana é relativamente rara para
desempenhar um papel na manutenção deste helminto na natureza. Animais silvestres
como canídeos felídeos e roedores são considerados os prováveis reservatórios naturais
de L. minor (Paço & Campos 1998; Barbosa et al. 2005; Prudente et al. 2008).
Entre os hospedeiros conhecidos, além do homem, há registros de infecção
natural por L. minor em cães e gatos domésticos. O cão doméstico foi encontrado
naturalmente infectado em Foz do Iguaçú (Barbosa et al. 2005). Volcán & Medrano
(1990) relataram a infecção natural por L. minor em um cachorro do mato Speothos
venaticus. Fraiha et al. (1989) relataram o único caso de infecção natural em gato
doméstico ocorrido no Brasil, ocorrendo associação entre infecção animal e humana,
pois ambos, paciente e gato doméstico, habitavam o mesmo ambiente. Sakamoto &
Cabrera (2002) registraram gatos com lagochilascariose natural no Uruguai, porém sem
associação aparente com a doença humana.
Em 1971, Sprent sugeriu que o ciclo evolutivo de L. minor fosse semelhante ao
ciclo de Ascaris lumbricóides, desde a ingestão do ovo até a chegada de larvas de 2º
estádio (L2) aos pulmões, onde ocorreria a segunda muda. As larvas de 3º estádio (L3)
dos pulmões chegariam à traquéia e, ao invés de serem deglutidas, como no ciclo de A.
lumbricóides, se estabeleceriam nas criptas das tonsilas, seios nasais e tecidos
relacionados. Além desta hipótese, outros autores acreditam que a via hídrica seja a
3
mais importante para infecção através de larvas L2 infectantes, provenientes de felinos
silvestres (Prudente et al. 2008).
Smith et al. (1983) sugeriram que o ciclo de L. minor deveria envolver um
hospedeiro que não o homem, nos estágios precoces do desenvolvimento e que a
infecção resultaria da ingestão de larvas encistadas em carnes cruas ou mal cozidas de
um mamífero contaminado. As larvas poderiam migrar do estômago para os tecidos que
se comunicam com a faringe, e fazer a muda para larvas de 4º estádio (L4) e parasito
adulto durante este percurso. De fato, parasitos adultos são encontrados no homem em
locais como: tonsilas, seios nasais, seios maxilares, ouvido médio e processo mastóide
Em relação ao ciclo de transmissão (Figura 1), hospedeiros naturais (carnívoros
silvestres) abrigariam o PA nas primeiras porções do sistema digestório ou respiratório.
Os ovos de L. minor seriam eliminados nas fezes desses animais, contaminando o solo.
Esses ovos ao se tornarem embrionados contendo larvas L3, quando ingeridos por
hospedeiros intermediários (provavelmente roedores silvestres), infectariam esses
animais. Durante a infecção desses hospedeiros, são encontradas as formas larvárias
encistadas no tecido muscular e tecido subcutâneo. Os hospedeiros definitivos ao se
alimentarem desses animais seriam infectados por L3 encistadas, fechando o ciclo
enzoótico natural (Sprent 1971; Smith et al. 1983; Leão & Fraiha 1997). Acredita-se
que a infecção humana por L. minor seja decorrente da ingestão de carne crua ou mal
cozida de animais silvestres contendo larvas L3 encistadas do parasito. O homem, o cão
e o gato doméstico ao se infectarem comportariam-se como hospedeiros definitivos
acidentais, albergando todos os estágios evolutivos do parasito, que seriam capazes de
se reproduzir em ciclos sucessivos (Smith et al. 1983).
4
Figura 1. Ciclo da transmissão da lagochilascariose, adaptado de: Stanford
University 2006.
1.2 – Ciclo evolutivo experimental
O ciclo evolutivo experimental tem sido descrito para o parasito utilizando-se
camundongos e/ou roedores silvestres e gatos domésticos (Paçô et al. 1999). Nesses
modelos, o camundongo é considerado como hospedeiro intermediário no ciclo
experimental. Além do camundongo, cutia, preá e camundongo silvestre respondem à
infecção por L. minor comportando-se como hospedeiros intermediários no ciclo
experimental (Volcán & Medrano 1990).
Vários autores (Campos et al. 1992, Volcán et al. 1992, Paçô et al. 1999),
confirmaram a hipótese formulada por Smith et al. (1983), de que o homem se infectaria
através da ingestão de larvas encapsuladas em carnes cruas ou mal cozidas de animais
silvestres, os quais funcionariam como hospedeiros intermediários obrigatórios do
parasito. Esses autores acreditam que larvas L3 encistadas nos tecidos de roedores
(hospedeiros intermediários), ingeridas por felinos ou humanos (hospedeiros
definitivos), fazem a muda para larvas L4 e PA, e este migra para as porções superiores
do trato digestório e tecidos vizinhos à faringe (tonsila, palato, seios paranasais, conduto
auditivo) no hospedeiro definitivo, onde são encontrados na infecção natural humana ou
de felinos. Nos felinos (hospedeiros definitivos), os PAs acasalam, dando lugar a
postura de ovos que irão para as fezes.
Nesses estudos demonstrou-se que Felis domesticus atuam como hospedeiros
definitivos no ciclo experimental, confirmando, assim, a natureza heteroxênica do ciclo
5
evolutivo, apesar de ser reconhecida a ocorrência do ciclo autoinfectante. Barbosa et al.
(2005) obtiveram 100% de reprodução da infecção experimental em F. domesticus,
confirmando a possibilidade de o gato doméstico atuar como reservatório em potencial
de L. minor na natureza.
No ciclo evolutivo experimental observou-se que em camundongos inoculados
com ovos infectantes do parasito (contendo L3 encistadas) por via oral, as larvas L3 do
interior dos ovos eclodem nas porções terminais do intestino delgado e ceco, quatro a
seis horas após a inoculação, atingindo vasos e parênquima hepático. Em seguida,
disseminam para outros tecidos, como pulmões, músculos, tecido subcutâneo,
parênquima renal e pâncreas e depois de um a dois dias, encistam-se na musculatura
esquelética e tecido subcutâneo de camundongos infectados. Lesões granulomatosas
contendo larvas L3 encistadas foram encontradas nos pulmões, músculos esqueléticos,
tecido subcutâneo e linfonodos (LN) aos 30 dias após a infecção (DAI) (Campos et al.
1992; Volcán et al. 1992). Quando gatos são alimentados com carcaças de
camundongos infectados observa-se a continuidade do ciclo evolutivo do parasito.
Nestes hospedeiros, as larvas L3 eclodem dos cistos no estômago e ascendem pelas
porções superiores do trato digestório até a orofaringe, e larvas L4 são vistas do
segundo ao oitavo dia, atingindo a fase adulta entre nove e quinze DAI, em tecidos da
rino e orofaringe, tecido subcutâneo da região cervical, LN cervicais, ouvido, seios
nasais, mastóide, face, pulmões e cérebro. Ovos de L. minor são expelidos e
encontrados nas fezes de gatos infectados (Campos et al. 1992; Volcán et al. 1992; Paço
et al. 1999; Semerene et al. 2004).
Freitas et al. (2008) demonstraram pela primeira vez na literatura que
camundongos podem ser hospedeiros definitivos deste helminto, pois quando infectados
por ovos contendo larvas L3, desenvolveram abscessos purulentos com presença de
parasitas adultos, mas sem a postura de ovos no local. Alguns autores consideram o
hospedeiro definitivo aquele no qual um parasito de reproduz sexualmente (McGraw
2003); no entanto, outros consideram como hospedeiro definitivo aquele que alberga a
fase adulta do parasito (Opperdoes & Hannaert 2006). Por esta definição, camundongos
podem ser hospedeiros definitivos de L. minor, apontando para a possibilidade de
infecção natural de animais e humanos por ovos de L. minor contendo L3, sem a
necessidade da presença de um hospedeiro intermediário (Freitas et al. 2008).
Em estudo anterior do nosso grupo, após observação da taxa de mortalidade
acumulada no período de um ano de infecção, foi possível classificar as linhagens
6
isogênicas de camundongos, em resistentes (A/J, BALB.xid, BALB/c) e susceptíveis
(C57BL/6, B10.A) à infecção experimental por L. minor (Carvalhaes 2002, Carvalhaes
et al. 2008, Prudente et al. 2009b, Spadafora-Ferreira et al. 2010). Larvas L3 foram
encontradas em animais de todas as linhagens, enquanto que larvas L4 e PAs foram
encontrados com maior freqüência em camundongos C57BL/6 e B10.A. O padrão de
infecção em camundongos C57BL/6 foi semelhante ao apresentado pelos camundongos
B10.A, por outro lado, camundongos A/J infectados mostraram-se mais resistentes.
Camundongos BALB/c infectados foram considerados animais com susceptibilidade
intermediária ou resistentes. Neste estudo, não foram observadas diferenças ligadas ao
sexo em relação à taxa de sobrevivência dos animais infectados e número de L3
recuperadas de nódulos da musculatura esquelética e tecido subcutâneo dos
camundongos. Estes resultados demonstraram que a progesterona e outros hormônios
ligados ao sexo, não parecem afetar o crescimento e reprodução de L. minor (Prudente
et al. 2009b, Spadafora-Ferreira et al. 2010).
Na lagochilascariose experimental a resistência ao L. minor não está ligada ao
haplótipo H-2ª do complexo principal de histocompatibilidade (MHC), porque ambas as
linhagens de camundongos, B10.A e A/J, expressam o haplótipo H-2ª, sendo a primeira
suscetível e a última resistente à infecção experimental (Prudente et al. 2009b;
Spadafora-Ferreira et al. 2010). Por outro lado, temos padrão semelhante de mortalidade
e recuperação de larvas L3 em camundongos susceptíveis (C57BL/6 e B10.A) à
infecção por L. minor, que apresentam o mesmo background genético, o que indica que
o background é uma característica relevante na susceptibilidade à lagochilascariose
experimental (Prudente et al. 2009b).
Camundongos
BALB/c
infectados
experimentalmente
com
L.
minor
desenvolvem uma infecção com patogenia menos grave, sugerindo que este é um
possível modelo experimental do ciclo de vida natural do parasito em hospedeiros
intermediários ou paratênicos. Já a linhagem C57BL/6 apresentou uma infecção mais
grave, com presença de um maior número de PAs, sugerindo que esta linhagem é o
melhor modelo experimental para estudo da doença humana (Freitas et al. 2008).
2– Lagochilascariose humana e animal
O parasitismo no homem caracteriza-se pelo desenvolvimento de lesões que
parecem tumores, supurativas, de natureza crônica ou recorrente, no pescoço, no ouvido
médio e na região mastóidea (Leão & Neto 1997; Campos 2005). A constatação da
7
existência de sítios preferenciais das lesões nessas regiões permanece sem justificativa
plausível (Palheta-Neto et al. 2002).
A doença humana apresenta distribuição geográfica restrita a países das
Américas como México, Costa Rica, Trinidad-Tobago, Colômbia, Venezuela,
Suriname, Brasil e mais recentemente Bolívia e Uruguai. A infecção humana por L.
minor ainda não constitui um problema de saúde pública em nenhum país do mundo;
entretanto, a sua incidência tem aumentado sensivelmente no Brasil, permitindo
caracterizá-la como uma helmintose emergente (Campos 2005; Barbosa et al. 2005).
O Brasil lidera a casuística da lagochilascariose humana, com muitos casos
descritos na Amazônia brasileira (Pará, Rondônia, Tocantins, Acre, Mato Grosso). Isso
sugere que o parasito encontra nestes locais, condições ideais para seu desenvolvimento.
Os estados de Goiás, Mato Grosso do Sul, São Paulo, Roraima e Paraná, também
apresentam raros casos descritos da doença (Figura 2) (Paçô & Campos 1998; Campos
2005; Leão et al. 2005).
Figura 2. Ocorrência de casos de lagochilascariose no Brasil, adaptado de: Palheta-Neto et al.
2002.
Muitos projetos governamentais determinaram um verdadeiro êxodo urbano,
levando milhares de pessoas a abandonar grandes centros, passando a habitar áreas
próximas a matas, sendo importante fator de aumento de risco de infecção. Os
indivíduos infectados geralmente vivem em habitações precárias ao lado de mata densa,
sobrevivendo da ingestão de carne de animais silvestres tais como: tatu, preá, cutia,
paca, porco do mato, jabuti e outros animais (Campos et al. 1987; Palheta-Neto 2002).
O primeiro caso humano brasileiro foi registrado por Artigas et al. (1968) no
estado de São Paulo. Vários casos de abscessos purulentos na região do pescoço
(Campos et al. 1987, 1995; Costa et al. 1986; Fraiha et al. 1989; Vieira et al. 2000),
região temporo-parieto-occipital (Baracat et al. 1984), ouvido (Rocha et al. 1984;
8
Guimarães et al. 2010), seios paranasais (Draper & Buckley 1963; Volcán et al. 1982),
osso mastóide (Brujining 1957; Corrêa et al. 1978; Moraes et al. 1983; Campos et al.
1987; Guimarães et al. 2010; Roig-Ocampos 2010 ), rinofaringe (Leão et al. 1978)
alvélolo dentário (Volcán et al. 1982), pulmões (Moraes et al. 1985; Rosemberg et al.
1986), SNC (Campos et al. 1985; Orihuela R et al. 1987; Rosemberg et al. 1986),
foram descritos na literatura.
Barbosa et al. (2005) demonstraram em gatos experimentalmente infectados por
L. minor que: 75% apresentaram lesões que evoluíram para nódulos no tecido
subcutâneo da região cervical e orofaringe, havendo eliminação de ovos nas fezes; nos
25% restantes, as lesões estavam presentes em localizações semelhantes às descritas no
ser humano. Isso evidenciou a semelhança do padrão de infecção de F. domesticus e do
ser humano quanto a: localização das lesões, formação de fístulas na orofaringe,
eliminação de ovos nas fezes. Deste modo, felídeos silvestres ou domésticos parecem
atuar na natureza como reservatório de L. minor. Os relatos de infecção natural do gato
doméstico e a suscetibilidade deste hospedeiro à infecção experimental sugerem que
este animal possa atuar como um reservatório de L. minor na natureza.
2.1 – Patogenia
O fenômeno de auto-infecção foi registrado em animais e no homem, podendo
ser decorrente da reprodução do PA no local das lesões, visto que podem ser
encontrados todos os estádios evolutivos do helminto, simultaneamente, às vezes em
grande número (Moraes et al. 1985, Campos et al. 1987, 1995).
Durante a lagochilascariose humana ocorre o desenvolvimento de reações
granulomatosas crônicas. Histologicamente, as lesões apresentam numerosos abscessos
interligados por fistulas, envolvidos por tecido de granulação, células gigantes
multinucleadas, áreas densas de fibrose, presença de edema, restos parasitários e
infiltrado difuso de células mononucleares. PA, larvas e ovos foram encontrados no
interior de granulomas primários, secundários ou terciários (Moraes et al. 1983; Veloso
et al. 1992; Leão & Fraiha 1997; Palheta-Neto et al. 2002).
Moraes et al. (1985) observaram grande quantidade de ovos embrionados no
interior de microabscessos e granulomas, em pulmão de paciente que foi a óbito por
lagochilascariose. Também foram vistos parasitos adultos no centro dos granulomas ou
de áreas de necrose, e restos larvários circundados por fibrose; no restante do
9
parênquima pulmonar, os alvéolos mostravam-se repletos de macrófagos vacuolizados,
neutrófilos e fibrina; ao redor e na luz dos brônquios, observou-se lesão intensa com
presença de exsudato contendo linfócitos e plasmócitos. É importante ressaltar que
esses autores observaram a ocorrência do ciclo autoinfectante e ausência de eosinófilos
nos tecidos e sangue periférico.
Em um caso de otomastoidite por L. minor, o exame histopatológico mostrou
granuloma
contendo
acentuado
infiltrado
linfohistioplasmocitário
e
lesão
granulomatosa, englobando fragmentos parasitários com camada quitinosa. Porém,
devido à fragmentação do parasito este não foi identificado com precisão no material
estudado (Guimarães et al. 2010).
Diferentes linhagens isogênicas de camundongos foram avaliadas quanto à
histopatologia encontrada durante a infecção por L. minor. Semerene et al. (2004)
demonstraram que, em camundongos da linhagem C57BL/6, a infecção por L. minor
induz uma reação granulomatosa nos pulmões, constituída por células gigantes a partir
dos 13 DAI, com presença de eosinófilos e neutrófilos, em meio ao infiltrado
inflamatório perivascular, evoluindo para encistamento com fibrose concêntrica aos 61
DAI.
Durante a infecção experimental por L. minor, foram observadas por Freitas et
al. (2008) diferenças histopatológicas entre as linhagens BALB/c e C57BL/6. Nos
camundongos BALB/c, observou-se nos pulmões, uma reação granulomatosa pouco
organizada
ao
redor
de
larvas
L3/L4
intactas
ou
fragmentadas,
alguns
polimorfonucleares neutrófilos (PMNN), raros polimorfonucleares eosinófilos (PMNE)
e discreta fibrose durante o período de 45-210 DAI. Já os animais C57BL/6
apresentaram inflamação granulomatosa organizada em torno das larvas L3/L4 intactas,
áreas com fibrose central e necrose, PMNN e alguns PMNE, nos pulmões no período
estudado. Essas lesões de camundongos C57BL/6 infectados foram semelhantes às
descritas por Semerene et al. (2004), porém apresentaram maior número de neutrófilos.
Camundongos BALB.xid (deficientes de linfócitos B1), mais resistentes à
infecção
experimental
que
camundongos
BALB/c,
apresentaram
reações
granulomatosas menos intensas contendo larvas L3 localizadas no centro dos
granulomas e poucas áreas de inflamação intersticial com prevalência de células
mononucleares (Freitas et al. 2009; Prudente et al. 2009a).
Nos estudos histopatológicos realizados por Spadafora-Ferreira et al. (2010)
foram descritas diferenças nas reações granulomatosas dos pulmões entre as linhagens
10
B10.A e A/J durante a lagochilascariose experimental. Nos camundongos B10.A, na
fase inicial da infecção (7-30 DAI), observou-se granuloma primário com infiltrado
inflamatório difuso, composto de macrófagos e neutrófilos. Na fase intermediária (4590 DAI) foram observados granulomas secundários em torno de larvas L3/L4 e
presença de intenso infiltrado inflamatório com predomínio de macrófagos e
neutrófilos. Na fase tardia (120 DAI ou mais) foram detectados granulomas terciários
com fibrose concêntrica e infiltrado inflamatório moderado composto por macrófagos e
poucos neutrófilos. Nos camundongos da linhagem A/J, linhagem mais resistente, na
fase inicial da infecção foram visualizados granulomas primários em volta de larvas
intactas e infiltrado inflamatório moderado composto de macrófagos e discreto
infiltrado de neutrófilos. Na fase intermediária, observou-se a presença de granulomas
secundários com infiltração menor em volta das larvas L3 fragmentadas ou intactas e
discreta fibrose nos pulmões. Granulomas terciários foram encontrados na fase tardia,
contendo larvas L3 fragmentadas, tecido com necrose moderada e fibrose concêntrica
(Spadafora-Ferreira et al. 2010).
Essa diferença observada na susceptibilidade à infecção em diferentes linhagens
isogênicas de camundongos, com formação distinta de granulomas, pode ser
influenciada pelo background genético do hospedeiro e pela resposta imune ao parasita
(Freitas et al. 2008).
2.2 – Manifestações Clínicas
A lagochilascariose, no homem, instala-se geralmente de forma insidiosa,
apresenta caráter crônico e evolui com períodos de remissões e recidivas, às vezes
evoluindo para o óbito. A infecção é caracterizada pelo desenvolvimento de nódulos
subcutâneos, pseudocistos ou abscessos e aparecimento de novas lesões em locais
próximos aos iniciais, na maioria das vezes com drenagem de material purulento ou
serossanguinolento e eliminação de diferentes estágios evolutivos do parasito, causando
sérios problemas sociais (Moraes et al. 1983; Campos 2005).
A localização das lesões direciona a gravidade da doença, sendo relatados desde
casos fatais até casos em que as lesões pouco influem no estado geral do paciente
(Campos 2005). Assim sendo, os sintomas clínicos da doença dependem: da localização
tecidual dessas lesões; da carga parasitária; e da resposta imune do hospedeiro, que pode
minimizar ou bloquear os processos patogênicos, bem como o surgimento de novas
11
lesões (Fraiha et al. 1989; Campos et al. 1992; Prudente et al. 2009b; Guimarães et al.
2010).
Na fase inicial da doença, alguns pacientes relatam febre diária, inapetência,
perda ponderal e adenopatia. Nos casos de comprometimento cervical, observam-se
nódulos que aumentam gradativamente de tamanho, podendo atingir cerca de 10 cm de
diâmetro, fistulando-se espontaneamente. Existem relatos de quadros de otalgia,
mastoidite e rinite. Entre as manifestações neurológicas existem relatos de cefaléia
intensa, distúrbios de comportamento, tetraparesia de membros inferiores, rigidez da
nuca, sinais de irritação meníngea, crises convulsivas e óbito (Campos 2005). O
comprometimento pulmonar pode ser acompanhado de febre e dificuldade respiratória,
podendo evoluir para cianose e óbito. A letalidade tem sido observada em pacientes
com comprometimento pulmonar ou do SNC. Isto se deve a falta de diagnóstico
parasitológico adequado e da utilização de terapêutica específica (Leão & Fraiha 1997;
Palheta-Neto et al. 2002).
A infecção humana pode ter evolução crônica, com 5 a 20 anos de duração, ou
levar o indivíduo ao óbito, três meses após o início dos sintomas (Paço & Campos
1998). Existem indivíduos que permanecem infectados por cinco a dez anos, havendo
melhora do quadro clínico e em seguida reagudização dos processos parasitários após a
interrupção do tratamento (Campos 2005). Existem dez casos fatais registrados na
literatura (Leão et al. 2005).
No parasitismo humano, não é raro se observar comprometimento do SNC, rino
e orofaringe, na ausência de lesões no tecido subcutâneo, ouvido médio ou seios nasais.
Nessas condições, o diagnóstico é extremamente difícil de ser realizado; mas
comumente, o paciente relata a eliminação de parasitos vivos através da cavidade oral,
conduto auditivo externo e fossas nasais (Campos 2005; Barbosa et al. 2005).
3 – Resposta imune aos helmintos incluindo a lagochilascariose
Respostas imunes desempenham um papel central na determinação da evolução
de uma infecção, estabelecendo um balanço crítico destinado a garantir a sobrevivência
do hospedeiro e/ou do patógeno. No entanto, muitos patógenos desenvolveram
complexas estratégias de evasão a esses mecanismos de defesa e capacidade de
imunomodulação dessa resposta. O sistema imunológico dos mamíferos evoluiu com
mecanismos especializados, pois distintos órgãos linfóides, populações celulares e
12
componentes humorais compõem os sistemas inato e adaptativo, para proteção do
hospedeiro (Allen & Maizels 2011).
Antígenos derivados de helmintos podem ser drenados para órgãos linfóides
secundários, ou interagir com as células no local da infecção, incluindo células epiteliais
ou células dendríticas (DCs). O baço é o maior órgão linfóide secundário nos
mamíferos, que desempenha funções imunológicas essenciais, sendo o principal local
de resposta a antígenos provenientes do sangue. Esse órgão é microanatomicamente
organizado em: polpa branca, com áreas segregadas de linfócitos T (região linfóide
perioarteriolar) e folículos com células B, que fornecem um ambiente para o início
eficiente de respostas imunes específicas; e em polpa vermelha, constituída por grande
número de eritrócitos, macrófagos, linfócitos, DCs e células plasmáticas. As áreas
linfóides da polpa branca estão confinadas por uma zona marginal (MZ) que separa a
polpa branca da polpa vermelha (Aichele et al. 2003; Mebius & Kraal 2005).
Uma ampla variedade de espécies de helmintos parasita os vertebrados,
apresentando um ciclo de vida que pode ser direto, com transmissão de um hospedeiro
definitivo para outro, ou complexo, envolvendo distintos ciclos e estágios de
desenvolvimento, como ovos, larvas ou parasitos adultos, em diferentes espécies de
hospedeiro. Nesses estágios, estes parasitas muitas vezes são capazes de migrar através
de diferentes órgãos, sistemas e tecidos dentro do hospedeiro parasitado (Riet et al.
2007; Jackson et al. 2008).
As infecções por helmintos são as mais comuns nos seres humanos, afetam
bilhões de pessoas em todo o mundo, são responsáveis por altos índices de morbilidade
e em alguns casos podem levar a morte (Riet et al. 2007). Todavia, o cuidado efetivo
com a saúde e medidas de saneamento podem eliminar muitas infecções por helmintos,
e intervenções imunológicas podem se tornar um importante tratamento. Ainda assim,
vacinas ou outras imunoterapias efetivas não foram desenvolvidas e o entendimento da
resposta imune para esses importantes patógenos permanece em um estágio rudimentar.
(Gause et al. 2003).
As moléculas e células envolvidas na ativação da resposta imune contra
helmintos
permanecem
imunorreguladores
enigmáticas.
“mestres”,
visto
Parasitas
que
helmintos
normalmente
são
chamados
ativam
de
macrófagos
alternativamente ativados (AAMs), células T helper 2 (Th2) e T reguladoras (Tregs). Os
níveis elevados de imunoglobulina (Ig)E, mastocitose e eosinofilia são consideradas
13
características da infecção por helmintos (Figura 3) (Hewitson et al. 2009; Maizels et
al. 2009; Cadman & Lawrence 2010).
Figura 3. Resposta imune aos helmintos adapatado de: Maizels et al. 2009.
Os componentes celulares da imunidade inata incluem células de origem
hematopoética e não hematopoética, como macrófagos, DCs, mastócitos, neutrófilos,
eosinófilos, monócitos, células natural killer (NK), células da pele como macrófagos e
mastócitos, células do trato respiratório, gastrointestinal e geniturinário (Turvey et al.
2009).
O sistema imune inato possui uma família de receptores que reconhecem
padrões moleculares associados à patógenos (PAMPs) dos diversos microorganismos e
sinalizam a presença dos patógenos. PAMPs são moléculas vitais para os
microorganismos e altamente conservadas, sendo representadas por carboidratos,
proteínas, lipídios e ácidos nucléicos. Entre estes receptores, os receptores similares à
Toll
(TLR)
representam
importantes
moléculas
para
a
identificação
de
microorganismos. Os TLR são expressos em várias células do sistema imune inato, tais
como, monócitos, macrófagos, mastócitos, PMNN, PMNE, polimorfonuclear basófilo
(PMNB) e DCs em diferentes estágios de maturação e subtipos (Trujillo et al. 2007;
Friberg et al. 2010).
PAMPs de helmintos estimulam a atividade de células da imunidade inata
(eosinófilos, basófilos, mastócitos ou células do epitélio intestinal) que por sua vez,
14
influenciam DCs ou mesmo células T naives (Th0). PAMPs de helmintos também
direcionam a maturação de DCs induzindo uma resposta Th2 ou Treg e podem suprimir
a expressão ou função de TLRs (Jackson et al. 2008; Cadman & Lawrence 2010).
Durante a resposta imune inata, granulócitos são ativados e podem agir como
células imunes efetoras durante a infecção por helmintos. Estudos in vitro mostram que
a imunidade mediada por eosinófilos contra helmintos pode levar a citotoxicidade
mediada por células dependente de anticorpos (ADCC): o anticorpo se liga ao receptor
Fc (FcR) na superfície do granulócito e esta célula inicia degranulação e extrusão do
conteúdo de grânulos tóxicos contra o parasita. In vivo são observadas alterações na
fisiologia do intestino e produção de muco por células caliciformes mediada por
granulócitos durante infecções por helmintos no intestino (Cadman & Lawrence 2010;
Paul & Zhu 2010; Allen & Maizels 2011).
Eosinófilos apresentam papel crucial na produção precoce de interleucina (IL) 4.
Os anticorpos IgE se ligam à superfície dos helmintos e os eosinófilos então aderem por
meio de receptores FcRε, sendo ativados para secretar grânulos com enzimas que
destroem os parasitas. Eosinófilos armazenam em seus grânulos proteínas tóxicas contra
o parasita como: proteína básica principal (MBP-1), peroxidase eosinofílica (EPO) e
proteína catiônica eosinofílica (ECP). Os grânulos também contêm uma série de
proteínas pré-formadas como quimiocinas e citocinas (IL4, IL13), que podem ser rápida
e seletivamente liberadas. A liberação de eosinófilos da medula óssea para a circulação
periférica é mediada por IL5 (Cadman & Lawrence 2010).
Camundongos IL5-/- com infecção por Trichinella spiralis mostraram cargas
maiores de parasitas adultos e expulsão lenta em infecções secundárias. No entanto,
durante a infecção experimental por Nippostrongylus brasiliensis, embora camundongos
apresentem eosinofília dependente de IL5 e aumento de IgE, nenhum desses fatores
desempenharam um papel na expulsão parasitária na infecção primária. Camundongos
deficientes em eosinófilos exibiram expulsão normal do parasita em infecção primária
por N. brasiliensis. Esses animais montaram respostas Th2, acumulo de basófilos e
produção de IgE inalteradas, demonstrando que eosinófilos desempenham um papel
pequeno durante a infecção por N. brasiliensis (Cadman & Lawrence 2010).
Estudos recentes sobre a expressão de IL4 e IL13 em camundongos mostraram
que um número significativo de células não-B, não-T produtoras dessas citocinas, são
encontrados durante infecção por helmintos. Essas células denominadas de nuócitos
(innate helper cell) foram identificadas no modelo experimental de infecção por N.
15
brasiliensis (Allen & Maizels 2011). A proliferação dessas células foi mimetizada pela
estimulação com IL25 e IL33, tanto in vitro quanto in vivo. Os nuócitos não expressam
marcadores de superfície característicos de nenhuma linhagem leucocitária conhecida,
incluindo linfócitos T e B, NK, DCs, neutrófilos, eosinófilos, mastócitos, basófilos ou
macrófagos. A transferência de nuócitos de animais selvagens para camundongos
deficientes em IL4-/- e IL13-/- foi capaz de restaurar a capacidade desses animais em
controlar a infecção e expulsar o helminto, demonstrando um papel importante para esse
tipo celular na infecção (Neill et al. 2010).
Vários tipos de células epiteliais não-linfóides produzem linfopoietina estromal
tímica (TSLP), IL25 e IL33 em resposta a helmintos. Essas citocinas influenciam a
imunidade inata e adaptativa associada à resposta Th2. As DCs ativadas por TSLP
produzem CXCL8 e CCL24 que atraem neutrófilos e eosinófilos, respectivamente. As
quimiocinas CCL17 e CCL22 atraem células Th2 para o sítio de infecção e também
podem ser produzidas por DCs ativadas por TSLP (Smits et al. 2010; Koyasu & Moro
et al. 2011).
Os polimorfonucleares podem ser rapidamente recrutados para os sítios de
infecção e linfonodos de drenagem, onde produzem IL4 e/ou IL13. PMNN atuam na
fagocitose e produzem espécies reativas do oxigênio (ROs) em fagolisossomos
destruindo microorganismos. Também podem agir sobre larvas de helmintos; contudo,
os helmintos são demasiadamente grandes para a fagocitose e alguns possuem o
tegumento espesso, o que os torna resistentes aos mecanismos microbicidas durante
essa resposta imune inata (Cadman & Lawrence 2010; Allen & Maizels 2011).
A capacidade fagocitária dos neutrófilos é estimulada por TLRs que reconhecem
PAMPs presentes na superfície dos microrganismos, receptores para opsoninas,
receptores para Fc de IgG e receptores para C3b. O chamado sistema de oxidase dos
fagócitos é composto por múltiplas subunidades enzimáticas, muitas das quais presentes
na membrana fagolisossomal de fagócitos ativados e sua função é reduzir o oxigênio
molecular a ROs, que são bastante tóxicos para bactérias, mas pouco efetivos contra
helmintos. Outra via de ação neutrofílica é mediada por grânulos secretados no meio
extracelular, pelo processo de degranulação. Existem três classes de grânulos liberados
por estas células: grânulos primários, também conhecidos como grânulos azurófilos,
que contêm mieloperoxidase, defensinas, elastase neutrofílica, proteína de aumento da
permeabilidade e as catepsinas G; grânulos secundários, que apresentam componentes
16
secretados especificamente por neutrófilos, sendo a lactoferrina o principal exemplo;
grânulos terciários, contendo catepsinas e gelatinases (Mesquita-Júnior et al. 2010).
No modelo experimental de filariose murina, o encapsulamento da filaria em
nódulos inflamatórios é essencial para a morte das mesmas, e estes nódulos são ricos em
PMNN. Neutrófilos, mas não macrófagos ou eosinófilos, controlam a formação destes
nódulos e a eliminação do parasito, na dependêndia de interferon γ (IFNγ) (Saeftel et al.
2001).
Basófilos também são células da imunidade inata que produzem altos níveis de
IL4 e TSLP, e auxiliam na amplificação da resposta de células Th2 nas helmintoses
humanas e em camundongos. Essas células expressam CD40L, bem como IL4 e IL13, e
por isso podem induzir as células B para produção de IgE (Cadman & Lawrence 2010;
Voehringer
2011).
Imunocomplexos
e
IgE
ativam
basófilos
e
mastócitos,
desencadeando a secreção de citocinas, quimiocinas, histamina, heparina, serotonina e
proteases, o que resulta na contração do músculo liso, aumento da permeabilidade
vascular e recrutamento de células inflamatórias. O recrutamento de mastócitos está
relacionado à liberação de IL9 produzida por células Th2. Mastócitos, PMNE, PMNB
são células da resposta imune inata responsáveis pela iniciação de uma resposta do tipo
Th2, e que reforçam essa resposta ao longo da infecção (Paul & Zhu 2010).
Macrófagos classicamente ativados (CAMs) surgem em resposta: ao IFNγ, que
pode ser produzido durante uma resposta imune adaptativa por células Th1 ou células T
citolíticas (Tc) CD8, ou durante uma resposta imune inata por células NK de origem
tímica (NKTi) ou não (NK); e ao fator de necrose tumoral alfa (TNFα), que pode ser
produzido por macrófagos (Mosser & Edwards 2008). Esses macrófagos estão
associados com respostas nas infecções virais e bacterianas, e atuam na destruição de
microrganismos por meio de vias que são dependentes de ROS, de espécies reativas
nitrogênio (RNS), e da síntese de óxido nítrico (NO) (Mantovani et al. 2002). O NO
derivado de CAMs é citotóxico para as larvas de metazoários (Ahmed et al.
1997).Estudos comprovam a importância de CAMs e produção de NO na resistência à
Taenia crassiceps (Trujillo et al. 2007).
Vários estudos demonstram a presença de AAM, pelo estímulo de IL4 ou IL13,
que podem ser produzidas durante uma resposta imune adaptativa por células Th2, ou
durante uma resposta imune inata por basófilos e mastócitos (Mosser & Edwards 2008).
Após a ativação, estes macrófagos são recrutados para os sítios da infecção durante
respostas Th2 a helmintos, e aumentam a expressão de arginase-1, receptor para manose
17
(CD206), receptor α para IL4 (IL4Rα), e são rapidamente recrutados para os sítios da
infecção (Anthony et al. 2007; Hesse et al. 2001).
Um dos melhores marcadores utilizados para identificar macrófagos é o F4/80
(Austyn & Gordon 1981) cuja expressão pode variar durante a ativação e maturação
dessas células (Van den Berg & Kraal 2005).
A imunidade adaptativa envolve componentes celulares e humorais, sendo que
os linfócitos T e B são as principais células de defesa que mediam esta imunidade. Em
contraste com o número reduzido de repertório dos receptores utilizados pelas células da
imunidade inata, a imunidade adaptativa possui uma grande diversidade de receptores
sendo estes bastante específicos. Após o encontro com o patógeno, linfócitos T e B
sofrem expansão clonal e diferenciação, tentando armar uma resposta imune capaz de
eliminar o patógeno invasor (Turvey et al. 2009).
As infecções por helmintos intestinais em seres humanos e nos modelos
experimentais induzem uma resposta forte e polarizada tipo Th2, mediada por IL3, IL4,
IL5, IL9, IL10, IL13, IL21, IL25 e IL33, que levam a mecanismos efetores que incluem
produção dos isótipos de anticorpos IgE, IgA, IgG1 e IgG4, ativação de mastócitos,
basófilos, eosinófilos, diferenciação de AAMs, contração da musculatura lisa e
produção de muco intestinal. As IL4 e IL13 são fatores críticos que mediam a
imunidade protetora contra nematódeos gastrointestinais. Ambas citocinas são
produzidas por células Th2, mas também por uma variedade de tipos de células da
resposta inata (Trujillo et al. 2007; Jackson et al. 2008; Maizels et al. 2009; Allen &
Maizels 2011).
N. brasiliensis e Heligmosomoides polygyrus, são usados como modelos de
infecções gastrointestinais por helmintos e caracterizam uma forte polarização de
resposta Th2 (Finkelman et al. 1997). Essa resposta é atribuída à propensão dos
helmintos de estimular linfócitos Th2, os quais secretam IL4, que permitem aos
linfócitos B produzirem IgE, e a IL5 que, estimulam o desenvolvimento e a ativação de
eosinófilos. Por ação direta sobre as células epiteliais (através de IL4, IL9 e IL13) e
células musculares lisas (através de IL4 e IL13), as células Th2 induzem a produção de
muco pelas células caliciformes (Paul & Zhu 2010; Allen & Maizels 2011).
Linfócitos Th2 sintetizam IL4 e IL13, que estimulam AAMs. Esses macrófagos
produzem moléculas como arginase-1, que contribuem diretamente para regulação e
resistência à infecção, reparação de tecidos, pois geram prolina, que é essencial para a
síntese de colágeno, e poliaminas para o crescimento celular. A arginase é uma potente
18
supressora da ativação de células T, devido à sua capacidade de esgotar a L-arginina
local, que é essencial para a ativação de células T. A L-arginina também é metabolizada
pela iNOS para a síntese de NO por CAMs. Assim, competindo com o substrato
necessário para a produção de NO, a arginase-1 é uma molécula antiinflamatória
(Maizels et al. 2009; Allen & Maizels 2011).
As células Th foliculares (ThF) produzem IL4 e induzem células B a produzirem
IgG1 e IgE (Figura 3). Durante a fase inicial da resposta imune para helmintos,
basófilos expressam moléculas de MHC-classe II e entram nos órgãos linfóides
auxiliando na polarização de uma resposta Th2. IgE pode então, ativar basófilos, que
por sua vez produzem citocinas (IL4, IL5, IL13) que ativam macrófagos de forma
alternativa (Maizels et al. 2009).
O perfil humoral da imunidade do tipo Th2 é baseado na elevação dos níveis de
anticorpos dos isótipos de IgG1, IgG4 e IgE (em humanos). Embora dependentes de
citocinas de células das respostas inata e adaptativa, células da imunidade inata não
podem substituir o papel essencial de células T mediada pelo CD40 ligante (CD40L) na
co-estimulação das células B. (Cadman & Lawrence 2010; Allen & Maizels 2011).
IgE, comumente encontrada em helmintoses, não desempenha um papel
essencial na imunidade protetora durante infecções por H. polygyrus, N. brasiliensis, e
Shistossoma mansoni, em camundongos, visto que as células B e os anticorpos
secretados por plasmócitos não interferem na expulsão eficaz de N. brasiliensis
(Maizels et al. 2009). Por outro lado, a ausência de células B está correlacionada com
aumento da carga parasitária nas infecções secundárias por S. mansoni, Litomosoides
sigmodontis, Trichuris muris e H. polygyrus (Harris & Gause 2011).
As proteínas de membrana caracterizam os precursores e os estágios de
diferenciação de células B. CD19 é um co-receptor que amplifica a cascata de
sinalização em células B, estando presente na superfície de praticamente todos os
linfócitos B, incluindo células pré-B, células B maduras, plasmócitos e células B de
memória (Bm) (Tedder et al. 1995; Mesquita-Junior et al. 2010).
A resposta imune humoral ao envolver células B1, promove uma resposta imune
inata; enquanto que, células B da zona marginal do baço (MZB), que são células B2
foliculares, estão relacionadas com uma resposta imune adaptativa. As células B
possuem uma variedade de funções imunes, incluindo a produção de anticorpos,
apresentação de antígenos, e produção de citocinas. Em camundongos células Th1 e
19
IFNγ medeiam a produção de IgG2a, células Th2 e IL4 de IgE,e IgG1, e células Treg e
TGFβ de IgA (Schimidt-Weber et al. 2007).
Em modelos de inflamação crônica parasitária, como a esquistossomose crônica e
filariose, células B produtoras de IL10 parecem associadas com a patologia reduzida e
modulação de respostas das células T (Smits et al. 2010). A infecção por S. mansoni
promove a expansão de células B1 peritoneais e células B esplênicas, onde
oligossacarídeos derivados do ovo do parasito promovem a proliferação de células B e
produção de IL10 (King & Mohrs 2009).
Infecções por helmintos são reconhecidamente de natureza crônica, com
algumas espécies de parasitos sobrevivendo no seu hospedeiro por muitos anos, ou
mesmo décadas. Para facilitar esta sobrevivência a longo prazo, estes organismos
desenvolveram estratégias de sobrevivência sofisticadas, incluindo a capacidade de
modelar e manipular o sistema imunológico (Helmby 2009). Essas infecções
parasitárias em humanos estão associadas com uma forte resposta imunomodulatória
(Loukas & Prociv 2001).
Os helmintos podem interagir com o sistema imune do hospedeiro levando á
imunossupressão da imunidade inata e adquirida, com a indução de linfócitos Tregs
(CD4+ CD25+FOXP3), linfócitos B regulatórios (Bregs) e citocinas anti-inflamatórias
como IL10, TGFβ, ou outro tipo de célula T, incluindo células T CD8 com atividade
supressora independente de citocinas (Riet et al. 2007; Jackson et al. 2008).
Em pacientes com filariose, o agravamento da patologia está associado com
deficiência de células Tregs (Allen & Maizels 2011). Durante infecção experimental foi
demonstrado que o parasita H. polygyrus induziu a diferenciação de células Th0 em
linfócitos Tregs ao secretar um produto que se liga aos receptores de TGFβ do
hospedeiro (Maizels et al. 2009).
Apesar da participação de células com fenótipo Th2 ser evidente em infecções
por helmintos intestinais, outras populações de células T CD4 podem expandir durante
essas infecções, e a população de células Th2 podem diminuir ao longo do tempo,
refletindo respostas mistas e constantes competições entre as distintas subpopulações de
linfócitos Th (Allen & Maizels 2011). Desde a criação do paradigma de Th1-Th2, na
década de 1980, muitos tipos de células Th especializados, incluindo Th1, Th2, Th17,
Th9, ThF, e Treg, já foram identificados. Evidências recentes sugerem que sob certas
condições, as células Th CD4 possuem plasticidade, e podem se converter em outros
tipos de células efetoras. Uma ampla variedade de respostas induzidas por parasitas
20
apresentam um padrão de produção de citocinas, derivadas desses subtipos de linfócitos
Th (Wan 2010).
Um perfil de linfócitos Th9 foi descrito em murinos com células produtoras de
grandes quantidades de IL9, citocina importante nas respostas contra parasitas
intestinais. Foi demonstrado também que elas são o resultado da polarização de
linfócitos Th2 estimulados na presença de TGFβ e IL4, e que não apresentam nenhum
dos fatores de transcrição característicos das vias Th1, Th2, Th17 ou Treg. Dependendo
do ambiente de citocinas, essas células também podem ser originadas de células Th0.
Estudos comprovam a participação de células Th9 na resistência à infecção
experimental por Trichuris sp (Veldhoen et al. 2008).
Durante a esquistossomose mansônica murina foi descrito o papel de Th17 e
TGFβ na resistência ao parasita (Tallima et al. 2009). Outros estudos descrevem células
Th17 com participação no agravamento da patologia na esquistossomose em
camundongos (Rutitzky & Stadecker 2006). Estudos mais elaborados da resposta imune
em modelos murinos revelaram que as respostas Th1 são induzidas em vários estágios
da infecção com nematóides intestinais, e a indução seqüencial de Th1 seguida de
respostas Th2 também é um fato bem estabelecido durante a esquistossomose (Helmby
2009). Respostas Th2 durante a esquistossomose experimental podem agravar a
hepatoesplenomegalia (Maizels et al. 2009).
As infecções granulomatosas crônicas estão associados com respostas
inflamatórias do tipo Th1 que se desenvolvem em volta de um microorganismo ou
parasita invasor. Na esquistossomose experimental, o granuloma no início da infecção
é do tipo Th1. Essa resposta Th1 é caracterizada pelo aumento dos níveis de citocinas
pro-inflamatórias, tais como TNFα, IL1, IL6 e IFNγ. Entretanto, ocorre a transição para
uma resposta do tipo Th2 logo após a postura dos ovos, sendo as moléculas coestimulatórias e células B necessárias para esta mudança. A resposta imune
desenvolvida difere conforme a fase de desenvolvimento do parasito. A falha no
desenvolvimento de uma resposta Th2 em função do desenvolvimento de uma resposta
imune com perfil Th1 ou Th17 pode levar a morte do hospedeiro. No entanto, a fibrose
tecidual, que é em grande parte estimulada pela IL13, também pode se tornar patológica
e, portanto, representa uma desvantagem potencial da resposta do tipo Th2 durante a
esquistossomose crônica (Anthony et al. 2007).
Respostas Th1 em infecções por S. mansoni e Fascíola hepática, com a
participação de NO, determinam a eliminação dos parasitas durante as infecções
21
experimentais (Moreau & Chauvin 2010). Mecanismos efetores da resposta Th1 podem
estar implicados na resistência, sendo importantes principalmente na destruição das
larvas que estão migrando nos tecidos do hospedeiro (Jackson et al. 2008). A resposta
Th1 também pode contribuir na expulsão de algumas espécies de helmintos adultos
viáveis por meio da produção de IFNγ, que está relacionada com na geração de CAMs
com produção de ROS e RNS que destroem o parasita (Finkelman et al. 1997). A
produção aumentada de IFNγ é importante para ativar a produção de NO e pode
contribuir para a eliminação de cisticercos de T. crassiceps (Trujillo et al. 2007).
Classicamente, as respostas do tipo Th2/Treg associadas com componentes
celulares e humorais, estão relacionadas com a proteção durante as helmintoses. No
entanto, vários relatos sugerem que esta afirmação não é sempre verdadeira,
principalmente quando os parasitas estão localizados nos tecidos extra-intestinais
(Trujillo et al. 2007). Muitos helmintos migram através dos tecidos epiteliais, tecido
muscular, nos pulmões, e cérebro, onde poucos mecanismos de proteção dependem de
uma resposta tipo Th2 (Mulcahy et al. 2005).
A presença de células TCD8+ durante a esquistossomose experimental parece
relacionada com a redução do tamanho dos granulomas. Foi demonstrado in vivo que a
imunização de camundongos com antígeno do ovo de schistosoma (SEA) é capaz de
estimular a resposta de células TCD8+ esplênicas produtoras de IFNγ e IL2, sugerindo
uma resposta do tipo 1 (Tc1) ao SEA (Pedras-Vasconcelos et al. 1996; Pancrι et al.
1999).
Muitas outras interações potenciais entre imunidade por Th, subpopulações de
células T não CD4 + e células CD19+ ainda têm de ser devidamente exploradas durante
as infecções por helmintos. A expansão de células TCD8+, populações de células NKT
e componentes humorais já foram descritas durantes essas infecções (Mallevaey et al.
2006; Allen & Maizels 2011).
A importância relativa de cada tipo de célula do hospedeiro depende tanto do
tecido em questão como do perfil de susceptibilidade do hospedeiro às infecções (Allen
& Maizels 2011). É evidente que muitos estudos, são conduzidos com base em uma
resposta simplista da resposta imunológica aos helmintos, que tendem a ser geralmente
agrupadas em uma resposta Th2 /Treg, não levando em consideração características
como: as diferentes espécies, nichos biológicos dentro do hospedeiro, e os distintos
estágios da infecção (Helmby 2009).
22
Animais BALB.xid, deficientes em células B1 que conhecidamente secretam
IL10, produzem preferencialmente IFNg. Durante a infecção experimental por L. minor,
foi observado que na ausência de células B1 e baixa produção de anticorpos,
camundongos BALB.xid infectados apresentam baixo nível sérico de IL10 quando
comparados ao camundongos BALB/c infectados, e maior nível sérico de IFNg quando
comparado aos camundongos BALB/c infectados. Essa alta produção de IFNg em
camundongos BALB.xid infectados poderia estar atuando no controle do número de
larvas L3 e no desenvolvimento de lesões pulmonares durante evolução da
lagochilascariose
experimental
(Prudente
et
al.
2009b).
Essa
diferença
de
susceptibilidade à infecção por L. minor entre as linhagens BALB/c e BALB.xid pode
ser decorrente dos perfis diferentes de citocinas e de anticorpos, visto que ambas as
linhagens apresentam o mesmo background genético e MHC (H-2d), diferindo apenas
em uma mutação no gene Btk (Prudente et al. 2009a).
Em estudo anterior do nosso grupo, ao avaliar a resposta imune de camundongos
A/J e B10.A imunizados com EBL3 de L. minor, Spadafora-Ferreira et al. (2010)
demonstraram que linfócitos esplênicos de camundongos A/J imunizados e
posteriormente estimulados com antígenos do extrato bruto (EB) do parasito ou
concanavalina A (ConA) apresentaram uma melhor resposta proliferativa e aumento
significativo na produção de IL10 e IFNγ, quando comparados aos camundongos
B10.A. A produção de IL10 e IFNγ em camundongos A/J na lagochilascariose
experimental poderia controlar as lesões de tecidos e o número de parasitas, limitando o
dano tecidual causado por uma resposta imune antiparasitária exacerbada.
Em outro estudo do nosso grupo, por Freitas et al. (2008) demonstraram uma
reação inflamatória no fígado e baço de camundongos BALB/c e C57BL/ 6 infectados
por L. minor, indicando que o helminto e seus antígenos secretados e excretados (SE)
induzem uma resposta forte e constante, que é mais acentuada em camundongos
C57BL/6. Nos pulmões de camundongos C57BL/6 infectados (45-210 DAI), foram
observadas lesões granulomatosas com muitos neutrófilos. Este infiltrado inflamatório
pode sugerir a participação de IL17 durante a lagochilascariose experimental, tal como
foi demonstrado em camundongos com esquistossomose (Rutitzky et al. 2005).
Nesse mesmo estudo, a análise de citocinas séricas nas linhagens (BALB/c e
C57BL/6) aos 90 DAI, (período com maior número de larvas L3 recuperadas),
demonstrou o aumento das taxas de IL10, porém pequeno, nos animais infectados em
23
relação aos respectivos controles, e isso pode refletir um mecanismo de controle das
lesões inflamatórias, mediado por células Th2 ou Treg. Camundongos BALB/c
(resistentes à infecção por L. minor) apresentaram maior nível sérico de IFNγ. Assim,
células Th1 (e outras) ao produzirem IFNγ durante a infecção poderiam estar atuando na
evolução da lagochilascariose, controlando o número de larvas L3 e permitindo uma
maior taxa de sobrevivência destes animais (Freitas et al. 2008).
Durante a lagochilascariose experimental verificou-se que camundongos
C57BL/6 (linhagem susceptível) produziram IgM, IgA e IgG contra o EB de L. minor.
IgM foi detectada durante todo o período de estudo (15-210 DAI). IgA também foi
detectada no início da infecção, mas com redução após 90 DAI; e IgG foi detectada
somente depois de 60 DAI, possivelmente em decorrência do tempo necessário para a
ativação de linfócitos T e geração de células T de memória e células plasmáticas de
longa vida. Vale lembrar que células B1 que interagem com antígenos que apresentam
epítopos repetidos, em geral produzem grande quantidade de IgM, IgA e IgG3
(Prudente et al. 2009c).
Prudente et al. (2009c) também avaliaram a resposta de anticorpos contra os
antígenos SE do parasita na linhagem C57BL/6. Foi demonstrada uma baixa produção
de anticorpos, visto que IgA e IgM tornaram-se positivas por curto período da infecção,
e IgG foi detectada somente aos 45 DAI. Assim, a linhagem C57BL/6 parece responder
melhor aos antígenos do EB do que aos produtos SE de L. minor (Prudente et al.
2009c).
As imunoglobulinas (IgG, IgM e IgA) produzidas contra os antígenos EB e SE
de L. minor nas linhagens A/J e B10.A foram analisadas por Prudente et al. 2011. Foi
demonstrado que camundongos A/J infectados produzem altos níveis dessas
imunoglobulinas contra os antígenos do parasita, quando comparados a quantidade
produzida por camundongos B10.A infectados, refletindo um mecanismo de resistência
durante a lagochilascariose experimental.
Camundongos BALB.xid apresentam deficiência de linfócitos B1 e, em menor
proporção de células B2. As células B1 constituem uma pequena fração da população de
células B no baço e não são detectados nos LN de camundongos. No entanto,
representam a principal população de células B das cavidades peritoneal e pleural destes
animais (Freitas et al. 2009; Prudente et al. 2009a). Ficou demonstrado que
camundongos BALB/c produziram IgM, IgG, IgA e IgE contra o EB e antígenos SE do
parasito; mas camundongos BALB.xid não produziram IgM, produziram baixos níveis
24
de IgG e IgA, e quantidades semelhantes de IgE. Os anticorpos IgA e IgE foram os
primeiros a tornar-se positivos (30-45 DAI) e permaneceram positivos durante o
período de estudo (210 DAI), indicando a importância da IgA e IgE para a detecção de
infecção recente em camundongos; mas não funcionaram como marcador de
susceptibilidade ou resistência à infecção experimental (Freitas et al. 2009).
Na lagochilascariose experimental as linhagens BALB/c e BALB.xid produzem
quantidades semelhantes de IgE (Freitas et al. 2009) e a linhagem B10.A, linhagem
mais susceptível, produz quantidades maiores de IgE contra os produtos SE de L. minor
que camundongos A/J (Prudente et al. 2011). Diante disso, os níveis de IgE não
demonstram ter papel na susceptibilidade ou resistência à infecção experimental.
As diferenças geneticamente determinadas entre indivíduos de uma população
afetam diretamente a eficácia da resposta imune e, portanto, o fenótipo de
susceptibilidade do hospedeiro (Spadafora-Ferreira et al. 2010). A diferença na
susceptibilidade de diferentes linhagens de camundongos à infecção por L. minor pode
ser influenciada pela resposta imune individual ao parasito (Prudente et al. 2009b).
25
JUSTIFICATIVA
Pouco se sabe a respeito da biologia e do mecanismo da infecção pelo helminto L.
minor e o modelo experimental em camundongos tem sido utilizado no estudo do ciclo
evolutivo do parasita e da patogenia da infecção. A interação parasita-hospedeiro, desde
a manipulação da resposta imune do hospedeiro por antígenos dos helmintos com
indução de distintas células F4/80+, CD4+, CD8+, CD19+ e outras células da
imunidade inata e adaptativa apresentando diferentes marcadores e funcionalidades
podem ser determinantes na susceptibilidade ou resistência de um hospedeiro durante
uma infecção.
Com o intuito de elucidar alguns dos mecanismos envolvidos na patogênese da
lagochilascariose, ainda tão pouco estudados, e compreender melhor os mecanismos
imunopatológicos de resistência ou susceptibilidade à infecção por L. minor, o presente
estudo teve como meta principal avaliar as populações celulares do baço de
camundongos
BALB/c
(resistentes)
e
C57BL/6
(susceptíveis)
durante
a
lagochilascariose experimental. Os trabalhos do grupo da Profa. Mara Carvalhaes são os
primeiros a avaliar a resposta imune nesta helmintose.
26
OBJETIVOS
1 – Objetivo Geral
Avaliar as populações de células esplênicas em camundongos susceptíveis e resistentes
à lagochilascariose experimental.
2 – Objetivos Específicos
a) Avaliar o perfil imunofenotípico (IFT) por imunoistoquímica (IIQ) das células
F4/80+ esplênicas de camundongos BALB/c e C57BL/6 infectados e controles, dos 35
aos 250 dias após infecção (DAI);
b) Avaliar o perfil IFT por IIQ das células CD4+ esplênicas de camundongos BALB/c e
C57BL/6 infectados e controles, dos 35 aos 250 dias após infecção (DAI);
c) Avaliar o perfil IFT por IIQ das células CD8+ esplênicas de camundongos BALB/c e
C57BL/6 infectados e controles, dos 35 aos 250 dias após infecção (DAI);
d) Avaliar o perfil IFT por IIQ das células CD19+ esplênicas de camundongos BALB/c
e C57BL/6 infectados e controles, dos 35 aos 250 dias após infecção (DAI).
27
MATERIAIS E MÉTODOS
1 – Animais e Infecção
Os procedimentos deste projeto foram avaliados e aprovados pelo Comitê de
Ética em Pesquisa Animal do Instituto Butantan de São Paulo (Anexo 1).
Para manutenção do ciclo de L. minor, camundongos C57BL/6 foram utilizados
como hospedeiros intermediários, e gatos domésticos (Felis domesticus) como
hospedeiros definitivos experimentais. A manutenção do ciclo de L. minor nos
camundongos e gatos foi realizada no biotério do IPTSP, pelos bolsistas do Laboratório
de Imunoquímica-IPTSP/UFG (Lucas Rangel, Mariana Felix de Souza Prudente,
Thayssa Dourado). A infecção dos animais e coleta do material para imunoistoquímica
(IHQ) foram realizadas no Instituto Butantan de São Paulo, pelas alunas Mariana F.S.
Prudente e Lara Priscila Guirão, sob orientação da pesquisadora Profa. Dra. Mônica
Spadafora-Ferreira.
1.1 – Obtenção de ovos de L. minor
Felinos foram individualmente alimentados com carcaças de camundongos
C57BL/6 infectados, contendo 50 a 100 nódulos encistados no tecido subcutâneo com
larvas L3 de L. minor. Os ovos do parasita foram colhidos das fezes dos felinos após 30
dias de inoculação e submetidos ao método de Hoffman e Faust (Oliveira et al. 2002).
Estes ovos foram mantidos em tubo de polipropileno contendo solução de formalina a
1%, por 40 dias à temperatura de 25°C. Em seguida, os tubos foram centrifugados 3
vezes em salina tamponada com fosfatos (PBS), retirando-se 3 alíquotas de 1µl para
serem examinadas entre lâmina e lamínula com auxilio de microscópio óptico comum
(aumento de 100X). A concentração de ovos por ml foi calculada sobre o resultado da
média aritmética das contagens. Os ovos foram mantidos em formalina 1%, sendo
lavados e ressuspendidos em PBS para a inoculação. Os ovos foram obtidos pelos
alunos: Lucas Rangel, Mariana F.S. Prudente, Thayssa Dourado.
1.2 – Infecção experimental
Para análise imunoistoquímica, foram utilizados camundongos isogênicos,
machos, das linhagens BALB/c (n=50) e C57BL/6 (n=50), obtidos do Biotério Central
do Instituto Butantan. Os camundongos foram inoculados por gavagem com 1000 ± 200
ovos infectantes do parasito por animal. Grupos de 5 animais foram eutanasiados em
28
câmara de CO2, em diferentes períodos pós-infecção (35, 100, 150 e 250). Igual número
de camundongos não infectados (inoculados com PBS por via oral) foram eutanasiados
no mesmo período, servindo como controles. Realizou-se evisceração e coleta do baço
desses animais, destinados ao congelamento para reação imunoistoquímica. Estes
animais foram inoculados, eutanasiados e seus materiais processados no Biotério do
Laboratório de Imunoquímica, no Instituto Butantan de São Paulo, em estante ventilada,
com caixa, maravalha, água, bebedouro e ração autoclavadas.
2 – Imunoistoquímica (IIQ)
As reações de IIQs foram padronizadas e efetuadas pela equipe da Dra. Mônica
Spadafora-Ferreira do Laboratório de Imunoquímica, Instituto Butantan - São Paulo
com a colaboração da Profa. Dra Mara Carvalhaes, e analisadas no Laboratório de
Imunoquímica-IPTSP-UFG, com a colaboração do Prof. Dr. Ruy Lino Júnior do
Laboratório de Patologia Experimental-IPTSP-UFG.
Para avaliar o perfil imunofenotípico (IFT) por IIQ de células esplênicas,
fragmentos de baço dos diferentes períodos (35, 100, 150 e 250 dias) após a infecção,
foram embebidos em meio de inclusão para congelamento de tecidos (OCT, Aotec),
imersos em isopentano gelado (Vetec, Brasile) e imediatamente congelados em
nitrogênio líquido e posteriormente, armazenados em freezer -80oC. Os fragmentos
foram cortados em criostato e fixados em acetona gelada por 10 minutos, sendo
mantidos congelados a -80 oC. Antes de fazer a incubação com os diferentes anticorpos,
cada lâmina seguiu dois bloqueios de 15 min. O bloqueio da peroxidase endógena foi
feito por tratamento com H2O2 (30 Volumes) a 1/1000 em metanol. Após lavagem com
PBS seguiu-se o bloqueio dos sítios livres com soro normal de cabra. Em seguida, sem
lavar as lâminas, retirou-se o excesso de soro e foram adicionados os anticorpos
diluídos. Estas reações foram efetuadas no Instituto Butantan pelas alunas Lara Guirão e
Mariana F.S. Prudente.
Foram utilizados os seguintes anticorpos de rato para camundongos: anti-F4/80
(clone, A3-1, Serotec, EUA), anti-CD19 (clone 1D3, BD Biosciences), anti-CD4 (clone
H129.19, BD Biosciences), e anti-CD8 (clone 53-6.7, BD Biosciences), não marcados.
Os anticorpos foram diluídos em PBS contendo 2% de soro fetal bovino (SFB),
conforme titulação prévia. Após incubação por 18h (overnight) a 4ºC em câmara úmida,
as lâminas foram lavadas com PBS e posteriormente incubadas com anticorpo
secundário anti-IgG de rato biotinilado (BD Biosciences). A seguir, foi adicionado o
29
complexo ABC-peroxidase (Dako, Dinamarca) por 30 min à t.a. As lâminas foram
reveladas com diaminobenzidina-H2O2 (DAB-BD Biosciences) como cromógeno
precipitante e substrato, e contracoradas com hematoxilina de Mayer (Merck,
Alemanha) (Figura 4).
Figura 4. Esquema ilustrativo de imunoistoquímica, adaptado de: LAPAC 2011.
3 – Quantificação dos subtipos celulares
Em cada ponto da infecção (35, 100, 150 e 250 DAI), foram coletados baços de
cinco camundongos e para cada camundongo fez-se uma lâmina de IIQ (feito pelas
alunas Lara Guirão e Mariana F.S. Prudente). Para cada lâmina foram fotografados 30
campos na objetiva de 40X. As imagens dos campos para quantificação foram
capturadas por meio de uma câmera (Cyber shot DSC-S85) acoplada ao microscópio e
ao computador para digitalização. As fotografias foram efetuadas pela Profa. Mara
Carvalhaes e pelas alunas Thayssa Dourado e Leticia de Almeida Leandro.
A análise e quantificação das células foram realizadas no sistema analisador de
imagens Image J (NIH/EUA). Foram quantificadas as células marcadas positivamente,
nas 30 intersecções da grade em cada um dos 30 campos analisados, e calculada a média
acumulada (Teixeira et al. 2005) (Figura 5). Os resultados foram expressos em mediana
e desvio médio do número de células marcadas por campo. Foi também determinado o
índice de células (IC) marcadas por campo, dividindo-se a média aritmética do número
de células marcadas presentes nos animais infectados (Мcel+Inf), pela média aritmética
do número de células marcadas encontradas nos controles não infectados (Мcel+Cont),
nos diferentes DAI [IC = (Мcel+Inf) / (Мcel+Cont)].
30
Figura 5. Fotografia de um campo de imunoistoquímica representando a quantificação celular nas 30
intersecções da grade. As setas indicam células esplênicas marcadas nas intersecções (aumento de 400X).
No presente trabalho foram selecionados campos de imunoistoquímica
representativos dos valores da mediana obtidos na quantificação celular. Esses campos
foram classificados de acordo com a quantidade de células marcadas para cada
anticorpo (anti-F4/80, anti-CD4, anti-CD8, anti-CD19). Os campos com células
esplênicas F4/80+ foram classificados em quantidade discreta, menos que 4 células;
moderada, entre 4-6 células e acentuada, mais que 6 células. Os campos com células
esplênicas CD4+ foram classificados em quantidade discreta, menos que 3 células;
moderada, entre 3-5 células e acentuada, mais que 5 células. Os campos com células
esplênicas CD8+ foram classificados em quantidade discreta, menos que 3 células;
moderada, entre 3-5 células e acentuada, mais que 5 células. Os campos com células
esplênicas CD19+ foram classificados em quantidade discreta, menos que 6 células;
moderada, entre 6-7 células e acentuada, mais que 7 células (Tabela 1).
31
Tabela 1. Classificação dos campos de imunoistoquímica para os marcadores F4/80, CD4, CD8,
CD19 de acordo com a quantidade de células marcadas.
Marcador
Quantidade
Quantidade
Quantidade
discreta
moderada
acentuada
F4/80
< 4 células marcadas
4-6 células marcadas
> 6 células marcadas
CD4
< 3 células marcadas
3-5 células marcadas
> 5 células marcadas
CD8
< 3 células marcadas
3-5 células marcadas
> 5 células marcadas
CD19
< 6 células marcadas
6-7 células marcadas
> 7 células marcadas
4– Análise Estatística
A análise estatística das contagens de IIQ foi realizada por meio do programa
Prisma 4.0. Todas as variáveis foram testadas quanto à distribuição normal e variância
homogênea. Para análise de uma variável utilizou-se a mediana e desvio médio seguido
de teste Mann Whitney (não paramétrico). Para mais de uma variável: ANOVA seguido
de teste Tukey. As diferenças observadas foram consideradas significantes quando p <
0,05.
32
RESULTADOS
A disponibilidade de linhagens isogênicas de camundongos com diferentes
background genéticos tem contribuído para o estudo da relação parasita-hospedeiro que
é crucial no entendimento da resposta imune aos diversos parasitos. Com o intuito de
caracterizar as populações celulares no baço de camundongos BALB/c e C57BL/6
controles e experimentalmente infectados com L. minor, foi realizada a análise IIQ da
presença de células positivas para os marcadores F4/80 (marcador de macrófagos),
CD19 (marcador de linfócitos B), CD4 (marcador de linfócitos T auxiliares), CD8
(marcador de linfócitos T citolíticos).
1 – Análise imunoistoquímica do baço de camundongos infectados com L. minor
A marcação das células esplênicas nos camundongos BALB/c e C57BL/6 com
os anticorpos de rato anti-F4/80+, CD4+, CD8+ e CD19, seguida de incubação com
conjugado anti-rato e mistura substrato-cromógeno, mostrou-se positiva e específica,
quando comparada ao controle negativo (CN) efetuado sem adição de anticorpos contra
os marcadores. Notar a localização predominante destas células na região da polpa
vermelha para o marcador F4/80 e região folicular da polpa branca do baço para os
outros marcadores (Figura 6).
Figura 6. Imunoistoquímica do baço de camundongos BALB/c infectados, sem anticorpo de marcação
(CN, controle negativo) e com os anticorpos anti-marcadores celulares F4/80, CD4, CD8 e CD19. As setas
apontam para marcação celular localizada na polpa vermelha para o marcador F4/80 e na região folicular da
polpa branca do baço para os marcadores CD4, CD8 e CD19; aumento de 100X.
33
1.1 – Análise quantitativa das células esplênicas F4/80+
Nos animais da linhagem BALB/c não foi observada variação significativa na
quantidade de células esplênicas F4/80+. Nos camundongos da linhagem C57BL/6, aos
100 dias após a infecção, as células F4/80+ nos animais infectados apresentaram
número reduzido de células marcadas por campo em relação aos controles (Controles:
7,0+1,8; Infectados: 4,0+2,0; p< 0,05) e aos 250 dias apresentaram número aumentado
em relação aos controles (Controles: 6,0+1,7; Infectados: 9,0+1,8; p< 0,05). A cinética
desta população celular foi parecida nas duas linhagens de camundongos infectados,
com queda aos 100 dias de infecção, e posterior aumento, dependente do tempo, que foi
mais acentuado nos animais C57BL/6 infectados. Considerando o índice de células
esplênicas F4/80+, a linhagem BALB/c apresentou aumento somente aos 100 DAI (IC =
1,2), enquanto nos animais C57BL/6 houve aumento do índice de células F4/80+ aos
250 DAI (IC = 1,3) (Figura 7).
Na figura 8 são visualizados campos de imunoistoquímica de baços marcados
com o anticorpo anti-F4/80, representativo da quantificação celular aos 100 DAI.
Camundongos BALB/c não infectados apresentaram quantidade discreta de células
marcadas (Figura 8A) e camundongos BALB/c infectados apresentaram quantidade
moderada dessas células (Figura 8B). Para os animais controles da linhagem C57BL/6
foi observada intensa presença de células F4/80+ (Figura 8C) e nos animais C57BL/6
infectados por L. minor foi moderada a presença das mesmas (Figura 8D).
34
F4/80-BALB/c
F4/80-C57BL/6
Controle
Controle
Infectado
17.5
15.0
12.5
10.0
7.5
5.0
2.5
0.0
35
100
150
250
Infectado
20.0
Número de células/campo
Número de células/campo
20.0
17.5
15.0
12.5
*
10.0
*
7.5
5.0
2.5
0.0
35
Dias após infecção
IC
0,9
1,2
0,9
100
150
250
Dias após infecção
1,0
IC
1, 0
0,9
1,0
1,3
Figura 7. Determinação por imunoistoquímica de células F4/80+ no baço dos camundongos BALB/c e
C57BL/6 não infectados (controles- linha fina) ou infectados com 1.000 ovos de Lagochilascaris minor por
via oral (infectados- negrito), em diferentes dias após a infecção. Os resultados foram expressos em
mediana do número de células por campo, com coluna indicando desvio médio, e barra determinando o
valor mínimo e máximo de células marcadas (* p< 0,05, Teste Mann Whitney). IC: Índice de células
F4/80+, considerando a média aritmética do número de células marcadas por campo nos animais infectados
(Мcel+Inf), dividida pela média aritmética do número de células marcadas nos controles não infectados
(Мcel+Cont), nos diferentes dias após a infecção.
Figura 8. Imunoistoquímica com presença de células esplênicas F4/80+. Camundongo BALB/c não
infectado (controle) com quantidade discreta de células marcadas (A); camundongo BALB/c aos 100 dias
após a infecção com quantidade moderada de células F4/80+ (B); camundongo C57BL/6 não infectado
(controle) com quantidade acentuada de células marcadas (C); camundongo C57BL/6 aos 100 dias de
infecção com quantidade moderada de células F4/80+ (D); aumento de 400X.
35
1.2 – Análise quantitativa das células esplênicas CD4+
As células esplênicas CD4+ durante o período de 100 DAI, apresentaram-se
aumentadas nos camundongos BALB/c infectados em relação aos animais controles
(Controles: 2,0+1,5; Infectados: 3,0+1,9; p< 0,05). Na linhagem C57BL/6, foi
observado aumento aos 150 DAI nos animais infectados em relação aos seus controles
(Controles: 4,0+0,8; Infectados: 5,0+1,4; p< 0,05). Nos animais da linhagem BALB/c
infectada a cinética de células CD4+ foi crescente em relação ao tempo; entretanto, os
camundongos da linhagem C57BL/6 infectada apresentaram cinética oscilante dessas
células. O índice de células CD4+ no baço demonstrou que os camundongos da
linhagem C57BL/6 apresentaram aumento aos 150 DAI (IC = 1,4); enquanto nos
animais BALB/c houve aumento do índice dessas células marcadas aos 100 (IC = 1,2) e
250 DAI (IC = 1,3) (Figura 9).
Na figura 10 observam-se os campos de imunoistoquímica com células CD4+
referente aos 100 DAI. Nos tecidos esplênicos de camundongos controles da linhagem
BALB/c visualizou-se quantidade discreta de células marcadas, já os animais infectados
apresentaram quantidade moderada de células CD4+ (Figura 10A, 10B). Nos
camundongos da linhagem C57BL/6 observou-se quantidade moderada de células
CD4+ nos baços de camundongos não infectados e camundongos infectados (Figura
10C, 10D).
36
CD4-C57BL/6
CD4-BALB/c
Controle
Controle
Número de células/campo
Infectado
17.5
15.0
12.5
10.0
*
7.5
5.0
2.5
0.0
35
100
150
Número de células/campo
20.0
20.0
Infectado
17.5
15.0
12.5
10.0
*
7.5
5.0
2.5
0.0
35
250
Dias após infecção
IC
0,9
1,2
0,9
100
150
250
Dias após infecção
1,3
IC
1,0
1,0
1,4
1,0
Figura 9. Determinação por imunoistoquímica de células CD4+ no baço dos camundongos BALB/c e
C57BL/6 não infectados (controles- linha fina) ou infectados com 1.000 ovos de Lagochilascaris minor por
via oral (infectados- negrito), em diferentes dias após a infecção. Os resultados foram expressos em
mediana do número de células por campo, com coluna indicando desvio médio, e barra determinando o
valor mínimo e máximo de células marcadas (* p< 0,05, Teste Mann Whitney). IC: Índice de células
CD4+, considerando a média aritmética do número de células marcadas por campo nos animais infectados
(Мcel+Inf), dividida pela média aritmética do número de células marcadas nos controles não infectados
(Мcel+Cont), nos diferentes dias após a infecção.
Figura 10. Imunoistoquímica com presença de células esplênicas CD4+. Camundongo BALB/c não
infectado (controle) com quantidade discreta de células marcadas (A); camundongo BALB/c aos 100 dias
após a infecção com quantidade moderada de células CD4+ (B); camundongo C57BL/6 não infectado
(controle) com quantidade moderada de células marcadas (C); camundongo C57BL/6 aos 100 dias de
infecção com quantidade moderada de células CD4+ (D); aumento de 400X.
37
1.3 – Análise quantitativa das células esplênicas CD8+
A quantificação das células CD8+ no baço de camundongos BALB/c infectados
apresentou, somente aos 100 DAI, valores acima dos controles (Controles: 0,0+1,0;
Infectados: 1,0+1,2; p< 0,05). Nos camundongos C57BL/6 as células CD8+
apresentaram-se aumentadas em relação aos controles, aos 35 (Controles: 2,0+1,0;
Infectados: 3,0+1,2; p< 0,05) e 150 DAI (Controles: 4,0+1,1; Infectados: 5,0+2,3; p<
0,05). Camundongos BALB/c e C57BL/6 infetados apresentaram cinética semelhante
da quantidade de células esplênicas CD8+; no entanto, camundongos da linhagem
C57BL/6 mostraram maior quantidade de linfócitos TCD8+ esplênicos dos 35 aos 150
dias de infecção, quando comparado aos BALB/c. Considerando o índice de células
CD8+ no baço, os camundongos da linhagem BALB/c apresentaram aumento do índice
de células marcadas aos 35 (IC = 1,1) e 100 DAI (IC = 1,3), enquanto nos animais
C57BL/6 houve aumento índice dessas células aos 35 (IC = 1,2), 150 (IC = 1,5) e 250
dias (IC = 1,1) pós-infecção (Figura 11).
Os campos de imunoistoquímica na figura 12 mostram células CD8+ referente
aos 35 DAI. Nos camundongos não infectados e infectados da linhagem BALB/c, foi
visualizado quantidade discreta de células CD8+ esplênicas (Figura 12A, 12B). Nos
tecidos esplênicos de camundongos controles da linhagem C57BL/6 visualizou-se
quantidade discreta de células marcadas, já os animais infectados apresentaram
quantidade moderada de células CD8+ (Figura 12C, 12D).
38
CD8-BALB/c
CD8-C57BL/6
Número de células/campo
20.0
Infectado
17.5
15.0
12.5
10.0
7.5
*
5.0
2.5
0.0
35
100
150
Número de células/campo
Controle
20.0
Controle
17.5
Infectado
15.0
12.5
10.0
*
7.5
5.0
*
2.5
0.0
35
250
IC
1,1
1,3
1,0
100
150
250
Dias após infecção
Dias após infecção
0,9
IC
1,2
0,9
1,5
1,1
Figura 11. Determinação por imunoistoquímica de células CD8+ no baço dos camundongos BALB/c e
C57BL/6 não infectados (controles- linha fina) ou infectados com 1.000 ovos de Lagochilascaris minor por
via oral (infectados- negrito), em diferentes dias após a infecção. Os resultados foram expressos em
mediana do número de células por campo, com coluna indicando desvio médio, e barra determinando o
valor mínimo e máximo de células marcadas (* p< 0,05, Teste Mann Whitney). IC: Índice de células
CD8+, considerando a média aritmética do número de células marcadas por campo nos animais infectados
(Мcel+Inf), dividida pela média aritmética do número de células marcadas nos controles não infectados
(Мcel+Cont), nos diferentes dias após a infecção.
Figura 12. Imunoistoquímica com presença de células esplênicas CD8+. Camundongo BALB/c não
infectado (controle) com quantidade discreta de células marcadas (A); camundongo BALB/c aos 35 dias
após a infecção com quantidade discreta de células CD8+ (B); camundongo C57BL/6 não infectado
(controle) com quantidade discreta de células marcadas (C); camundongo C57BL/6 aos 35 dias de infecção
com quantidade moderada de células CD8+ (D); aumento de 400X.
39
1.4 – Análise quantitativa das células esplênicas CD19+
O número de células CD19+ no baço de camundongos BALB/c infectados
estava aumentado aos 100 (Infectados: 4,0+2,4; Controles: 5,0+1,8; p< 0,05), 150
(Controles: 5,0+1,5; Infectados: 7,0+2,0; p< 0,05) e 250 DAI (Controles: 4,0+1,9;
Infectados: 6,0+2,0; p< 0,05) em relação aos animais controles. Aos 250 DAI na
linhagem C57BL/6, o número das células CD19+ estava aumentado em relação aos
controles (Controles: 5,0+1,0; Infectados: 9,0+1,8; p< 0,05). A cinética do número de
células CD19+ nas duas linhagens de camundongos infetados foi diferente, pois nos
animais BALB/c observamos aumento gradativo desta população celular até os 150
DAI e posterior queda, e na linhagem C57BL/6 uma cinética oscilante nos diferentes
dias de infecção. Verificou-se aumento do índice de células CD19+ aos 100 (IC = 1,2),
150 (IC = 1,3) e 250 DAI (IC = 1,6) nos camundongos BALB/c e aos 150 (IC = 1,1) e
250 DAI (IC = 1,1) nos camundongos da linhagem C57BL/6 (Figura 13).
Na figura 14 são apresentados campos de imunoistoquímica de baço com células
CD19+ aos 150 DAI. Camundongos BALB/c não infectados apresentaram quantidade
discreta de células marcadas (Figura 14A) e camundongo BALB/c infectados
apresentaram quantidade moderada dessas células (Figura 14B). Observou-se
quantidade acentuada de células CD19+ esplênicas nos camundongos não infectados e
infectados da linhagem C57BL/6 (Figura 14C, 14D).
40
CD19- C57BL/6
CD19- BALB/c
Infectado
17.5
15.0
12.5
*
10.0
*
7.5
*
5.0
2.5
0.0
35
100
150
Número de células/campo
20.0
20.0
Número de células/campo
Controle
Controle
Infectado
17.5
15.0
12.5
*
10.0
7.5
5.0
2.5
0.0
35
250
Dias após infecção
IC
1,0
1,2
1,3
100
150
250
Dias após infecção
1,6
IC
1,0
0,9
1,1
1,1
Figura 13. Determinação por imunoistoquímica de células CD19+ no baço dos camundongos BALB/c e
C57BL/6 não infectados (controles- linha fina) ou infectados com 1.000 ovos de Lagochilascaris minor por
via oral (infectados- negrito), em diferentes dias após a infecção. Os resultados foram expressos em
mediana do número de células por campo, com coluna indicando desvio médio, e barra determinando o
valor mínimo e máximo de células marcadas (* p< 0,05, Teste Mann Whitney). IC: Índice de células
CD19+, considerando a média aritmética do número de células marcadas por campo nos animais infectados
(Мcel+Inf), dividida pela média aritmética do número de células marcadas nos controles não infectados
(Мcel+Cont), nos diferentes dias após a infecção.
Figura 14. Imunoistoquímica com presença de células esplênicas CD19+. Camundongo BALB/c não
infectado (controle) com quantidade discreta de células marcadas (A); camundongo BALB/c aos 150 dias
após a infecção com quantidade moderada de células CD19+ (B); camundongo C57BL/6 não infectado
(controle) com quantidade acentuada de células marcadas (C); camundongo C57BL/6 aos 150 dias de
infecção com quantidade acentuada de células CD19+ (D); aumento de 400X.
41
DISCUSSÃO
Em estudo anterior do grupo foi demonstrado que camundongos da linhagem
C57BL/6 são mais susceptíveis à infecção por L. minor do que os da linhagem BALB/c,
com diferenças histopatológicas importantes (Freitas et al. 2008). Posteriormente foi
mostrado que esplenócitos de camundongos imunizados com antígenos de L. minor
respondem a estes e produzem IFNg e IL-10 (Spadafora-Ferreira et al. 2010). A
caracterização IFT das células presentes no baço por IIQ, mostrou que a infecção por L.
minor envolve diferentes populações celulares.
A disposição anatômica das células apresentadoras de antígenos (APCs),
células B e células T da polpa branca do baço promove as interações necessárias para o
desenvolvimento eficiente de respostas imunes. A MZ do baço recebe parte do fluxo
sanguíneo que entra neste órgão e antígenos são liberados para este local por DCs
circulantes ou são capturados por macrófagos da zona marginal (MZM) que apresentam
alta capacidade fagocítica. Os macrófagos metalófilos marginais (MMM), com menor
capacidade fagocítica, estão localizados no lado interno da MZ (Aichele et al. 2003;
Nolte et al. 2004; Mebius & Kraal 2005).
MZM foram descritos primeiramente por sua capacidade de reter e interiorizar
haptenos polissacarídicos. São caracterizados pela expressão de CR3 (receptor
heterodimérico para os produtos de clivagem do C3) em abundância; enquanto que
macrófagos da polpa vermelha são desprovidos de CR3. Receptores scavenger I e II,
CD36 e receptor de manose também são expressos nos MZM. MZM e MMM são
F4/80-, enquanto que macrófagos da polpa vermelha são F4/80+. Macrófagos da polpa
vermelha removem auto-antígenos e fagocitam eritrócitos (Nolte et al. 2004; Mebius &
Kraal 2005;Van den Berg & Kraal 2005).
Aos 100 dias pós-infecção, na linhagem C57BL/6 os animais infectados
apresentaram número reduzido de células F4/80+ em relação aos controles, enquanto na
linhagem BALB/c apesar de não significativo observou-se um aumento destas células
nos animais infectados em relação aos controles no mesmo período.
Resultados publicados anteriormente mostraram que aos 90 dias na
lagochilascariose experimental, camundongos BALB/c apresentaram lesões pulmonares
menos intensas e um menor número de nódulos subcutâneos contendo larvas L3
encistadas em relação à linhagem C57BL/6 (Freitas et al. 2008). Como no presente
estudo, camundongos BALB/c, linhagem mais resistente a infecção, apresentaram
42
aumento de células F4/80+ aos 100 DAI, sugerimos um papel importante dessas células
na resistência à infecção por L. minor.
Kurotaki et al. (2010) em estudo com população purificada de macrófagos
com fenótipo F4/80(hi)Mac-1(low) residentes da polpa vermelha no baço de
camundongos, demonstraram que essas células produzem citocinas imunossupressoras
como TGFβ e IL10 e induzem a diferenciação de linfócitos Th0 em Tregs
CD4+Foxp3+. Os autores sugerem que esta subpopulação pode atuar na homeostase
imune periférica.
As células F4/80+ no baço dos animais BALB/c infectados apresentaram
aumento do índice aos 100 DAI e nos animais C57BL/6 aos 250 DAI. O anticorpo
monoclonal F4/80 tem sido amplamente utilizado como um marcador para macrófagos
de camundongos (Van den Berg & Kraal 2005). A molécula F4/80 é expressa em vários
subgrupos de macrófagos, incluindo células de Kupffer do fígado, macrófagos
residentes da medula óssea, macrófagos da região cortical do timo, macrófagos da polpa
vermelha, macrófagos da região medular de LNs e células da microglia no cérebro.
Baixa expressão de F4/80 pode ser encontrada em monócitos, e determinados
subconjuntos de macrófagos maduros, incluindo aqueles das áreas de células T dos
tecidos linfóides secundários. Células de Langerhans e algumas DCs mielóides CD8-,
são F4/80+, muito embora a expressão de F4/80 aparentemente seja reduzida com a
interiorização do Ag e a migração para o tecido linfóide, visto que DCs maduras das
zonas de células T não expressam níveis detectáveis desse marcador. Existem
evidências de que eosinófilos apresentam o marcador F4/80+ (Van den Berg & Kraal
2005).
No baço, particularmente os macrófagos da polpa vermelha apresentam o
marcador F4/80+, mas também devemos considerar que macrófagos residentes com
diferentes características fenotípicas e funcionais, e seus precursores no sangue, os
monócitos que infiltram os tecidos, podem estar respondendo ao L. minor durante a
infecção. Assim, fica clara a importância dos macrófagos na lagochilascariose
experimental, no sentido de possivelmente direcionar as respostas imunes inata ou
adquirida, para: produção de citocinas pro-inflamatórias com ativação de PMNN,
citocinas regulatórias, que modulem a inflamação exacerbada; e para citocinas que
auxiliem na diferenciação dos diferentes perfis de linfócitos CD4+. Para investigar o
possível papel das células F4/80+ na evolução da infecção experimental por L. minor,
seria necessária a investigação de outros marcadores celulares como CD11, CD68,
43
Foxp3, Gr1, MR, CD68, CD301, e analisar diferencialmente a presença dessas células
em regiões específicas do baço como polpa branca e vermelha do baço, e zona marginal
e outros órgãos.
Os helmintos possuem vários carboidratos, lipídeos e glicoproteínas na
superfície, e produtos que podem ser excretados ou secretados, e que têm um importante
papel na regulação da resposta imune (Hewitson et al. 2009). Estes constituintes de
patógenos são capazes de direcionar a ativação de macrófagos para um perfil CAMs, via
TLR-2, 4, 5, 6 e 11, induzindo a produção de IL1, 6 e TNFα (Medeiros et al. 2010,
Kogiso et al. 2011). Entre os constituintes de L. minor, já foram descritas uma molécula
LPS-like, quitina, e glicoproteínas ricas em manose (Silva et al. 2008, Carvalhaes 2002;
Carvalhaes et al. 2008). A quitina é um polímero de N-acetilglicosamina, que, depois da
celulose, é o segundo polissacarídeo mais abundante na natureza e está presente em
fungos, insetos e parasitas sendo encontrada na bainha de microfilárias e no ovo de
nematódeos, incluindo L. minor. É um PAMP que regula a produção de IL17 e a
expressão do receptor para IL17A (IL17AR) por macrófagos murinos in vitro, e
induzem inflamação aguda in vivo com produção de IL12p/40, IL23 e TNF por
macrófagos, através de uma via que depende de TLR-2 e MyD88. Estudos in vitro
demonstram que a quitina também induz respostas inflamatórias agudas ricas em
neutrófilos (Silva et al. 2008).
A heterogeneidade de antígenos e produtos SE de helmintos influenciam a
ativação de macrófagos e o perfil de células TCD4+ (Th1, Th2, Th17, Treg), associado
com uma variedade de moléculas co-estimulatórias e citocinas (Noel et al. 2004). A
maior detecção de IFNg no soro dos camundongos BALB/c observada por Freitas et al.
(2008) sugere a participação de células Th1. Por outro lado, a presença de neutrófilos
nas lesões granulomatosas observada na linhagem C57BL/6 sugere a participação de
células Th17 nesta linhagem.
A análise por IIQ do índice de células esplênicas CD4+ neste trabalho
demonstrou que camundongos BALB/c infectados apresentaram aumento significativo
na quantidade dessas células aos 100 e 250 DAI, enquanto que camundongos C57BL/6
apresentaram aumento de células esplênicas CD4+ somente aos 150 DAI. Deve-se
ressaltar que camundongos BALB/c apresentam maior percentagem no baço de células
CD4+ (20,8%) em relação aos camundongos C57BL/6 (13,6%) (The Jackson
Laboratory 2011) isso pode favorecer o aumento dessas células na linhagem BALB/c.
A molécula CD4 é uma glicoproteína de superfície celular que funciona como
44
co-receptor importante na ativação das células T induzida pelos antígenos restritos ao
MHC-II, sendo expressa em linfócitos T maduros que apresentam receptores TCRαβ
(Gaubin et al. 1996). A modulação de diferentes subpopulações de linfócitos CD4+ foi
observada em muitos modelos experimentais de helmintoses (Noël et al. 2004).
Uma resposta Th2 não está necessariamente sempre associada à resistência
durante uma helmintose, mas pode significar uma resposta favorável ao parasita e estar
associada a um aumento na susceptibilidade de camundongos infectados por helmintos
que se localizam em tecidos fora do intestino. A resposta Th1 parece estar envolvida na
resistência de camundongos A/J à lagochilascariose experimental, visto que linfócitos
esplênicos dos animais infectados, estimulados com o EB do parasita ou ConA,
apresentaram maior produção de IFNγ em relação aos camundongos susceptíveis, da
linhagem B10.A (Spadafora-Ferreira et al. 2010). De forma semelhante, RodriguezSosa et al. (2004) observaram nos estágios iniciais da infecção experimental por
cisticerco de T. crassiceps, que células esplênicas de camundongos ao serem
estimuladas com ConA produzem preferencialmente citocinas do perfil Th1, e isto está
associado a uma maior destruição do parasito e uma carga parasitária baixa.
Na lagochilascariose experimental, Dias et al. (2011) descrevem nos
camundongos A/J (resistentes) aumento na produção de IFNγ, TNFα e IL10 em
relação aos animais B10.A (susceptíveis), após 30-60 dias de infecção. Nesse mesmo
período não foi detectada diferença significativa na produção de IL-4 entre os animais
infectados. Chamamos atenção para a ausência de polarização de uma resposta do tipo
Th2 associada com a resistência ou susceptibilidade na infecção por L. minor.
Em estudo realizado por Amri et al. (2007) com células mononucleares do
sangue periférico (PBMCs) de pacientes com hidatidose incubadas com IFNγ e em cocultura com a forma larval de Echinococcus granulosus indicaram que uma provável
resposta Th1 fosse eficaz na eliminação do parasita.
A participação de células Treg (CD4+CD25+ ou CD4+CD25+Foxp3+) na
infecção por helmintos foi mostrada em diferentes modelos experimentais, e aparece
vinculada à indução de um estado de imunossupressão que piora a evolução da
infecção; e outras vezes, regula as lesões induzidas durante a infecção (Finney 2007;
McSorley 2008). Na esquistossomose experimental murina, em camundongos TLR3-/foi observada redução de citocinas e quimiocinas ligadas à resposta Th1 e maior
quantidade de células T CD4+CD25+pulmonares, que parecem estar relacionadas com a
resistência à infecção (Joshi et al. 2008).
45
No presente estudo, encontramos preferencialmente um aumento de células
CD4+ na linhagem BALB/c. As células CD4+ esplênicas detectadas podem ser células
residentes do baço ou linfócitos que chegam da corrente sanguínea para a MZ. Freitas et
al. (2008) detectaram nessa linhagem aumento de IFNγ e IL10 no soro. Não podemos
excluir a ativação de células TCD4+ com fenótipo Th1, Treg, Tγδ, NK, NKT, durante a
infecção.
Também foi observado durante infecção experimental por L. minor, alta
produção de IL17 nos camundongos B10.A, associada à susceptibilidade desta
linhagem (Dias et al. 2011). IL17A e IL17F são duas das várias citocinas produzidas
por células Th17 que são capazes de induzir indiretamente o recrutamento de neutrófilos
(Pelletier et al. 2010), e PMNN estão presentes em grande quantidade nas lesões
pulmonares de camundongos B10.A e C57BL/6, susceptíveis a infecção experimental
por L. minor (Prudente et al. 2009a).
Além de células CD4+ serem produtoras de IL17, os linfócitos Tγδ e células
NKT também podem ser fontes de IL17 (Roark et al. 2008). No modelo de
neurocisticercose experimental com Mesocestoides corti observou-se a produção de
citocinas do tipo Th1 no SNC, e do tipo Th2 no sangue periférico. Fato interessante foi
que
neste
modelo,
células
Tγδ
predominaram
no
infiltrado
inflamatório
extraparenquimal (Cardona et al. 1999).
Outras células como as NK e NKT também podem ser ativadas durante
infecções helmínticas. Estudos demonstram que a incubação do produto SE de N.
americanus com células NK esplênicas de camundongos estimulou o aumento de IFNγ
dependente da presença de IL2 e IL12 (Hsieh et al. 2004). A expansão de células iNKT
in vivo induzida por SEA de S. mansoni foi descrita por Zaccone et al. (2007). Células
NKT invariantes (iNKT) reconhecem glicolipídeos apresentados por CD1d, podendo
secretar citocinas como: IL2, IL4, IL5, IL13, IFNγ, TNFα e fator estimulante de
colônias de granulócitos e macrófagos (GM-CSF).
A avaliação de células CD8+ ao longo da infecção experimental por L. minor,
demonstrou que camundongos da linhagem BALB/c apresentaram aumento do índice
de células aos 35 DAI e aumento significativo aos 100 DAI de forma semelhante aos
achados para CD4+; no entanto, camundongos C57BL/6 apresentaram aumento do
índice de células esplênicas CD8+ aos 35, 150 e 250 DAI.
A molécula CD8 é uma glicoproteína expressa em células hematopoiéticas que
pode estar presente em duas diferentes configurações, CD8αβ e CD8αα. A primeira atua
46
como co-receptor do TCR e é expressa de maneira constitutiva em linfócitos T restritos
por moléculas do MHC-I. Já a isoforma CD8αα pode ser expressa de maneira transitória
ou permanente em diferentes linhagens de linfócitos T, independentemente da restrição
pelo MHC ou da presença de co-receptores convencionais. A expressão de CD8αα já foi
descrita em linfócitos Tγδ (Cheroutre & Lambolez 2008), e células Tγδ já foram
descritas em helmintoses, podendo ser produtoras de IFNγ ou IL17 (Hogg et al. 2009;
Neves et al. 2010. Ribot et al. 2009).
A molécula CD8 também pode estar expressa nas células dendríticas. Segundo
Kushwah & Hu (2011), DCs linfóides são encontradas em órgãos linfóides como o baço
e são divididas de acordo com a expressão variada de CD4 e CD8. Subconjuntos de
DCs linfóides incluem DCsCD8-CD4-, DCsCD8-CD4+ e DCsCD8+CD4+. DCs CD8+
podem ser observadas nas áreas de células T dos tecidos linfóides e DCsCD8- são
encontrados no interior das MZs de tecidos linfóides e somente migram para as áreas de
células T após estimulação. DCsCD8+são potentes indutores de resposta de células
TCD8 à antígenos exógenos, enquanto que DCsCD8- são indutores de uma resposta
TCD4+.
Diante disso, é importante estudarmos futuramente a participação de linfócitos
TCD8+, não citolíticos, através da produção de citocinas pró-inflamatórias e
regulatórias durante o curso da infecção por L. minor. O aumento preferencial dessas
células nos camundongos da linhagem C57BL/6 parece estar associado com a
susceptibilidade à lagochilascariose experimental.
A participação de células CD8+ também foi estudada em outras infecções por
helmintos. Humphreys et al. (2004) descreveram uma grande quantidade de células
TCD8+ produtoras de IFNγ nos linfonodos mesentéricos e mucosa cecal, e associaram
tal fato a susceptibilidade de camundongos na infecção crônica por T. muris. Metwali et
al. (2006) demonstraram que H. polygyrus induz células TCD8+ na mucosa intestinal de
camundongos, as quais inibem a proliferação de células T. Neste mesmo estudo, as
células TCD8+ reverteram o quadro de colite induzida em camundongos Rag-/- -
(deficientes em células T e B) reconstituídos com células T IL10 / .
Em humanos com helmintoses a imunofenotipagem por citometria de fluxo
demonstrou decréscimo de células TCD4+ e aumento de células TCD8+ no sangue
periférico associada com a cronicidade das infecções (Kalinkovich et al. 1998). A
ativação de linfócitos TCD8+ também foi relatada em pacientes com equinococose
47
alveolar (EA). Pacientes com EA crônica que apresentavam lesão hepática exibiram um
aumento da ativação dessas células no sangue periférico quando comparado aos
pacientes com EA sem lesões e controles saudáveis. A ativação policlonal de células
CD8+ nesses pacientes sugeriu uma hiporeatividade aos antígenos persistentes, estando
associada com a cronicidade da doença (Manfras et al. 2002).
No baço de camundongos BALB/c infectados por L. minor foram detectados
aumento na quantidade de células CD19+ dos 100 aos 250 dias após a infecção quando
comparados aos animais controles. Observamos no grupo infectado aumento gradativo
desta população celular esplênica até os 150 DAI e posterior queda. Na linhagem de
camundongos C57BL/6 infectados por L. minor, somente aos 250 DAI, observou-se
aumento significativo na porcentagem de células CD19+ em relação ao grupo controle.
Esses resultados são condizentes com a análise dos índices celulares, visto que
camundongos da linhagem BALB/c apresentaram aumento dessas células CD19+ aos
100, 150 e aos 250 DAI, enquanto que a linhagem susceptível C57BL/6 apresentou
discreto aumento nos índices celulares aos 150 e 250 DAI. Assim podemos concluir que
camundongos da linhagem BALB/c apresentaram aumento preferencial de células
CD19+.
As principais populações de linfócitos B efetores do baço são os linfócitos B
foliculares (FCB) e os MZB. Os FCB atuam na geração de Bm e plasmócitos por meio da
resposta humoral timo dependente (TD). Os MZB geram as chamadas respostas humorais
timo independentes (TI), podendo responder avidamente a estímulos antigênicos e se
diferenciarem em células secretoras de anticorpos sem a necessidade de auxilio de
linfócitos T. MZB também medeiam o transporte de antígenos dos imunocomplexos para
os folículos esplênicos (Aichele et al. 2003; Allman & Pillai 2008). Fenotipicamente,
estes linfócitos são muito semelhantes aos linfócitos convencionais, sendo classificadas
também no grupo de linfócitos B2 (Allman & Pillai 2008). Células MZB são
fenotipicamente CD19
mid
, CD1dhi, CD23-, CD43-, IgMhi, IgDlow, CD5-, CD21hi e
constituem 15% das células B esplênicas. Já as células FCB apresentam um fenótipo
mid
CD19
, CD1dhi, CD23+, CD43-, IgMlow, IgDhi, CD5- e constituem mais de 70% das
células B esplênicas (Baumgarth et al. 2011).
Além de linfócitos B foliculares e linfócitos B da zona marginal, os linfócitos B
naives (B0) que são fenotipicamente IgM+, IgD+, CD23+,CD21+, CD19+ migram para o
baço. A diferenciação dessas células em Bm e plasmócitos ocorre no centro germinativo,
48
após os processos de proliferação, hipermutação somática dos genes da região variável
(V) de imunoglobulina e troca de classes. Sinais de linfócitos Th através da interação
CD40L-CD40 e produção de citocinas são essenciais nessa troca de isótipos de Ig durante
respostas TD (Cariappa & Pillai 2002).
Os linfócitos B1, que se localizam predominantemente nas cavidades pleurais e
peritoneais, também representam uma subpopulação minoritária de células B esplênicas
(Lundy & Boros 2002; Allman & Pillai 2008). Camundongos congenitamente asplênicos
ou esplenectomizados apresentam redução de células B1 e de IgM contra Ags
polissacarídicos de bactérias, indicando que o baço também apresenta um papel na
geração e manutenção de linfócitos B1 (Wardemann et al. 2002).
Linfócitos B1a são CD19hi, CD23-, CD43+, B220lo, CD11b+, IgMhi, IgD(variable),
CD1dmid, CD5+, constituindo cerca de 2 % das células B esplênicas. Células B1b
constituem menos de 1%, e diferem dos linfócitos B1a pela ausência do marcador CD5.
Diferente de linfócitos B2, linfócitos B1 não sofrem mutação somática, não requerem
auxílio de linfócitos T e produzem anticorpos de baixa afinidade que incluem IgM, IgA e
IgG3, sendo responsáveis pela produção da maior parte das IgMs naturais. Juntos, MZB e
linfócitos B1 fazem parte das chamadas repostas de memória natural, pois geram
rapidamente células efetoras nos estágios iniciais da resposta imune (Zaccone et al. 2007;
Allman & Pillai 2008; Baumgarth et al. 2011).
Diante disso sugerimos que as células CD19+ quantificadas no baço incluem
na sua maioria os linfócitos B foliculares e da zona marginal, não excluindo a
possibilidade de parte destes serem linfócitos B1. Os resultados aqui apresentados
sugerem que a maior quantidade de células CD19+ no baço de camundongos BALB/c
possa estar associada com funcionalidade dessas células e melhor produção de
anticorpos que participam na resistência a infecção por L. minor. Destacamos que este é
o primeiro trabalho que avalia a participação de células F4/80+, CD4+, CD8+ e CD19+
esplênicas durante a infecção experimental por L. minor.
49
CONCLUSÕES
·
Os camundongos BALB/c, mais resistentes a lagochilascariose experimental,
apresentaram aumento preferencial de células CD4+ e CD19+ esplênicas; já os
C57BL/6, mais susceptíveis exibiram aumento preferencial de células CD8+
esplênicas.
·
Os camundongos da linhagem BALB/c apresentaram aumento dos índices de células
F4/80+ aos 100 DAI e a linhagem C57BL/6 aos 250 DAI.
·
Os camundongos da linhagem BALB/c apresentaram aumento dos índices de células
CD4+ aos 100 e 250 DAI e a linhagem C57BL/6 aos 150 DAI.
·
Camundongos BALB/c apresentaram aumento dos índices de células CD8+ aos 35 e
100 DAI, enquanto que os camundongos C57BL/6 aos 35,150 e 250 DAI.
·
Camundongos BALB/c apresentaram aumento dos índices de células CD19+ aos
100, 150 e 250 DAI, enquanto que camundongos C57BL/6 aos 150 e 250 DAI.
·
Camundongos BALB/c apresentaram aumento no índice celular para todos os
marcadores aos 100 DAI.
50
CONSIDERAÇÕES FINAIS
Diante dos resultados encontrados, neste e em outros trabalhos do grupo da Profa.
Mara Carvalhaes sugere-se que PAMP’s como quitina, LPS-Like, glicoproteínas ricas em
manose e antígenos presentes nos produtos SE e EB de L. minor, estejam envolvidos na
modulação da resposta imune, e consequentemente na indução das diferentes populações
celulares descritas, (F4/80+, CD4+, CD8+, CD19+), durante o curso da infecção (Figura
15).
Figura 15. Esquema representativo da interação das populações celulares F4/80+, CD4+, CD8+, CD19+
durante a lagochilascariose experimental. Os camundongos da linhagem BALB/c apresentaram aumento
preferencial de células CD4+ e CD19+. Já os camundongos da linhagem C57BL/6 mostraram aumento
preferencial de células CD8+.
Diante disto sugerimos que a resistência à infecção por L. minor, na linhagem
BALB/c pode estar relacionada com aumento preferencial de células CD4+, células
CD19+ esplênicas. Vale destacar que as populações F4/80+, CD4+, CD8+, CD19+
esplênicas exibiram índices celulares aumentados aos 100 DAI nos camundongos
BALB/c, período em que estes apresentam lesões pulmonares menos intensas e menor
51
número de nódulos subcutâneos contendo larvas L3 encistadas em relação à linhagem
C57BL/6 (Freitas et al.2008). A interação celular com a produção de citocinas como
IFNγ e IL10 por células CD4+ dos perfis Th1 e Treg e o aumento de células CD19+
associada à produção de anticorpos IgG, IgA e IgM (Prudente et al. 2009b, 2009c, 2011),
contra o EB e os produtos SE do parasita, na linhagem BALB/c, mais resistente à
infecção por L. minor, devem contribuir na melhor evolução da infecção.
Sugerimos que o aumento de células CD8+ esplênicas esteja associado com
susceptibilidade durante a infecção experimental por L. minor nos camundongos
C57BL/6. É possível que células CD4+ do perfil Th17, células CD8+ e produção de
IL17 induzidas pela quitina e outros antígenos presentes ou secretadas por larvas L3
estejam associadas à presença de intenso processo inflamatório com recrutamento de
PMNN nas lesões pulmonares de camundongos C57BL/6.
52
REFERÊNCIAS BIBLIOGRÁFICAS 1
1 Referências bibliográficas de acordo com as normas da revista Memórias do Instituto Oswaldo
Cruz.
Ahmed SF, Oswald IP, Caspar P, Hieny S, Keefer L, Sher A, James SL 1997.
Developmental differences determine larval susceptibility to nitric oxide-mediated
killing in a murine model of vaccination against Schistosoma mansoni. Infect Immun
65: 219-226.
Aichele P, Zinke J, Grode L, Schwendener RA, Kaufmann SHE, Seiler P 2003.
Macrophages of the splenic marginal zone are essential for trapping of blood-borne
particulate antigen but dispensable for induction of specific T cell responses.
J Immunol 171: 1148-1155.
Allen JE & Maizels RM 2011. Diversity and dialogue in immunity to helminths.
Nature Rev Immunol 11:375-388.
Allman D & Pillai S 2008. Peripheral B cell subsets. Curr Opin Immunol 20: 149157.
Amri M, Aissa SA, Belguendouz H, Mezioug D, Touil-Boukoffa 2007. In vitro
antihydatic action of IFN-gamma is dependent on the nitric oxide pathway. J
Interferon Cytok Res 27: 781-787.
Anthony RM, Rutitzky LI, Urban Jr JF, Stadecker MJ, Gause WC 2007. Protective
immune mechanisms in helminth infection. Nat Rev Immunol 7: 975-987.
Artigas PT, Araújo P, Romiti N, Ruivo M 1968. Sobre um caso de parasitismo
humano por Lagochilascaris minor Leiper, 1909, no Estado de São Paulo, Brasil.
Rev Inst Med Trop S Paulo 10: 78-83.
Austyn JM & Gordon S 1981. F4/80, a monoclonal antibody directed specifically
against the mouse macrophage. Eur. J. Immunol 11, 805.
Baracat DA, Freire EL, Aquino JL 1984. Oto-mastoidite crônica por
Lagochilascaris minor com comprometimento da região temporo-parieto-occipital.
Rev Univ Fed Mato Grosso 2: 9-14.
Barbosa CAL & Campos DMB 2001. Avaliação da eficácia terapêutica da
ivermectina sobre larvas de quarto estádio de Lagochilascaris minor em gatos
infectados experimentalmente. Rev da Soc Bras Med Trop 34: 373-376.
Barbosa AP, Caldeira NM, Filho JS, Santos MJ, Ferreira A, Guimarães R, Dutra F,
Marques S, Barbosa CAL, Guilardi A, Teixeira KIS, Santana J, Campos DMB
2005. Lagochilascaríase com envolvimento do sistema nervoso central e coluna
cervical. Rev Soc Bras Med Trop 38: 466-466.
53
Barbosa CAL, Barbosa AP, Campos DMB 2005. Gato doméstico (Felis catus
domesticus) como possível reservatório de Lagochilascaris minor Leiper, 1909. Rev
Patol Trop 34: 205-211.
Baumgarth N 2011. The double life of a B-1 cell: self-reactivity selects for
protective effector functions. Nat Rev Immunol 11: 34-46.
Berland R & Wortis HH 2002. Origins and functions of B-1 cells with notes on the
role of CD5. Annu Rev Immunol 20: 253-300.
Bruijning CFA, 1957. Notes on Lagochilascaris minor Leiper, 1909. Doc Med
Geogr Trop 9: 173-175.
Cadman ET & Lawrence RA 2010. Granulocytes: effector cells or
immunomodulators in the immune response to helminth infection? Parasite
Immunol 32:1-19.
Campos DMB, Koma MD, Barbosa W, Santos MAQ, Pinto RNL, Bracélos M,
Carneiro JR 1987. Notas parasitológicas sobre Lagochilascaríase humana em Goiás.
Rev Patol Trop 16: 129-142.
Campos DMB, Freire Filha LG, Vieira MA, Paçô JM, Maia MA 1992.
Experimental life cycle of Lagochilascaris minor Leiper, 1909. Rev Inst Med Trop
S.Paulo 34: 277-287.
Campos DMB, Santos ER, Paçô JM, Souza MA 1995. Lagochilascaríase humana.
Registro de um novo caso procedente do sul do Pará. Rev Patol Trop 24: 313-313.
Campos DMB 2005, Lagochilascaris. In: David PN(ed) Parasitologia humana.
11ªedição. Atheneu, São Paulo, 443-446.
Cardona AE, Restrepo BI, Jaramillo JM, Teale JM 1999. Development of an animal
model for neurocysticercosis: immune response in the central nervous system is
characterized by a predominance of gamma delta T cells. J Immunol 162: 995-1002.
Carvalhaes MS 2002. Produtos secretados e excretados por larvas L3 de L.minor
inibem a atividade hemolítica do sistema complemento humano. Reunião Anual da
SBPC, Goiânia, home Page www.sbpcnet.org.br/eventos/54ra/TEXTOS/SBI.
Carvalhaes MS, Spadafora-Ferreira MS, Portaro F, Mortara R, Tambourgi DV 2008.
A CRT-like molecule from L3 L.minor larvae. In: ImmunoRib, Ribeirão Preto.
Anais da SBI: 77-77.
Cariappa A & Pillai S 2002. Antigen-dependent B-cell development. Curr Op
Immunol 14: 241-249.
Cheroutre H & Lambolez F 2008. Doubting the TCR coreceptor function of CD8
alpha alpha. Immunity 28: 149-59.
54
Corrêa MOA, Hyakutake S, Brandi AJ, Monteiro CG 1978. Novo caso de
parasitismo humano por Lagochilascaris minor Leiper, 1909. Rev Inst Adolfo Lutz
38: 59-65.
Costa HMA, Silva AVM, Costa PR, Assis SB 1986. Lagochilascaris minor Leiper,
1909, (Nematoda Ascaridae) de origem humana. Rev Inst Med Trop São Paulo 28:
126-126.
Dias NMC, Dourado T, Carvalhaes MS. 2011. Produção de citocinas séricas pro e
anti-inflamatórias em camundongos A/J e B10.A infectados com Lagochilascaris
minor. 63ª Reunião Anual da SBPC-Anais, Goiânia-GO.
Draper JW & Buckley JJC 1963. Lagochilascaris minor Leiper, 1909, from a
patient in Tobago. Trans Roy Soc Trop Med Hyg 57: 7-8.
Finkelman FD, Shea-Donohue T, Goldhill J, Sullivan CA, Morris SC, Madden KB,
Gause WC, and Urban JF, Jr. 1997. Cytokine regulation of host defense against
parasitic gastrointestinal nematodes: lessons from studies with rodent models. Annu
Rev Immunol 15: 505-533.
Fraiha H, Leao RNQ, Costa FSA 1989. Lagochilascariase humana e dos animais
domésticos. Vet Int Zoon 1: 25-33.
Freitas JG, Prudente MFS, Spadafora-Ferreira M, Junqueira-Kipnis AP, Paula EC,
Tambourgi DV, Lino-Júnior RS, Carvalhaes MS 2008. Lagochilascaris minor:
Experimental infection of C57BL/6 and BALB/c isogenic mice reveals the presence
of adult worms. Exp Parasitol 119: 325-331.
Freitas JAG, Prudente MFS, Carvalhaes MS 2009. Experimental lagochilascariosis
in the X- chromossome-linked immunodeficient mice. Rev da Soc Bras de Med
Trop 42: 381-385.
Friberg IM, Bradley JE, Jackson JA 2010. Macroparasites, innate immunity and
immunoregulation: developing natural. Trends in Parasitol 26: 540-549.
Gaubin M, Autiero M, Houlgatte R, Basmaciogullari S, Auffray C, Piatier-Tonneau
D 1996. Molecular basis of T lymphocyte CD4 antigen functions. Eur J Clin Chem
Clin Biochem 34: 723-728.
Gause WC, Urban JF, Jr, Stadecker MJ 2003. The immune response to parasitic
helminths: insights from murine models. Trends Immunol 24: 269-277.
Guimarães VC, Barbosa AP, Camargo LA, Siqueira PH, Silva Filho J, Castro VLS,
Barbosa MA, Campos DMB 2010. Lagochilascaris minor otomastoiditis in child:
case repost. Int Arch Otorhinolaryngol 14: 373-376.
Harris N & Gause WC 2011. To B or not to B: B cells and the Th2-type immune
response to helminthes. Trends Immunol 32: 80-88.
Helmby H 2009. Helminths and our immune system: Friend or foe? Parasitol Int
55
58: 121-127.
Hesse M, Modolell M, La Flamme AC, Schito M, Fuentes JM, Cheever AW, Pearce
EJ, Wynn TA 2001. Differential regulation of nitric oxide synthase-2 and arginase-1
by type 1/type 2 cytokines in vivo: granulomatous pathology is shaped by the
pattern of L-arginine metabolism. J Immunol 167: 6533-6544.
Hewitson PJ, Grainger RJ, Maizels MR 2009. Helminth immunoregulation: The role
of parasite secreted proteins in modulating host immunity. Mol Biochem Parasitol
167: 1-11.
Hogg AE, Worth A, Beverley P, Howard CJ, Villarreal-Ramos B 2009. The
antigen-specific memory CD8+ T-cell response induced by BCG in cattle resides in
the CD8+gamma/deltaTCR-CD45RO+ T-cell population. Vaccine 27: 270-279.
Humphreys NE, Worthington JJ, Little MC, Rice EJ, Grencis RK 2004.The role
of CD8+ cells in the establishment and maintenance of a Trichuris muris infection.
Parasite Immunol 26: 187-96.
Hsieh GC, Loukas A, Wahl AM, Bhatia M, Wang Y, Williamson AL, Kehn
KW, Maruyama H, Hotez PJ, Leitenberg D, Bethony J, Constant SL 2004. A
secreted protein from the human hookworm Necator americanus binds selectively
to NK Cells and induces IFN-γ production. J Immunol 173: 2699-704.
Jackson AJ, Friberg MI, Little S, Bradley EJ 2008. Review series on helminths,
immune modulation and the hygiene hypothesis: Immunity against helminths and
immunological phenomena in modern human populations: coevolutionary legacies?
Immunology 126: 18-27.
Joshi AD, Schaller MA, Lukacs NW, Kunkel SL, Hogaboam CM 2008. TLR3
modulates immunopathology during a Schistosoma mansoni egg-driven Th2
response in the lung. Eur J Immunol 38: 3436-3449.
Kalinkovich A, Weisman Z, Greenberg Z, Nahmias J, Eitan S, Stein M, Bentwich Z
1998. Decreased CD4 and increased CD8 counts with T cell activation is associated
with chronic helminth infection. Clin Exp Immunol 114: 414-421.
King IL & Mohrs M 2009. IL-4-producing CD4+ T cells in reactive lymph nodes
during helminth infection are T follicular helper cells. J Exp Med 206: 1001-1007.
Kogiso M, Nishiyama A, Shinohara T, Nakamura M, Mizoguchi E, Misawa Y,
Guinet E,Nouri-Shirazi M, Dorey CK, Henriksen RA, Shibata Y. 2011. Chitin
particles induce size-dependent but carbohydrate-independ. J Leuk Biol 90: 1-10.
Koyasu S & Moro K 2011. Type 2 innate immune responses and the natural helper
cell. Immunology 132: 475-481.
Kurotaki D, Kon S, Bae K, Ito K, Matsui Y, Nakayama Y, Kanayama M, Kimura
C, Narita Y, Nishimura T, Iwabuchi K, Mack M, van Rooijen N, Sakaguchi S, Uede
56
T, Morimoto J 2011.CSF-1–dependent red pulp macrophages regulate CD4 T cell
responses. J Immunol 186: 2229-2237.
Kushwah R & Hu J 2011. Complexity of dendritic cell subsets and their function in
the host immune system. Immunology 133: 409-419.
Lapac 2011. Imunoistoquímica.
Disponível no endereço eltrônico:
<http://www.lapac-pi.com.br/exame,imunoistoquimica,1.html>. Acesso em outubro
de 2011.
Leão RNQ, Leão Filho J, Dias LB, Calheiros LB 1978. Infecção humana pelo
Lagochilascaris minor Leiper, 1909. Registro de um caso observado no Estado do
Pará (Brasil). Rev Inst Med Trop S Paulo 20: 300-306.
Leão RNQ & Fraiha Neto H 1997. Lagochilascaríase. In: Leão RNQ. Doenças
infecciosas e Parasitárias. Enfoque amazônico, Belém: Cejup/ UEPa/ IEC, 723-731.
Leão RNQ, Fraiha-Neto H, Dias LB. Lagoquilascaríase 2005. In: Focaccia R (ed.)
Veronesi Tratado de Infectologia. 3. ed. Atheneu, São Paulo, 1781-1785.
Leiper RT 1909. A new nematode worm from Trinidad, Lagochilascaris minor.
Proceed Zoo Soc Lond 4: 742-743.
Lobo Neto A, Paula AM, Silva AF, Fraiha Neto H, Leão RNQ, Lobo AP, Lobo OP,
Amorim PA 1994. Aspectos radiográficos da lagochilascaríase humana. Avaliação
dos achados em 10 casos. Rev Soc Bras Med Trop 27: 330-330.
Loukas A & Prociv P 2001. Immune responses in hookworm infections. Clin
Microbiol Rev 14: 689-703.
Lundy SK & Boros DL 2002. Fas ligand-expressing B-1a lymphocytes mediate
CD4 (+) T cell apoptosis during schistosomal infection: induction by interleukin 4
(IL-4) and IL-10. Infect Immun 70: 812-819.
Maizels RM, Pearce EJ, Artis D, Yazdanbakhsh M, Wynn TA 2009. Regulation of
pathogenesis and immunity in helminthes infections. J Exp Med 206: 2059-2066.
Mallevaey T. et al 2006. Activation of invariant NKT cells by the helminth parasite
Schistosoma mansoni. J Immunol 176: 2476-2485.
Manfras BJ, Reuter S, Wendland T, Kern P 2002. Increased activation and
oligoclonality of peripheral CD8 T Cells in the chronic human helminth infection
Alveolar Echinococcosis. Inf Immun 70: 1168-1174.
Mantovani A, Sozzani S, Locati M, Allavena P, Sica A 2002: Macrophage
polarization: tumor-associated macrophages as a paradigm for polarized M2
mononuclear phagocytes. Trends Immunol 23: 549-555.
McGraw H 2003. Dictionary of Scientific and Technical Terms. McGraw-Hill
Companies. Disponível no endereço eletrônico: <http://www.answers.com/topic>.
Acesso em: maio de 2011.
57
McSorley HJ, Harcus YM, Murray J, Taylor MD, Maizels RM 2008. Expansion of
Foxp3+ regulatory T cells in mice infected with the filarial parasite Brugia malayi. J
Immunol 181: 6456-6466.
Mebius RE & Kraal G 2005. Structure and function of the spleen. Nat Rev Immunol
5: 606-616.
Medeiros N, Yanna K; Lozano VF; Araújo TS; Carvalho DD; Bocca AL 2010. The
cell wall fraction from Fonsecaea pedrosoi stimulates production of different
profiles of cytokines and nitric oxide by murine peritoneal cells in vitro.
Mycopathologia 170: 89-98.
Mesquita-Júnior D, Araújo JAP, Catelan TTT, Souza AWS, Silva N, Andrade LEC,
Cruvinel WM 2010. Aspectos celulares e moleculares da inflamação. Rev Bras
Reumatol 3: 66-81.
Metwali A, Setiawan T, Blum AM, Urban J, Elliott DE, Hang L, Weinstock JV
2006. Induction of CD8+ regulatory T cells in the intestine by Heligmosomoides
polygyrus infection. Am J Physiol Gastrointest Liver Physiol 291: 253-259.
Moraes AMP, Arnaud MVC, Lima PE 1983. Novos casos de infecção humana por
Lagochilascaris minor Leiper, 1909, encontrados no Estado do Pará, Brasil. Rev Inst
Med Trop S Paulo 25: 139-146.
Moraes MAP, Arnaud MVC, Macedo RC, Anglada AE 1985. Infecção pulmonar
fatal por Lagochilascaris sp. provavelmente Lagochilascaris minor Leiper, 1909.
Rev Inst Med Trop S Paulo 27: 46-46.
Mosser DM & Edwards JP 2008. Exploring the full spectrum of macrophage
activation. Nature Rev Immunol 8: 958-969.
Mulcahy G, O’Neill S, Fanning J, McCarthy E, Sekiya M 2005.Tissue migration by
parasitic helminthes an immunoevasive strategy? Trends Parasitol 21: 273-277.
Neill DR, Wong SH, Bellosi A, Flynn RJ, Daly M, Langford TKA, Bucks C, Kane
CM, Fallon PG, Pannell R, Jolin HE, Mckenzie ANJ 2010. Nuocytes represent a
new innate effector leukocyte that mediates type-2 immunity. Nature 464: 13671370.
Neves PC, Rudersdorf RA, Galler R, Bonaldo MC, de Santana MG, Mudd
PA, Martins MA, Rakasz EG, Wilson NA, Watkins DI 2010. CD8+ gamma-delta
TCR+ and CD4+ T cells produce IFN-γ at 5–7 days after yellow fever vaccination
in Indian rhesus macaques, before the induction of classical antigen-specific T cell
responses. Vaccine 28: 8183-8188.
Noël W, Raes G, Hassanzadeh Ghassabeh G, De Baetselier P, Beschin A 2004.
Alternatively activated macrophages during parasite infections. Trends Parasitol 20:
126-133.
58
Nolte MA, Arens R, Kraus M , van Oers MHJ, Kraal G, van Lier RAW, Mebius RE
2004. B Cells are crucial for both development and maintenance of the splenic
marginal zone. J Immunol 172: 3620-3627.
Oliveira JA, Barbosa CL, Vieira MA, Paço JM, Carrijo AS, Fiorini MP, Campos
DMB 2002. Isolado de Lagochilascaris minor: procedimentos para obtenção de
ovos infectantes. Rev Patol Trop 31: 121-128.
Opperdoes FR, Hannaert V, 2006. Parasitology Course and Compléments de
Parasitology.
Disponível
no
endereço
eletrônico:
http://www.icp.ucl.ac.br/ôpperd/parasite/ Frame5201093. Acesso em: maio de 2011.
Orihuela R, Botto C, Delgado O, Ortiz A, Suares JA, Arguello C 1987.
Lagochilascariasis humana en Venezuela: descripción de un caso fatal. Rev Soc Bras
Med Trop 20: 217-221.
Paçô JM & Campos DMB 1998. Lagochilascaris minor Leiper, 1909: Nove décadas
de revisão bibliográfica. Rev Patol Trop 27: 11-34.
Paçô JM, Campos DMB, Oliveira JA 1999. Wild Rodents as Experimental
intermediate hosts of Lagochilascaris minor Leiper, 1909. Mem Inst Oswaldo Cruz
94: 441-449.
Palheta-Neto, Leão RNQ, Neto HF, Tomita S, Lima MAMT, Pezzin-Palheta AC
2002. Contribuição ao estudo da Lagochilascaríase humana. Rev Bras
Otorrinolaringol 68: 101-105.
Pancré V, Delacre M, Herno J, Auriault C 1999. Schistosomal egg antigenresponsive CD8 T-cell population in Schistosoma mansoni-infected BALB/c mice.
Immunology 98: 525-34.
Paul WE & Zhu J 2010. How are TH2-type immune responses initiated and
amplified? Nat Rev Immunol 10: 225-235.
Pedras-Vasconcelos A & Pearce EJ 1996. Type 1 CD8+ T cell responses during
infection with the helminth Schistosoma mansoni. J Immunol 157: 3046-3053.
Pelletier M, Maggi L, Micheletti A, Lazzeri E, Tamassia N, Costantini C, Cosmi
L, Lunardi C, Annunziato F, Romagnani S, Cassatella MA 2010. Evidence for a
cross-talk between human neutrophils and Th17 cells. Blood 115: 335-343.
Prudente MFS, Lima KC, Carvalhaes MS 2008. Perfil hematológico, bioquímico
sérico e sorológico de Felis domesticus com lagochilascariose experimental. Rev da
Soc Bras de Med Trop 41: 496-501.
Prudente MFS, Lino Junior RS, Carvalhaes MS 2009a. The X-chromosome-linked
immunodeficiency determines an improved course of murine lagochilascariosis.
Helminthologia 46: 205-208.
Prudente MFS, Freitas JG, Ribeiro EL, Carvalhaes MS 2009b. Influence of the
59
genetic pattern and sex of mice in experimental lagochilascariosis. Helminthologia
46: 31-34.
Prudente MFS, Crespo AMC, Carvalhaes MS 2009c. Lagochilascaris minor:
antibody production in experimentally infected mice. Rev da Soc Bras de Med Trop
42: 325-328.
Prudente MFS, Freitas JAG, Ribeiro EL, Carvalhaes MS 2011. Lagochilascaris
minor: Specific antibodies are related with resistance to experimental infection in
A/J strain of mice. Helminthologia 48: 137-144.
Orihuela R, Botto C, Delgado O, Ortiz A, Suares JA, Arguello C 1987.
Lagochilascariasis humana en Venezuela: descripción de un caso fatal. Rev Soc Bras
Med Trop 20: 217-221.
Ribot JC, de Barros A, Pang DJ, Neves JF, Peperzak V, Roberts SJ, Girardi
M, Borst J, Hayday AC, Pennington DJ, Silva-Santos B 2009. CD27 is a thymic
determinant of the balance between interferon-gamma- and interleukin 17producing gamma-delta T cell subsets. Nature Immunol 10: 427-436.
Riet EV, Hartgers FC, Yazdanbakhsh M 2007. Chronic helminth infections induce
immunomodulation: Consequences and mechanisms. Immunobiology 212: 475-490.
Roark CL, Simonian PL, Fontenot AP, Born WK, O'Brien RL 2008. γδ T cells:
an important source of IL-17. Curr Opin Immunol 20: 353-357.
Rocha MPC, Fraiha NH, Barreto NACP 1984. Infecção de ouvido médio e mastóide
por Lagochilascaris minor Leiper, 1909 (Nematoda, Ascaridiae). Relato de um caso
do Sul do Estado do Pará, Amazônia, Brasil. Hiléia Médica 6: 3-14.
Rodriguez-Sosa M, Saavedra R, Tenorio EP, Rosas LE, Satoskar AR, and Terrazas
LI 2004. A STAT4-dependent Th1 response is required for resistance to
the helminth parasite Taenia crassiceps. Infect Immun 72: 4552-4560.
Roig-Ocampos JL, Forteza JLRO, Granato L, Serafini DP 2010. Otomastoidititis
with right retroauricular fistula by Lagochilascaris minor. Braz J Otorhinolaryngol
76: 407-407.
Rosemberg S, Lopes MBS, Masuda Z, Campos R and Bressan MCR 1986. Fatal
encephalopathy due to Lagochilascaris minor infection. Am J Trop Med Hyg 35:
575-578.
Rutitzky LI, Lopes da Rosa JR, Stadecker MJ 2005. Severe CD4 T cell- mediated
immunopathology in murine schistosomiasis is dependent on 12p40 and correlates
with high levels of IL-17. Journal of Immunology 175, 3920-3926.
Rutitzky I & Stadecker MJ 2006. CD4 T cells producing pro-inflammatory
interleukin-17 mediate high pathology in schistosomiasis. Mem Inst Oswaldo Cruz
101: 327-330.
60
Saeftel M, Volkmann L, Korten S, Brattig N, Al-Qaoud1 K, Fleischer B, Hoerauf A
2001. Lack of interferon-γ confers impaired neutrophil granulocyte function and
imparts prolonged survival of adult filarial worms in murine filariasis. Microb Inf 3:
203-213.
Sakamoto T & Cabrera PA 2002. Subcutaneous infection of Lagochilascaris minor
in domestic cats from Uruguay. Vet Parasitol 108: 145-152.
Stanford University 2006. Lagochilascariasis. Disponível no endereço
eletrônico:<http://www.stanford.edu/class/humbio103/ParaSites2006/Lagochilascari
s/>. Acesso em: maio de 2011.
Semerene AR, Lino Junior RS, Oliveira JA, Magalhães AV, Stefani MMA, Barbosa
AP, Campos DMB 2004. Experimental Lagochilascariosis: Histopathological study
of inflammatory response to larval migration in the murine model. Mem Inst
Oswaldo Cruz 99: 393-398.
Schimidt-Weber, Akdis C, Akdis M 2007. Th17 cells in the big picture of
immunology. J Allergy Clin Immunol 120: 247-253.
Silva CA, Hartl D, Liu W, Lee CG, Elias JA 2008. TLR-2 and IL-17a in chitininduced macrophage activation and acute inflammation. J Immunol 181: 4279-4286.
Smith JL, Bowman DD, Little MD 1983. Life cycle and development of
Lagochilascaris sprenti (Nematoda: Ascarididae) from apossums (Marsupialia:
Didelphidae) in Lousiana. J Parasitol 69: 736-745.
Smits HH, Everts B, Hartgers FC, Yazdanbakhsh M 2010. Chronic helminth
infections protect against allergic diseases by active regulatory processes. Curr
Allergy Asthma Resp 10: 3-12.
Spadafora-Ferreira M, Fernandes LC, Hoffman Pfrimer IA, Pichiteli CR, Vilarinho
Tambourgi D, de Souza Lino-Junior R, Carvalhaes MS 2010. Lagochilascaris
minor: Susceptibility and resistance to experimental infection in mice is
independent of H-2a haplotype and correlates with the immune response in
immunized animals. J Parasitol Res 1-8.
Sprenti JFA 1971. Speciation and development in the genus Lagochilascaris.
Parasitology 62: 71-112.
Tallima H, Salah M, Guirguis FR, Ridi RE 2009. Transforming growth factor-β and
Th17 responses in resistance to primary murine Shistosomiasis mansoni. Cytokine
48: 239-245.
Tedder TF, Inaoki M, Sato S 1997. The CD19-CD21 complex regulates signal
transduction thresholds governing humoral immunity and autoimmunity. Immunity
6: 107-118.
Teixeira VPA; Pereira SAL. et al. Princípios básicos e aplicações da morfometria.
[on line]. Minas Gerais, 2005. Disponível no endereço eletrônico:
61
<http://www.uftm.edu.br/instpub/fmtm/patge/morfometria01.htm>.
maio de 2011.
Acesso
em:
The Jackson Laboratory 2011. Mouse Phenome Database. Disponível no endreço
eletônico: <jaxmice.jax.org/support/phenotyping/BALBcJdata000651.pdf 2007>.
Acesso em: dezembro de 2011.
Trujillo JA, Montoya IR, Sosa MR, Terrazas LI 2007. Nitric oxide contributes to
host resistance against experimental Taenia crassiceps cysticercosis. Parasitol Res
100: 1341-1350.
Turvey SE, DPhil BS, Broide DH 2010. Innate Immunity. J Allergy Clin Immunol
125: S24-S32.
Van den Berg TK & Kraal G 2005. A function for the macrophage F4/80 molecule
in tolerance induction. Trends Immunol 26: 506-509.
Veldhoen M, Uyttenhove C, van Snick J, Helmby H, Westendorf A, Buer J
2008.Transforming growth factor-beta ‘reprograms’ the differentiation of T helper 2
cells and promotes an interleukin 9-producing subset. Nat Immunol 9: 1341-1346.
Veloso MGP, Faria MCAR, Freitas JD, Moraes MAP, Gorin DF, Mendonça JLF
1992. Lagochilascaríase humana. Sobre três casos encontrados no Distrito Federal
Brasil. Rev Inst Med Trop S Paulo 34: 587-591.
Vieira MA, Oliveira JA, Ferreira LS, Oliveira V e Barbosa CAL 2000. Relato de
caso de Lagochilascariose humana procedente do Estado do Pará, Brasil. Rev da Soc
Bras de Med Trop 33: 87-90.
Voehringer D 2011. Basophils in immune responses against helminths. Microb Inf.
May 27. [Epub ahead of print] www.ncbi.nlm.nih.gov/pubmed/21658463.
Volcán GS, Ochoa FR, Medrano CE, Valera Y 1982. Lagochilascaris minor
infection in Venezuela. Report of case. Am J Trop Med Hyg 31: 111-113.
Volcán GS & Medrano CE 1990. Infectión inducida em el roedor selvático
Dasyprocta leporina (Rodentia: Dasyproctidae), com huevos de Lagochilascaris
minor (Nematoda: Ascarididae). Rev Inst Med Trop S Paulo 32: 1111-1113.
Volcán GS, Medrano CE, Payares G 1992. Experimental heteroxenenous cycle of
Lagochilascaris minor Leiper, 1909 (Nematoda: Ascarididae), in write mice and
cats. Mem Inst Oswaldo Cruz 87: 532-535.
Wan YY 2010. Multi-tasking of helper T cells. Immunology 130: 166-171.
Wardemann
H, Boehm
T, Dear
N, Carsetti
R
2002.
1a B cells that link the innate and adaptive immune responses are lacking in
the absence of the spleen. J Exp Med 195: 771-780.
B
62
Yamaguti S 1961. Systema helminthum: Oesophagostomum watanabei n.sp.
(Nematoda, Strongylidae) from Japanese wild boar. J Helminthol 35: 203-206.
Zaccone P, Burton OT, Cooke A 2007. Interplay of parasite-driven immune
responses and autoimmunity. Trends Parasitol 24: 35-42
63
ANEXO 1 – Aprovação do comitê de ética em pesquisa animal do Instituto
Butantan de São Paulo
64
ANEXO 2 – Manuscrito A ser submetido a revista Experimental Parasitology
IMUNOFENOTIPAGEM
CAMUNDONGOS
DE
SUSCEPTÍVEIS
CÉLULAS
E
ESPLÊNICAS
RESISTENTES
EM
COM
LAGOCHILASCARIOSE EXPERIMENTAL
Priscila Guirão Lara, 2; Mariana Felix de Souza Prudente, 1; Neusa Mariana
Costa Dias, 1; Denise Vilarinho Tambourgi, 2; Ruy de Souza Lino-Junior, 1; Mara Silvia
Carvalhaes, 1; Mônica Spadafora Ferreira 2
Endereço para correspondência: Profª Drª Mara Silvia Carvalhaes, Laboratório de
Imunoquímica (328), Setor de Imunologia, Instituto de Patologia Tropical e Saúde
Pública, Universidade Federal de Goiás. Rua 235, esq. c/ a 1ª Avenida sem número,
Setor Universitário, CEP: 74605-050, Goiânia, Goiás.
E-mail: [email protected]; [email protected]
1- Laboratório de Imunoquímica, Instituto de Patologia Tropical e Saúde Pública/UFG.
2- Laboratório de Imunoquímica, Instituto Butantãn de São Paulo.
ÓRGÃO FINANCIADOR: Fundação de amparo à pesquisa do estado de Goiás
(FAPEG) e Fundação de amparo à pesquisa do estado de São Paulo (FAPESP).
Artigo formatado de acordo com as normas da revista de Patologia Tropical
65
RESUMO
A lagoquilascariose é uma parasitose emergente cujo agente etiológico é
Lagochilascaris minor. O modelo experimental em camundongos tem sido utilizado no
estudo da resposta imune durante a infecção por L. minor. No presente trabalho,
avaliaram-se as populações de células esplênicas em camundongos susceptíveis
(C57BL/6) e resistentes (BALB/c), experimentalmente infectados por L. minor.
Camundongos BALB/c exibiram aumento do índice de células esplênicas: F4/80+ aos
100 dias pós-infecção; CD4+ aos 100 e 250 dias após a infecção; células CD8+ aos 35 e
100 dias pós-infecção; CD19+ aos 100, 150 e 250 dias pós-infecção. Nos camundongos
C57BL/6 infectados observou-se aumento do índice de células esplênicas: F4/80+ aos
250 dias de infecção; CD4+ aos 150 dias; CD8+ aos 35, 150 e 250 dias; CD19+ aos 150
e 250 dias após infecção. Esses resultados indicam participação dessas células no
controle da infecção experimental por L. minor.
DESCRITORES
Lagochilascaris minor, Helmintose, Resposta imune, Linfócitos
INTRODUÇÃO
A lagochilascariose é uma antropozoonose causada por Lagochilascaris
minor, que pode ser o agente etiológico da infecção humana (4), e eventualmente é
encontrado em animais domésticos, como cão e gato (21). Apesar de não constituir um
problema de saúde pública, a lagochilascariose pode ser considerada uma doença
emergente no Brasil, que lidera a casuística mundial com 90% dos casos descritos (4).
A lagochilascariose é uma doença crônica caracterizada pela presença de
lesões granulomatosas na região da oro-naso-faringe que provoca abscessos exsudativos
com presença de ovos, parasitos adultos e larvas, indicando a ocorrência de auto-
66
infecção. A letalidade nesta infecção tem sido observada quando o parasita invade o
tecido pulmonar e o sistema nervoso central (9, 19).
O ciclo de vida natural de L. minor e o mecanismo de infecção não estão bem
esclarecidos, pois pouco se sabe a respeito da biologia desse parasito. Animais silvestres
como canídeos felídeos e roedores são considerados os prováveis reservatórios naturais
de L. minor (2). O ciclo experimental heteroxênico do parasita foi descrito utilizando-se
camundongos como hospedeiros intermediários e felinos domésticos como hospedeiros
definitivos (3, 29).
A extraordinária capacidade de L. minor para migrar entre diferentes tecidos
humanos também foi observada em modelos experimentais (17). Em camundongos
inoculados com ovos infectantes do parasita, contendo larvas de terceiro estádio (L3),
larvas eclodidas podem ser observadas durante a migração no trato intestinal e em
seguida, a disseminação destas ocorre para outros tecidos, tais como os pulmões,
músculos esqueléticos e tecidos subcutâneos. Quando gatos são alimentados com
carcaças de camundongos infectados, as larvas L3 eclodem dos cistos no estômago e
ascendem até a orofaringe, onde larvas de quarto estádio (L4) são encontradas. Ovos de
L. minor podem ser expelidos e encontrados nas fezes de gatos infectados (22).
A relação parasita-hospedeiro durante a infecção experimental por L. minor
tem sido estudada em linhagens de camundongos isogênicos com diferentes background
genéticos. Em estudos anteriores, após observação da taxa de mortalidade acumulada no
período de um ano de infecção, foi possível classificar as linhagens de camundongos em
resistentes (A/J, BALB.xid, BALB/c) e susceptíveis (C57BL/6 e B10.A) à infecção
experimental por L. minor. As linhagens susceptíveis apresentaram: menor tempo de
sobrevida; maior quantidade de larvas L3 e parasitos adultos; e granulomas mais
intensos (6, 17, 24).
67
É evidente que a diferença na susceptibilidade de camundongos à
lagochilascariose experimental possa ser influenciada pela resposta imune individual ao
parasito, que desempenha um papel essencial na evolução da infecção, minimizando ou
bloqueando os processos patológicos (17).
Recentemente foi demonstrado que o nível sérico de interleucina (IL) 10 em
camundongos C57BL/6 e BALB/c infectados pelo parasito foi semelhante entre as
linhagens, aos 90 dias após a infecção (DAI); porém, os animais BALB/c apresentaram
níveis elevados de interferon-γ (IFN-γ). Nesse período observaram-se lesões
pulmonares menos intensas e um menor número de nódulos subcutâneos contendo L3
encistadas nos camundongos BALB/c em relação aos camundongos C57BL/6 (8).
Assim, consideramos importante avaliar as populações de células esplênicas
durante a infecção experimental por L. minor. Como o perfil de células esplênicas
durante a lagochilascariose experimental nunca foi estudado, realizamos a
imunofenotipagem de células F4/80+, CD4+, CD8+ e CD19+ do baço de camundongos
BALB/c e C57BL/6 controles e experimentalmente infectados com L. minor, com o
intuito de saber quais populações celulares apresentam-se alteradas na lagochilascariose
experimental.
MATERIAL E MÉTODOS
Obtenção de ovos
Gatos domésticos (Felis domesticus) foram individualmente alimentados com
carcaças de camundongos C57BL/6 infectados, contendo 30 a 100 nódulos encistados
no tecido subcutâneo contendo larvas de terceiro estádio (L3) de L. minor. Os ovos do
parasita foram colhidos das fezes dos felinos após 30 dias de inoculação e submetidos
aos métodos de Hoffman e Faust (16). A suspensão de ovos foi mantida a temperatura
68
ambiente (t.a.), em solução de formalina a 1%, por 40 dias. Após lavagem exaustiva, a
suspensão de ovos destinada à preparação do inóculo foi ajustada para 1000 ovos/ml.
Os ovos foram mantidos em formalina 1%, sendo lavados e ressuspendidos em PBS
para a inoculação.
Infecção experimental
Foram utilizados camundongos isogênicos, machos, das linhagens BALB/c
(n=50) e C57BL/6 (n=50), obtidos do Biotério Central do Instituto Butantan. Os
camundongos foram inoculados por gavagem com 1000 ± 200 ovos infectantes do
parasito por animal. Grupos de 5 animais foram eutanasiados em câmara de CO2, em
diferentes períodos pós-infecção (35, 100, 150 e 250). Igual número de camundongos
não infectados (inoculados com PBS por via oral) foram eutanasiados no mesmo
período, servindo como controles. Realizou-se evisceração e coleta do baço desses
animais, destinados ao congelamento para reação imunoistoquímica.
Os procedimentos deste projeto foram aprovados pelo Comitê de Ética em
Pesquisa Animal do Instituto Butantan de São Paulo, protocolo nº 403/07.
Imunoistoquímica
Fragmentos de baço colhido dos animais nos diferentes períodos após a
infecção, foram embebidos em meio de inclusão para congelamento de tecidos (OCT,
Aotec), imersos em isopentano gelado (Vetec, Brasile) e imediatamente congelados em
nitrogênio líquido e posteriormente, armazenados em freezer -80oC. Os fragmentos
foram cortados em criostato e fixados em acetona gelada por 10 minutos, sendo
mantidos congelados a -80 oC. Em seguida, os fragmentos foram submetidos ao
bloqueio com H2O2 30 volumes diluída a 1/1000 em metanol (15 minutos), e com soro
normal de cabra (15 minutos). Em seguida, sem lavar as lâminas, retirou-se o excesso
de soro, os cortes foram incubados com os anticorpos diluídos em PBS contendo 2% de
69
soro fetal bovino, em câmara úmida durante 18h a 4ºC. Foram utilizados os seguintes
anticorpos de rato para camundongos: anti-F4/80 (marcador de macrófagos), clone, A31 (Serotec, EUA); anti-CD19 (marcador de linfócitos B), clone 1D3 (BD Biosciences);
anti-CD4 (marcador de linfócitos T helper), clone H129.19 (BD Biosciences); e antiCD8 (marcador de linfócitos T citolíticos); clone 53-6.7 (BD Biosciences), não
marcados. Posteriormente as lâminas foram lavadas com PBS e incubadas com
anticorpo secundário anti-IgG de rato biotinilado (BD Biosciences). A seguir, foi
adicionado o complexo ABC-peroxidase (Dako, Dinamarca) por 30 minutos à t.a. A
revelação da reação foi realizada com diaminobenzidina-H2O2 (DAB - BD
Biosciences), e a contracoloração com hematoxilina de Mayer (Merck, Alemanha).
Quantificação dos subtipos celulares
Para cada camundongo fez-se uma lâmina de IIQ e para cada lâmina foram
fotografados 30 campos na objetiva de 40X. As imagens dos campos para quantificação
foram capturadas por meio de uma câmera (Cyber shot DSC-S85) acoplada ao
microscópio e ao computador para digitalização e a análise das células foi realizada no
sistema analisador de imagens Image J (NIH/EUA).
Foram quantificadas as células marcadas positivamente, nas 30 intersecções da
grade em cada um dos 30 campos analisados, e calculada a média acumulada (26),
sendo os resultados expressos em mediana e desvio médio. Também foi determinado o
índice de células (IC) marcadas, dividindo-se a média aritmética do número de células
marcadas presentes nos animais infectados (Мcel+Inf), pela média aritmética do
número de células marcadas encontradas nos controles não infectados (Мcel+Cont), nos
diferentes DAI [Índice= (Мcel+Inf) / (Мcel+Cont)].
Análise estatística
A análise estatística das contagens de IIQ foi realizada por meio do programa
70
GraphPas Prism 4.0. Todas as variáveis foram testadas quanto à distribuição normal e
variância homogênea. Para análise de uma variável utilizou-se a mediana e desvio
médio seguido de teste Mann Whitney (não paramétrico). Para mais de uma variável:
ANOVA seguido de teste Tukey. As diferenças observadas foram consideradas
significantes quando p < 0,05.
RESULTADOS
Observou-se ausência de marcação positiva no controle negativo (CN)
efetuado sem adição de anticorpos contra os marcadores e a localização predominante
de células esplênicas marcadas na região folicular da polpa branca do baço com os
anticorpos de rato anti-F4/80+, CD4+, CD8+ e CD19+, na análise qualitativa (Figura 1).
Nos animais da linhagem BALB/c não houve variação significativa na
quantidade de células esplênicas F4/80+. Aos 100 dias após a infecção, as células
F4/80+ nos animais infectados da linhagem C57BL/6 apresentaram número reduzido de
células marcadas por campo em relação aos controles (p< 0,05), e aos 250 dias
apresentaram número aumentado em relação aos controles (p< 0,05). O índice de
células (IC) F4/80+ esplênicas da linhagem BALB/c apresentou aumento aos 100 DAI
(IC = 1,2); e nos animais C57BL/6 aos 250 DAI (IC = 1,3) (Figura 2A e B).
As células esplênicas CD4+ apresentaram-se aumentadas nos camundongos
BALB/c infectados em relação aos animais controles aos 100 DAI (p< 0,05). Na
linhagem C57BL/6, foi observado aumento de células CD4+ aos 150 DAI nos animais
infectados em relação aos seus controles (p< 0,05). Detectamos IC CD4+ esplênicas
aumentados em camundongos BALB/c aos 100 DAI (IC = 1,2) e 250 DAI (IC = 1,3); e
nos animais C57BL/6 aos 150 DAI (IC = 1,4) (Figura 3A e B).
A quantificação das células CD8+ no baço de camundongos BALB/c
71
infectados apresentou, somente aos 100 DAI, valores acima dos controles (p< 0,05).
Nos camundongos C57BL/6 as células CD8+ apresentaram-se aumentadas em relação
aos controles, aos 35 e 150 DAI (p< 0,05). O IC CD8+ esplênicas de camundongos
BALB/c aumentou aos 35 DAI (IC = 1,1) e 100 DAI (IC = 1,3); e nos camundongos
C57BL/6, aos 35 DAI (IC = 1,2), 150 DAI (IC = 1,5) e 250 DAI (IC = 1,1) (Figura 4A e
B).
O número de células CD19+ no baço de camundongos BALB/c infectados
aumentou aos 100, 150 e 250 DAI (p< 0,05) em relação aos animais controles. Aos 250
DAI na linhagem C57BL/6, o número das células CD19+ estava aumentado em relação
aos controles (p< 0,05). O IC CD19+ esplênicas nos camundongos BALB/c aumentou
aos 100 DAI (IC = 1,2), 150 DAI (IC = 1,3) e 250 DAI (IC = 1,6); e nos animais
C57BL/6 aumentou aos 150 DAI (IC = 1,1) e 250 DAI (IC = 1,1) (Figura 5A e B).
DISCUSSÃO
O índice de células F4/80+ no baço de camundongos infectados exibiu
aumento aos 100 DAI na linhagem BALB/c e na linhagem C57BL/6 aos 250 DAI. Os
macrófagos da polpa vermelha são F4/80+ e apresentam a função de remover autoantígenos e fagocitar eritrócitos e determinados subconjuntos de macrófagos maduros,
das áreas de células T do baço apresentam baixa expressão da molécula F4/80+.
Devemos considerar que macrófagos residentes com diferentes características
fenotípicas e funcionais, e seus precursores no sangue, os monócitos que infiltram os
tecidos, podem estar respondendo ao helminto no local de infecção e a expressão de
F4/80 pode variar durante a ativação e maturação de macrófagos (28). Células F4/80+
durante a infecção experimental por L. minor, podem ser importantes no sentido de
direcionar a resposta imune, para: produção de citocinas pro-inflamatórias com ativação
72
de neutrófilos, citocinas regulatórias, que modulem a inflamação exacerbada; e para
citocinas que auxiliem na diferenciação dos diferentes perfis de linfócitos CD4+.
No baço de camundongos, foi identificada uma população de macrófagos com
o fenótipo F4/80(hi) Mac-1(low) que produz citocinas imunossupressoras como TGFβ e
IL10 (12). Alguns estudos têm demonstrado que macrófagos alternativamente ativados
(AAMs) estão associados à resistência em infecções parasitárias e liberação de citocinas
e fatores de crescimento angiogênicos durante infecções por helmintos (14).
Macrófagos classicamente ativados (CAMs) que produzem óxido nítrico (NO),
citotóxico para larvas de metazoários (1) parecem ser importantes na resistência à
helmintoses (27).
Camundongos BALB/c exibiram aumento do índice de células CD4+
esplênicas aos 100 e 250 DAI, e os camundongos da linhagem C57BL/6 somente aos
150 DAI. Acredita-se que essas células CD4+ esplênicas detectadas possam ser células
residentes do baço ou linfócitos que chegam da corrente sanguínea para a zona marginal
(MZ) do baço (13). A modulação de diferentes subpopulações de linfócitos CD4+ foi
observada em muitos modelos experimentais de helmintoses (15). A maior detecção de
IFNg no soro dos camundongos BALB/c sugere a participação de células com perfil
Th1 (8). Vários estudos descrevem células Th17 com participação no agravamento da
patologia na esquistossomose em camundongos (20); e de fato, a presença de
neutrófilos nas lesões granulomatosas observadas na linhagem C57BL/6 sugere a
participação de células Th17 nesta linhagem (8).
Nossos resultados demonstraram um aumento nos índices de células CD8+
esplênicas nos camundongos C57BL/6 aos 35, 150 e 250 DAI. A susceptibilidade de
camundongos na infecção crônica por Trichuris muris está associada com grande
quantidade de células TCD8+ (10). A molécula CD8 na configuração CD8αα pode ser
73
expressa em linfócitos Tγδ (7) e essas células já foram descritas em outras helmintoses
(5). Assim é importante a avaliação futura da participação de linfócitos CD8+ não
citolíticos, produtores de citocinas pró-inflamatórias e regulatórias, durante o curso da
infecção por L. minor. O aumento preferencial dessas células nos camundongos da
linhagem C57BL/6 parece estar associado com a susceptibilidade à infecção
experimental.
Os camundongos na linhagem BALB/c apresentaram índices aumentados de
células CD19+ esplênicas aos 100, 150 e aos 250 DAI. A molécula CD19+ está
presente na superfície de praticamente todos os linfócitos B, funcionando como um coreceptor que amplifica a cascata de sinalização (25). Linfócitos B possuem uma
variedade de funções imunes, incluindo a produção de anticorpos, apresentação de
antígenos e produção de citocinas, colaborando com uma imunidade protetora durante
infecções por helmintos (11). Durante infecção experimental por Heligmosomoides
polygyrus os anticorpos impedem a invasão intestinal nos primeiros dias de infecção
(23). Ficou demonstrado que camundongos BALB/c produziram IgM, IgG, IgA e IgE
contra o extrato bruto (EB) e antígenos secretados e excretados (SE) do parasito (8), já
os camundongos da linhagem C57BL/6 produziram as imunoglobulinas: IgA, IgM, IgG
respondendo melhor aos antígenos do EB do que aos produtos SE de L. minor (18).
Os resultados aqui apresentados sugerem que a maior quantidade de células
CD19+ no baço de camundongos BALB/c possa estar associada com funcionalidade
dessas células e melhor produção de anticorpos que participam na resistência a infecção
por L. minor.
Aos 100 DAI na linhagem BALB/c foi verificado aumento no índice de
células F4/80+, CD4+, CD8+ e CD19+ esplênicas. Neste dia de infecção descrevemos
anteriormente lesões pulmonares menos intensas e um menor número de nódulos
74
subcutâneos contendo L3 encistadas nos camundongos BALB/c, em relação aos
camundongos linhagem C57BL/6 infectados.
Os achados da avaliação por IHQ considerando os índices de células marcadas
possibilitaram associar o aumento preferencial de células CD4+ e CD19+ esplênicas
com resistência a lagochilascariose experimental nos camundongos BALB/c e o
aumento preferencial de células CD8+ esplênicas com susceptibilidade nos animais
C57BL/6.
IMMUNOPHENOTYPING OF SPLEEN CELLS IN SUSCEPTIBLE AND
RESISTANT MICE WITH EXPERIMENTAL LAGOCHILASCARIOSIS
Lagochilascariosis is an emerging parasitic disease whose etiologic agent is
Lagochilascaris minor. The experimental model in mice has been used to study the
immune response during infection by L. minor. In this study, we evaluated spleen cell
populations in susceptible (BALB/c) and resistant (C57BL/6) mice experimentally
infected with L. minor. BALB /c mice exhibited increased the index of spleen cells:
F4/80+ at 100 days post-infection; CD4 + cells to 100 and 250 days after infection; CD8
+ cells at 35 and 100 days post-infection; CD19 + cells at 100, 150 and 250 days postinfection. In C57BL / 6 mice infected showed an increase the index of spleen cells: of
F4/80 + to 250 days of infection, increase in CD4 + cells at 150 days, an increase of
CD8 + cells at 35, 150 and 250 days and increased CD19 + cells to 150 and 250 days
after infection. These results indicate involvement of these cells in the control of
experimental infection by L. minor.
KEY WORDS
Lagochilascaris minor, helminths, immune response, lymphocytes
75
REFERÊNCIAS
1. Ahmed SF, Oswald IP, Caspar P, Hieny S, Keefer L, Sher A, James SL.
Developmental differences determine larval susceptibility to nitric oxide-mediated
killing in a murine model of vaccination against Schistosoma mansoni. Infect Immun
65: 219- 226, 1997.
2. Barbosa CAL, Barbosa AP, Campos DMB. Gato doméstico (Felis catus domesticus)
como possível reservatório de Lagochilascaris minor Leiper, 1909. Rev Patol Trop 34:
205- 211, 2005.
3. Campos DMB, Freire Filha LG, Vieira MA, Paçô JM, Maia MA. Experimental life
cycle of Lagochilascaris minor Leiper, 1909. Rev Inst Med Trop S.Paulo 34: 277- 287,
1992.
4. Campos DMB. Lagochilascaris. In: David PN(ed) Parasitologia humana. 11ªedição.
Atheneu, São Paulo, 443- 446, 2005.
5. Cardona AE, Restrepo BI, Jaramillo JM, Teale JM. Development of an animal model
for neurocysticercosis: immune response in the central nervous system is characterized
by a predominance of gamma delta T cells. J Immunol 162: 995- 1002, 1999.
6. Carvalhaes MS, Spadafora-Ferreira MS, Portaro F, Mortara R, Tambourgi DV. A
CRT-like molecule from L3 L.minor larvae. In: ImmunoRib, Ribeirão Preto. Anais da
SBI: 77- 77, 2008.
7. Cheroutre H & Lambolez F. Doubting the TCR coreceptor function of CD8 alpha
alpha. Immunity 28: 149- 159, 2008.
8. Freitas JG, Prudente MFS, Spadafora-Ferreira M, Junqueira-Kipnis AP, Paula EC,
Tambourgi DV, Lino-Júnior RS, Carvalhaes MS. Lagochilascaris minor: Experimental
infection of C57BL/6 and BALB/c isogenic mice reveals the presence of adult worms.
Exp Parasitol 119: 325- 331, 2008.
76
9. Guimarães VC, Barbosa AP, Camargo LA, Siqueira PH, Silva Filho J, Castro VLS,
Barbosa MA, Campos DMB. Lagochilascaris minor otomastoiditis in child: case repost.
Int Arch Otorhinolaryngol 14: 373- 376, 2010.
10. Humphreys NE, Worthington JJ, Little MC, Rice EJ, Grencis RK.The role of CD8+
cells in the establishment and maintenance of a Trichuris muris infection. Parasite
Immunol 26: 187- 196, 2004.
11. King IL & Mohrs M. IL-4-producing CD4+ T cells in reactive lymph nodes during
helminth infection are T follicular helper cells. J Exp Med 206: 1001- 1007, 2009.
12. Kurotaki D, Kon S, Bae K, Ito K, Matsui Y, Nakayama Y, Kanayama M, Kimura
C, Narita Y, Nishimura T, Iwabuchi K, Mack M, van Rooijen N, Sakaguchi S, Uede
T, Morimoto J.CSF-1–dependent red pulp macrophages regulate CD4 T Cell
Responses. J Immunol 186: 2229- 2237, 2011.
13. Mebius RE & Kraal G. Structure and function of the spleen. Nat Rev Immunol 5:
606- 616, 2005.
14. Mosser DM & Edwards JP. Exploring the full spectrum of macrophage activation.
Nature Rev Immunol 8: 958- 969, 2008.
15. Noël W, Raes G, Hassanzadeh Ghassabeh G, De Baetselier P, Beschin A.
Alternatively activated macrophages during parasite infections. Trends Parasitol 20:
126- 133, 2004.
16. Oliveira JA, Barbosa CL, Vieira MA, Paço JM, Carrijo AS, Fiorini MP, Campos
DMB. Isolado de Lagochilascaris minor: procedimentos para obtenção de ovos
infectantes. Rev Patol Trop 31: 121-128, 2002.
17. Prudente MFS, Freitas JG, Ribeiro EL, Carvalhaes MS. Influence of the genetic
pattern and sex of mice in experimental lagochilascariosis. Helminthologia 46: 31- 34,
2009.
77
18. Prudente MFS, Crespo AMC, Carvalhaes MS. Lagochilascaris minor: antibody
production in experimentally infected mice. Rev da Soc Bras de Med Trop 42: 325328, 2009.
19. Roig-Ocampos JL, Forteza JLRO, Granato L, Serafini DP. Otomastoidititis with
right retroauricular fistula by Lagochilascaris minor. Braz J Otorhinolaryngol 76: 407407, 2010.
20. Rutitzky LI, Lopes da Rosa JR, Stadecker MJ. Severe CD4 T cell- mediated
immunopathology in murine schistosomiasis is dependent on 12p40 and correlates with
high levels of IL-17. Journal of Immunology 175: 3920- 3926, 2005.
21. Sakamoto T & Cabrera PA. Subcutaneous infection of Lagochilascaris minor in
domestic cats from Uruguay. Vet Parasitol 108: 145-152, 2002.
22. Semerene AR, Lino Junior RS, Oliveira JA, Magalhães AV, Stefani MMA, Barbosa
AP, Campos DMB. Experimental Lagochilascariosis: Histopathological study of
inflammatory response to larval migration in the murine model. Mem Inst Oswaldo
Cruz 99: 393- 398, 2004.
23. Smits HH, Everts B, Hartgers FC, Yazdanbakhsh M. Chronic helminth infections
protect against allergic diseases by active regulatory processes. Curr Allergy Asthma
Resp 10: 3- 12, 2010.
24. Spadafora-Ferreira M, Fernandes LC, Hoffman Pfrimer IA, Pichiteli CR, Vilarinho
Tambourgi D, de Souza Lino-Junior R, Carvalhaes MS. Lagochilascaris minor:
Susceptibility and resistance to experimental infection in mice is independent of H-2a
haplotype and correlates with the immune response in immunized animals. J Parasitol
Res 1- 8, 2010.
78
25. Tedder TF, Inaoki M, Sato S. The CD19-CD21 complex regulates signal
transduction thresholds governing humoral immunity and autoimmunity. Immunity 6:
107- 118, 1997.
26. Teixeira VPA; Pereira SAL. et al. Princípios básicos e aplicações da morfometria.
[on
line].
Minas
Gerais,
2005.
Disponível
no
endereço
eletrônico:
http://www.uftm.edu.br/instpub/fmtm/patge/morfometria01.htm. Acesso em maio de
2011.
27. Trujillo JA, Montoya IR, Sosa MR, Terrazas LI. Nitric oxide contributes to host
resistance against experimental Taenia crassiceps cysticercosis. Parasitol Res 100:
1341- 1350, 2007.
28. Van den Berg TK & Kraal G. A function for the macrophage F4/80 molecule in
tolerance induction. Trends Immunol 26: 506- 509, 2005.
29. Volcán GS, Ochoa FR, Medrano CE, Valera Y. Lagochilascaris minor infection in
Venezuela. Report of case. Am J Trop Med Hyg 31: 111- 113, 1992.
LEGENDAS DAS FIGURAS
Figura 1.
Imunoistoquímica do baço de camundongos BALB/c infectados, sem
anticorpo de marcação (CN, controle negativo) e com os anticorpos anti-marcadores
celulares F4/80, CD4, CD8 e CD19. As setas apontam para marcação celular localizada
na região folicular da polpa branca do baço; aumento de 100X.
79
Figura 2. Determinação por imunoistoquímica de células F4/90+ no baço dos
camundongos BALB/c (A) e C57BL/6 (B) não infectados (controles - linha fina) ou
infectados com 1.000 ovos de Lagochilascaris minor por via oral (infectados - negrito),
em diferentes dias após a infecção. Os resultados foram expressos em mediana do
número de células por campo, com coluna indicando desvio médio, e barra
determinando o valor mínimo e máximo de células marcadas (* p< 0,05, Teste Mann
Whitney). IC: Índice de células F4/80+, considerando a média aritmética do número de
células marcadas por campo nos animais infectados (Мcel+Inf), dividida pela média
aritmética do número de células marcadas nos controles não infectados (Мcel+Cont),
nos diferentes dias após a infecção.
Figura 3. Determinação por imunoistoquímica de células CD4+ no baço dos
camundongos BALB/c (A) e C57BL/6 (B) não infectados (controles- linha fina) ou
infectados com 1.000 ovos de Lagochilascaris minor por via oral (infectados - negrito),
em diferentes dias após a infecção. Os resultados foram expressos em mediana do
número de células por campo, com coluna indicando desvio médio, e barra
determinando o valor mínimo e máximo de células marcadas (* p< 0,05, Teste Mann
Whitney). IC: Índice de células CD4+, considerando a média aritmética do número de
células marcadas por campo nos animais infectados (Мcel+Inf), dividida pela média
aritmética do número de células marcadas nos controles não infectados (Мcel+Cont),
nos diferentes dias após a infecção.
80
Figura 4. Determinação por imunoistoquímica de células CD8+ no baço dos
camundongos BALB/c (A) e C57BL/6 (B) não infectados (controles- linha fina) ou
infectados com 1.000 ovos de Lagochilascaris minor por via oral (infectados - negrito),
em diferentes dias após a infecção. Os resultados foram expressos em mediana do
número de células por campo, com coluna indicando desvio médio, e barra
determinando o valor mínimo e máximo de células marcadas (* p< 0,05, Teste Mann
Whitney). IC: Índice de células CD8+, considerando a média aritmética do número de
células marcadas por campo nos animais infectados (Мcel+Inf), dividida pela média
aritmética do número de células marcadas nos controles não infectados (Мcel+Cont),
nos diferentes dias após a infecção.
Figura 5. Determinação por imunoistoquímica de células CD19+ no baço dos
camundongos BALB/c (A) e C57BL/6 (B) não infectados (controles - linha fina) ou
infectados com 1.000 ovos de Lagochilascaris minor por via oral (infectados - negrito),
em diferentes dias após a infecção. Os resultados foram expressos em mediana do
número de células por campo, com coluna indicando desvio médio, e barra
determinando o valor mínimo e máximo de células marcadas (* p< 0,05, Teste Mann
Whitney). IC: Índice de células CD19+, considerando a média aritmética do número de
células marcadas por campo nos animais infectados (Мcel+Inf), dividida pela média
aritmética do número de células marcadas nos controles não infectados (Мcel+Cont),
nos diferentes dias após a infecção.
81
FIGURAS
82
83
84
ANEXO 3 – Regras do Convênio Butantan-UFG para publicação de
trabalho
A- Segundo termos do convenio entre os laboratórios de
Imunoquímica do Instituto Butantan de São Paulo e do
Laboratório de Imunoquímica da UFG, a ordem dos autores
nos trabalhos a serem publicados obedecerá a ordem
quantitativa de trabalho, salvo quando um dos pesquisadores
solicitar a primeira autoria, seguindo as regras Nacionais e
Internacionais de publicação;
B- Para fins de participação em Congressos, a Profa. Monica
Spadafora-Ferreira será sempre última autora, e Profa. Mara
Silvia Carvalhaes a penúltima. O nome dos alunos deve
obedecer a ordem quantitativa de trabalho, exceto quando
para fins de solicitação de verba para participação em evento
esta ordem necessitar de modificação, com a anuência dos
corrdenadores do projeto, seguindo as regras Nacionais e
Internacionais de participação em Congressos e eventos.
Profa. Dra Mara Carvalhaes
Sub-coordenadora do convênio entre os laboratórios de Imunoquímica do Instituto Butantan e
UFG
Profa. Dra. Mara Carvalhaes
Lab. Imunoquimica
IPTSP-UFG
Atentar para a RESOLUÇÃO – CEPEC/UFG Nº 1037Seção II
Do Desligamento
Art. 47. Além dos casos previstos no Regimento Geral da UFG, será
desligado do Programa o aluno que:
VIII - ferir protocolo de programa de convênio nacional ou internacional ao qual
o projeto do estudante esteja vinculado