COLÉGIO RESSURREIÇÃO NOSSA SENHORA
Série/Turma:
Data:
18/04/2016
3ª Série
Disciplina:
Professor(a):
Química
Avaliação:
Trabalho de recuperação
Natan
Período:
Valor:
Nota:
1o. Bimestre
Aluno(a): ___________________________________________
ATENÇÃO: ENTREGAR O TRABALHO DIA 18/04/2016. ANTES DA PROVA
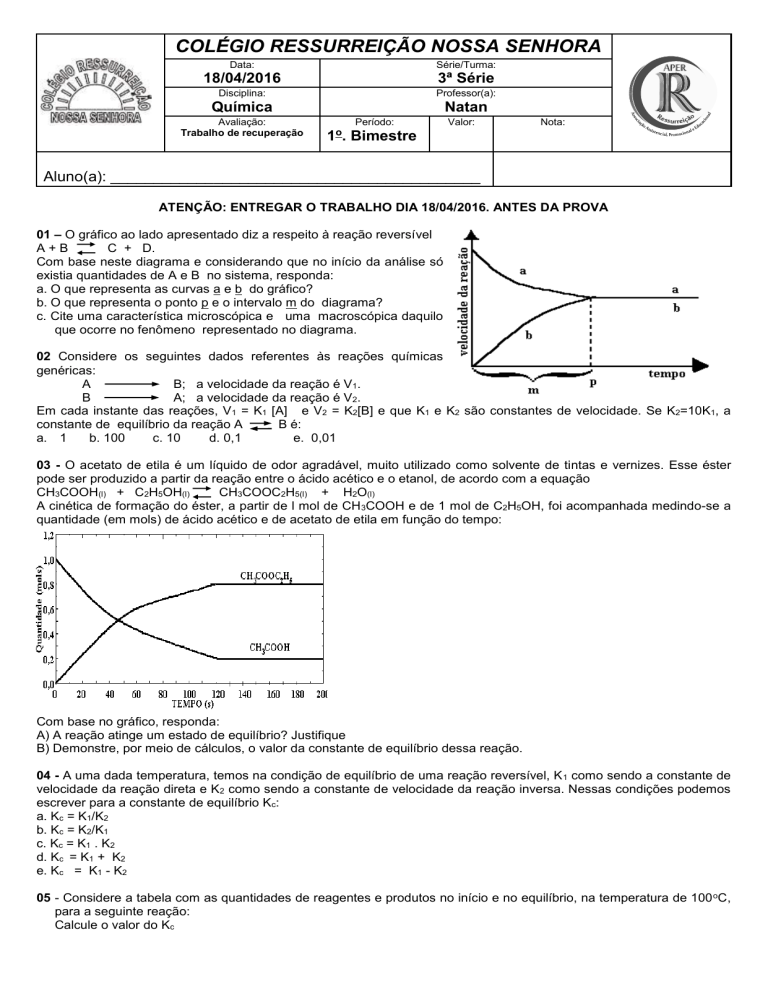
01 – O gráfico ao lado apresentado diz a respeito à reação reversível
A+B
C + D.
Com base neste diagrama e considerando que no início da análise só
existia quantidades de A e B no sistema, responda:
a. O que representa as curvas a e b do gráfico?
b. O que representa o ponto p e o intervalo m do diagrama?
c. Cite uma característica microscópica e uma macroscópica daquilo
que ocorre no fenômeno representado no diagrama.
02 Considere os seguintes dados referentes às reações químicas
genéricas:
A
B; a velocidade da reação é V1.
B
A; a velocidade da reação é V2.
Em cada instante das reações, V1 = K1 [A] e V2 = K2[B] e que K1 e K2 são constantes de velocidade. Se K2=10K1, a
constante de equilíbrio da reação A
B é:
a. 1
b. 100
c. 10
d. 0,1
e. 0,01
03 - O acetato de etila é um líquido de odor agradável, muito utilizado como solvente de tintas e vernizes. Esse éster
pode ser produzido a partir da reação entre o ácido acético e o etanol, de acordo com a equação
CH3COOH(l) + C2H5OH(l)
CH3COOC2H5(l) + H2O(l)
A cinética de formação do éster, a partir de l mol de CH 3COOH e de 1 mol de C2H5OH, foi acompanhada medindo-se a
quantidade (em mols) de ácido acético e de acetato de etila em função do tempo:
Com base no gráfico, responda:
A) A reação atinge um estado de equilíbrio? Justifique
B) Demonstre, por meio de cálculos, o valor da constante de equilíbrio dessa reação.
04 - A uma dada temperatura, temos na condição de equilíbrio de uma reação reversível, K 1 como sendo a constante de
velocidade da reação direta e K2 como sendo a constante de velocidade da reação inversa. Nessas condições podemos
escrever para a constante de equilíbrio Kc:
a. Kc = K1/K2
b. Kc = K2/K1
c. Kc = K1 . K2
d. Kc = K1 + K2
e. Kc = K1 - K2
05 - Considere a tabela com as quantidades de reagentes e produtos no início e no equilíbrio, na temperatura de 100 oC,
para a seguinte reação:
Calcule o valor do Kc
06 - O metanol, usado como combustível, pode ser obtido industrialmente pela hidrogenação do monóxido de carbono,
de acordo com a equação representada abaixo:
Assinale a afirmativa INCORRETA:
a) A diminuição da temperatura favorece a produção do metanol.
b) O aumento da pressão total sobre o sistema favorece a produção do monóxido de carbono.
c) O aumento da concentração de H2(g) aumenta a concentração de metanol no equilíbrio.
d) Trata-se de uma reação exotérmica.
e) O aumento da concentração de CO aumenta a temperatura.
07 - Uma das principais descobertas que impulsionou a produção de alimentos foi o processo industrial de Haber-Bosch
da produção de amônia, que ocorreu há cerca de 100 anos, de acordo com a reação (1):
O gráfico abaixo representa a modificação que acontece nas concentrações dos reagentes e produto, após uma
perturbação do equilíbrio no tempo t1.
De acordo com o gráfico, essa perturbação poderia ser causada por:
a) Aumento da pressão total.
b) Adição de NH3.
c) Aumento da temperatura.
d) Adição de H2.
e) Adição de N2.
08 - A síntese do metanol envolve o seguinte equilíbrio:
A respeito dos fatores que alteram o equilíbrio de uma reação, o procedimento correto, para aumentar o rendimento
da produção do metanol, é:
a) Remover CO do sistema.
b) Comprimir o sistema.
c) Diminuir a pressão total do sistema.
d) Adicionar CH3OH ao sistema.
e) Aumentar a temperatura.
09- Conhecido como um protetor da saúde humana, por bloquear os raios ultravioletas na atmosfera, o ozônio é também
um dos maiores poluentes do ar nas grandes cidades. Os automóveis emitem os gases necessários para sua formação.
Sob ação de radiações eletromagnéticas, o ozônio é formado através da reação endotérmica:
Sobre essa reação, assinale a afirmativa CORRETA:
a) O aumento da temperatura dificulta a formação de ozônio.
b) Se para a reação K 1, então o oxigênio predomina no equilíbrio.
c) Considerando a concentração, no equilíbrio, de ambos os gases igual a 0,3 mol/L, então o valor de K será 1,33.
d) O aumento da pressão favorece a formação de ozônio.
e) O valor da temperatura e o da K variam de modo inversamente proporcional.
10 – O equilíbrio representativo da formação da amônia é:
É INCORRETO afirmar que:
a) A constante desse equilíbrio depende da temperatura.
b) A constante desse equilíbrio independe da pressão.
c) A reação de formação da amônia é exotérmica.
d) Um aumento da pressão deslocará o equilíbrio para o lado esquerdo.
e) Um aumento da temperatura deslocará o equilíbrio para o lado esquerdo.
11 - Uma reação química atinge o equilíbrio químico quando:
a) O número de moléculas da reação direta é igual ao número de moléculas da reação inversa.
b) A concentração das substâncias envolvidas nas reações direta e inversa não apresenta mudança perceptível a
olho nu.
c) Os reagentes da reação direta são totalmente consumidos.
d) As reações direta e inversa ocorrem simultaneamente.
e) Na reação direta o número de mol dos reagentes é igual ao número de mol dos produtos.
12 - Sobre uma reação química em equilíbrio químico: Marque V ou F:
I - ( ) A velocidade da reação direta é igual à velocidade da reação inversa.
II – ( ) A mudança da concentração de um dos reagentes não altera o equilíbrio.
III – ( ) A constante de equilíbrio é proporcional à concentração dos produtos da reação direta.
IV – ( ) Numa reação gasosa o aumento da pressão sobre o sistema altera o equilíbrio.
13 - O metano retirado do biogás pode ser a alternativa para a produção de hidrogênio utilizado em células de
combustível, de acordo com o sistema em equilíbrio representado pela equação química:
CH4(g) + H2O(g)
CO(g) + 3H2(g),
Considerando-se essas informações e admitindo-se que as pressões parciais do CH4(g),H2O(g) ,CO(g) e H2(g) são,
respectivamente, 0,40 atm,0,40 atm, 0,40 atm e 0,80 atm na mistura em equilíbrio a 900K,
a) Escreva a expressão para o cálculo do Kp para esse equilíbrio.
b) Calcule o valor do Kp desse equilíbrio a 900K.
14 - Na fabricação de bebida refrigerante, durante a etapa de envasamento, é realizada a gaseificação, que consiste na
adição de CO2(g) ao líquido. Portanto, em uma garrafa de refrigerante tem-se o seguinte equilíbrio:
CO2(g) + H2O(l)
H2CO3(aq)
a) Escreva a expressão matemática do Kc para esse equilíbrio.
b) Qual é a condição a ser mantida para que o refrigerante não perca o gás?
15 - As reações químicas abaixo se referem a equilíbrios químicos que foram estabelecidos dentro de cilindros providos
de êmbolo com válvulas fechadas. Se o volume interno em cada cilindro for reduzido à metade, a temperatura
permanecendo constante, como deslocará cada equilíbrio?
a)H2(g) + I2(g)
2 HI(g)
b) CaCO3(s)
CaO(s) + CO2(g)
c) NH3(g) + H2O(l)
NH4OH(aq)
d) 2CO(g) + O2(g)
2CO2(g)












