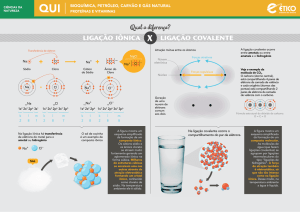
Exercício de ligações Químicas
1. Escreva as fórmulas íonicas ou moleculares e as eletrônicas (Lewis) para os compostos formados entre:
a. C e Cℓ
d. Na e S
g. Ba e S
l. N e Cℓ
b. N e H
e. C e O
h. Aℓ e O
m. K e F
c. Ca e Br
f. O e F
i. P e Cℓ
n. Mg e O
2. Para os compostos abaixo, selecione aqueles capazes de conduzir corrente elétrica, aponte as condições
(estado físico ou solução aquosa) e justifique.
KBr ; PH3 ; Na2SO4 ; CaO ; C16H18N2O4 ; CaCO3 ; NaCl ; C12H22O11 ; N2O5 ; CuSO4 ; C6H12O6
3. A fórmula entre cátion X
a) XY.
b) XY3.
c) X7Y
3+
e o ânion Y – 1 é:
.d) X3Y7
.e) X7Y3.
4. Em um determinado tipo de ligação química, ocorre a formação de íons devido à perda ou ao ganho de
elétrons pelos átomos. Supondo-se uma ligação que dê origem aos íons Na 1 + e F – 1, é correto afirmar que:
(Dados: 11Na23 e 9F19).
a) O íon F – 1 tem massa maior que o íon Na1 +.
d) Os íons são isótopos.
b) Os íons têm distribuição eletrônica igual.
e) Os íons têm massa atômica igual.
c) Os íons têm números atômicos iguais.
5. Um elemento químico M apresenta distribuição eletrônica 1s2 2s2 2p6 3s2 3p6 4s2. Sobre este elemento é
errado dizer que:
a) Origina cátion bivalente
b)Liga-se ao oxigênio, formando um composto do tipo MO2.
c) Perde 2 elétrons para se tornar estável. d) É um metal. e) Forma composto iônico com o cloro.
6. Assinale a alternativa que apresenta composto com ligação química essencialmente iônica?
a) NaI.
b) CO2.
c) HCl. d) H2O. e) CH4.
7. A camada mais externa de um elemento X possui 3 elétrons, enquanto a camada mais externa de outro
elemento Y tem 7 elétrons. Uma provável fórmula de um composto, formado por esses elementos é:
a) XY3.
b) X5Y.
c) X3Y.
d) X7Y3.
e) XY.
8. Sobre o composto formado pela combinação do elemento X (Z = 20) com o elemento Y (Z = 9) podemos
afirmar que:
a) É um composto iônico.
c) Tem fórmula XY2.
b) O ânion presente foi originado pelo átomo de X.
d) Possui cátion X2+.
e) Apresenta fórmula XY.
9. Sobre ligações iônicas afirma-se:
a) Os gases nobres, sem exceção, têm 8 elétrons na camada de valência.
b) Em geral, um átomo torna-se estável, quando adquire configuração de gás nobre
c) Em uma ligação iônica, há transferência de prótons de um elemento para o outro.
d) Uma ligação eletrovalente (iônica) ocorre entre um metal e um ametal.
e) Todo composto iônico tem baixo ponto de fusão.
10. Átomos do elemento X, da família 3A, combina-se com Y, da família 5A. Sobre estes átomos temos que:
a) O elemento X possui na sua camada de valência 3 elétrons.
b) O elemento Y possui na sua camada de valência 5 elétrons.
d) O elemento X forma o íon X
3+.
e)O elemento Y forma o ânion Y3
c) O composto formado possui fórmula X5Y3.
11. Um elemento X, cujo número atômico é 12, combina-se com um elemento Y, situado na família 5A da tabela
periódica e resulta num composto iônico cuja fórmula provável será:
a) XY.
b) XY2.
c) X2Y.
d) X2Y3.
e) X3Y2.
12. Num composto, sendo X o cátion e Y o ânion, e a fórmula X 2Y3, provavelmente os átomos X e Y no estado
normal tinham os seguintes números de elétrons na camada de valência, respectivamente:
a) 2 e 3.
b) 2 e 5.
c) 3 e 2.
d) 3 e 6.
e) 5 e 6.
13. Um elemento X (Z = 20) forma com Y um composto de fórmula X3Y2. O número atômico de Y é:
a) 7.
b) 9.
c) 11.
d) 12.
e) 18.
14. O elemento químico alumínio (Z = 13) pode se ligar a um elemento químico para formar um composto iônico
na proporção de 1:3. Este elemento químico pode ter número atômico:
a) 11.
b) 3.
c) 9.
d) 31.
e) 5.
15. Nas condições ambientes, os compostos iônicos:
a) São sempre sólidos.
b) São sempre líquidos.
c) Podem ser líquidos ou gasosos.
d) São sempre gasosos.
e) Podem ser sólidos, líquidos ou gasosos.
16. Um composto apresenta as propriedades a seguir:
1 – alto ponto de fusão e ebulição.
2 – sólido à temperatura ambiente.
3 – bom condutor de corrente elétrica no estado líquido ou em solução aquosa.
Este composto deve ser formado pelos seguintes elementos:
a) sódio e potássio.
d) oxigênio e nitrogênio.
b) magnésio e flúor.
e) carbono e hidrogênio.
c) cloro e oxigênio.
17. Dois elementos químicos X e Y combinam-se formando uma substância molecular XY3.
números atômicos, respectivamente:
a) 1 e 7.
b) 2 e 9.
c) 13 e 16.
d) 15 e 35.
X e Y podem ter
e) 20 e 36.
18. A fórmula N Ξ N indica que os átomos de nitrogênio estão compartilhando três:
a) Prótons.
b) Elétrons.
c) Pares de prótons.
d) Pares de nêutrons.
e) Pares de elétrons.
19. O hidrogênio (Z = 1) e o nitrogênio (Z = 7) devem formar o composto de fórmula:
a) N2H.
b) NH2.
c) NH3.
d) NH4.
e) NH5.
20. Na reação de óxido de lítio com ácido clorídrico, ocorre a formação de cloreto de lítio e água:
Li2O + 2
HCℓ 2 LiCℓ + H2O . As substâncias envolvidas nesta reação apresentam os seguintes tipos de ligações
químicas:
Li2O
Covalente
Covalente
Iônica
Iônica
Iônica
a)
b)
c)
d)
e)
HCℓ
Covalente
Iônica
Covalente
Covalente
Iônica
LiCℓ
Iônica
Iônica
Covalente
Iônica
Covalente
H2O
Iônica
Covalente
Iônica
Iônica
Covalente
21. O elemento mais eletronegativo do terceiro período na classificação periódica une-se, respectivamente, ao
hidrogênio e ao sódio através de ligações:
a) covalente e metálica.
b) covalente e iônica. c) metálica e covalente.
d) metálica e iônica.
e) iônica e covalente.
22. As ligações químicas nas substâncias K(s), HCl(g), KCl(s) e Cl2(g), são respectivamente:
a) Metálica, covalente polar, iônica, covalente apolar.
b) Iônica, covalente polar, metálica, covalente apolar.
c) Covalente apolar, covalente polar, metálica, covalente apolar.
d) Metálica, covalente apolar, iônica, covalente polar.
e) Covalente apolar, covalente polar, iônica, metálica.
23. Uma ligação química formada pelo compartilhamento de elétrons é uma ligação
a) eletrostática.
b) iônica.
c) covalente.
d) poliatômica.
e) eletrovalente.
24. Quantos elétrons são requeridos na camada mais externa de um elemento para que o mesmo seja estável?
a) 1.
b) 4.
c) 5.
d) 6.
25. Gases nobres não reagem com nenhum outro elemento porque
a) o nível eletrônico mais externo está completo com 8 elétrons..
b) seus núcleos são muito pequenos.
c) a temperatura não está alta o suficiente.
d) a pressão não está alta o suficiente..
e) a camada de valência está vazia.
e) 8.