Vidro fosco difuso com
insuficiência respiratória
achados
de
fibrose
e
Autores: Mariah Prata*, Lilian Tiemi Kuranishi**, Karin Muller Storrer**,
Rimarcs Gomes Ferreira***, Carlos Alberto de Castro Pereira****.
*Residente da Disciplina de Pneumologia-UNIFESP
** Pós-graduandas programa de Doenças Intersticiais, Disciplina de
Pneumologia- UNIFESP
*** Docente Anatomia Patológica-UNIFESP
****Orientador de pós-graduação, programa de Doenças Intersticiais,
Disciplina de Pneumologia- UNIFESP
Paciente do sexo masculino, 44 anos, natural e procedente de Jequié –
BA, ex-comerciante e atual caminhoneiro. Vem encaminhado de outro serviço,
com história de dispnéia aos esforços há 2 anos, com piora progressiva, sendo
que atualmente apresentava-se aos mínimos esforços. Há 4 meses iniciou com
tosse produtiva com secreção clara. Negava emagrecimento ou febre no
período. Negava tabagismo ou sintomas para colagenose. Relatava ter morado
em casa com mofo por 5 anos, mudando-se há 2 anos. Como comorbidades,
referia ser hipertenso controlado em uso de losartana e anlodipino. Queixavase de sintomas de azia e queimação epigástrica freqüente, controlados com
uso de omeprazol 20mg/d. Pelo quadro pulmonar, já estava usando prednisona
40mg/d e oxigenioterapia há 8m, sem melhora dos sintomas.
Ao exame, encontrava-se em regular estado geral, lúcido, corado,
taquipneico. À ausculta cardiopulmonar, evidenciavam-se estertores em velcro
nas bases com bulhas cardíacas normofonéticas. PA=140x85mmHg,
FC=85bpm, FR=28irpm SpO2=90% com O2 4L/min/ 70%em ar ambiente e ao
repouso. Abdome sem visceromegalias, extremidades com baqueteamento
digital.
A espirometria mostrava: CVF=0,97L (24%) VEF1=0,68L (26%)
VEF1/CVF=0,70.
Gasometria
arterial
com
O2
4L/min:
pH=7,37
PaO2=67,9mmHg
PaCO2=49,6mmHg
Bic=28mmol/L
SatO2=92,4%.
Hemograma, função renal e hepática normais. Provas reumatológicas
negativas.
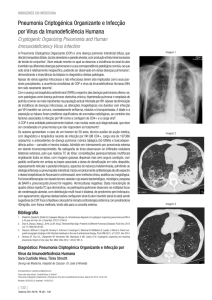
A tomogafia de tórax de alta resolução tinha um padrão em vidro fosco
difuso, associado a infiltrado reticular com bronquiectasias de tração e
bronquioloectasias com predomínio em campos superiores e regiões centrais.
TOMOGRAFIA DE TÓRAX
BIÓPSIA PULMONAR CIRÚRGICA
Questões
1. Considerando os dados clínicos e o padrão tomográfico do presente
caso, qual a hipótese diagnóstica mais provável?
a) Pneumonite de Hipersensibilidade
b) Pneumonia Intersticial Não Específica
c) Fibrose Pulmonar Idiopática
d) DPI secundária à aspiração crônica
e) Sarcoidose Fibrosante
Neste caso, o paciente apresenta poucos dados clínicos e
epidemiológicos que ajudam na definição do diagnóstico. Os dados
positivos são: exposição prévia a mofo, que sugere PH, e sintomas
dispépticos, porém não comprovados, que sugere DPI associado a
aspiração crônica. A TCAR possui um padrão em vidro fosco difuso,
com sinais de fibrose pelos achados de infiltrado reticular,
bronquiectasias de tração e bronquioloectasias, com predomínio nos
campos superiores e em região central. Este padrão em vidro fosco com
fibrose pode ser encontrado na PINE com fibrose, na PH crônica, na
pneumonia intersticial descamativa, na FIP atípica, na pneumonia
intersticial de células gigantes e mais raramente em outras DPIs. Assim,
os achados tomográficos, somados à exposição prévia a mofo, sugerem
mais o diagnóstico de PH.
A PINE está mais associada a colagenoses, e neste caso o paciente não
apresentava sintomas e as provas reumatológicas eram negativas. Para
sarcoidose e FIP, o padrão tomográfico do caso não é característico
destas DPIs. Na aspiração crônica, o comprometimento é mais central e
em regiões de língula e lobo médio, campos basais posteriores, distinto
do caso.
2. Qual a conduta a ser tomada para definição do diagnóstico?
a) Broncoscopia com biópsia transbrônquica e Lavado broncoalveolar
b) Pesquisa de antígenos causadores de PH
c) Biópsia pulmonar cirúrgica
d) Iniciar corticóide em doses altas
e) Encaminhar ao transplante pulmonar
A biópsia tranbrônquica com lavado broncoalveolar é muito utilizada
para definição das pneumopatias intersticiais. Entretanto, nos casos
onde o achado radiológico predominante é vidro fosco com fibrose, a
positividade é baixa, em torno de 25%, segundo um levantamento de
nosso banco de dados com cerca de 1800 pacientes (dados não
publicados). Além disso, o paciente não apresenta condições
clínicas favoráveis para o exame, evidenciado pela acentuada
hipoxemia e taquipnéia, com alto risco de necessidade de intubação
orotraqueal.
Por outro lado, sabemos que a biópsia pulmonar cirúrgica também
possui riscos, inerentes ao próprio procedimento, bem como ao
paciente. Fatores de risco associados a complicações são: CVF <
50% do predito, VEF1 < 1L, PaO2< 50-55mmHg, hipercapnia, uso
prolongado de oxigenioterapia. No presente caso todas essas
características estavam presentes.
O uso de corticosteróides em doses altas poderia trazer algum
benefício ao paciente, com alguma melhora clínica e funcional.
Entretanto, o paciente já fazia uso de prednisona 40mg/dia por 8
meses, sem resposta clínica.
Quanto ao transplante pulmonar, certamente haveria indicação,
entretanto, as condições sócio-econômicas eram totalmente
desfavoráveis.
Por fim, considerando que temos um paciente jovem, com uma
doença progressiva, é importante a definição do diagnóstico para
iniciar um tratamento o quanto antes e estabelecer um prognóstico.
Comparando-se os riscos e a positividade entre as biópsias
transbrônquica e cirúrgica, foi optado pela biópsia cirúrgica.
Felizmente o procedimento transcorreu sem intercorrências e o
paciente teve uma boa evolução no pós operatório.
3. Considerando os achados histológicos, qual seria o diagnóstico
provável?
a) Pneumonite de hipersensibilidade
b) Pneumonia intersticial não específica
c) Pneumonia descamativa
d) Pneumonia de células gigantes
e) Pneumonia em organização
Os achados histológicos foram de comprometimento difuso e
heterogêneo, com presença de processo inflamatório às custas de
linfócitos, descamação intra-alveolar, presença de células gigantes
multinucleadas. Estes achados são característicos de pneumonia de
células gigantes. Esta entidade é encontrada na peumopatia por
metal duro. O primeiro relato desta doença foi feita por Liebow, em
1968, quando descreveu uma pneumopatia intersticial em
trabalhadores de fábricas metalúrgicas que eram expostos a
tungstênio. Mais tarde, outros autores observaram a mesma DPI em
lapidadores de diamantes, que eram expostos a cobalto. Estes dois
metais são os mais frequentemente associados a PICG e já foram
publicados estudos onde foram identificados estas substâncias no
interior dos macrófagos e células multinucledas, por microscopia
eletrônica de varredura. Outros achados histológicos possíveis na
PICG são: áreas de bronquiolite obliterante, certa broncocentricidade
das lesões e faveolamento com extensa fibrose nas fases mais
avançadas.
Uma nova revisão detalhada da história ocupacional não revelou
causa aparente, no Brasil a mais freqüente sendo o trabalho com
afiação de ferramentas. Temos ainda observado casos expostos à
fabricação de tintas, onde o cobalto (azul) é utilizado.
4. Com o diagnóstico definido, qual seria a proposta terapêutica para o
caso?
a) Manter corticóide e oxigenioterapia
b) Manter apenas oxigenioterapia
c) Iniciar imunossupressor associado ao corticóide
d) Encaminhar ao transplante pulmonar
e) Iniciar imunobiológicos
O tratamento da PICG não está bem definido, segundo a literatura.
De maneira semelhante ao que ocorre na pneumonia de
hipersensibilidade, existem casos que melhoram apenas com
afastamento da exposição ao metal duro. Outros casos necessitam
de imunossupressores, como corticóide e ciclofosfamida. Entretanto,
são apenas alguns relatos de caso que mostraram boa evolução com
o tratamento imunossupressor. Quanto ao transplante pulmonar,
alguns casos já foram relatados com boa evolução, entretanto,
também há relatos de recidiva da doença após o transplante,
denotando um possível mecanismo de auto-imunidade. Quanto aos
imunobiológicos, não há estudos com estes medicamentos na PICG.
O paciente está em tratamento com pulsoterapia de
metilprednisolona semanal e ciclofosfamida mensal. Será reavaliado
após três meses de tratamento.
Bibliografia
1. Webb, RW, Muller, NL, Naidich, DP. High-resolution CT of the
lung. 2009.
2. Balmes JR. Hard metal interstitial lung disease: high-resolution
computed tomography appearance. J Thorac Imaging. 2002
Oct;17(4):314-8.
3. Choi JW, Lee KS, Chung MP, Han J, Chung MJ, Park JS. Giant
cell interstitial pneumonia: high-resolution CT and pathologic
findings in four adult patients. AJR Am J Roentgenol. 2005
Jan;184(1):268-72.
4. Nemery B, Verbeken EK, Demedts M. Giant cell interstitial
pneumonia (hard metal lung disease, cobalt lung). Semin Respir
Crit Care Med. 2001Aug;22(4):435-48.
5. Naqvi AH, Hunt A, Burnett BR, Abraham JL. Pathologic spectrum
and lung dust burden in giant cell interstitial pneumonia (hard
metal disease/cobalt pneumonitis): review of 100 cases. Arch
Environ Occup Health. 2008 Summer;63(2):51-70.
6. Moriyama H, Kobayashi M, Takada T, Shimizu T, Terada M,
Narita J, Maruyama M, Watanabe K, Suzuki E, Gejyo F. Twodimensional analysis of elements and mononuclear cells in hard
metal lung disease. Am J Respir Crit Care Med. 2007 Jul
1;176(1):70-7.
7. Bezerra PN, Vasconcelos AG, Cavalcante LL, Marques VB,
Nogueira TN, Holanda MA. Hard metal lung disease in an oil
industry worker. J Bras Pneumol. 2009 Dec;35(12):1254-8.
English, Portuguese. PubMed PMID: 20126930.


![[159] 65. BROnQUITE AGUdA 66. PnEUMOnIA cOMUnITÁRIA nO](http://s1.studylibpt.com/store/data/005889019_1-5f1e317583c896c73e7e648b6bfd1d7b-300x300.png)