UNIVERSIDADE TUIUTI DO PARANÁ
Fernando Augusto Pizzatto Sella
INSEMINAÇÃO ARTIFICIAL EM TEMPO FIXO (IATF)
CURITIBA
2011
Fernando Augusto Pizzatto Sella
INSEMINAÇÃO ARTIFICIAL EM TEMPO FIXO (IATF)
Trabalho de conclusão de curso apresentado ao curso
de Medicina Veterinária da Faculdade de Ciências
Biológicas e da Saúde da Universidade Tuiuti do
Paraná, como requisito parcial para obtenção de grau
de Médico Veterinário.
Orientador Acadêmico: Prof. Welington Hartmann
Orientador Profissional: Clovis Juk Fazzano.
CURITIBA
2011
2
TERMO DE APROVAÇÃO
Fernando Augusto Pizzatto Sella
INSEMINAÇÃO ARTIFICIAL EM TEMPO FIXO (IATF)
Este Trabalho de Conclusão de Curso foi julgado e aprovado para obtenção de título de Médico
Veterinário por uma banca examinadora do Curso de Medicina Veterinária da Universidade Tuiuti do
Paraná.
Curitiba, 21 de junho de 2011.
Orientador:
Prof.Dr. Welington Hartmann
Universidade Tuiuti do Paraná
Profª.Msc. Beatriz Calderari Viana
Universidade Tuiuti do Paraná
Prof. Antonio Carlos do Nascimento
Universidade Tuiuti do Paraná
3
APRESENTAÇÃO
Este é trabalho de Conclusão de Curso (TCC) apresentado ao curso de
Medicina Veterinária da Faculdade de Ciência e da Saúde da Universidade Tuiuti do
Paraná, pelo universitário Fernando Augusto Pizzatto Sella, como requisito parcial
para obtenção do título de Médico Veterinário. É composto de relatório de estágio,
no qual estão descritas as atividades na área de clínica, cirurgia de grandes animais
e biotecnologia da reprodução, durante o período de 14 de fevereiro a 20 de Abril de
2011 em Araçatuba - São Paulo. O estágio foi realizado em diversas localidades,
cumprindo estágio curricular correspondente a 360 horas de atividades. Nesse
trabalho foram descritas as atividades realizadas durante o estágio dando ênfase em
Inseminação Artificial em Tempo Fixo (IATF).
4
Este trabalho é dedicado a meus pais: Mauro Augusto e LucienDanielle,e a
meus avós Jair e Verônica.
5
AGRADECIMENTOS
Agradeço primeiramente a Deus e aos amigos espirituais, que me deram
forças para enfrentar as dificuldades encontradas ao longo da vida.
Aos meus pais Mauro Augusto Bertan Sella e Lucien Danielle Pizzatto Sella,a
meu irmão Vinicius Augusto Pizzatto Sella, que nunca mediram esforços nas suas
vidas para que eu pudesse realizar meus sonhos, e sempre dando o apoio e
incentivo necessário em todos os momentos em que precisei obrigado pelo amor,
carinho e confiança em mim depositados. A minha namorada Evelyn Oliveira Araujo
Gutervil pela compreensão, apoio nos momentos mais difíceis que sempre me
ajudou com muito amor.
Agradeço a equipe técnica da Fazzembryo, especialmente ao Médico
veterinário orientador e amigo Clovís Juk Fazzano, o meu muito obrigado por
sempre ter me passado seus conhecimentos e estando sempre disponível em todos
os momentos em que precisei.
Aos professores, mestres e amigos Antonio Carlos, Maria Aparecida de
Alcântara, Beatriz Calderari, João Ari Hill, Elza Maria Galvão Ciffoni, e meu
orientador e grande amigo Wellington Hartmann.
Aos grandes amigos conquistados durante estes 5 anos de faculdade, que
sempre estavam dispostos a me ajudar nas horas em que precisei, as provas, os
churrascos, os momentos de risadas, as conversas sérias, e com certeza ficaram
registrados em minha memória, obrigado a todos: Rogelio (Drauzio), Frederico
(Mancha), André Signor (Rondonia), Alexandre (Kibe) e Elder Capelleto, Thiago
(Cola) e todos os outros amigos que sempre lembrarei.
6
SUMÁRIO
LISTA DE ABREVIATURAS..................................................................................
LISTA DE TABELAS.............................................................................................
LISTA DE FIGURAS..............................................................................................
RESUMO................................................................................................................
1 INTRODUÇÃO....................................................................................................
2 ATIVIDADES REALIZADAS...............................................................................
3 INSEMINAÇÃO ARTIFICIAL EM TEMPO FIXO................................................
3.1 CICLO ESTRAL................................................................................................
3.2 HIPOTÁLAMO..................................................................................................
3.2.1 Hormônio Liberador de Gonadotrofina..........................................................
3.3 HIPÓFISE.........................................................................................................
3.4 HORMÔNIOS HIPOFISÁRIOS GONADOTRÓFICOS.....................................
3.4.1 Prolactina.......................................................................................................
3.4.2 Ocitocina........................................................................................................
3.5 HORMÔNIOS SINTETIZADOS NOS OVÁRIOS..............................................
4 FOLÍCULOS........................................................................................................
4.1 FOLICULOGÊNESE.........................................................................................
4.1.1 Folículo primário ou primordial......................................................................
4.1.2 Folículo secundário ou pré-antral..................................................................
4.1.3 Folículo terciário ou antral.............................................................................
4.1.4 Atresia folicular..............................................................................................
4.1.5 Corpo lúteo....................................................................................................
4.2 HORMÔNIOS ESTEROIDES GONADAIS.......................................................
4.2.1 Estrógenos....................................................................................................
4.2.2 Progestágenos..............................................................................................
4.2.3 Relaxina.........................................................................................................
4.2.4 Inibina............................................................................................................
4.2.5 Ativinas..........................................................................................................
4.2.6 Folistatina .....................................................................................................
4.3 HORMÔNIOS PLACENTÁRIOS......................................................................
4.3.1 Gonadotrofina coriônica equina.....................................................................
4.3.2 Gonadotrofina coriônica humana..................................................................
4.3.3 Lactogênio placentário..................................................................................
4.3.3 Proteína B......................................................................................................
5 ÚTERO................................................................................................................
5.1 FUNÇÃO DO ÚTERO......................................................................................
5.1.1 Transporte espermático.................................................................................
5.1.2 Implantação e gestação................................................................................
5.2 Prostaglandina..................................................................................................
6 MANEJO REPRODUTIVO..................................................................................
6.1 ESCORE CORPORAL.....................................................................................
6.1.1 Influência do ECC sobre as taxas de não retorno.........................................
6.2 MANEJO DE AMAMENTAÇÃO E RETORNO DA ATIVIDADE OVARIANA...
6.2.1 Manejo de amamentação avaliados no experimento....................................
6.2.2 Atividade ovariana pós-parto.........................................................................
6.3 FATORES QUE AFETAM O ESTRO APÓS O PARTO OU ANESTRO PÓSPARTO...................................................................................................................
6.4 PROGRAMA DE DESCARTE DE FÊMEAS....................................................
6.5 PROGRAMA DE MANEJO SANITÁRIO..........................................................
7 INSEMINAÇÃO ARTIFICIAL EM TEMPO FIXO................................................
7.1 INSEMINAÇÃO ARTIFICIAL............................................................................
7.1.1 Vantagens da inseminação artificial..............................................................
9
10
11
12
13
14
15
16
17
18
18
19
20
20
21
22
22
22
23
23
23
24
25
25
26
27
27
28
28
28
28
29
29
29
30
30
30
31
31
33
34
37
37
38
38
39
40
41
42
42
42
7
7.1.2 Reconhecimento de cio.................................................................................
7.1.3 Problemas da baixa taxa de estro.................................................................
7.2 INSEMINAÇÃO ARTIFICIAL EM TEMPO FIXO..............................................
7.2.1 Vantagens da IATF........................................................................................
7.2.2 As principais vantagens da IATF...................................................................
7.2.3 Desvantagens da IATF..................................................................................
7.2.4 Limitações da IATF........................................................................................
7.2.5 Triagem de fêmeas visando inclusão em programas de IATF......................
7.2.6 Estrutura e análise para programas de IATF................................................
7.3 SINCRONIZAÇÃO DE ESTRO........................................................................
7.3.1 Programas hormonais para IATF..................................................................
7.3.2 Protocolo Ovsynch........................................................................................
7.3.3 Protocolo IATF...............................................................................................
8 DESCRIÇÃO DAS ATIVIDADES REALIZADAS DURANTE O ESTÁGIO........
8.1 DISCUSSÃO....................................................................................................
9 CONCLUSÃO.....................................................................................................
REFERÊNCIAS BIBLIOGRÁFICAS......................................................................
43
44
45
46
47
48
48
48
49
50
50
51
52
53
55
57
58
8
LISTA DE ABREVIATURAS
AOLC
Atividade Ovariana Luteal Cíclica
BE
Benzoato de Estradiol
CL
Corpo Lúteo
ECC
Escore de Condição Corporal
eCG
Gonadotrofina Coriônica Equina
EM
Estação de Monta
E2
Estrógeno
FD
Folículo Dominante
FSH
Hormônio Folículo Estimulante
GH
Hormônio do Crescimento
GnRH
Hormônio Liberador de Gonadotrofinas
IA
Inseminação Artificial
IATF
Inseminação Artificial em Tempo Fixo
LH
Hormônio Luteinizante
MN
Monta Natural
PGF2α
Prostaglandina F2α
P4
Progesterona
SNC
Sistema Nervoso Central
9
LISTA DE TABELAS
TABELA 1
AVALIAÇÃO DO ECC .................................................................... 35
TABELA 2
PROGRAMA DE MANEJO SANITÁRIO.........................................
TABELA 3
INFORMAÇÕES SOBRE O AUMENTO DA UTILIZAÇÃO DA 47
41
IATF NO BRASIL ...........................................................................
TABELA 4
IATF EM GADO COMERCIAL .......................................................
53
TABELA 5
IATF EM GADO PO .......................................................................
54
TABELA 6
ATIVIDADES REALIZADAS EM BOVINOS ................................... 55
10
LISTA DE FIGURAS
FIGURA 1
INFLUÊNCIA DO ECC SOBRE A TAXA DE PRENHEZ..................
36
FIGURA 2
ECC 1 ...............................................................................................
36
FIGURA 3
ECC 2 ...............................................................................................
36
FIGURA 4
ECC 3 ...............................................................................................
36
FIGURA 5
ECC 4 ...............................................................................................
37
FIGURA 6
ECC 5 ...............................................................................................
37
FIGURA 7
MÉTODO DE TRIMBERGER ...........................................................
44
11
RESUMO
A bovinocultura tem apresentado avanços significativos na área de reprodução, ás
novas biotecnologias de produção e reprodução de animais, os atendimentos da
clínica cirúrgica constituem grandes desafios e proporcionam um novo e amplo
campo de trabalho para os médicos veterinários que prestam atendimentos a
fazendas especializadas em bovinocultura de corte e leite. O emprego de técnicas
como a Inseminação Artificial (IA), Inseminação Artificial em Tempo Fixo (IATF),
Transferência de Embriões (TE), ultrassonografia e Sexagem Fetal vêm melhorando
os índices e resultados. Durante o estágio curricular realizado no período de 14 de
fevereiro a 20 de abril de 2011 houve a oportunidade de acompanhar a rotina de
fazenda de produção de gado de corte com o emprego da Inseminação Artificial em
Tempo Fixo e utilização de ultrassom para diagnóstico de gestação. Houve
acompanhamento a 416 atendimentos de clínica médica, 3 atendimentos de clínica
cirúrgica e 1694 relacionados a biotecnologias da reprodução, das quais 602 foram a
Inseminação Artificial em Tempo Fixo, sob orientação acadêmica do professor
Welington Hartmann e orientação profissional do médico veterinário Clóvis Juk
Fazzano.
12
1 INTRODUÇÃO
O Brasil possui o maior rebanho bovino comercial do mundo, com 207
milhões de cabeças (IBGE, 2007), destacando-se não somente pelo tamanho do
rebanho, mas também, pelo potencial de crescimento. O rebanho bovino no Estado
de São Paulo foi estimado para 2006 em 13,66 milhões de cabeças, com queda de
2,92% em relação ao ano de 2005 (BARUSSELLI, 2004).
Apesar dos números e das boas perspectivas, a produtividade do rebanho
brasileiro, quando comparada a de países de clima temperado, fica aquém do
desejado. A presença de componentes políticos, socioeconômicos e culturais, de
forma isolada ou em conjunto, contribuem para o baixo desempenho econômico da
pecuária bovina brasileira (PEREIRA, 2000). Fatores como forragens de baixa
qualidade, alta incidência de doenças infecciosas, parasitárias e nutricionais,
insuficiência de programas de melhoramento genético e sistema fundiário
ultrapassado, contribuem para os baixos índices de produtividade. A falha na
reprodução é um dos fatores mais importantes que limita o desempenho da pecuária
de corte brasileira (SILVA, 2005).
O melhoramento genético, baseado na seleção de indivíduos com maior
desenvolvimento ponderal, rendimento de carcaça, produção leiteira, melhor
conversão alimentar e precocidade sexual, possibilita o aumento da produtividade,
tanto de carne quanto de leite. Assim, a eficiente multiplicação de animais superiores
proporciona maior retorno econômico da atividade pecuária. No entanto, a
multiplicação e distribuição desse material genético somente são possíveis com
adequado manejo, sem o comprometimento da eficiência reprodutiva do rebanho
(SILVA, 2005).
13
2 LOCAL DE REALIZAÇÃO DE ESTÁGIO
O estágio curricular foi realizado na Empresa Fazzembryo, fundada no ano
de 2004 pelo médico veterinário Clóvis Juk Fazzano, com mais de 20 anos de
experiência na área de reprodução bovina. Foi criada, originalmente, com objetivo
de atender aos criadores com técnicas de última geração para melhores ganhos dos
criadores de bovinos de leite e corte.
Fazzembryo conta com avançado laboratório próprio para realização de
exames de brucelose, exame andrológico de bovinos, ovinos e equinos.
Atualmente, trabalham na referida empresa sete médicos veterinários e uma
zootecnista. Destaca-se que tais profissionais são especializados em diversas áreas,
como: coleta e congelamento de sêmen, atendimento clínico e cirúrgico, avaliação
reprodutiva por ultrassonografia em bovinos, ovinos e equinos, monitoramento de
estação de monta por monta natural, inseminação artificial, inseminação artificial em
tempo fixo, transferência de embriões em tempo fixo, inseminação artificial por
laparoscopia em ovinos, controle sanitário, monitoramento de programas de
melhoramento genético, entre outros.
A empresa está situada na região noroeste do estado de São Paulo, na
cidade de Araçatuba, a 550 km da capital, ponto estratégico para atender os estados
de Mato Grosso do Sul, Mato Grosso, Goiás, Minas Gerais, Paraná, Bahia, além do
estado de São Paulo. Atende grandes criadores de raças de bovinos de corte e leite,
além de ovinos e equinos, tornando-se, assim, uma referência na produção e
reprodução de grandes animais.
O estágio foi realizado em várias fazendas da região de São Paulo e Mato
Grosso do Sul. Cita-se as propriedades com maior frequência de atendimento:
Sítio 5 Mulheres - Bilac – SP, Agropecuária Jacarezinho - Valparaiso – SP,
Katayama Agropecuária - Guararapes – SP, Agropecuária Guadalupe - Santo
Antônio do Aracanguá – SP, Fazenda Pampili I e Pampili II – Birigui – SP, Nelore
Zeus - Birigui – SP, Fazenda Nova Alvorada- Piacatu – SP, Fazenda Jatobá - Três
Lagoas – MS, Fazenda Califórnia - Brasilândia - MS
14
3 INSEMINAÇÃO ARTIFICIAL EM TEMPO FIXO- IATF
Considerando as dificuldades existentes para detecção de cio, atualmente
vêm sendo desenvolvidos protocolos que sincronizam a ovulação pela aplicação de
fármacos e possibilitam o emprego da (IATF), independente da manifestação de cio.
Tais protocolos permitem inseminar um grande número de animais em dias prédeterminados sem a necessidade de se implantar programas intensivos de detecção
de cio.
A sincronização de cio é uma biotécnica reprodutiva que permite a
concentração da inseminação e da parição em épocas desejáveis.
As perdas de cio aumentaram o número de dias improdutivos dos animais, o
intervalo entre partos, e diminuem o número de bezerros nascidos. Ao observarem
esses efeitos, muitos fazendeiros interromperam seus programas de inseminação
artificial. Dessa forma, programas de inseminação em tempo fixo, sem a
necessidade de detecção de cio, colaboram para o aumento da eficiência e do
emprego dessa técnica (BARUSELLI, 2004).
A sincronização é uma ferramenta importante quando o objetivo é trabalhar
com a inseminação artificial em tempo fixo (IATF), pois se torna mais preciso o
momento e o mecanismo da ovulação nos animais tratados, ou seja, pela aplicação
de hormônios os quais possam promover um mecanismo de ação positivo para LH
no momento final do crescimento folicular (MOREIRA, 2002).
A IATF é aplicada no rebanho através do uso de fármacos capazes de
controlar e sincronizar o ciclo estral e a ovulação das vacas, de modo que, se
possam inseminar essas fêmeas em horários pré-determinados, com boas taxas de
concepção. Sendo capaz de trazer fêmeas em anestro à ciclicidade, se incluirmos
um hormônio chamado gonadotrofina coriônica equina (eCG) no protocolo.
Deve-se utilizar em propriedades assistidas por veterinário capacitado, a
IATF, com adequado manejo nutricional, sanitário e reprodutivo, com fêmeas em
boa condição corporal e períodos acima de 45 dias de pós-parto.
Em caso de novilhas, somente as que já atingiram a puberdade e o peso
adequado, devem participar de protocolos de IATF.
Existem vários protocolos desenvolvidos para IATF, a decisão de qual deles
se utilizar é técnica, levando-se em conta a avaliação dos animais e o manejo da
15
propriedade, contudo, pelos resultados proporcionados, destacam-se os protocolos
que utilizam dispositivos intravaginais de progesterona e eCG.
Vale a pena lembrar que, os fármacos e hormônios utilizados, não
prejudicam as fêmeas, pois são substâncias iguais ou similares às que participam do
ciclo estral natural, e terminando seu efeito, não interferem em ciclos estrais
posteriores, nem geram resíduos no leite ou carne produzidos.
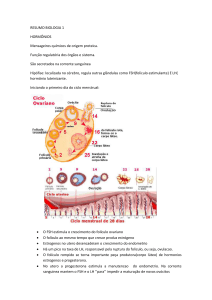
3.1CICLO ESTRAL
O ciclo estral em bovinos apresenta duração média de 21 dias (17 a 25
dias)(SIROIS & FORTUNE, 1988) e é regido por interações e antagonismos
endocrinológicos de hormônios secretados pelo hipotálamo, hipófise, gônadas e
útero (MACMILLAN & BURKE, 1996).
Segundo Macmillan e Burke (1996), o ciclo estral pode ser dividido em duas
fases distintas: a fase folicular ou estrogênica, que se estende do proestro ao estro
culminando na ovulação, e a fase luteínica ou progesterônica, que compreende o
metaestro e o diestro terminando com a luteólise. A fase folicular consiste no período
em que ocorre o crescimento folicular sob baixas concentrações plasmáticas de
progesterona e alta pulsatilidade de FSH (após o fenômeno da luteólise) culminando
na ovulação. A fase luteínica consiste no crescimento folicular sob maiores
concentrações plasmáticas de progesterona (P4) secretada pelo corpo lúteo,
levando ao crescimento e atresia dos folículos (onda de crescimento folicular),devido
à diminuição da pulsatilidade e ausência do pico de LH.
Segundo Hartigan (2008), o ciclo estral corresponde ao intervalo entre o
inicio de dois períodos sucessivos de receptividade ao macho (cio). Tanto a
manifestação de cio quanto a duração do ciclo se devem a alterações cíclicas nos
ovários, envolvendo duas estruturas endócrinas temporárias (os folículos ovarianos
e o corpo lúteo) e suas principais secreções (estrógenos e progesterona).
O ciclo estral é regulado por mecanismos endócrinos e neuroendócrinos,
principalmente os hormônios hipotalâmicos, as gonadotrofinas e os esteroides
secretados pelos testículos e ovários. A regulação da secreção de gonadotrofina
durante o ciclo estral requer um esmerado balanceamento entre complexas
interações hormonais. Um componente conhecido pela sua importante influencia é o
hormônio liberador de gonadotrofinas (GNRH).No nível dos ovários, o período de cio
16
é caracterizado por elevada secreção de estrógenos dos folículos pré-ovulatórios de
Graaf. Os estrógenos estimulam o crescimento uterino por meio de um mecanismo
que envolve a interação do hormônio com receptores e o aumento dos processos de
síntese dentro das células (HAFEZ&HAFEZ, 2004).
Segundo Hartigan (2008), o comportamento durante o cio se deve á
exposição do hipotálamo anterior á (P4) progesterona e ao estrógeno, em
concentrações fisiológicas, e á sequencia temporal apropriada. A (P4) progesterona,
por si só, inibe a ocorrência de cio. Na ausência de (P4) progesterona a
concentração fisiológica de estrógeno é incapaz de induzir sinais de cio.
Segundo Hafez e Hafez (2004), no final do cio, ocorre a ovulação seguida
pela formação de corpo lúteo, resultando na secreção de (P4) progesterona. O corpo
lúteo é formado por dois tipos celulares esteroidogênicos distintos e ambos
contribuem significativamente para a quantidade de progesterona total secretada
durante a fase luteínica do ciclo estral. O período de atividade do corpo lúteo é
chamado fase luteínica, que dura de 16 á 17 dias em vacas. A fase folicular desde a
regressão do corpo lúteo até a ovulação, é relativamente curta 3 a 6 dias em vacas.
A duração do ciclo estral está intimamente relacionada com a duração da fase
luteínica. A regressão do corpo lúteo não é causada por diminuição da secreção de
hormônios luteotróficos hipofisários (LH e prolactina), mas sim pela ação do fator
luteolítico, PGF2α.
3.2 HIPOTÁLAMO
O hipotálamo ocupa apenas uma porção do cérebro. Ele consiste da região
do terceiro ventrículo, estendendo-se do quiasma óptico aos corpos mamilares.
Existem conexões vasculares entre o hipotálamo e a adeno-hipófise
(hipófise anterior). O sangue arterial ganha à hipófise através da artéria hipofisária
superior e inferior. A artéria hipofisária superior forma capilares no nível da
eminência média. Destes capilares, o sangue flui para o sistema porta hipotálamohipofisário o qual começa e termina em capilares sem passagem pelo coração. Parte
do fluxo venoso que sai da hipófise anterior se dá através de um fluxo retrógrado,
que expõe o hipotálamo a altas concentrações dos hormônios da hipófise anterior.
Tal fluxo sanguíneo possibilita ao mecanismo hipofisário a retroalimentação negativa
17
de regulação das funções hipotalâmicas. Esse tipo de retroalimentação é conhecido
como retroalimentação de alça curta(HAFEZ&HAFEZ, 2004).
Os hormônios do hipotálamo que regulam a reprodução são o hormônio
liberador de gonadotrofinas (GnRH), o hormônio adrenocorticotrófico (ACTH) e o
fator inibidor e liberador de prolactina (PRH e PIF respectivamente). O GnRH é
secretado pelas extremidades dos axônios que fazem sinapses com os capilares da
eminência
média
do
hipotálamo.
O
sangue
flui
para
o
sistema
porta
hipotálamohipofisário, desta forma o GnRH produzido no hipotálamo é transportado
até a hipófise para estimular a produção hormonal dos gonadotrofos.
3.2.1 Hormônio Liberador de Gonadotrofina
O hormônio liberador das gonadotrofinas é um hormônio proteico, um
decapeptídio (10 aminoácidos) produzido naturalmente pelo hipotálamo. Induz a
liberação pulsátil de LH e constitutiva de FSH, hormônios estes envolvidos no
desencadeamento das ondas de crescimento folicular, maturação folicular, ovulação
e luteinização do folículo ovulatório.
3.3HIPÓFISE
Segundo Davidson &Stabenfeldt (1999), a hipófise esta composta de três
partes: um lobo anterior denominado adeno-hipófise ou parsdistalis; um lobo
intermediário chamado pars intermedia;um lobo posterior chamado neuro-hipofise ou
pars nervosa. A hipófise produz dois hormônios proteicos que são importantes para
o controle da reprodução, denominados gonadotrofinas, o hormônio folículos
estimulantes (FSH) e o hormônio luteinizante (LH), e um terceiro hormônio
denominado prolactina. O (FSH e LH) são sinérgicos no desenvolvimento dos
folículos ovarianos e na ovulação; o (FSH) desempenha um papel mais dominante
durante o crescimento folicular e o (LH) age nos estágios finas da maturação
folicular através da ovulação.
Tanto a liberação do FSH quanto a de LH são estimuladas pela pulsatilidade
de GnRH, sendo que a frequência e a amplitude dos pulsos de GnRH determinará
qual gonadotrofina será secretada em determinado momento. O GnRH secretado
18
em maior frequência e menor amplitude leva à secreção de LH e em menor
frequência e maior amplitude, de FSH (WILTBANCK & HAUGHIAN, 2003).
A hipófise anterior tem cinco tipos diferentes de células, que secretam seis
hormônios: os somatótrofos, que secretam hormônios de crescimento; os
corticótrofos, que secretam o hormônio adrenocorticotrófico (ACTH); os mamótrofos,
responsáveis pela secreção da prolactina; os tireótrofos, que secretam o hormônio
tiro-estimulante (TSH), e os gonadotrofos, que secretam o hormônio folículo
estimulante (FSH) e o hormônio luteinizante (LH) (HAFEZ&HAFEZ, 2004).
3.4 HORMÔNIOS HIPOFISÁRIOS GONADOTRÓFICOS
OFSH e o LH são hormônios glicoproteicos com peso molecular de
aproximadamente 32.000 dáltons. Gonadotrofos da hipófise anterior secretam
ambos os hormônios. Cada hormônio consiste de duas subunidades diferentes
chamadas alfa e beta. A subunidade ou cadeia alfa é comum a ambos, FSH e LH,
entre as espécies, enquanto a subunidade beta é diferente e confere especificidade
a cada gonadotrofina. As subunidades alfa e beta de qualquer um desses hormônios
não possuem atividade biológica de modo separado (HAFEZ & HAFEZ, 2004).
O hormônio folículo estimulante (FSH), estimula o crescimento e a
maturação do folículo de Graaf. O FSH por si só não causa a secreção de
estrógenos no ovário; ao contrario, ele necessita da presença do LH para estimular a
produção estrogênica. O hormônio luteinizante (LH) é uma glicoproteína composta
de uma subunidade alfa e uma beta com peso molecular de 30.000 dáltons e meia
vida biológica de 30 minutos (HAFEZ & HAFEZ, 2004). Níveis basais ou tônicos de
LH agem juntamente com o FSH para induzir a secreção de estrógenos no folículo
de Graaf; a onda pré-ovulatória de LH induz uma série de alterações no folículo, que
culminam com a ruptura do folículo e expulsão do óvulo do seu interior (ovulação).
Tem ação e estimula as células do corpo lúteo a produzirem progesterona
(ALBUQUERQUE et al., 2004).
19
3.4.1 PROLACTINA
A prolactina é o terceiro hormônio produzido pela adeno-hipófise que é
importante para a reprodução, principalmente por seus efeitos sobrea glândula
mamária e a lactação dos mamíferos (DAVIDSON & STABENFELDT, 1999).
A prolactina é um hormônio polipeptídeo secretado pela adeno-hipófise. Não
é uma glicoproteína como as outras gonadotrofinas. A prolactina ovina é
umaproteína com 198 aminoácidos e peso molecular de 24.000 dáltons. A molécula
da prolactina tem uma estrutura similar ao hormônio do crescimento (GH), em
algumas espécies estes hormônios têm propriedades biológicas semelhantes
(HAFEZ & HAFEZ, 2004).
Um hormônio inibitório denominado fator inibitório da prolactina (PIF), regula
a secreção da prolactina. O PIF, é provavelmente, a catecolamina, dopamina, uma
amina de baixo peso molecular sintetizada a partir da L-tirosina. Ela é secretada dos
terminais nervosos, predominantemente no núcleo arqueado localizado na
eminência média, e transportada pelo sistema porta hipotálamo-hipofisário, até a
adeno-hipófise (DAVIDSON, 1999).
A prolactina mantém a lactação. É conhecida como um hormônio
gonadotrófico por causa das suas propriedades luteotróficas (manutenção do corpo
lúteo) em roedores. Entretanto, em animais domésticos, o LH é o principal hormônio
luteotrófico, sendo que a prolactina desempenha um papel menos importante no
complexo luteotróficos (DAVIDSON, 1999).
3.4.2 Ocitocina
Promove as contrações uterinas em sinergismo com a PGF2α no trabalho
de parto e promove ejeção de leite ao atuar sobre as células mioepiteliais dos
alvéolos mamários (PALHANO, 2008).
Ocitocina é sintetizada no núcleo supra-óptico do hipotálamo e transportada
em pequenas vesículas envoltas por uma membrana através dos axônios do nervo
hipotálamo-hipofisário. Elas são armazenadas nos terminais nervosos próximos dos
leitos capilares da neuro-hipófise até sua liberação para a corrente circulatória.
Ocitocina também é produzida pelo corpo lúteo, portanto a ocitocina tem dois sítios
de origem: um ovariano e outro hipotalâmico (HAFEZ &HAFEZ, 2004).
20
3.5 HORMONIOS SINTETIZADOS NOS OVÁRIOS
Os ovários apresentam, principalmente, as funções de produção de gametas
e de hormônios, notadamente estrógeno(E2) e progesterona(P4), cujas funções são
desenvolvimento e manutenção das características reprodutivas, reprodução e
lactação. Localizam-se na cavidade abdominal, atrás dos rins, e são sustentados
pelo ligamento útero ovariano. Pesam aproximadamente 0,6 a 3 g, dependendo da
fase do ciclo estral. Apresentam externamente o epitélio germinativo sustentado pela
túnica albugínea em volta do córtex, onde se localizam demais estruturas, que são o
estroma, os folículos em várias fases de desenvolvimento, o corpo lúteo, o corpo
albicante, os vasos e os nervos(CAMPOS., et al 2001).
Durante a fase de maturação dos folículos, verifica-se um aumento na
produção de estrógeno, que age no sistema nervoso central (SNC), estimulando o
comportamento de cio, e no útero, vagina, vulva, oviduto, provocando alterações
importantes para transporte e maturação de gametas. Após a ovulação forma-se
uma estrutura chamada corpo lúteo, a qual será responsável pela produção de
progesterona (P4). Este hormônio é responsável pelo preparo do endométrio uterino
para a futura gestação, e pela manutenção da mesma por um determinado
período(BIOGENESIS, 2004).
Os ovários são órgãos sexuais primários, pares, com funções endócrinas e
gametogênicas. Os ovários da vaca possuem formato ovalado, apresentando, em
média, cerca de 3,0 a 4,0 cm de comprimento, 2,0 a 3,0 cm de largura e 1,5 cm de
espessura em sua parte mais larga. Podem estar localizados na cavidade pélvica ou
na cavidade peritoneal de acordo com o estado reprodutivo da vaca (vacas não
gestantes, gestação, puerpério, piometra e vacas velhas) (PALHANO 2008).
21
4 FOLÍCULOS
4.1FOLICULOGÊNESE
Da reserva de folículos primordiais, formada durante a vida fetal ou logo
após o nascimento, alguns folículos crescem continuamente durante a vida do
animal, ou pelo menos até a reserva se exaurir. Quando um determinado folículo
deixa essa reserva, ele cresce ate á ovulação ou até que ocorra a sua degeneração,
o que acontece com a maioria dos folículos. O folículo de maior tamanho é liberado
pelo ovário durante o cio, sendo que essa liberação decresce rapidamente durante o
pico de LH.
As fêmeas ruminantes domésticas são poliéstricas apresentando estros em
intervalos mais ou menos regulares e 21 dias. Durante o ciclo estral ocorre uma
cadeia de eventos que se repetem até o impedimento da luteólise pela gestação.
Nas fêmeas ruminantes, o processo de Foliculogênese (ativação, crescimento,
maturação folicular) tem inicio com a formação dos folículos durante a vida fetal, ou
seja, ao nascimento as crias já tem estabelecido, em geral, o número de folículos
primordiais nas suas gônadas. Durante as fases de crescimento e maturação, a
maioria desses folículos vai se degenerar no processo conhecido por atresia
folicular, ao passo que apenas uma minoria vai completar sua maturação e ovular
(HAFEZ &HAFEZ ,2004).
4.1.1 Folículo Primordial ou Primário
Estima-se que o número médio de folículos na vaca, no momento do
nascimento, seja 150.000, reduzindo para 60.000 na vaca adulta chegando a 1.000
folículos nas vacas velhas. Cada folículo dentro do estroma cortical é composto por
um oócito de primeira ordem (oócito I), medindo cerca de 20 a 30 μm de diâmetro,
circundado por uma camada de células foliculares planas cobertas por uma
membrana basal e circundado por tecido intersticial. O folículo primordial se
transforma em folículo primário quando as células foliculares planas se transformam
em células cúbicas.
Os folículos primordiais compõem o estoque de folículos formados durante a
fase fetal e que vão se desenvolver durante a vida reprodutiva da fêmea. Esses
22
folículos, em estado quiescente, são caracterizados por um oócito na prófase da
primeira divisão meiótica, sem zona pelúcida, rodeado por algumas células da prégranulosa e envolvidas pela membrana basal. Os folículos nesse estágio não tem
suprimento sanguíneo próprio e, dessa forma, recebem nutrientes apenas por
difusão (HAFEZ &HAFEZ, 2004).
4.1.2 Folículo Secundário-Pré Antral
Para que os folículos possam progredir além dos estágios pré-antral, a
granulosa e a teca precisam desenvolver receptores para gonadotrofinas. Os
receptores de FSH e LH desenvolvem-se sobre a granulosa e sobre a teca,
respectivamente. O inicio do folículo antral é marcado pelo aparecimento deum
liquido que começa a dividir a granulosa. O FSH que se dirige para a granulosa
transforma os andrógenos em estrógenos.
4.1.3 Folículo Terciário- Antral
O efeito do estrogênio é a formação de receptores adicionais para o FSH à
medida que ocorre o desenvolvimento folicular. Com esta situação, o folículo antral
torna-se sensível ao FSH, após seu desenvolvimento é capaz de crescer com níveis
basais de FSH. Na última fase folicular ovariana, os receptores de LH desenvolvemse na granulosa, o que permite a onda pré-ovulatória do LH para promover a
ovulação. O FSH e os E2 na fase final do desenvolvimento do folículo iniciam a
formação dos receptores de LH na granulosa, e os receptores de FSH tendem a
diminuir. Com o aumento da secreção de E2 pelo folículo antral ocorre o inicio da
onda pré-ovulatória de gonadotrofina. Nos estágios finais de desenvolvimento, o
folículo torna-se dependente do controle do LH e seu crescimento forma um ponto
posterior para ovulação.
4.1.4 Atresia Folicular
Os ovários dos mamíferos contêm milhares de oócitos inclusos em folículos
pré-antrais. Entretanto, a grande maioria desses folículos não chega á ovulação,
mas ao contrário, é eliminado por meio de um processo conhecido por atresia
23
folicular. A atresia folicular é um processo fisiológico, de duração desconhecida, que
pode ocorrer por via degenerativa e/ou apoptótica. Um grande número de evidências
tem demonstrado que a apoptose, na verdade, é o mecanismo bioquímico
responsável pela atresia folicular (GONÇALVES et al., 2001).
4.1.5 Corpo Lúteo
A principal função do CL é a secreção de P4, que prepara o útero para a
iniciação e a manutenção da gestação.
O CL forma-se a partir das paredes do folículo, que se colapsa e forma
pregas após a ovulação. Com a ruptura do folículo, há uma desintegração dos
tecidos que rodeiam a granulosa, particularmente a membrana própria, e pode
ocorrer hemorragia intracavitária a partir dos vasos da teca. Embora o predomínio de
células do CL seja de células da granulosa, as células da teca também contribuem
de modo significativo para a composição da estrutura. O processo, que as células da
granulosa se submetem durante a mudança de secreção de E2 para P4, ou seja, a
luteinização começa com o inicio da onda pré-ovulatória de LH e se acelera com a
ovulação (Cunningham, 1999).
O CL desenvolve-se após um colapso no folículo ovulatório. A parede
interna do folículo desdobra-se em pregas macro e microscópicas, que penetram na
cavidade central. Essas pregas consistem de uma porção central de estroma e de
grandes vasos venosos que se distendem. As células desenvolvem-se poucos dias
antes da ovulação e regridem rapidamente. Após 24 horas da ovulação, todas as
células remanescentes da teca encontram-se em estado avançado de degeneração.
Inicia-se um processo hipertrófico e de luteinização das células da granulosa
após a ovulação.
A P4 é secretada pelas células luteinicas na forma de grânulos. O aumento
de peso do CL é rápido no inicio. Geralmente, o período de crescimento ultrapassa a
metade do ciclo estral. Na vaca, o peso e conteúdo de P4 do CL aumentam
rapidamente entre o terceiro e o décimo segundo dia do ciclo, e permanecem
relativamente constantes até o décimo sexto dia, quando se inicia a regressão. O
diâmetro do CL maduro é maior que o do folículo de Graaf, exceto na égua (HAFEZ
& HAFEZ, 2004).
24
4.2 HORMONIOS ESTEROIDES GONADAIS
Os hormônios esteroides gonadais são produzidos primariamente nos
ovários e nos testículos. Órgãos não-gonadais, tais como as adrenais e a placenta,
também secretam uma certa quantidade de hormônios esteroides. Tais hormônios
podem ser de quatro tipos: andrógenos, estrógenos, progestágenos e relaxina, os
três primeiros tipos são esteroides, enquanto o quarto é uma proteína. Os ovários
produzem dois hormônios esteróides (estradiol e progesterona) e um protéico
(relaxina); o testículo secreta um único hormônio (testosterona). A atividade
secretora de hormônios esteroides pelas gônadas está sobre o controle endócrino
da hipófise anterior.
4.2.1 Estrógenos
Atuam no desenvolvimento sexual dos órgãos sexuais e características
sexuais secundárias, sobre o endométrio, promovendo o desenvolvimento glandular
e
maior
fluxo
sanguíneo,
sobre
as
glândulas
mamárias,
promovendo
desenvolvimento glandular, sobre o miométrio, estimulando a contratilidade no parto
em sinergismo com a PGF2α e sobre a vagina e a vulva, aumentando a
vascularização. Promove, ainda, efeito psíquico, determinando receptividade sexual
(aceitação da monta) durante o estro, efeito sobre a cérvix promovendo seu
relaxamento e abertura, efeito anabólico proteico e feedback(+) para liberação de
LH. Secretado pelo folículo dominante, o 17β-estradiol juntamente com a inibina,
determina o bloqueio da liberação de FSH, inibindo, assim, o crescimento dos
folículos subordinados. Alguns produtos estrogênicos sintéticos são utilizados
rotineiramente em programa de sincronização de cios, como é o caso do benzoato
de estradiol (PALHANO, 2008).
Os estrógenos são carregados na corrente circulatória por meio de proteínas
ligadoras. De todos os esteroides, os estrógenos tem a mais ampla gama de
funções fisiológicas.
Algumas dessas funções são:
Atuam no SNC induzindo comportamento de cio na fêmea; entretanto,
pequenas quantidades de progesterona, juntamente com o estrógeno,
25
são necessárias para indução do cio em algumas espécies, tal como a
vaca.
Atuam no útero aumentando tanto a amplitude quanto a frequência das
contrações,
potencializando
os
efeitos
da
ocitocina
e
da
prostaglandina.
Desenvolvimento das características físicas sexuais femininas.
Estimulam o crescimento dos ductos e desenvolvem as glândulas
mamárias.
Exercem efeitos de retroalimentação positiva e negativa no controle da
liberação de LH e FSH através do hipotálamo. O efeito negativo se dá
no centrotônico do hipotálamo e o positivo, no centro pré-ovulatório
(HAFEZ&HAFEZ, 2004).
4.2.2 Progestágenos
Atuam sobre o endométrio, promovendo o desenvolvimento e a secreção
glandular, inibem a motilidade uterina espontânea, promovem efeito antagônico á
ocitocina, efeito sobre as glândulas mamárias estimulando o desenvolvimento
lóbulo-alveolar, podem inibir a ovulação em tratamentos para sincronização de cio e
são essenciais para a manutenção da gestação.
Exercem efeito inibitório sobre a liberação hipotalâmica e hipofisária de
GnRH e LH, respectivamente. O CL, formado após a ovulação de um folículo
dominante, é a principal fonte de progesterona em fêmeas bovinas não gestantes. A
P4 também é secretada pela placenta, contudo a fêmea mantém a atividade luteal
durante toda a gestação (PALHANO, 2008).
Segundo Hafez & Hafez (2004), a progesterona é o progestágeno natural de
maior prevalência sendo secretada pelas células luteínicas do corpo lúteo, pela
placenta e pelas glândulas adrenais. A P4, assim como os andrógenos e os
estrógenos, é transportada na corrente circulatória por uma proteína de ligação, e
sua secreção é estimulada primariamente pelo LH.
26
A progesterona desempenha as seguintes funções:
Prepara o endométrio para a implantação e a manutenção da prenhez,
aumentando a atividade secretora das glândulas do endométrio e
inibindo a motilidade do miométrio.
Atua sinergicamente com os estrógenos na indução do comportamento
de cio.
Auxilia no desenvolvimento do tecido secretor(alvéolos) da glândula
mamária.
Provoca a inibição do cio e do pico pré-ovulatório do LH quando em
níveis elevados. Portanto, a P4 desempenha papel fundamental na
regulação hormonal do ciclo estral.
Inibe a motilidade uterina.
4.2.3 Relaxina
A relaxina é um hormônio polipeptídeo que consiste de uma subunidade alfa
e outra beta, conectadas por duas pontes dissulfídicas e possui peso molecular de
5.700 daltons. A relaxina é secretada primariamente pelo CL durante a gestação.
Em algumas espécies, a placenta e o útero também secretam relaxina. A principal
ação biológica da relaxina é a dilatação da cérvix e da vagina antes do parto. Ela
também inibe as contrações uterinas e causa crescimento das glândulas mamárias
quando administrada em conjunto com estradiol.
Provoca o relaxamento da sínfise púbica e dilatação da cervix uterina para a
passagem fetal, estimula o crescimento uterino em conjunto com os E2 e a P4.
4.2.4 Inibinas
As gônadas são a principal fonte de inibina e proteínas correlatadas,
que contribuem para a regulação endócrina do sistema reprodutivo. As inibinas não
são esteróides. Desempenham um papel importante na regulação hormonal da
foliculogênese ovariana durante o ciclo estral. Elas atuam como sinalizadores
químicos para a hipófise sobre o número de folículos em crescimento no ovário. Pela
27
inibição da liberação de FSH sem alteração no LH, as inibinas podem ser
parcialmente responsáveis pela liberação diferenciada de LH e FSH pela hipófise.
4.2.5 Ativinas
As ativinas são potentes dímeros liberadores de FSH e estão presentes nos
fluídos gonadais, como, por exemplo, no fluído folicular e no fluído rede testis. A
ativina é um membro completamente funcional nos fatores de crescimento.
Secretada pelas células da granulosa, estimula a secreção de FSH e LH.
4.2.6 Folistatina
A folistatina bloqueia a ação da ativina e a secreção de FSH. Ela é uma
proteína isolada do fluido folicular, não somente inibe a secreção de FSH
similarmente à inibina, mas também se liga à ativina, neutralizando sua atividade
biológica. Portanto, constitui-se num agente modulatório da secreção de FSH.
4.3 HORMÔNIOS PLACENTÁRIOS
A placenta secreta diversos hormônios idênticos ou com atividades
biológicas similares aos hormônios reprodutivos dos mamíferos. São eles:,
gonadotrofina coriônica humana (hCG), lactogêneo placentário(PL) e proteína B.
4.3.1 Gonadotrofina Coriônica Equina
A eCG é uma glicoproteína com subunidades α e β similares ao LH e ao
FSH, porém, com conteúdo de carboidrato mais elevado. O alto conteúdo de ácido
siálico parece contribuir para a longa meia-vida de diversos dia do eCG. Portanto
uma única injeção de eCG possui efeitos biológicos na glândula-alvo por mais de
uma semana. A eCG possui atividade biológica semelhante tanto ao FSH quanto ao
LH, porém predominantemente ao FSH. A eCG foi uma das primeiras
gonadotrofinas comercialmente disponíveis usadas para indução da superovulação
em animais domésticos(CUNNINGHAM, 1999).
Exerce forte ação dos tipos FSH e LH. Possui como vantagens a facilidade
de aplicação e o menor custo por possuir um longo tempo de meia-vida biológica.
28
A eCG cria condições de crescimento folicular e de ovulação, e seu uso tem
se mostrado compensador em rebanhos com baixa taxa de ciclicidade, em animais
recém paridos (período pós-parto inferior a 2 meses) e em animais com condição
corporal comprometida ( BARUSELLI, 2004).
4.3.2 Gonadotrofina Coriônica Humana
Glicoproteína na hCG consiste de uma subunidade α e outra β, com cadeias
de aminoácidos e cadeias de carboidratos sintetizadas nas células sinciotroblásticas
da placenta nos primatas e nas mulheres. É obtida na urina e no soro sanguíneo da
mulher gestante. É detectada por radiomunoensaio, na urina, 8 dias após a
concepção da mulher. Possui funções semelhantes ao LH, sendo indicada para
tratamento de ovários císticos, indução de ovulação e no estudo de receptores do
LH. A hCG substitui o LH pituitário, por seu alto custo de purificação, para induzir
ovulação de vacas com ovários císticos, em programas de sincronização da
ovulação e superovulação (ALBURQUERQUE et al., 2004).
4.3.3 Lactogênio Placentário
Lactogênio placentário é uma proteína com propriedades químicas similares
à prolactina e ao hormônio do crescimento. Tem grande importância na regulação da
passagem de nutrientes maternos para o feto e, possivelmente, no crescimento fetal.
Pode ainda desempenhar funções na produção de leite.
4.3.4 Proteína B
O concepto bovino produz uma série de sinais durante o início da prenhez.
Atualmente, somente uma proteína oriunda do tecido placentário foi parcialmente
purificada, a proteína B específica da prenhez bovina. A ação fisiológica da proteína
B parece estar envolvida na prevenção da luteólise no início da prenhez da vaca ou
ovelha. Este hormônio placentário tem o potencial de ser o primeiro teste hormonal
de prenhez confiável para ruminantes.
29
5 ÚTERO
O útero possui dois cornos e um corpo. O corpo é pequeno (3 a 5 cm) e os
cornos medem de 9 a 16 cm. A parede uterina é constituída de endométrio,
miométrio e uma serosa, externamente. As contrações musculares são importantes
para o transporte espermático, assim como para a expulsão do feto durante o parto.
A ligação do feto se dá por meio das carúnculas em numero de 70 a 100. É o órgão
responsável pela produção de prostaglandina (PGF2α), a qual regula a duração do
ciclo estral pelo seu efeito luteolítico (Gonçalves et al., 2008).
Órgão reprodutivo acessório, tubular, oco, que se comunica cranialmente
com as tubas e caudalmente com a vagina. Mantem relação dorsal com o reto e
relação ventral com as vísceras abdominais. Quando gestante sua maior porção
encontra-se na cavidade peritoneal, apresentando uma porção pélvica. Em sua
extremidade caudal apresenta formação de anéis fibrosos, constituindo assim a
cérvix ou colo uterino, estrutura que promove o seu contato com a vagina. O colo
uterino ou cérvix representa uma barreira física de proteção do útero contra agentes
externos (PALHANO 2008).
5.1 FUNÇÃO DO ÚTERO
O útero apresenta uma série de funções. O endométrio e seus fluídos têm
grande relevância no processo reprodutivo: (A) transporte da fertilização no oviduto,
(B) regulação da função do CL e (C) inicio da implantação, gestação e parto (HAFEZ
& HAFEZ, 2004).
5.1.1 Transporte Espermático
No acasalamento, a contração do miométrio é essencial para o transporte
dos espermatozoides do ponto de ejaculação para o local da fertilização. Um grande
número de espermatozoides se agrega nas glândulas endometriais. À medida que
eles são transportados ao longo do lúmen uterino até oviduto, eles sofrem
“capacitação” nas secreções endometriais(HAFEZ & HAFEZ, 2004).
30
5.1.2 Implantação e Gestação
O útero é um órgão altamente especializado, adaptado para aceitar e nutri
os produtos da concepção, desde a implantação até o parto. Uma “diferenciação”
uterina é governada pelos hormônios esteroides ovarianos. Esse processo envolve
alguns estágios críticos quando o útero está preparado para aceitar seletivamente o
blastocisto. Se não acorrer a diferenciação, o útero não estará adaptado para
permitir a implantação.
Após a implantação, o embrião depende de um suprimento vascular
adequado do endométrio para o seu desenvolvimento. Durante a gestação, as
propriedades fisiológicas do endométrio e seu suprimento sanguíneo são
importantes para a sobrevivência e o desenvolvimento do feto. O útero tem
capacidade de sofrer extraordinárias modificações no tamanho, na estrutura e na
posição a fim de acomodar as necessidades do concepto em crescimento (HAFEZ
&HAFEZ, 2004).
5.2 PROSTAGLANDINA
Todas as prostaglandinas são ácidos graxos hidroxilados insaturados com
vinte átomos de carbono e um anel ciclo/pentano. O ácido araquidônico, um ácido
graxo essencial, é o precursor da maioria das prostaglandinas mais intimamente
associadas com a produção, principalmente a PGF2α e a prostaglandina E 2(PGE2).
A PGF2α é o agente luteolítico natural associado ao final da fase luteínica
(corpo lúteo) do ciclo estral, permitindo, assim, o inicio de um novo ciclo quando da
ausência de fertilização. As PGF2α podem ser consideradas hormônios que regulam
diversos fenômenos fisiológicos e farmacológicos, tais como a contração da
musculatura lisa dos tratos reprodutivos e gastrointestinal, a ereção, a ejaculação, o
transporte espermático, a ovulação, a formação do CL, o parto e a ejeção de leite
(HAFEZ & HAFEZ, 2004).
Segundo Palhano (2008) no ciclo estral, o CL, formado após a ovulação de
um folículo dominante, passando antes pela formação do corpo hemorrágico, é uma
estrutura altamente vascularizada, cujo fluxo sanguíneo permite a sua manutenção,
sendo assim, extremamente sensível as alterações do mesmo.
31
A regressão do CL, ou a luteólise, é um fenômeno que ocorre pela ação da
PGF2α, produzida pelo endométrio e liberada de forma pulsátil durante todo o ciclo
estral, observando-se um padrão de três a quatro pulsos por dia no início do
processo, sendo necessários cinco pulsos diários para sua completa regressão
(GONÇALVES et al., 2001).
A prostaglandina é um hormônio liberado pelo útero cuja função é lisar o
corpo lúteo. Esta estrutura é formada após a ovulação e produz progesterona, um
hormônio responsável por preparar o útero para receber o embrião e manter a
gestação. A manipulação do ciclo estral com prostaglandina permitirá a lise do corpo
lúteo, queda do nível de progesterona e o retorno da fêmea ao cio.
32
6 MANEJO REPRODUTIVO
Quando se analisa a eficiência reprodutiva de um rebanho, interpreta-se que
os dados do período de serviço, da taxa de inseminação, intervalo de partos, da
idade à primeira cria e da distribuição da taxa de prenhez ao longo da estação de
monta, juntamente com a eficiência produtiva,( mortalidade, precocidade e qualidade
de carcaça), tem-se ideia exata da taxa de desfrute desse rebanho, bem como a
rentabilidade que ele proporciona para o pecuarista(BARBOSA, 2004).
O sucesso de propriedades que exploram a comercialização de bezerros
depende diretamente da eficiência reprodutiva, da taxa de crescimento dos bezerros
até a desmama, quando, então, serão comercializados, e da eficiência de utilização
de alimentos. Concluí-se que a excelente condição de fertilidade de uma vaca pode
ser medida pelo número de bezerros que ela pariu e desmamou em boas condições
em sua vida útil. Sendo assim, a vaca deverá parir sua primeira cria em idade
precoce, desmamá-la em boas condições de peso corporal (BARBOSA, 2004).
Pode-se relatar que toda exploração bovina está alicerçada sobre quatro
pilares básicos, reprodução e sanidade, sofrendo ainda forte influência ambiental e
de manejo. Para que um determinado potencial genético se manifeste plenamente e
gere rentabilidade é necessário que o rebanho esteja livre ou sofra um menor
impacto possível de doenças infecciosas e parasitárias, pois essas doenças podem
interferir diretamente sobre o sistema reprodutor de machos e fêmeas, determinando
a diminuição da concentração espermática, do vigor, do turbilhamento, do aumento
das patologias de sêmen, dos abortamentos, das repetições de cio do aumento do
período de serviço e intervalo entre partos, dos natimortos e do nascimento de crias
fracas que apresentarão desenvolvimento inferior á média do rebanho, contribuindo
todos esses problemas para uma baixa taxa de desfrute (CAMPOS, 2001).
As deficiências nutricionais também determinam grande impacto sobre a
taxa de desfrute, pois interferem diretamente sobre todos os aspectos reprodutivos,
a começar pelo alongamento do período de serviço, determinando maior IP e
consequente diminuição na produção de crias de vida útil de uma matriz.
Resultados de diversas pesquisas confirmam que na medida em que se
melhoram os níveis quantitativos e qualitativos da dieta no período entre à desmama
e à puberdade diminuí-se a idade ao abate e aumenta-se o peso à puberdade. Outra
consequência drástica decorrente de deficiências nutricionais é o prolongamento do
33
período de serviço devido à inatividade ovariana, sendo o anestro pós-parto um
indicador de baixo nível nutricional das vacas de um rebanho. Além de uma
deficiente condição corporal no período puerperal, muitos estudos apontam, ainda, o
efeito da cria junto da vaca como um fator que leva à queda de eficiência reprodutiva
(PEREIRA, 2002).
Segundo Fonseca (1991), quando maior o número de mamadas,
principalmente em vacas que apresentam deficiências nutricionais (a deficiência
energética sendo a mais importante), maior é a produção e a liberação de opióides
endógenos (à nível hipotalâmico, hipofisário e gonadal), como as encefalinas,
endorfinas e dinorfinas, que agem como inibidores do GnRH. O efeito negativo da
mamada sobre o ciclo estral em vacas de corte, determinando o anestro pós-parto
em função da inibição da secreção de GnRH por esses opióides.
6.1 ESCORE CORPORAL
Semelhante à avaliação da condição corporal da vaca leiteira, a vaca de
corte também pode ser avaliada, por inspeção da cobertura subcutânea na região
das costelas, do dorso lombar, das ancas e da inserção de cauda, determinando,
assim o escore de condição corporal com escala de pontuação variando de 1 vaca
muito magra, a 9 vaca muito gorda.
Para que a vaca de corte apresente uma boa performance reprodutiva,
deve-se estabelecer um plano nutricional que mantenha seu escore corporal pelo
menos entre 5 e 6 no período que se aproxima ao parto, o que permitirá uma boa
atividade ovariana (manifestação de cio) pós-parto, aumentando as chances de
concepção, contribuindo, ainda, para a manutenção de reservas corporais
necessárias a uma boa lactação e consequente nutrição de sua cria. Ainda deve-se
estar atento aos custos e às dificuldades de se implementar um programa que visa o
aumento de peso e a melhoria das condições corporais no pós-parto recente, pois
geralmente torna-se muito dispendioso em função da qualidade de nutrientes.
A qualidade das pastagens influencia diretamente sobre o número de vacas
prenhes quando em regime exclusivo de pasto.
Segundo Mannetje e Coates (1975), pastos consorciados de gramíneas e
leguminosas aumentaram a performance reprodutiva de vacas Hereford (97% de
34
concepção e 94% de nascimento) quando comparadas aquelas mantidas em
pastagens nativas (87% de concepção e 78%) na Austrália.
Tabela 1: Avaliação de escore de condição corporal
PEREIRA, 2002
35
FIGURA 1: Influência do Escore de Condição Corporal sobre a Taxa de
Prenhez
Figura 2: ECC 1
Figura 3: ECC 2
Figura 4: ECC 3
36
Figura 5:ECC 4
Figura 6: ECC 5
6.1.1Influência do ECC sobre as taxas de não retorno
Segundo Baruselli, Bo e Marques (2004), a baixa nutrição é a principal
causa da reduzida fertilidade de vacas criadas em áreas tropicais e subtropicais.
Estudos demonstram que os escores de condição corporal (ECC) indicam, com
elevada acurácia, o nível de armazenamento de energia do animal, o que está
relacionado diretamente com o reinicio da atividade ovariana pós-parto.
6.2 MANEJO DE AMAMENTAÇÃO E RETORNO DA ATIVIDADE OVARIANA
Estudos que utilizaram vacas nelore paridas com bezerros ao pé, em
anestro, com ou sem a remoção temporária do bezerro por 48 horas e tratadas logo
após com GnRH, demostraram através de acompanhamentos ultra-sonográficos de
dinâmica folicular que o tamanho do folículo dominante no dia da aplicação do
GnRH foi influenciado pela remoção, apresentando assim as vacas manejadas
maior taxa de ovulação.
FONSECA et al. (1991) demonstraram em experimentos de racionalização do
manejo de amamentação uma queda significativa do período de serviço e do
intervalo entre partos das vacas avaliadas. Comparando-se o sistema tradicional
(cria ao pé) aos diferentes tipos de manejo de amamentação, observaram ainda
diferentes percentuais de vacas gestantes.
37
6.2.1 Manejos de amamentação avaliados no experimento
Destacam-se os manejos de amamentação avaliados no experimento:
1
Tradicional (cria ao pé)
2
Amamentação interrompida (48 horas a cada 30 dias)
3
Duas amamentações por dia.
4
Amamentação interrompida mais duas amamentações (manejo 2 e 3).
5
Uma amamentação por dia
6
Amamentação interrompida mais uma amamentação (manejo 2e 5).
Neste estudo, observou-se que associação dos manejos 2 e 3, ou seja ,
amamentação interrompida (por 48 horas a cada 30 dias) com manejo de duas
amamentações por dia, proporcionou maior percentual de vacas em cio (91,2%),
porém, o manejo que resultou maior percentual de vacas gestantes foi o quinto
chegando a 72,7% contra 64,7% da associação 2 e 3. Frequentemente, o primeiro
cio após estímulo de remoção da cria é anovulatório.
Vilela et al. (1999) observaram maior taxa de ovulação e sincronização em
vacas nelores submetidas à remoção temporária da cria em programas de
sincronização de cio para reduzir o anestro pós-parto.
A amamentação controlada ou a remoção do bezerro aumenta a frequência
dos pulsos de LH, estimulando o crescimento folicular e a ovulação em vacas com
mais de 30 dias pós-parto.
6.2.2 Atividade ovariana pós-parto
Durante o final da gestação o eixo hipotálamo-hipofisário está sob a ação da
retroalimentação negativa dos esteroides placentários e ovarianos, suprimindo a
liberação de FSH, com acúmulo deste hormônio na hipófise anterior e depleção dos
estoques de LH. Após o parto ocorre a imediata liberação de FSH (2 a 7 dias),
seguida da emergência da primeira onda de crescimento folicular.
A dominância folicular é constatada de 10 a 21 dias após o parto. No
entanto, os primeiros folículos dominantes não têm capacidade ovulatória e tornamse atrésicos, levando ao crescimento de subseqüentes ondas de crescimento
folicular.
38
Desta forma, conclui-se que o FSH não é o limitante para o reinício da
ciclicidade ovariana pós-parto é a diminuição da sensibilidade do hipotálamo ao
estradiol produzido pelo folículo dominante.
O folículo cresce até atingir tamanho suficiente para que ocorra a ovulação,
no entanto, o hipotálamo esta dessensibilizado ao estradiol e não libera picos de
GnRH para que ocorra a liberação de picos de LH pela hipófise. Após,
restabelecidos os estoques de LH (15 a 30 dias pós-parto) e reativada a
sensibilidade do hipotálamo ao estradiol, as diferentes condições de nutrição e
amamentação passam a ser os principais responsáveis pelo atraso na primeira
ovulação.
6.3 FATORES QUE AFETAM O ESTRO APÓS O PARTO OU ANESTRO PÓSPARTO.
Os fatores que afetam o estro após o parto são a nutrição pré e pós-parto
(condição corporal deficiente), as doenças debilitantes, a produção de leite, as
patologias uterinas, as patologias de ovário e o estresse térmico. A observação de
cio impacta diretamente no intervalo entre partos. Estudos em gado de leite apontam
perdas de 47,3% de cios por deficiência de observação.
O anestro pós-parto prolongado, as perdas embrionárias e gestacionais são
os principais fatores que afetam diretamente a eficiência de produção do rebanho de
cria (SANTOS, 2000).
Segundo Short et al. (1972) a duração do anestro pós-parto é afetada por
diversos fatores, sendo os de maior importância à nutrição, a amamentação, a
condição corporal e a idade. Existem também, vários outros fatores que podem
contribuir para o anestro, como: a estação do ano, a raça, o grau de dificuldade do
parto e a ocorrência de doenças puerperais.
O anestro pós-parto é o período que estende desde o parto até o
aparecimento do primeiro estro, sendo caracterizado por ausência de manifestação
estral. Neste período, também conhecido como puerpério, ocorre a involução uterina
e o restabelecimento da atividade ovariana. A involução uterina é indispensável para
que possa haver concepção e envolve processos fisiológicos simultâneos como,
redução do tamanho do útero, perda de tecidos, reparação do tecido residual e
39
diminuição do fluído tissular. O tempo de involução uterina da vaca normalmente
ocorre por volta dos 35 a 45 dias pós-parto (Hafez & Hafez, 2004).
6.4 PROGRAMA DE DESCARTE DE FÊMEAS
As características de fertilidades de um rebanho apresentam baixa
herdabilidade, sendo agravadas pelas interações de fatores ambientais e
genotípicos.
Ao estabelecer um programa de descarte deve ser levados em
consideração, os seguintes critérios: performance reprodutiva da vaca durante a
estação de monta, defeitos anatômicos externos e defeitos anatômicos do aparelho
reprodutivo que impeçam uma vaca de levar sua gestação a termo.
FONSECA (1991) propõe um programa apresentando sete tópicos e que
encerram essas características sendo:
Eliminação de todas as novilhas que se apresentarem vazias após sua
primeira estação de monta.
Eliminação de todas as matrizes que se apresentarem vazias por dois
anos consecutivos ou não.
Eliminação de todas as matrizes idosas que se apresentarem vazias.
Eliminação de todas as matrizes com defeitos fenotípicos (prognatismo,
bragnatismo,
despigmentação,
tetos
muito
grandes
ou
muito
pequenos).
Eliminação de todas as matrizes que tenham recusado a cria ou
desmamado
em
situação
de
inferioridade
em
relação
aos
companheiros de rebanho.
Eliminação de todas as matrizes vazias que apresentarem quaisquer
alterações do aparelho genital ao exame ginecológico (endometrites,
vaginites, útero flácido, ovários afuncionais ou/ assimétricos, cérvix
tortuosa, excessivamente grande ou prolapsada, alterações de tuba,
dos ligamentos ou da cavidade pélvica de modo geral).
As matrizes vazias que escaparem desta triagem serão identificadas e
aguardarão a próxima estação de monta, quando terão um prazo de 30
40
dias para se transformarem em reprodutoras regulares. Se falharem,
deverão ser eliminadas.
6.5 PROGRAMA DE CONTROLE SANITÁRIO
Para prevenção de doenças deve-se trabalhar com um esquema profilático
de controle das principais enfermidades e parasitoses da região. O mais prático é
fazer um cronograma e deixá-lo na propriedade. Deverão ficar programados os
meses de exames, das vacinas e dos tratamentos periódicos.
Tabela 2 -PROGRAMA DE MANEJO SANITÁRIO
(PALHANO, 2008).
41
7 INSEMINAÇÃO ARTIFICIAL EM TEMPO FIXO-IATF
7.1 INSEMINAÇÃO ARTIFICIAL
A inseminação artificial tem sido utilizada em rebanhos de corte,
principalmente em rebanhos de elite, no Brasil, com um efetivo bovino de 180
milhões de cabeças de gado, apenas 7% das fêmeas são inseminadas.
Entende-se por inseminação artificial a deposição mecânica do sêmen no
aparelho reprodutivo da fêmea com o objetivo de fertilização do óvulo.
Condições mínimas para que ocorra a inseminação artificial:
Nutrição adequada.
Controle sanitário
Manejo eficiente
Fêmeas com idade de reprodução
Fêmeas com algum potencial genético
Funcionário com potencial para ser um bom inseminador.
7.1.1 Vantagens da inseminação artificial:
Citam-se como vantagens da inseminação artificial:
Melhoramento do rebanho em menor tempo e a baixo custo.
Melhor aproveitamento de reprodutores de alto potencial genético.
Aumento no número de descendentes de um reprodutor.
Melhor controle sanitário do rebanho.
Utilização de touros com problemas adquiridos, impossibilitados de
efetuar a monta.
Padronização do rebanho com a utilização de um só reprodutor em um
grande número de vacas.
Viabilização e maior eficiência no teste de progênie.
Controle de doenças hereditárias.
42
7.1.2 Reconhecimento do cio
Recomenda-se para o reconhecimento do cio duas ou mais observações
diárias, com intervalo de pelo menos de 60 minutos a cada observação, durante a
qual o observador deverá estar atento ao comportamento do rebanho.
O cio é o período em que a fêmea aceita a monta, mais há outros sinais que
ajudem na identificação do cio, como: inquietação (o animal mantem a cauda
erguida), urina constantemente, a vulva apresenta-se edemaciada e brilhante, com
muco cristalino, chegando, no início, a montar nas companheiras.
Obviamente a manifestação de cios de muitas vacas pode ocorrer no
período noturno, que só poderá ser detectado com maior precisão com a utilização
do rufião com buçal marcador. Boas condições ambientais (água de qualidade,
sombreamento e boa pastagem) favorecem a manifestação e consequente
identificação de cios (PALHANO, 2008).
Como o Brasil possui cerca de 73 milhões de fêmeas bovinas em
reprodução, com prevalência de aproximadamente 80% de sangue zebu
(bosindicus), criadas na sua grande maioria a pasto, ocorrem significativos
comprometimentos na taxa de detecção de cio e na eficiência dos programas de
Inseminação artificial (BARUSELLI, 2004).
O cio se caracteriza por uma série de transformações no comportamento e
fisiologia da fêmea, ocasionadas pelo aumento da circulação de hormônios
estrogênicos. É a fase em que a fêmea aceita a monta (HARTMANN, 2010).
Sinais externos de cio:
A vaca fica inquieta e separada das demais;
Urina frequentemente;
Apresenta vulva edemaciada, hiperêmica e procura manter a cauda
erguida;
A queda de produção de leite e a diminuição da ingestão de alimentos;
Monta sobre outras vacas;
Apresenta corrimento vaginal cristalino e transparente.
43
7.1.3 Problemas da baixa taxa de detecção de estro
Os problemas que levam à baixa detecção de estro devem ser solucionados
com as seguintes medidas:
A observação do cio deve ter prioridade máxima dentro do manejo.
Evitar atividades paralelas nos momentos de observação de cio.
Utilizar fichas e quadros de rebanhos para facilitar o trabalho de
identificação.
As observações devem ser realizadas pelo menos duas vezes ao dia.
As pessoas envolvidas no serviço de inseminação devem conhecer os
sinais de cio.
Vacas estabuladas ou não devem ser observadas em grupos, em
áreas de conforto.
Usar ajuda de rufião para detecção de cio.
O método de Trimberger serve para avaliar qual o melhor momento para IA
(Figura 7).
FIGURA 7: MÉTODO DE TRIMBERGER
44
7.2 INSEMINAÇÃO ARTIFICIAL EM TEMPO FIXO
A inseminação artificial em tempo fixo (IATF) é uma técnica que visa facilitar
o manejo da inseminação artificial reduzindo a mão-de-obra e concentrando as
atividades (BARROS et al, 2000).
Como qualquer outra técnica, não pode ser aplicada em todas as condições
de manejo existentes e merece uma detalhada avaliação do seu custo beneficio,
pois os resultados dos trabalhos de pesquisa apontaram, além do custo de
medicamentos muito elevado, taxas de gestação similares ou levemente inferiores a
protocolos padrão de inseminação artificial. Porém pesquisas observaram um
aumento da taxa de concepção e prenhez após IATF comparados com IA após estro
sincronizado com PGF2α (BARUSELLI, 2004).
Desta maneira, um dos principais objetivos da IATF é a inseminação artificial
sem a necessidade de observação de estro, pois no decorrer dos anos, com o
aumento do rebanho e da produção de leite por animal, a disposição dos animais em
pisos de concreto ou ainda free-stalls, dentre outros fatores levam os sinais de cio a
ficarem menos visíveis ou evidentes, o que acarreta em diminuição das taxas de
concepção e, por conseguinte menores taxas de prenhez na propriedade
(BARUSELLI, 2004).
A detecção visual de estro depende de inúmeros fatores. Em primeiro lugar,
deve-se saber reconhecer os sinais comportamentais para determinar se a vaca
pode ou não ser inseminada e o horário correto da inseminação. Falhas na detecção
causam decréscimo na taxa de concepção e consequentemente, aumento o período
de serviço. O tempo gasto por dia e o horário de observação são muito importantes
na eficiência da detecção de estro. Como aumento do número de vezes/dia gastos
na observação, aumenta-se a eficiência da detecção (Hafez & Hafez, 2004).
As manifestações de estro são menores, devido às doenças, problemas nos
membros ou a fatores estressantes, principalmente em rebanhos leiteiros. Fatores
ambientais podem influenciar o número de montas durante o período de estro e
também decrescem a duração e a intensidade do mesmo. Vacas alojadas em pisos
de concreto também mostram o cio em menor intensidade que vacas mantidas a
pasto. Portanto, a eficiência na detecção irá, provavelmente, continuar a afetar a
eficiência reprodutiva em fazendas com seleção genética e com práticas de manejo
que continuam a aumentar a produção de leite e bezerros.
45
São muitos os fatores que influenciam a rotina de observação de estro, o
que torna muitas vezes falha, levando á baixa taxa de detecção, menor taxa de
prenhes, aumento do período do parto á primeiro IA e consequentemente, maior
intervalo entre partos. Desta maneira, a técnica de IATF vem eliminar a necessidade
de observação de cios, que quando insatisfatória acarreta grandes prejuízos para a
pecuária(BARROS, 2000).
7.2.1 Vantagens da IATF
A inseminação artificial mostrou ser uma técnica viável economicamente
para acelerar o ganho genético e o retorno econômico da pecuária. No entanto, em
todo o mundo existem relatos que indicam baixa taxa de serviço em bovinos, devido
também ao comprometimento na eficiência de detecção de estro. Desta forma,
programas que visam empregar a inseminação em tempo fixo, sem necessidade de
observação do estro, podem colaborar no aumento do emprego desta tecnologia e,
possivelmente, na taxa de prenhez, pelo aumento da eficiência reprodutiva.
(MADUREIRA, 2000).
Porém, a simples justificativa de eliminar a observação de estro não pode
ser considerada como principal argumento para o emprego da IATF. A maior parte
dos trabalhos relatou que não se consegue detectar mais do que 50% dos cios.
Istopode ser verdade em rebanhos mal manejados, onde a tarefa de detecção não
fica a cargo de uma pessoa capacitada para tal (FERNANDES, 1997).
Outro detalhe é que esta técnica (IATF) elimina a necessidade de
observação de estro para inseminação artificial somente durante o protocolo. É
imprescindível a correta detecção dos animais que retornam ao cio após a
inseminação em tempo fixo, para que sejam re-inseminados o mais rápido possível.
Caso contrário, somente poderiam ser reutilizados após diagnóstico de gestação, o
que
levaria
tempo
e,
com
certeza,
prejudicaria
a
eficiência
reprodutiva
(FERNANDES, 1997).
46
Tabela 3: Informações sobre o aumento da utilização de IATF no Brasil.
7.2.2 As principais vantagens da IATF
Destacam-se como as principais vantagens da IATF:
Permite a inseminação de grande quantidade de vacas ao dia,
aumentando a produtividade da inseminação artificial.
Aumenta a produção de bezerros provenientes de inseminação artificial
(melhoramento genético).
Elimina a necessidade de observação de cio para se realizar a
inseminação.
Torna possível inseminarem-se vacas em anestro com boas taxas de
prenhez.
As fêmeas que não emprenham da IATF passam a apresentar cios
regularmente, se tornando prenhes mais facilmente, através de repasse
com IA convencional ou com uso de touros.
Permite obter altas taxas de prenhez já no inicio da estação de monta.
Antecipa e concentra o nascimento de bezerros, fazendo com que
apresentem maior peso ao desmame.
Diminui o intervalo entre partos e a nova prenhez das vacas do
rebanho, aumentando a eficiência reprodutiva.
Diminui o intervalo entre parto do rebanho, aumentando a produção de
bezerros e leite ao ano.
47
Diminui o descarte de fêmeas que ficariam vazias ao final da estação
de monta, se a IATF não fosse utilizada.
Diminui a necessidade de compra e manutenção de touros de repasse.
Facilita o manejo para inseminar as vacas.
7.2.3 Desvantagens da IATF
Como desvantagens da IATF pode-se citar: o custo do protocolo,
desinformação da queda do custo do protocolo pelo produtor e mão de obra
qualificada.
7.2.4 Limitações da IATF
Entre as limitações da IATF pode-se destacar: boa nutrição e condição
corpora l (ECC acima de 2,5); sanidade: rebanho isento de doenças, instalações
(tronco de contenção), organização: aplicação dos fármacos (IM) em todos os
animais e em todas as etapas do protocolo, qualidade do sêmen e por fim
acompanhamento técnico.
7.2.5 Triagem de fêmeas visando inclusão em programas de IATF
Para melhorar os índices de IATF indica-se uma avaliação seguindo os
seguintes tópicos:
Identificação e escrituração zootécnica confiável,
Escore de condição corporal,
Ciclicidade,
Infecções uterinas inespecíficas,
Doenças da reprodução (campilobacteriose, tricomonose, brucelose) e
outra que interferem na reprodução (leptospirose, IBR, BVD),
Histórico de maceração fetal em gestação anterior,
Defeitos anatômicos do sistema genital.
48
7.2.6 Estrutura e análise para programas de IATF
A estrutura e análise para programas de IATF deverão ser analisados os
seguintes itens:
Instalações
Inseminadores versus número de animais a serem inseminados
Diagnóstico de gestação: palpação retal versus U-S
Custo do sêmen versus protocolo a ser utilizado.
Análise da taxa de detecção de estro e taxa de concepção ao primeiro
serviço.
7.3 SINCRONIZAÇÃO DE ESTRO
Visando minimizar os prejuízos causados por um longo intervalo de partos
em gado de corte e leite, diversos estudos foram desenvolvidos no campo da
manipulação hormonal para a sincronização da ovulação. Além de reduzir o intervalo
entre partos, viabiliza de forma mais eficaz, a inseminação artificial e a concentração
de parição, proporcionando, assim, a formação de lotes mais homogêneos de
animais para abate.
A escolha dos principais protocolos a serem utilizados deverá estar baseada
nas características de viabilidade econômica e prática da propriedade trabalhada
(qualificação de mão-obra, características da observação de cio, uso ou não de
rufião, número de animais, uso da ultrassonografia para diagnóstico precoce de
gestação). Os métodos de sincronização compreendem o uso de drogas que agem
ao nível hipotalâmico-hipofisário e/ou gonadal. Os primeiros métodos de
sincronização de estros eram baseados na redução da fase luteínica com o uso de
análogos sintéticos de prostaglandinas, sendo indispensável que as fêmeas a
participarem deste programa apresentassem atividade ovariana luteal cíclica
(AOLC), pois estes compostos atuam especificamente promovendo luteólise e
consequente manifestação de estro num período aproximado de 48 a 96 horas.
49
7.3.1 Programas Hormonais para IATF
Pursleyet al. (1997) apresentaram à comunidade científica os resultados de
trabalhos desenvolvidos com a finalidade de se realizar a inseminação artificial em
tempo fixo (IATF) sincronizando a ovulação de fêmeas bovinas para minimizar o
impacto negativo associado ás dificuldades de detecção de estro em propriedades
de exploração leiteira. Foi elaborado o protocolo Ovysynch, cuja taxa de ovulação
proporcionada dependerá do tamanho do folículo no momento da indução, da taxa
de progesterona circulante e de fatores externos. A fertilidade dependerá ainda da
qualidade do oócito liberado, do perfil hormonal, do transporte dos gametas, do
reconhecimento materno da gestação, da estrutura luteal formada para a
manutenção da gestação, da inexistência de patologias, do inseminador e do próprio
sêmen. Os resultados em taxa de gestação obtidos normalmente com este protocolo
são próximos a 35% a 40% (considerando-se que não haja perda embrionária). Este
programa hormonal serviu de modelo para a grande maioria dos protocolos
atualmente utilizados para este fim, apresentados todos eles basicamente três
princípios, ou três fundamentos que são:
Sincronização da onda de crescimento folicular: è a ovulação ou atresia
do folículo dominante induzida com o uso de GnRH em dia aleatório do
ciclo estral, determinando a emergência de uma nova onda de
crescimento folicular num período de dois a três dias após a sua
aplicação.
Luteólise: é a lise do corpo lúteo do ciclo natural e de uma provável
estrutura luteal formada após a sincronização com GnRH, quando o
folículo dominante da onda sincronizada ovula e não entra em atresia.
A indução da luteólise com as prostaglandinas determina rápida queda
na taxa de progesterona.
Indução de Ovulação: realizada após 48 horas da aplicação de PGF2α,
novamente é aplicada uma dose de GnRH, que determinará a ovulação
de um folículo dominante quando a sincronização for realizada com
sucesso.
50
7.3.2Protocolo Ovsynch
Protocolo pioneiro para sincronização de vacas, a partir deste protocolo
desenvolveram-se vários outros protocolos para sincronização de estro.
Alvarez et al.,(2003) avaliaram a eficácia do protocolo Ovsynch em rebanhos
Bostaurus e Bosindicus utilizando rebanhos das raças Holandesa, Caracu, Nelore e
Mantiqueira. Neste estudo também foi incluído um rebanho de vacas Gir com
problemas de fertilidade. Cada rebanho foi dividido em três grupos, sendo o primeiro
grupo tratado pelo protocolo Ovsynch e inseminado em tempo fixo, o segundo grupo
inseminado em cio induzido pelo cloproestenol, e o terceiro grupo inseminado em cio
natural. Não houve diferença estatística significativa na taxa de concepção entre os
grupos, contudo a taxa de prenhez foi superior no primeiro e segundo grupo quando
comparado ao terceiro grupo. No rebanho Gir não encontraram alteração na taxa de
prenhez nem na taxa de concepção utilizando o protocolo Ovsynch, não
aumentando assim a fertilidade de vacas com problemas reprodutivos inespecíficos.
Concluíram os autores que independentemente da raça, os tratamentos Ovsynch e
cloprostenol não afetam a taxa de concepção, mas melhoram a taxa de prenhez. Os
trabalhos foram realizados no período de janeiro a junho de 2001 nas estações
experimentais do Instituto de Zootecnia em Nova Odessa e em Pindamonhangaba,
no Estado de São Paulo.
Gonçalves et al.,(2001) descreveram o protocolo Select-synch, como um
alternativa ao protocolo Ovsynch, no qual se realiza a sincronização da primeira
onda com o uso de GnRH em D0 e aplicação de prostaglandina em D7. A partir de
D9 substitui-se á aplicação de GnRH pela observação de cio para IA.
A utilização de implantes vaginais de progesterona adaptados ao protocolo
Ovsynch vem proporcionando melhores resultados na taxa de prenhez, em fêmeas
nelore a campo que se apresentam em anestro (pelo estímulo da mamada), desde
51
que apresentem boa condição corporal (> 3). Melhores resultados também são
obtidos em vacas ciclando quando comparamos a protocolos sem uso de
progesterona, sendo o uso deste hormônio extremamente vantajoso quando a
finalidade da sincronização e a Inseminação artificial em tempo fixo.
Trabalhos realizados com Flunixin Meglumine, aplicado 16 dias após IATF,
vêm proporcionando resultados animadores quanto á diminuição de perdas
embrionárias precoces ao inibir a síntese de prostaglandina endometrial no período
do reconhecimento materno na gestação. Contudo, ainda é necessário um maior
número de fêmeas avaliadas para uma interferência mais segura da eficiência deste
procedimento.
7.3.3 Protocolo IATF
Atualmente existe uma grande variedade de protocolos para IATF, cujos
resultados em taxa de concepção giram em torno de 50%. As pesquisas com o uso
do hormônio ECG (novormon®) apontam para maiores ganhos, principalmente, em
vacas leiteiras e vacas de corte em anestro pós-parto. Dentro das possibilidades da
utilização da IATF em gado de corte, as pesquisas apontam para maiores
vantagens, quando realizada no início da estação de monta, pois proporcionará a
desmama de crias mais pesadas e melhor distribuição de vacas gestantes. Com
relação ao repasse com touros, o ganho genético pela IA também determinará a
obtenção de bezerros mais pesados à desmama.
52
8 DESCRIÇÃO DAS ATIVIDADES REALIZADAS DURANTE O ESTÁGIO.
As atividades realizadas durante o estágio foram voltadas a produção e
reprodução animal, e foi possível trabalhar em vários campos da Medicina
Veterinária como clinica e cirurgia.
Durante o estágio foram realizadas atividades como exames andrológicos,
testes para brucelose e tuberculose, procedimentos cirúrgicos, procedimentos
clínicos em bovinos de corte e leite, diagnóstico de doenças que interferem na
produção leiteira e reprodução do gado de corte.
TABELA 4 – IATF EM GADO COMERCIAL
D-0
Implante de
Progestágeno(Cronipres®).
2,0
ml
de
Benzoato
de
Estradiol(Cronibest®).
D-8
Retirada do implante
1,5 ml de PGF (Ciosin®).
1,5 ml de ECG(novormon®)
0,5 ml de Cipionato de Estradiol
D-10
IA entre 10:00 e 18:00
Fonte: Fazzembryo, 2011
Este protocolo foi utilizado para IATF em grandes escalas comerciais.
Geralmente utilizado para produção de animais destinados ao confinamento e abate.
Quando as gestações resultam em nascimento de fêmeas estas são avaliadas e
podem ser utilizadas como receptoras para TETF.
53
TABELA 5– IATF EM GADO PO
D-0
Implante
em
Progestágenos(Cronipres®).
2,0
ml
de
Benzoato
de
Estradiol(Cronibest®).
D-8
Retirada do implante
2 ml de PGF(Ciosin®).
2 ml de ECG(Novormon®).
0,5 ml de Cipionato de Estradiol
D-10
IA entre 10:00 e 18:00
Fonte: Fazzembryo, 2011
Este protocolo foi utilizado em animais puros de origem (PO) e de maior
valor comercial. A principal diferença deste protocolo em relação aos demais é a
utilização de maior dose ECG e PGF, estimulando o desenvolvimento folicular
ovariano e aumentando a ação de FSH e LH.
54
TABELA 6 – ATIVIDADES REALIZADAS EM BOVINOS
HISTÓRICO
NÚMERO DE CASOS
PARTICIPAÇÃO
%
CLÍNICA
Brucelose e Tuberculose
268
64,4
Pneumonia
3
0,7
Babesiose
73
17,5
Afecções Podais
24
5,7
Transfusão sanguínea
21
5,0
Metrite
18
4,3
Ceratoconjuvite
8
1,9
Diagnóstico de fratura de meta-
1
0,2
416
100
Correção Umbilical
1
33,3
Cesariana
2
66,7
TOTAL
3
100
Diagnóstico US
460
27,1
Sexagem Fetal
118
6,9
Transferência de Embriões
126
7,43
Avaliação de doadoras
272
16,0
Exames Andrológicos
316
18,6
IATF
602
35,5
TOTAL
1694
100
TOTAL
2113
100
carpo em bezerro Nelore
TOTAL
CURURGIA
REPRODUÇÃO
e receptoras
8.1 DISCUSSÃO
No manejo adotado em duas propriedades onde foi possível acompanhar o
clico completo da Inseminação Artificial em Tempo Fixo, o proprietário junto com o
Médico Veterinário adotaram um manejo e IATF e após Monta Natural.
55
Na propriedade I foram protocolados 100 animais da raça Nelore com ECC
acima de 2,5 após o protocolo de IATF, as fêmeas ficaram soltas com touros para
que fosse feito o repasse das fêmeas que não obtiveram êxito na IATF. Para
verificar o percentual de fêmeas em gestação do protocolo de IATF, foi feito
diagnóstico de gestação aos 30 dias com auxilio de ultrassom, após 60 dias do
protocolo de IATF e outro diagnóstico de gestação para avaliar qual o percentual de
fêmeas obtiveram gestação de touros a campo.
Com os resultados do primeiro e segundo diagnóstico de gestação, foi
possível avaliar qual foi à porcentagem de fêmeas que obtiveram a gestação da
IATF e da monta natural, no ultrassom de 30 dias foi detectado que 52 fêmeas
gestantes e no ultrassom de 60 dias as 48 outras fêmeas estavam gestando com
concepção de monta natural.
De acordo com a média brasileira de IATF que está em torno de 50% de
concepção, na propriedade I pode ser avaliado que a média ficou em 52% de
concepção da IATF e 48% de concepção de monta natural, totalizando 100% do
rebanho acompanhado.
Na propriedade II foram protocoladas 160 fêmeas Nelore, com ECC entre 1,5
e 2,5. Após o protocolo, os animais foram soltos a campo com touros, e após 30 dias
foi feito diagnóstico de gestação com auxilio de US, neste procedimento verificou-se
que 45% das fêmeas (72) estavam em gestação. A partir do protocolo de IATF, após
60 dias foi feito diagnóstico de gestação para avaliar as taxas de concepção com
monta natural que foi de 50% totalizando 44 fêmeas gestantes de monta natural.
Os resultados do protocolo na propriedade II ficaram abaixo da média
brasileira, pelo fato de que os animais apresentaram abaixo ECC, que foi muito
significante para uma boa taxa de concepção de IATF. No total, após o protocolo de
IATF e monta natural obteve-se 72,5% de fêmeas gestando.
56
9 CONCLUSÃO
A inseminação artificial em tempo fixo apresenta-se como uma importante
alternativa para superar os problemas de baixa taxa de concepção, que ocorre em
várias fazendas. Quando a IATF é utilizada tem-se uma média de aproximadamente
50% das fêmeas, sincronizadas que emprenham apenas com uma inseminação.
Porém, para se implantar um manejo de IATF em uma propriedade, o
médico veterinário deverá ser criterioso em alguns aspectos como: manejo
nutricional, instalações, manejo sanitário, pois estes são alguns fatores que fazem
com que os resultados das taxas de concepção baixas, e, por conseguinte,
acarretarão na desmotivação do proprietário.
O estágio curricular foi de grande importância para o aprimoramento da
formação técnica, profissional e pessoal do futuro médico veterinário. Através dele
foi possível colocar em prática os ensinamentos realizados na Universidade,
especificamente nas áreas de clínica, cirurgia, manejo nutricional e biotecnologias
da reprodução em grandes animais.
Durante o estágio acompanhou-se o orientador profissional por várias
propriedades, conhecendo manejos adequados para cada realidade. Houve a
possibilidade de realizar contato com grandes produtores trocando informações com
relação ao manejo, criação e comercialização de animais.
57
REFERÊNCIAS BIBLIOGRÁFICAS
ALBUQUERQUE, F.T; BARROS FILHO, J.B.; VIANA, J.H.M. Bases Anatômicas,
Fisiológicas e Histológicas da Reprodução da Fêmea. UFLA – Universidade Federal
de Lavras, Lavras. 2004.
ALVAREZ, R.H. et al. Eficácia do tratamento Ovsynch associado á inseminação
artificial pré-fixada em rebanhos Bostaurus e Bosindicus. Pesq. Agropec. Bras.,
v.38, n.2, p317-323, 2003.
BARBOSA, F.A. Planejamento e Estratégias Nutricionais como ferramenta para
Aumento na Rentabilidade da Pecuária de Corte.III Simpósio nacional sobre
Pecuária e Gerenciamento da Pecuária de Corte. Escola veterinária da UFMG,
Belo Horizonte-MG, 2004
BARROS, C.M. Controle farmacológico do ciclo estral e superovulação em zebuínos
de corte. In: SIMPÓSIO SOBRE CONTROLE FARMACOLÓGICO DO CICLO
ESTRAL EM RUMINANTES, 2000. São Paulo, Anais... 2000, São Paulo, p.158-189.
BARUSELLI, P.; BO, G.A.; REIS, E.L.; MARQUES, M.O.; Inseminação artificial em
tempo fixo em bovinos de corte. In: I Simpósio Internacional de Reprodução Animal
aplicada. Biotecnologia da Reprodução em Bovinos. Londrina, Anais... p.155- 165,
2004.
BARUSELLI, P.; BO, G.A.; REIS, E.L.; MARQUES, M.O. Tratamientoshormonales
para mejorar La performancereproductiva de vacas de cria em anestro em
condiciones tropicales. In: 5° Simpósio Internacional de ReproduccíonAnimal ,
Córdoba, Argentina, p.103-116, 2003.
BIOGENESIS. Manual Prático de Inseminação Artificial. Curitiba: Idealgraf Editora
Ltda, 2004.
CAMPOS, A.T; FERREIRA, A.M. Composição do rebanho e sua importância no
manejo. Juiz de fora:Embrapa gado de leite, 2001.(Embrapa Gado de Leite. Circular
técnica, 32).
CUNNINGHAM,J.G. Tratado de Fisiologia Veterinária, segunda edição, Guanabara,
528 p.,1999.
DAVIDSON.A.P; STABENFELDT.G.H.Diplomate, American College of Veterinary
Internal Medicine, Associate Clinical, Department of Medicine school of Veterinary,
1999.
FERNANDES, P. Método de sincronização do estro em bovinos. In: JORNADA DE
INTEGRAÇÃO DOS ALUNOS DE GRADUAÇÃO E PÓS-GRADUAÇÃO EM
REPRODUÇÃO ANIMAL, 1, 1997. Botucatu. Anais... BOTUCATU, 1997, P156-174.
FONSECA, V.O ; ANDRADE, V.J; CHOW, L.A.; et.,al. Efeito de diferentes métodos
de amamentação sobre as eficiências produtivas e reprodutivas de um rebanho
bovino de corte. Arquivo Brasileiro Medicina veterinária e Zootecnia 39,v.2.
p.233-240, 1991.
58
GONÇALVES, P.B.D.; FIGUEIREDO, J.R; FREITAS, V.J.F. Biotécnicas aplicadas
á reprodução animal, São Paulo, Varela, p1-2, 340 p., 2001.
HAFEZ & HAFEZ. Reprodução Animal 7° Ed. Barueri: Manole Ltda, 2004.
HARTIGAN, P.N. Avaliação do estro em fêmeas bovinas para emprego manejo de
inseminação artificial em tempo fixo, 2008, Jaboticabal, Anais ,p.138-156.
HARTMANN,W. Curso de Inseminação Artificial em Bovinos, 2010, Universidade
Tuiuti do Paraná.
MACMILLAN, K.L.; BURKE, C.R. Effects of estrous cycle control on reproductive
efficiency. Animal Reproduction Science, v. 42, p.307-320, 1996.
MADUREIRA, E.H Controle farmacológico do ciclo estral com emprego de
progesterona e progestágeno em bovinos. In: SIMPÓSIO SOBRE CONTROLE
FARMACOLÓGICO DO CICLO ESTRAL DE RUMINANTES, 2000. São Paulo,
Anais... 2000, São Paulo, p.89-98.
PALHANO. Reprodução em Bovinos: Fisiopatologia, Terapêutica, Manejo e
Biotecnologias 2° Ed. Rio de Janeiro: L.F. Livros de Veterinária Ltda, 2008.
PEREIRA, M.N. Nutrição e seus efeitos na produção de bovinos. Alfenas, I Simpósio
de Atualização em Transferência de Embriões em Bovinos, 2000.
PURSLEY, J.R.; WILTBANK, M.C.; STEVENSON, J.S et.,al. Pregnancy rates in
cows and heifers inseminatd at a synchronized ovulation or synchronization estrus.
JournalofDairy Science v.80, p-295-300, 1997.
SANTOS, J. E. P. Importância da alimentação na reprodução da fêmea bovina. In: I
Workshop sobre reprodução animal. 2000. Pelotas. Anais... Pelotas, EMBRAPA
2000, p.7-82.
SILVA,R.J. Melhoramento Genético e Nutricional. Revista Brasileira de Zootecnia
v.35, n2, p.235-243,2005
SIROIS, J.; FORTUNE, J.E. Ovarian follicular dynamic during the estrous cycle in
heifers monitored by real-time ultrasonography. Biology of Reproduction, v.39, p.308317, 1988.
SHORT, R. E. et al. Effects of suckling and mastectomy on bovine post
partumreproduction.Journalof Animal Science, v.74, n. 2, p.70, 1972.
VILELA,E.R; VASCONCELOS,J.LM; FIGUEIREDO,R.A.et al. Efeito da remoção de
bezerros, em dois diferentes momentos durante protocolos de sincronização, na taxa
de ovulação em vacas nelore. In: Congresso Brasileiro de Reprodução Animal,
14,1999, Belo Horizonte, Anais..., Belo Horizonte: Colégio Brasileiro de Reprodução
Animal, 2001, p314-319.
59
WILTBANCK, M.C.; HAUGHIAN, J.M. GnRH: Bases farmacológicas para entender
sua utilização em protocolos de sincronização. VII CURSO NOVOS ENFOQUES NA
PRODUÇÃO DE BOVINOS, P.121-131, 2003.
60
61