CURSINHO ETWB 2012
Componente Curricular: Química
Professor: Ricardo Honda
Data: Terça-feira, 20/03/2012
Tema da aula: Reações de dupla troca
“Em uma reação química ocorre a transformação de substâncias com determinadas propriedades iniciais
(reagentes) em outras com propriedades diferentes (produtos). As principais reações envolvendo as funções
inorgânicas são classificadas em reações de adição (síntese), de decomposição (análise), de deslocamento
(simples troca) e de dupla troca”.
Reações de dupla troca
Para que essas reações ocorram, é necessário que pelo menos um dos produtos, quando comparado com
os reagentes, apresente no mínimo uma das características a seguir:
• seja mais fraco (menos ionizado ou dissociado);
• seja mais volátil (passa com maior facilidade para o estado gasoso ou produz um gás);
• seja menos solúvel (ocorre a formação de um precipitado).
Formação de um produto mais fraco
Nesse caso devemos ter:
Veja alguns exemplos em que essa condição pode ser verificada.
1º Experimento
Uma das reações de dupla troca mais comuns são as neutralizações, que ocorrem entre ácidos e bases:
ácido + base → sal + água
Essas reações ocorrem porque a água formada está menos ionizada do que o ácido ou a base.
2º Experimento
Outro exemplo de reação de dupla troca é a que ocorre quando são misturadas uma solução aquosa de
hidróxido de sódio (NaOH) e uma solução aquosa de sulfato de alumínio [Al2(SO4)3].
Essa reação é facilmente perceptível a olho nu, pois ocorre a formação de hidróxido de alumínio, uma
base insolúvel e, portanto, fraca, que se apresenta na solução na forma de flóculos, sendo este fenômeno
denominado floculação.
Formação de um produto mais volátil
Nesse caso devemos ter:
Uma das reações mais comuns que satisfaz essa condição ocorre quando se adiciona um ácido a um sal
2–
–
do tipo carbonato (CO3 ) ou bicarbonato (HCO3 ).
Aula 13
Página 1
Um dos produtos formados é o ácido carbônico (H2CO3), muito instável e fraco, que se decompõe
liberando gás carbônico (CO2).
Essas reações podem ser genericamente representadas por:
• ácido + carbonato
• ácido + bicarbonato
Esse tipo de reação ocorre, por exemplo, quando se usa o bicarbonato de sódio (NaHCO3) para diminuir a
acidez estomacal, pois ele reage com o ácido clorídrico presente no estômago:
Quando gotejamos, por exemplo, uma solução aquosa de ácido sulfúrico (H2SO4) a outra solução aquosa
de sulfeto de sódio (Na2S), essas substâncias reagem e liberam o H2S (g):
A ocorrência dessa reação nem sempre é perceptível a olho nu, mas pode ser percebida pelo odor
característico do H2S (g): ovos podres.
Formação de um produto menos solúvel ou insolúvel
Nesse caso devemos ter:
Um exemplo dessa reação pode ser observado quando misturamos duas soluções aquosas de nitrato de
chumbo [Pb(NO3)2] e iodeto de sódio (NaI):
A ocorrência dessa reação é perceptível a olho nu, pois forma-se um precipitado.
EXERCÍCIOS DE CLASSE
1. (FUVEST 2011) – Para identificar quatro soluções aquosas, A, B, C e D, que podem ser soluções de hidróxido
de sódio, sulfato de potássio, ácido sulfúrico e cloreto de bário, não necessariamente nessa ordem, foram
efetuados três ensaios, descritos a seguir, com as respectivas observações.
I. A adição de algumas gotas de fenolftaleína a amostras de cada solução fez com que apenas a amostra de B se
tornasse rosada.
II. A solução rosada, obtida no ensaio I, tornou-se incolor pela adição de amostra de A.
III. Amostras de A e C produziram precipitados brancos quando misturadas, em separado, com amostras de D.
Com base nessas observações e sabendo que sulfatos de metais alcalino-terrosos são pouco solúveis em água,
pode-se concluir que A, B, C e D são, respectivamente, soluções aquosas de
a) H2SO4, NaOH, BaCl2 e K2SO4.
b) BaCl2, NaOH, K2SO4 e H2SO4.
c) NaOH, H2SO4, K2SO4 e BaCl2.
d) K2SO4, H2SO4, BaCl2 e NaOH.
e) H2SO4, NaOH, K2SO4 e BaCl2.
Aula 13
Página 2
2. (FUVEST) – Ácido clorídrico pode reagir com diversos materiais, formando diferentes produtos, como mostrado
no esquema abaixo:
Os seguintes sinais evidentes de transformações químicas: liberação de gás, desaparecimento parcial ou total de
sólido e formação de sólido são observáveis, respectivamente, em:
a) I, II e III.
b) II, I e III.
c) II, III e I.
d) III, I e II.
e) III, II e I
3. (FUVEST) – Nitrato de bário pode ser preparado, em meio aquoso, através das transformações químicas
abaixo:
Nas etapas 1 e 2, ocorrem, respectivamente,
a) precipitação de carbonato de bário e desprendimento de dióxido de carbono.
b) precipitação de carbonato de bário e desprendimento de hidrogênio.
c) desprendimento de cloro e desprendimento de dióxido de carbono.
d) desprendimento de dióxido de carbono e precipitação de nitrato de bário.
e) desprendimento de cloro e neutralização do carbonato de bário.
EXERCÍCIOS COMPLEMENTARES
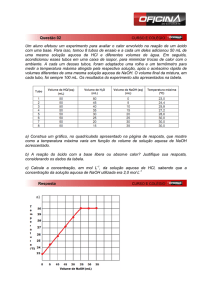
1. (FUVEST 2010) – Uma estudante de química realizou quatro experimentos, que consistiram em misturar
soluções aquosas de sais inorgânicos e observar os resultados. As observações foram anotadas em uma tabela:
Experimento
1
2
3
4
Solutos contidos inicialmente nas
soluções que foram misturadas
Ba(ClO3)2
Mg(IO3)2
Mg(IO3)2
Pb(ClO3)2
MgCrO4
Pb(ClO3)2
MgCrO4
Ca(ClO3)2
Observações
formação de precipitado branco
formação de precipitado branco
formação de precipitado amarelo
nenhuma transformação observação
A partir desses experimentos, conclui-se que são pouco solúveis em água somente os compostos
a) Ba(IO3)2 e Mg(ClO3)2.
b) PbCrO4 e Mg(ClO3)2.
c) Pb(IO3)2 e CaCrO4.
d) Ba(IO3)2, Pb(IO3)2 e PbCrO4.
e) Pb(IO3)2, PbCrO4 e CaCrO4.
2. (FUVEST) – Do livro de Antoine Laurent Lavoisier, Traité Élémentaire de Chimie, traduziu-se o seguinte trecho:
“Ácido cítrico é mais facilmente obtido saturando-se suco de limão com cal suficiente para formar citrato de cálcio,
que é insolúvel em água. Lava-se esse sal e acrescenta-se quantidade apropriada de ácido sulfúrico. Forma-se
sulfato de cálcio, que precipita, deixando o ácido cítrico livre na parte líquida”.
Representando-se o ácido cítrico por H3Cit, o procedimento descrito por Lavoisier pode ser esquematizado pela
sequência de equações:
2 H3Cit (aq) + x CaO (s) → Y (s) + 3 H2O (l)
Y (s) + z H2SO4 (aq) → 3 CaSO4 (s) + 2 H3Cit (aq)
Em tal sequência, x, Y, e z correspondem, respectivamente, a
a) 3, Ca3(Cit)2 e 3.
b) 2, Ca2(Cit)3 e 3.
c) 3, Ca3(Cit)2 e 2.
d) 3, Ca2(Cit)3 e 3.
e) 2, Ca3(Cit)2 e 2.
3. (FUVEST) – Para distinguir uma solução aquosa de ácido sulfúrico de outra de ácido clorídrico, basta adicionar
a cada uma delas:
a) um pouco de solução aquosa de hidróxido de sódio.
b) um pouco de solução aquosa de nitrato de bário.
c) raspas de magnésio.
Aula 13
d) uma porção de carbonato de sódio.
e) gotas de fenolftaleína.
Página 3