Questão 02
CURSO E COLÉGIO
Um aluno efetuou um experimento para avaliar o calor envolvido na reação de um ácido
com uma base. Para isso, tomou 8 tubos de ensaio e a cada um deles adicionou 50 mL de
uma mesma solução aquosa de HCl e diferentes volumes de água. Em seguida,
acondicionou esses tubos em uma caixa de isopor, para minimizar trocas de calor com o
ambiente. A cada um desses tubos, foram adaptados uma rolha e um termômetro para
medir a temperatura máxima atingida pela respectiva solução, após o acréscimo rápido de
volumes diferentes de uma mesma solução aquosa de NaOH. O volume final da mistura, em
cada tubo, foi sempre 100 mL. Os resultados do experimento são apresentados na tabela.
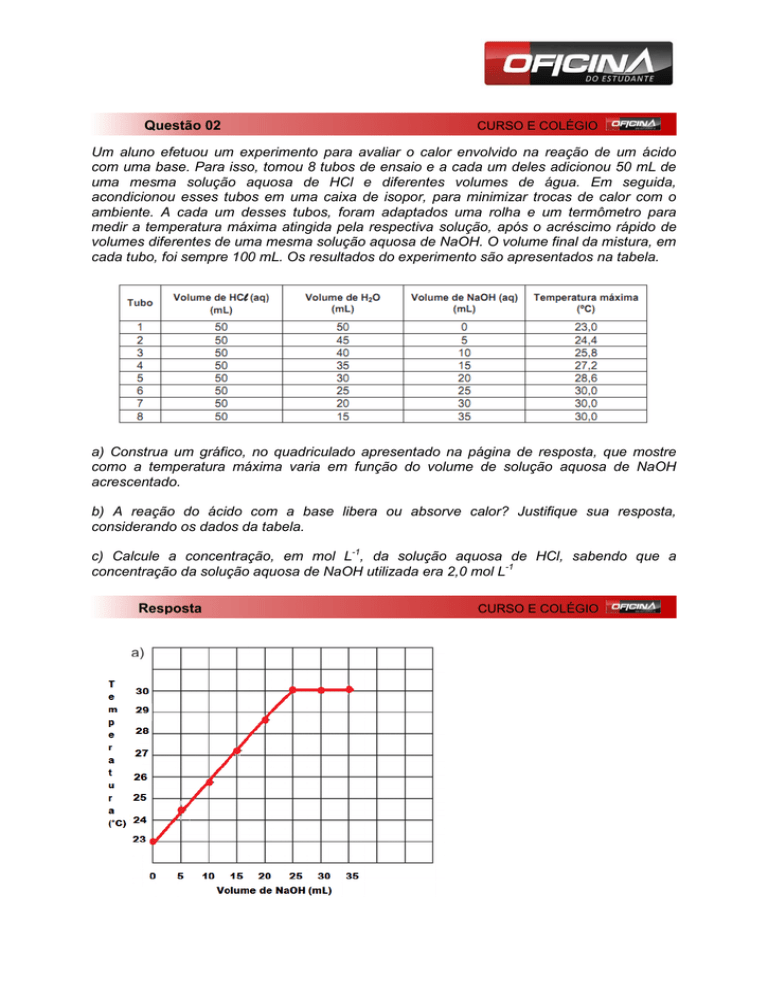
a) Construa um gráfico, no quadriculado apresentado na página de resposta, que mostre
como a temperatura máxima varia em função do volume de solução aquosa de NaOH
acrescentado.
b) A reação do ácido com a base libera ou absorve calor? Justifique sua resposta,
considerando os dados da tabela.
c) Calcule a concentração, em mol L-1, da solução aquosa de HCl, sabendo que a
concentração da solução aquosa de NaOH utilizada era 2,0 mol L-1
Resposta
CURSO E COLÉGIO
b) A reação do ácido com a base libera calor. Nota-se isso, pois o volume do ácido é
mantido constante e quanto maior o volume de base adicionado maior a temperatura do
sistema até que a reação aconteça por completo.
c) Para calcular a concentração da solução aquosa de HCl, deve-se utilizar os dados
obtidos no tubo 6, no qual a neutralização ocorre completamente, uma vez que a partir
desse experimento, a temperatura não mais se alterou, mesmo aumentando-se a
quantidade de base.
Na Equação 1 observa-se que a proporção ácido:base é 1:1, logo o número de mols
de ácido deve ser igual ao número de mols de base.
HCl (aq) + NaOH (aq) NaCl (aq) + H2O (l)
Equação 1
n° (H+) = n° (OH-) = 2 mol L-1 x 25 x 10-3 L = 5 x 10-2 mol
Como há 50 mL (50x10-3 L) de ácido: [H+] = (5x10-2 ) / (50x10-3) = 1 mol L-1












