Hospital do Servidor Público Municipal
RESISTÊNCIA AOS HORMÔNIOS TIREOIDIANOS E
INCIDENTALOMA HIPOFISÁRIO:
RELATO DE CASO E REVISÃO DE LITERATURA
LÍLIAN ARAÚJO CAETANO
São Paulo
2011
LÍLIAN ARAÚJO CAETANO
RESISTÊNCIA AOS HORMÔNIOS TIREOIDIANOS E
INCIDENTALOMA HIPOFISÁRIO
Trabalho de Conclusão de Curso
apresentado à Comissão de Residência
Médica do Hospital do Servidor Público
Municipal, para obtenção do título de
Residência Médica
Área: Endocrinologia
Orientador: Dr. Ricardo Ayello Guerra
São Paulo
2011
FICHA CATALOGRÁFICA
Caetano, Lílian Araújo
Resistência aos Hormônios Tireoidianos e Incidentaloma
Hipofisário / Lílian Araújo Caetano – São Paulo, 2011
Trabalho de Conclusão de Curso apresentado à
Comissão de Residência Médica do HSPM-SP,
para obter o título de Residência Médica, na área
de Endocrinologia.
1. Resistência aos Hormônios Tireoidianos, Receptor de hormônio
tireoidiano, Tireotrofinoma, Adenoma hipofisário, Incidentaloma
hipofisário
AUTORIZO A REPRODUÇÃO APENAS DO RESUMO DESTE
TRABALHO, DE MINHA AUTORIA, NA BIBLIOTECA VIRTUAL
DE SAÚDE DO MUNICIPIO DE SÃO PAULO.
São Paulo, 30/08/2011
Assinatura do Autor:
E-mail: [email protected]
LÍLIAN ARAÚJO CAETANO
RESISTÊNCIA AOS HORMÔNIOS TIREOIDIANOS E
INCIDENTALOMA HIPOFISÁRIO
Trabalho de Conclusão de Curso apresentado à Comissão de
Residência Médica do HSPM-SP, para obtenção do título de Residência
Médica
Área: Endocrinologia
Orientador: Dr. Ricardo Ayello Guerra
_________________________________________
Avaliador 1
_________________________________________
Avaliador 2
_________________________________________
Avaliador 3
SUMÁRIO
I.
Resumo........................................................................................................... 1
II.
Abstract.......................................................................................................... 2
III.
Introdução e Revisão da Literatura.............................................................. 3
IV.
Objetivo........................................................................................................... 5
V.
Relato de Caso............................................................................................... 6
VI.
Discussão...................................................................................................... 11
VII.
Conclusão..................................................................................................... 14
VIII.
Referências Bibliográficas.......................................................................... 15
RESISTÊNCIA AOS HORMÔNIOS TIREOIDIANOS E INCIDENTALOMA HIPOFISÁRIO
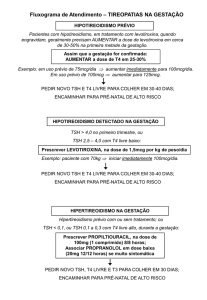
Introdução: A Resistência aos Hormônios Tireoidianos (RHT) é uma síndrome rara,
caracterizada por elevação persistente dos níveis de hormônios tireoidianos (HT) e TSH normal
ou elevado. Esta doença ocorre por mutações detectadas no gene TR em cerca de 90% dos
casos. Por conseqüência há um defeito no receptor de HT, o que leva a uma insensibilidade dos
tecidos à ação dos HT. A maioria dos casos (75%) é de ocorrência familiar, sendo a herança
autossômica dominante. O fenótipo é bastante variável mesmo com mutações idênticas do TR.
O principal diagnóstico diferencial é adenoma hipofisário produtor de TSH. Atualmente há mais
de 1.000 casos descritos de RHT, porém, até o momento na literatura, há descrição de apenas 4
casos de adenoma hipofisário em pacientes com RHT documentada.
Caso Clínico: Relatamos o caso de uma paciente de 58 anos, sexo feminino, previamente
hipertensa, encaminhada à Endocrinologia por alteração na função tireoidiana verificada em
exames de rotina, queixando apenas de ansiedade. Ao exame físico: FC=68bpm,
PA=130x80mmHg, tireóide pouco aumentada, sem nódulos palpáveis; ausência de exoftalmo,
Lid lag ausente, sem tremores. Apresentava TSH=6,76µIU/mL (VR=0,4-4,0), T4L=2,99ng/dl
(VR=0,89-1,76), T3=176ng/dl (VR=84-172), anticorpos anti-TPO e anti-Tg indetectáveis. Durante
o acompanhamento, os níveis de T4L, T3 e TSH persistiram elevados. A cintilografia de tireóide
evidenciou captação de 46%. Realizado teste de estímulo com TRH com resposta normal (TSH
basal=5,04mU/L, pico=14mU/L aos 15 minutos). Dosada a subunidade = 1040ng/L (VR=3404000) e SHBG = 69,2nmol/L (VR=18-114). Tais achados são compatíveis com Resistência aos
Hormônios Tireoidianos. Durante a investigação foi realizada RM de sela túrcica que mostrou
área hipocaptante no parênquima hipofisário de 0,6x0,4cm. Os níveis dos demais hormônios
hipofisários eram normais. Como a paciente não apresentava manifestações clínicas de
hipertireoidismo, foi optado por observação sem nenhuma medicação específica. A paciente
permanece clinicamente estável até o momento (seguimento de 4 anos).
Conclusão: Este caso representa uma situação rara de RHT coexistindo com adenoma
hipofisário. O incidentaloma hipofisário pode estar presente em 10-20% da população geral, o
que também pode ocorrer em pacientes com RHT. Portanto a avaliação hormonal cuidadosa,
previamente à realização da RM, é necessária para que se faça o correto diagnóstico diferencial
em um caso de hipertirotropinemia associada à hipertiroxinemia.
Descritores: Resistência aos Hormônios Tireoidianos, Receptor de hormônio tireoidiano,
Tireotrofinoma, Adenoma hipofisário, Incidentaloma hipofisário
THYROID HORMONE RESISTANCE AND PITUITARY INCIDENTALOMA
Background: Resistance to Thyroid Hormone (RTH) is a rare syndrome, characterized by
persistently elevated levels of thyroid hormones (TH) and normal or high TSH. This disease
occurs due to mutations detected in the beta-isoform of the thyroid hormone receptor (TR-) gene
in about 90% of cases. Consequently there is a defect in the TH receptor, which leads to an
insensitivity of tissues to the action of TH. Most of the cases (75%) are familial, with an autosomal
dominant inheritance. The phenotype is highly variable even with identical mutations of TR-. The
main differential diagnosis is TSH-secreting pituitary tumor. Currently, there are over 1,000
reported cases of RTH, but to our knowledge, in the literature, there are descriptions of only four
cases of pituitary adenoma in the setting of documented RTH.
Clinical Case: A 58-year-old female patient, with prior hypertension, was referred to our Unit
because of changes in thyroid function found during routine tests. She only complained of
anxiety. On physical examination she had HR = 68bpm, BP = 130x80mmHg, slightly enlarged
thyroid without palpable nodules; absence of lid lag or exophthalmos or tremor. Laboratory tests
showed TSH = 6.76mU/L (RV = 0.4-4.0), FT4 = 2.99ng/dL (RV = 0.89-1.76), T3 = 176ng/dl (RV =
84-172), undetectable anti-peroxidase and anti-thyroglobulin. During follow up, levels of FT4, T3
and TSH persisted elevated. Thyroidal
131
I uptake at 24 hr was 46%. She had a normal TSH
response to TRH (basal TSH = 5.04mU/L, peak level = 14.0mU/L, at 15 minutes), alphaglycoprotein subunit level was 1,040 ng/L (RV = 340-4,000) and SHBG was 69.2 nmol/L (RV =
18-114). These data suggest that inappropriate TSH secretion in the present patient resulted
from Resistance to Thyroid Hormone. During the investigation sellar MRI was performed and a
pituitary adenoma of 0.6x0.4 cm was seen. Other pituitary hormones were normal. As the patient
had no clinical signs of hyperthyroidism, it was chosen by observation without any specific
medication. The patient remains clinically stable so far (follow up of 4 years).
Conclusion: This case represents a rare presentation of RTH coexisting with incidental pituitary
adenoma. As a pituitary incidentaloma can be present in 10-20% of the general population, it can
also occur in patients with RTH. Moreover, the question of whether RTH could lead to pituitary
hyperplasia or adenoma development was also raised in the literature. Therefore, careful
hormonal evaluation prior to sellar MRI is necessary in order to do the correct differential
diagnosis in a case of hyperthyrotropinemia associated with hyperthyroxinemia.
Keywords: Resistance to Thyroid Hormone, Thyroid hormone receptor, TSH-secreting pituitary
tumor, Pituitary adenoma, Pituitary Incidentaloma
I.
INTRODUÇÃO E REVISÃO DA LITERATURA
A disfunção tireoidiana pode ocorrer por hipo ou hiperfuncionamento da glândula
tireóide, situações em que há uma relação inversa entre os níveis séricos de hormônio
tireoestimulante (TSH) e hormônios tireoidianos (HT). No hipotireoidismo primário, os níveis
séricos de T4 livre estão diminuídos e os de TSH elevados; já na tireotoxicose ocorre o
inverso. Todavia, há situações clínicas raras em que as variações destes hormônios
ocorrem no mesmo sentido.
As doenças que cursam com níveis séricos aumentados de HT e níveis elevados ou
inapropriadamente normais de TSH são: Resistência aos Hormônios Tireoidianos (RHT) e
Adenoma Hipofisário Produtor de TSH.
A RHT é uma síndrome rara, descrita pela primeira vez por Refetoff e cols. em 1967,
com incidência desconhecida, prevalência de 1 para 40.000 recém-nascidos, já tendo sido
relatados mais de 1.000 casos, provenientes de cerca de 250 famílias. O padrão de herança
é autossômico dominante, por mutação no gene TR-, sendo a transmissão recessiva
identificada em apenas uma família; alguns casos são “de novo‖ ou esporádicos (cerca de
25%), nos quais a família do paciente não apresentava nenhuma mutação. O receptor de
HT (TR) é um receptor nuclear que possui 2 isoformas: TR-α e TR-, codificados por dois
diferentes genes, localizados nos cromossomos 17 e 3, respectivamente. O TR-α modula os
efeitos dos HT no coração e na massa óssea e o TR- regula os efeitos dos HT no perfil
lipídico, gasto calórico e na secreção de TSH. Não há descrição de mutação do receptor alfa
(TR-α) até o momento, embora 15-20% dos pacientes com diagnóstico de RHT não
apresentem mutações no TR-. A patogênese da RHT é explicada por uma insensibilidade
dos tecidos à ação dos HT (o defeito no receptor de HT, causado pela mutação no gene TR, leva à resistência tecidual à ação dos HT). O fenótipo da RHT é bastante variável, tanto
inter-familiar, como entre membros da mesma família com mutações idênticas no TR-
(devido à variabilidade da resistência nos tecidos periféricos e hipófise), podendo se
manifestar como hipertireoidismo clínico ou hipo ou eutireoidismo. O bócio é encontrado em
85% dos casos de RHT e a taquicardia em 90% (pois o coração tem predominantemente
TR-α, que responde normalmente aos níveis elevados de HT). Não há tratamento específico
para o defeito da RHT. Assim, pacientes eutireoidianos não devem ser tratados, porém
necessitam ser seguidos. Em casos com sintomas de hipertireoidismo, pode-se usar betabloqueador ou ácido triiodotiroacético - TRIAC (reduz níveis séricos de TSH e de T4 e
diminui o bócio); o TRIAC suprime o TSH sem aumentar o efeito tireomimético nos tecidos
periféricos, devido à sua maior afinidade pelo TR- em relação ao TR-α, quando comparado
com T3, além de apresentar degradação mais rápida. Se o quadro clínico for de
hipotireoidismo, recomenda-se tratamento com Levotiroxina.
O Adenoma Hipofisário Produtor de TSH (Tireotrofinoma ou TSHoma) representa 0,5
a 2% dos adenomas hipofisários, sendo um tumor raro, com aproximadamente 300 casos
descritos. Seu pico de incidência é na sexta década de vida, acomete igualmente ambos os
sexos, 80% são macroadenomas e geralmente não tem relação com história familiar. No
TSHoma,
há
quadro
clínico
de
hipertireoidismo,
bócio
difuso
ou
multinodular,
freqüentemente associado a algum sinal ou sintoma decorrente de compressão tumoral,
como cefaléia, alteração visual, hipopituitarismo. O tratamento é preferencialmente cirúrgico
(ressecção transesfenoidal do tumor), associado, se necessário, a radioterapia e /ou
Octreotide.
O diagnóstico diferencial correto em um caso de hipertiroxinemia associada à
hipertirotropinemia depende de uma avaliação complementar cuidadosa, que inclui a
dosagem de SHBG (globulina ligadora de hormônios sexuais), dosagem da subunidade e
o teste do TRH (hormônio liberador de tireotrofina):
SHBG: geralmente elevada em pacientes com tireotoxicose.
Subunidade : normal na RHT e elevada no TSHoma.
Obs1: O TSH é um hormônio glicoprotéico (assim como FSH – hormônio folículo estimulante,
LH – hormônio luteinizante, e hCG – gonadotrofina coriônica humana), composto por 2
subunidades: e . A subunidade é idêntica nos 4 hormônios glicoprotéicos. A subunidade
confere especificidade biológica (determinando as funções distintas de cada hormônio).
Obs2: Os níveis de subunidade geralmente são elevados no TSHoma devido co-secreção
de subunidade livre.
Teste do TRH: na RHT, o TSH apresenta resposta normal ou exagerada em vigência
do estímulo com TRH (94-100% dos casos); já no TSHoma, a resposta é reduzida ou
plana (61-80% dos casos).
Já foi considerada na literatura a possibilidade da RHT levar a hiperplasia hipofisária
ou ao desenvolvimento de um adenoma de hipófise.
A maioria dos TSHomas são facilmente detectáveis pela ressonância magnética
(RM), enquanto pacientes com RHT geralmente apresentam RM hipofisária normal. Porém,
o achado de um adenoma pituitário em um paciente com suspeita de RHT pode ser
incidental, se for um tumor não-funcionante.
Atualmente, há mais de 1.000 casos relatados de RHT, porém, até o momento na
literatura, há descrição de apenas quatro casos de adenoma hipofisário coexistindo com
RHT documentada.
II.
OBJETIVO
O objetivo do presente trabalho é descrever o caso de uma paciente com níveis
elevados de hormônios tireoidianos (HT) e aumento dos níveis de TSH, que apresenta como
fator confundidor um adenoma hipofisário. E ainda, discutir sobre o diagnóstico diferencial e
a coexistência de RHT e TSHoma.
III.
RELATO DE CASO
Identificação:
Paciente: D.F.D.
Idade: 62 anos
Sexo: feminino
Natural: Maceió (AL); Procedente: São Paulo (SP)
Anamnese:
Paciente atualmente com 62 anos, encaminhada do ambulatório de Clínica Médica
do Hospital do Servidor Público Municipal de São Paulo (onde acompanhava por
hipertensão) ao ambulatório de Endocrinologia em agosto de 2007, aos 58 anos, devido
alteração na função tireoidiana verificada em exames de rotina.
Queixava-se apenas de ansiedade (―nervosismo‖, ―agitação‖).
Negava sudorese, palpitações, tremores, alterações do hábito intestinal, insônia ou
perda de peso significativa.
Antecedentes Pessoais: hipertensão arterial sistêmica (HAS), obesidade (grau I).
Negava tabagismo.
Antecedentes Ginecológicos e Obstétricos: Gesta 2, Para 2, Aborto 0. Menopausa
aos 51 anos; usou terapia de reposição hormonal dos 51 aos 57 anos.
Antecedentes Familiares: pais falecidos; 1 irmã falecida (por câncer de mama); 10
irmãos vivos, sendo que uma apresenta hipotireoidismo por doença de Hashimoto; 2 filhos
saudáveis.
Exame físico:
Peso = 69,5 Kg; Altura = 1,52 m; IMC = 30,08 kg/m2
FC = 68 bpm; PA = 130x80 mmHg
Ausculta cardíaca e pulmonar sem alterações.
Tireóide discretamente aumentada, sem nódulos palpáveis.
Ausência de tremores, Lid Lag negativo, sem exoftalmopatia.
Exames Complementares:
19/07/07
03/10/07
30/01/08
17/06/08
17/04/09
28/08/09
23/11/09
03/05/10
23/12/10
21/01/11
6,76
6,6
7,05
5,4
6,01
5,19
5,09
5,15
5,03
6,4
2,99
2,4
2,53
3,0
3,0
2,11
1,69
2,03
1,61
1,74
-
164
162
155
-
143
-
202
176
180
(µg/dL)
(VR: 4,5–12,5)
-
12,1
-
-
-
-
-
-
-
-
aTPO
25
(neg)
26,6
(neg)
-
< 10
(neg)
-
-
-
-
-
-
< 20
(neg)
< 20
(neg)
-
< 20
(neg)
-
-
-
-
-
-
TSH
(mU/L)
(VR: 0,4–4,0 )
T4L
(ng/dL)
(VR: 0,89–1,76)
T3
(ng/dL)
(VR: 84–172)
T4
(U/mL)
(VR < 35)
aTg
(U/mL)
(VR < 40)
Ultrassonografia de Tireóide (21/01/2008):
Tireóide de dimensões aumentadas com contornos regulares e textura heterogênea.
Lobo esquerdo (LE): com cistos (0,47 - 0,83 cm). Lobo direito (LD): com nódulo (0,5 x 0,8
cm). Volume total de 22,7 cm³ (volume normal até 15 cm³).
Cintilografia de Tireóide com 131I e 99mTc (20/02/2008):
Tireóide tópica com forma normal e aumentada em suas dimensões. Distribuição
homogênea do traçador no parênquima glandular. Conclusão: Bócio difuso. Captação de 24
horas: 46% (VR: 18-48%).
Ressonância Magnética (RM) de Sela Túrcica (06/11/2008):
Cavidade selar de dimensões conservadas. Área hipocaptante, medindo 0,6 x 0,4
cm, paramediana à direita do parênquima adenohipofisário. Haste hipofisária levemente
desviada para a esquerda, de espessura normal.
RM de Sela Túrcica (06/04/2011):
Sem alterações em relação ao exame anterior.
Avaliação dos Basais Hipofisários:
21/01/2011
FSH
(UI/L)
(VR pós-menopausa: 21,7–153)
LH
(UI/L)
(VR pós-menopausa: 11,3–39,8)
45,9
20,9
E2
(pg/mL)
(VR pós-menopausa < 30)
PRL
(ng/mL)
(VR: 1,9–25,0)
GH
(ng/mL)
(VR < 1,0)
IGF-1
(ng/mL)
(VR: 75–212)
Cortisol 8h
(µg/dL)
(VR: 5,0–25,0)
Cortisol pós-supressão c/ 1mg Dexa
(µg/dL)
(VR < 5,0)
26,7
7,1
0,64
61,6
12,0
< 1,0
Subunidade (07/08/2008): 1040 ng/L (VR p/ ♀ pós-menopausa = 340-4.000)
(ensaio imunofluorométrico)
SHBG (18/05/2010): 69,2 nmol/L (VR = 18-114)
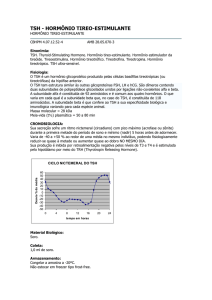
Teste de Estímulo com TRH (24/09/2008):
TSH
Prolactina
(mU/L)
(ng/mL)
0
5,04
5,5
15
14,0
45,9
30
11,20
35,9
60
8,56
15,9
Tempo (minutos)
TSH (mU/L)
PRL (ng/mL)
16
60
12
40
8
20
4
0
0
0'
15'
30'
60'
0'
15'
30'
60'
Resposta normal: incremento de no mínimo 5 mU/L no valor basal (nos tempos 15 e 30 minutos)
ou aumento > 6-10x o valor basal.
Obs: TSHoma: aumento < 2x o valor basal (80% dos casos).
Seqüenciamento do gene TR-: em andamento em outro serviço.
Análise:
RHT
*
T4L + TSH + Acs (-)
*
Subunidade : normal
*
Teste do TRH: resposta normal
*
SHBG: normal
Microadenoma hipofisário - incidentaloma
Conduta:
Optado por observação, sem nenhuma medicação específica para tratamento
tireoidiano (visto que a paciente encontrava-se clinicamente em eutireoidismo).
Seguimento:
No seguimento de 4 anos em nosso serviço, a paciente permanece clinicamente
estável, sendo que durante este período as únicas alterações verificadas foram osteoporose
e dislipidemia, além da obesidade e HAS já presentes no início.
Densitometria Óssea (23/10/2009): Osteoporose em coluna lombar e osteopenia em
fêmur
D.O. (Lunar)
T score
%
L1
- 4,0
58
L2
- 5,0
50
L3
- 3,1
69
L4
- 3,4
66
P
(mg/dL)
(VR: 2,5–4,9)
L1 – L4
- 3,8
62
L1 – L2
- 4,3
55
Colo fêmur
- 2,0
75
Fêmur total
- 2,2
74
03/05/10
PTH
(pg/mL)
(VR: 12–65)
47,2
Ca
(mg/dL)
(VR: 8,9–10,0)
9,94
3,9
Calciúria
(mg/24h)
(VR: 60-220)
223
IV.
DISCUSSÃO
A paciente relatada apresentava níveis séricos elevados de TSH e de HT – TSH
variando de 5,03 a 7,05 mUI/L; T4L de 1,61 a 3,0 ng/dL; T3 de 143 a 202 ng/dL (valores
altos considerando o TSH elevado) – podendo tratar-se de RHT ou TSHoma.
O aumento do volume da tireóide mostrado na ultra-sonografia e a captação no limite
superior vista na cintilografia podem ser encontrados tanto na RHT quanto no TSHoma.
Safer e cols. sugerem que sejam seguidos 3 passos para o diagnóstico diferencial de
casos com secreção inapropriada de TSH: dosagem da subunidade α, teste de estímulo
com TRH e RM hipofisária. Para complementação diagnóstica, sugerem também que sejam
dosados marcadores séricos de ação periférica dos HT, como SHBG.
A dosagem de SHBG na nossa paciente foi normal, sugerindo resistência hepática à
ação dos HT. Corroborando com o diagnóstico de RHT, a subunidade também foi normal
e o teste do TRH mostrou uma resposta normal (TSH basal de 5,04 mUI/L; pico aos 15
minutos de 14,0).
Para melhor documentação do caso, foi solicitada uma RM de Sela que evidenciou
um adenoma hipofisário, o que foi um fator de confusão para o diagnóstico.
Levando em consideração os achados acima associados a dosagens normais dos
outros hormônios hipofisários, consideramos que o TSH elevado no presente caso é
conseqüência da Síndrome de RHT e o achado da imagem hipofisária corresponde a um
incidentaloma. Este diagnóstico é reforçado pelo fato de não ter havido crescimento tumoral
em 3 anos de seguimento radiológico.
O adenoma hipofisário pode estar presente como um achado incidental em 10-20%
da população geral, o que pode ocorrer também em pacientes com RHT.
No seguimento, a paciente evoluiu com osteoporose, o que poderia ser uma
manifestação da disfunção tireoidiana neste caso. No tecido ósseo, predominam receptores
tireoidianos TR-α, que não sofrem mutação na RHT. Não sabemos quanto dessa perda de
massa óssea se deve à superexposição do osso ao excesso de HT.
Por outro lado, a dislipidemia e a obesidade, apresentadas pela paciente, podem ser
vistas como evidência de ausência de tireotoxicose hepática e adiposa, apesar de níveis
séricos elevados de HT. No fígado e no tecido adiposo predominam receptores tireoidianos
TR-β, que estão mutados na RHT, demonstrando resistência destes tecidos à ação dos HT.
A coexistência de RHT e adenoma hipofisário é rara (encontramos, na literatura,
apenas quatro casos descritos desta associação), o que nos faz pensar em um achado
ocasional. Se fossemos pensar na hipótese da RHT levar ao desenvolvimento de um tumor
hipofisário, provavelmente haveria um maior número de casos relatados desta associação,
visto que há mais de 1.000 casos descritos de RHT.
Revisando os 4 casos em que houve concomitância de RHT e adenoma hipofisário,
verificamos que todos apresentavam níveis normais de subunidade e aumento esperado
do TSH em vigência do estímulo com TRH; apenas em um caso houve aumento do valor de
SHBG, tratando-se de um TSHoma concomitante a RHT. Dois casos eram compatíveis com
incidentaloma associado à RHT e um caso tinha associação com acromegalia.
Considerando o que foi acima exposto, acreditamos que a nossa paciente apresenta
RHT com base apenas nos dados clínico-laboratoriais disponíveis, questionando a real
necessidade do exame de RM Selar neste caso.
Casos de RHT e Adenoma Hipofisário
Literatura
Itagaki et al
6
Watanabe et al
7
Safer et al
8
Berker et al
9
CASO (relato)
Publicação
Tohoku JEM 1989
JCEM 1993
Thyroid 2001
J Endoc Inv 2009
Procedência
Japão
Japão
EUA
Turquia
Brasil
Sexo
Masculino
feminino
feminino
masculino
feminino
Idade (anos)
22
21
42
34
58
Clínica
Tireotoxicose
tireotoxicose
hipotireoidismo
Normais
-
filhos c/ RHT
0,35 ng/mL
1,7 µg/mL
TFT (Testes de função
tireoidiana)
parentes
Subunidade
SHBG
Teste do TRH
RM Hipofisária
(VR < 1,0)
acromegalia
normais
0,7 µU/mL
irmã com
Hashimoto
1040 ng/L
(VR: 340-4.000)
(VR ?)
<1
1,5
não calculada, pois
subunidade
indetectável
<1
>1
136 nmol/L
normal
normal
69,2 nmol/L
(VR: 20-100)
(sem o valor descrito)
(sem o valor descrito)
(VR: 18-114)
normal
hiperresponsivo
normal
normal
normal
TSH basal=1,72mUI/L
TSH basal=10,7mUI/L
TSH basal=0,4mUI/L
TSH basal=1,2mUI/L
TSH basal= 5,04mUI/L
TSH pico=23,8mU/L
TSH pico=91,7mU/L
TSH pico=3,0mU/L
TSH pico=8,06mU/L
TSH pico=14,0mU/L
microadenoma
adenoma
adenoma
adenoma
adenoma
(TC; sem medida)
1,0x0,9cm
0,7cm
0,6cm
0,6x0,4cm
-
(pré-menopausa)
(VR < 0,8)
eutireoidismo
(VR < 2,5)
Razão molar
sub/TSH
< 0,2 ng/mL
tireotoxicose
(pós-menopausa)
IGF-1=901ng/mL
Outros hormônios
hipof.
Normais
normais
normais
(VR: 68-324)
OGTT-GH: sem
normais
supressão
Mutação no gene
TR-
HD
não pesquisada
RHT e
incidentaloma
não pesquisada
RHT + TSHoma
pesquisa em
R438H
não pesquisada
RHT e
RHT +
RHT e
incidentaloma
Somatotropinoma
incidentaloma
andamento
V.
CONCLUSÃO
Apresentamos um caso raro de RHT coexistindo com adenoma hipofisário incidental.
Trata-se de uma associação que não é comumente vista por endocrinologistas gerais,
caracterizando um difícil diagnóstico.
Enfatizamos que, na maioria dos casos, uma avaliação bioquímica e hormonal
criteriosa é suficiente para realizar o diagnóstico diferencial correto em um caso de
hipertiroxinemia associada à hipertirotropinemia, dispensando para este fim a realização de
exames de imagem como a RM Selar, com conseqüente redução de custos.
VI.
REFERÊNCIAS BIBLIOGRÁFICAS
1. KRONENBERG, H.M., et al. Williams Textbook of Endocrinology: 11th ed.
Philadelphia, USA: Ed Saunders Elsevier, 2008. p. 323, 396-397. ISBN 978-1-41602911-3.
2. GARDNER, D.G., SHOBACK, D. Greenspan’s Basic & Clinical Endocrinology: 6th
ed. USA: Ed McGraw-Hill Companies, 2001. p. 253-254. ISBN 978-0-07-144011-0.
3. GARDNER, D.G., SHOBACK, D. Greenspan’s Basic & Clinical Endocrinology: 8th
ed. USA: Ed McGraw-Hill Companies, 2007. p. 260. ISBN 978-0-07-144011-0.
4. SAAD, M.J.A., MACIEL, R.M.B, MENDONÇA, B.B. Endocrinologia. São Paulo:
Atheneu, 2007. p. 441-453. ISBN 978-85-7379-908-8
5. REFETOFF, S., et al. Chapter 16D Resistance to Thyroid Hormone: Thyroid Disease
Manager. Disponível em <http://www.thyroidmanager.org>.
6. ITAGAKI, Y., et al. A case of refetoff syndrome: selective venous sampling for TSH is
useful in differentiating thyroid hormone resistance from TSH secreting tumor.
Tohoku J Exp Med. 1989; 157(1):69-78.
7. WATANABE, K., et al. Thyrotropin-producing microadenoma associated with pituitary
resistance to thyroid hormone. J Clin Endocrinol Metab. 1993; 76(4):1025-30.
8. SAFER, J.D., et al. A pituitary tumor in a patient with thyroid hormone resistance: a
diagnostic dilemma. Thyroid. 2001; 11(3):281-91.
9. BERKER, D., et al. Somatotropin adenoma and resistance to thyroid hormone. J
Endocrinol Invest. 2009; 32: 284-28.
10. AKIYOSHI, F., et al. Difficulty in differentiating thyrotropin secreting pituitary
microadenoma from pituitary-selective thyroid hormone resistance accompanied by
pituitary incidentaloma. Thyroid. 1996; 6(6):619-25.
11. ABUCHAM, J., et al. Adenomas hipofisários produtores de glicoproteínas:
patogênese, diagnóstico e tratamento. Arq Bras Endocrinol Metab. 2005; 49
(5):657-673.
12. ANSELMO, J., REFETOFF, S. Regression of a large goiter in a patient with
resistance to thyroid hormone by every other day treatment with triiodothyronine.
Thyroid. 2004; 14(1):71-4.
13. BECK-PECCOZ, P., et al. Sex hormone-binding globulin measurement in patients
with inappropriate secretion of thyrotropin (IST): Evidence against selective pituitary
thyroid hormone resistance in nonneoplastic IST. J Clin Endocrinol Metab. 1990;
71:19-25.
14. BECK-PECCOZ, P., et al. The variable clinical phenotype in thyroid hormone
resistance syndrome. Thyroid. 1994; 4(2):225-32.
15. BRUCKER-DAVIS, F., et al. Genetic and clinical features of 42 kindreds with
resistance to thyroid hormone. The National Institutes of Health Prospective Study.
Ann Intern Med. 1995; 123(8):572-83.
16. BRUCKER-DAVIS, F., et al. Thyrotropin-Secreting Pituitary Tumors: Diagnostic
Criteria, Thyroid Hormone Sensitivity, and Treatment Outcome in 25 Patients
Followed at the National Institutes of Health. J Clin Endocrinol Metab. 1999;
84:476-486.
17. CARVALHO, G.A., et al. Thyroid hormone resistance syndrome. Arq Bras
Endocrinol Metab. 2004; 48(1):83-92.
18. FUKATA, S. Resistance to Thyroid Hormone in Hashimoto's Thyroiditis. N Engl J
Med. 2005; 352(5):517-518.
19. GURNELL, M., et al. Reversible pituitary enlargement in the syndrome of resistance
to thyroid hormone. Thyroid. 1998; 8(8):679-82.
20. McDERMOTT, J.H., et al. A case of Resistance to Thyroid Hormone without mutation
in the thyroid hormone receptor beta. Ir J Med Sci. 2005; 174(4):60-4.
21. RADETTI, G., et al. Clinical and hormonal outcome after two years of
triiodothyroacetic acid treatment in a child with thyroid hormone resistance.
Thyroid. 1997; 7(5):775-8.
22. REFETOFF, S., et al. The consequences of inappropriate treatment because of
failure to recognize the syndrome of pituitary and peripheral tissue resistance to
thyroid hormone. Metabolism 1983; 32(8):822-834.
23. REFETOFF, S., et al. The syndromes of resistance to thyroid hormone. Endocr Rev.
1993; 14(3):348-399.
24. TAKEDA, K., et al. Recessive inheritance of thyroid hormone resistance caused by
complete deletion of the protein-coding region of the thyroid hormone receptor-beta
gene. J Clin Endocrinol Metab. 1992; 74:49-55.
25. TAKEDA, T., et al. Triiodothyroacetic acid has unique potential for therapy of
resistance to thyroid hormone. J Clin Endocrinol Metab. 1995; 80:2033-2040.
26. UEDA, S., et al. Differences in response of thyrotropin to 3,5,3'-triiodothyronine and
3,5,3'-triiodothyroacetic acid in patients with resistance to thyroid hormone. Thyroid.
1996; 6(6):563-70.
27. WEISS, R.E. Management of resistance to thyroid hormone. Thyroid Today. 1999;
22:1-11
28. WEISS, R.E., et al. Dominant inheritance of resistance to thyroid hormone not linked
to defects in the thyroid hormone receptors a or ß genes may be due to a defective
co-factor. J Clin Endocrinol Metab. 1996; 81:4196-4203.
29. WEISS, R.E., REFETOFF, S. Treatment of Resistance to Thyroid Hormone—Primum
Non Nocere. J. Clin. Endocrinol. Metab. 1999 84: 401-404.
30. YEN PM. Molecular basis of resistance to thyroid hormone. Trends Endocrinol
Metab 2003; 14:327-33.