i
UNIVERSIDADE FEDERAL DE SERGIPE
PRÓ-REITORIA DE PÓS-GRADUAÇÃO E PESQUISA
NÚCLEO DE PÓS-GRADUAÇÃO EM BIOLOGIA PARASITÁRIA
MESTRADO EM BIOLOGIA PARASITÁRIA
NOVOS CASOS DA DOENÇA DE CHAGAS EM UMA ÁREA
RURAL DO MUNICÍPIO DE TOBIAS BARRETO – SERGIPE
Mestranda: Diana Matos Euzébio
Orientadora: Profa. Dra. Angela Maria Silva
SÃO CRISTÓVÃO
2015
ii
DIANA MATOS EUZÉBIO
NOVOS CASOS DA DOENÇA DE CHAGAS EM UMA ÁREA
RURAL DO MUNICÍPIO DE TOBIAS BARRETO – SERGIPE
Dissertação apresentada ao Núcleo de PósGraduação
em
Biologia
Parasitária
da
Universidade Federal de Sergipe, como requisito
para obtenção do grau de Mestre em Biologia
Parasitária.
Orientadora: Profa. Dra. Angela Maria da Silva
SÃO CRISTÓVÃO
2015
iii
FICHA CATALOGRÁFICA ELABORADA PELA BIBLIOTECA BISAU
UNIVERSIDADE FEDERAL DE SERGIPE
E91
Euzébio, Diana Matos
Novos casos da doença de chagas em área rural do município
de Tobias Barreto - Sergipe / Diana Matos Euzébio; orientadora
Angela Maria da Silva. – São Cristovão, 2015.
63 f.
Dissertação (mestrado em Biologia Parasitária)– Universidade
Federal de Sergipe, 2014.
1. Doença de chagas. 2. Epidemiologia. 3. Triatominae. 4.
Sorologia. 5. Doenças transmissíveis I. Silva, Angela Maria da,
orient. II. Título.
CDU 616.937
iv
DIANA MATOS EUZÉBIO
NOVOS CASOS DA DOENÇA DE CHAGAS EM UMA ÁREA
RURAL DO MUNICÍPIO DE TOBIAS BARRETO – SERGIPE
Dissertação apresentada ao Núcleo de PósGraduação
em
Biologia
Parasitária
da
Universidade Federal de Sergipe, como requisito
para obtenção do grau de Mestre em Biologia
Parasitária.
APROVADO EM: 06/04/2015
BANCA EXAMINADORA
Profa. Dra. Angela Maria Silva - Universidade Federal de Sergipe
Profa. Dra. Karina Conceição Araújo - Universidade Federal de Sergipe
Prof. Dr. Marco Antônio Prado Nunes - Universidade Federal de Sergipe
PARECER
v
DEDICATÓRIA
A DEUS, sem ELE nada seria possível.
A meus filhos, Daniel e Rafael, inspiração para minha vida.
A Madson (in memoriam), grande amor da minha vida, este trabalho não
teria existido sem seu apoio. Agradeço a Deus pelo tempo que nos foi permitido e
pelo filho que me deixou de presente.
A meus pais que me mostraram desde criança que a educação pode
mudar vidas, graças a isso nunca deixei de estudar.
vi
AGRADECIMENTOS
Agradeço a Deus, dia após dia fui sustentada por ELE que absorveu as
adversidades, dores, cansaço e dificuldades; sempre enviando um irmão para meu
socorro. ELE é o meu pastor, nada me falta!
À minha orientadora, Profª Dra. Angela Maria da Silva, por me ajudar a
perseverar, por todo apoio, carinho e paciência ofertados. Serei eternamente grata.
À minha amiga-irmã Genilde, não tenho palavras para agradecer seu
apoio em todos os momentos, nunca poderei retribuir os esforços para meu auxílio.
À Flávia Costa (outra irmã), sempre pronta a colaborar. Seu apoio e
palavras de incentivo foram fundamentais nesta caminhada.
À Iza Lobo, sua sede de conhecimento e valorização do ser humano
contagia todos que convivem com você. Muito obrigado por me apoiar e incentivar
neste mestrado.
À Secretaria Municipal de Saúde de Tobias Barreto, em especial à Maria
de Fátima Ramos Dantas de Santana (Secretária Municipal de Saúde), por seu
apoio.
Aos Agentes Comunitários de Saúde, Sérgio e José Arlindo; Maria
Raimunda (auxiliar de enfermagem) de Tobias Barreto; e outros voluntários como
Aldair (técnico de laboratório); Bernard (acadêmico de medicina - UFS); Paulo
(acadêmico de enfermagem - FASE), sem vocês não teria conseguido.
Aos habitantes dos povoados Poço da Clara e Alagoinhas pela
receptividade e confiança depositada.
Aos funcionários do Laboratório de Análises Clinicas do H. U. pela
dedicação e colaboração no armazenamento do material.
Aos funcionários do LACEN, em especial a superintendente Danusa
Duarte; gerentes Cristiane Marcieira, Sandra Araújo e Cliomar pela colaboração
prestada; Michelle (biomédica) Silvia Patrícia (farmacêutica) pela acolhida calorosa,
apoio e dedicação na realização dos exames.
Aos funcionários dos Métodos Gráficos do H.U, em especial a Dra.
Geodete, e Marcelo (Téc em Rx), pela acolhida calorosa e colaboração prestada nos
exames realizados.
Aos professores deste curso de pós-graduação pela dedicação ao ensino.
vii
Aos residentes de Epidemiologia Hospitalar em Saúde do HU, em
especial a Thialla (filha de coração). Agradeço o apoio e carinho de todos vocês.
Aos colegas de trabalho do HUSE e HU, muito obrigado pelo apoio
concedido.
À MINHA FAMÍLIA, pelo apoio incondicional, sem vocês eu não
conseguiria. Obrigada por acreditarem em mim.
viii
RESUMO
Euzébio D. M. Novos Casos da Doença de Chagas em uma Área Rural do
Município de Tobias Barreto – Sergipe. Sergipe: UFS, 2015. (Dissertação –
Mestrado em Biologia Parasitária).
A doença de Chagas humana, também conhecida como tripanossomíase
americana, é considerada pela Organização Mundial de Saúde uma das 17 doenças
tropicais mais negligenciadas no mundo.
A erradicação da doença por via de
transmissão vetorial no Brasil não está concretizada e foi comprovada nesse estudo.
O objetivo do trabalho foi investigar a infecção da doença de Chagas por
transmissão vetorial em humanos em área rural de Tobias Barreto. Trata-se de um
estudo transversal de campo, com abordagem quantitativa, onde foram investigados
255 indivíduos de 0 a 85 anos, residentes nos povoados Alagoinhas e Poço da
Clara, selecionados de forma aleatória. Os participantes receberam informações
sob os riscos da doença e responderam questionário sobre dados socioeconômico
e demográficos relevantes ao risco de transmissão vetorial na área estudada, e
cederam amostra sanguínea após assinarem o TCLE. Fatores relacionados à
transmissão da doença entre os pesquisados foram analisados através do software
Epi Info versão 7.1.4. Novos casos da doença foram encontrados, um sororeagente
e três não conclusivos. Os resultados demonstram que a transmissão vetorial não
está interrompida e a doença não está sendo diagnosticada. A domicialização de
espécie silvestre da região estudada assumindo o papel do Triatoma infestans, pode
ser responsável pela manutenção da transmissão da doença, demonstrando a
necessidade de mudanças nas políticas de prevenção e controle da doença.
Descritores: Doença de Chagas; epidemiologia; triatominae; sorologia.
ix
ABSTRACT
Euzébio D. M. New cases of Chagas disease in a Rural Area of the Municipality
of Tobias Barreto - Sergipe. Sergipe: UFS, 2015. (Thesis - Master in Parasitic
Biology).
The human Chagas disease, also called American trypanosomiasis, is considered by
the World Health Organization of the 17 most neglected tropical diseases in the
world. The eradication of disease vector transmission path in Brazil is not
implemented and was confirmed in this study. The objective was to investigate the
infection of Chagas disease vector transmission in humans in rural Tobias Barreto.
This is a cross-sectional field study with a quantitative approach, which were
investigated 255 individuals 0-85 years living in the villages and Alagoinhas Well
Clara, selected at random. Participants received information on the risks of the
disease, answered a questionnaire on socio-economic and demographic data
relevant to the risk of vector transmission in the study area, and gave blood sample
after signing the informed consent form. Factors related to transmission of the
disease among those surveyed were analyzed using Epi Info version 7.1.4 software.
New cases were found, one sororeagente and three inconclusive. The results
demonstrate that the vectorial transmission is not interrupted and the disease is not
being diagnosed. The wild species of domicialização the region studied assuming the
role of Triatoma infestans, may be responsible for maintaining the transmission of the
disease, demonstrating the need for changes in policies for prevention and control of
disease.
Key words: Chagas disease; epidemiology; triatominae; serology.
x
LISTA DE FIGURAS E TABELAS
Figura 1 – Ciclo de vida de Trypanosoma cruzi ........................................... 22
Figura 2 – Mapa do Brasil com destaque para o estado de Sergipe. Mapa de
Sergipe com destaque para o município de Tobias Barreto. Mapa do município de
Tobias Barreto e localização dos povoados Poço da Clara e Alagoinhas onde foi
realizada a pesquisa, 2014........................................................................... 30
Figura 3 – Recrutamento de participantes da pesquisa, Pov. Poço da Clara, Tobias
Barreto, 2014. .............................................................................................. 31
Figura 4 – Coleta de sangue dos pesquisados, Pov. Alagoinhas, Tobias Barreto,
2014. ............................................................................................................ 32
Figura 5 – Casa de alvenaria e anexo em taipa, Pov. Alagoinhas, Tobias Barreto,
2014. ............................................................................................................ 34
Figura 6 – Frequência da doença de Chagas nos Povoados Poço da Clara e
Alagoinhas, 2014. ........................................................................................ 38
Figura 7 – Triatomíneos encontrados em habitações e peridomicílio de Poço da
Clara e Alagoinhas, 2014. .......................................................................... 42
Figura 8 – Transfusão de sangue pelos residentes de Poço da Clara e Alagoinhas,
2014. ............................................................................................................ 42
Tabela 1. Quantitativo de triatomíneos capturados nos municípios de Sergipe em
2013. ........................................................................................................... 19
Tabela 2. Fatores de risco para doença de Chagas entre sororeagente e não
conclusivos dos povoados Poço da Clara e Alagoinhas de Tobias Barreto - SE,
2014. ............................................................................................................ 39
Tabela 3. Características socioeconômicas e demográficas dos habitantes avaliados
sorologicamente para doença de Chagas dos povoados Poço da Clara e Alagoinhas
de Tobias Barreto – SE, 2014. ..................................................................... 41
xi
LISTA DE ABREVIATURAS E SIGLAS
Anti T cruzi - anti-trypanosoma cruzi
CEP - Conselho de Ética em Pesquisa
DCA - Doença de Chagas Aguda
DCH - Doença de Chagas Humana
ELISA - Enzyme Linked Immunossorbent Assay
FCI - Forma Crônica Indeterminada da Doença
FUNED - Fundação Ezequiel Dias
HAI - Hemaglutinação Indireta
IBGE - Instituto Brasileiro de Geografia e Estatística
IFI - Imunofluorescência Indireta
IgG - Imunoglobulina G
WHO - World Health Organization
LACEN - Laboratório Central de Saúde Pública – Sergipe
PCDCh - Programa de Controle da Doença de Chagas
PCR - Reação em Cadeia de Polimerase
PAHO - Pan American Health Organization
OMS - Organização Mundial de Saúde
SINAN - Sistema de Informação de Agravos de Notificação
TCLE - Termo de Consentimento Livre e Esclarecido
MS - Ministério da Saúde
xii
SUMÁRIO
1. INTRODUÇÃO ......................................................................................... 14
2. JUSTIFICATIVA ....................................................................................... 15
3. REVISÃO DE LITERATURA ................................................................... 16
3.1 Histórico ............................................................................................. 16
3.2 Epidemiologia ..................................................................................... 17
3.2.1 Epidemiologia em Sergipe ........................................................ 18
3.3 Formas de Transmissão..................................................................... 19
3.4 Ciclo Evolutivo da Doença ................................................................. 21
3.5 Manifestações Clínicas ...................................................................... 22
3.5.1 Fase Aguda .............................................................................. 22
3.5.2 Fase Indeterminada ................................................................. 23
3.5.3 Fase Crônica............................................................................. 24
3.6 Diagnóstico Diferencial....................................................................... 25
3.7 Diagnóstico Laboratorial..................................................................... 26
3.8 Tratamento ......................................................................................... 27
4. OBJETIVO ............................................................................................... 28
5. HIPÓTESE .............................................................................................. 28
6. MATERIAIS E MÉTODOS ....................................................................... 28
6.1 Delineamento da Pesquisa ................................................................ 28
6.2 Localização da Área de Estudo .......................................................... 29
6.3 Seleção e Recrutamento dos Indivíduos ............................................ 30
6.3.1 Amostra Populacional ............................................................... 32
6.3.2 Critérios de Inclusão ................................................................. 33
6.3.3 Critérios de Exclusão ................................................................ 33
6.4 Considerações Éticas......................................................................... 33
6.5 Características da Área de Estudo ..................................................... 34
xiii
6.6 Testes Sorológicos Empregados no Estudo ...................................... 35
6.7 Análise das Amostras Coletadas ....................................................... 35
6.8 Análise Estatística .............................................................................. 37
7. RESULTADOS ......................................................................................... 37
8. DISCUSSÃO ............................................................................................ 43
9. CONCLUSÃO .......................................................................................... 47
REFERÊNCIAS ............................................................................................ 48
APÊNDICES ................................................................................................ 56
ANEXOS ...................................................................................................... 61
14
1. INTRODUÇÃO
A doença de Chagas é considerada pela Organização Mundial de Saúde
uma das 17 doenças tropicais mais negligenciadas no mundo (WHO, 2014). Tratase de uma antropozoonose causada pelo protozoário flagelado Trypanosoma cruzi
(BRASIL, 2014), a fonte primária de transmissão ocorre através de triatomíneos,
vetores responsáveis pela manutenção do ciclo silvestre da doença. De acordo com
Lazzari (2013), a proximidade com o ambiente silvestre e o deslocamento das fontes
naturais de alimento contribuem para domiciliação destes insetos e propagação da
doença entre humanos.
A doença é responsável por cerca de 12.000 mortes por ano e os custos
sociais com o tratamento são altos (OPAS, 2014), dados apontam que no Brasil
O
absenteísmo de trabalhadores afetados pela doença de Chagas atingiu uma perda
estimada de US$ 5,6 milhões/ano (OMS, 2010).
Decorridos 105 anos de sua descoberta, a doença continua sendo um
problema de saúde que afeta coletivamente indivíduos, sendo mais encontrada em
áreas rurais, prevalecendo em populações com baixo desenvolvimento sócio
econômico, associada a condições precárias de habitação e poucas ações no
Programa de Controle de Doença de Chagas Humana - PCDCH (LESCURE, 2010;
HENAO - MARTÍNEZ, 2012).
Fatores ambientais concorrem para manutenção da infecção humana por
via vetorial como o desequilíbrio provocado por ações desordenadas de
desflorestamento seja para agricultura, pecuária ou mesmo assentamentos,
afastando as fontes naturais alimentares dos triatomíneos, contribuindo para sua
domicialização (PINTO DIAS, 2012).
Vários trabalhos relacionam risco maior de transmissão vetorial em áreas
rurais, onde a proximidade do homem com ambientes silvestres favorece o contato
com o vetor. Segundo Dias (2006), a negligência na atenção à transmissão e falta
de assistência aos infectados assintomáticos ou com manifestações clínicas podem
impactar no recrudescimento da doença.
Segundo o Ministério da Saúde, no Brasil atualmente predominam os
casos crônicos, decorrentes de infecção por via vetorial, com aproximadamente três
milhões de indivíduos infectados (BRASIL, 2009).
15
Casos agudos da doença de Chagas vêm sendo descritos em vários
estados onde não havia incidência, em especial na região da Amazônia Legal que
compreende os estados do Acre, Amapá, Amazonas, Mato Grosso, Pará, Rondônia,
Roraima, Tocantins e parte do Maranhão, oeste do meridiano de 44º (BRASIL, 2009;
BRASIL, 1988).
2. JUSTIFICATIVA
O estudo se deve ao risco de infecção por doença de Chagas devido à
endemicidade de triatomíneos infestados por Trypanossoma cruzi encontrados nos
povoados Alagoinhas e Poço da Clara, município de Tobias Barreto sendo de
grande significância para a população local.
Dados entomológicos obtidos no Laboratório Central de Saúde Pública de
Sergipe (LACEN) referente aos anos de 2005 a 2014 confirmaram a presença de
espécies de triatomíneos no estado de Sergipe, ratificando o risco de transmissão
vetorial. Desse modo investigamos a infecção por doença de Chagas em humanos
em área rural de Tobias Barreto.
Segundo o estudo de Lins (2013), 48,2% dos triatomíneos capturados no
município de Tobias Barreto no período de 2006 a 2011, e examinados pelo LACEN,
foram considerados positivos demonstrando um índice de infecção natural por
Trypanosoma cruzi muito elevado. Os povoados com maior positividade foram Poço
da Clara e Alagoinhas.
Foi verificado junto ao setor de entomologia (LACEN – SE) que 168
triatomíneos foram enviados pelo município de Tobias Barreto no ano de 2012,
destes 162 foram capturados no intradomicilio, e seis no peridomicílio dos povoados
Poço
da
Clara
e
Alagoinhas.
Do
total
de
triatomíneos
capturados
76
intradomiciliados e cinco do peridomicilio estavam infestados.
A proposta do trabalho foi investigar a infecção humana por doença de
Chagas em duas localidades em área rural do município de Tobias Barreto, sul do
estado de Sergipe, contribuindo para melhoria da qualidade de vida da população
local através de informações sobre a doença e seus vetores, visando sua prevenção
e diagnóstico de indivíduos infectados, encaminhando os casos positivos para
acompanhamento clínico.
16
É considerada zona rural, área localizada fora dos limites de vilas e
cidades, e que não apresentem pelo menos dois tipos de melhoramentos como
meio-fio ou calçamento, canalização de águas pluviais, abastecimento de água,
sistema de esgotos sanitários, rede de iluminação pública, com ou sem posteamento
para distribuição domiciliar; escola primária ou posto de saúde a uma distância
máxima de três quilômetros do imóvel. Os povoados pesquisados não atingem os
requisitos mínimos para categorização como área urbana, uma vez que o
calçamento se dá apenas em um trecho do acesso à localidade e o distanciamento
mínimo entre escola e residências é superior ao recomendado (BRASIL, 1964;
BRASIL 1966; IBGE, 2010).
Lins (2013) realizou um inquérito epidemiológico na região, entre
indivíduos com idade de 0 a 30 anos e neste não foi verificada a presença da
infecção humana. Por se tratar de uma área endêmica, a proposta do atual estudo
foi avaliar a população de 0 a 85 anos, agora com o intuito de evidenciar a presença
de casos crônicos da doença.
Por se tratar de um problema de saúde de grande relevância, buscou - se
então realizar a pesquisa em área rural de Tobias Barreto, considerada endêmica
para a doença de Chagas.
3. REVISÃO DE LITERATURA
3.1 Histórico
Em 1907, Carlos Chagas, médico-pesquisador do Instituto Manguinhos foi
enviado a Lassance - Minas Gerais para ajudar no combate da malária que assolava
os trabalhadores na construção de estrada de ferro Central do Brasil. Na região
encontrou hemípteros hematófagos convivendo com humanos nas choupanas da
região, e conseguiu demonstrar um processo de doença através da ligação entre
vetor, parasita e o homem (COURA, 2013).
A descoberta de casos humanos da doença trouxe à tona uma
preocupação com casos agudos e crônicos que invariavelmente ganhariam
importância médica e social. (COURA, 2013).
17
O parasito existe na natureza há milhares de anos em diferentes
populações de hospedeiros vertebrados, tais como seres humanos, animais
silvestres, domésticos, e invertebrados, a exemplo dos insetos vetores. Estudos
paleoparasitológicos em tecidos humanos mumificados evidenciaram formas
amastigotas de T.cruzi nas fibras cardíacas e outros tecidos indicando infecção
humana cerca de 5.000 anos atrás (FERREIRA, 2011).
3.2 Epidemiologia
A distribuição espacial da doença é limitada primariamente ao continente
americano em virtude da localização do vetor estar restrito a esta área, por esta
razão também denominada de tripanossomíase americana. No entanto, países não
endêmicos têm registrado casos por outros mecanismos de transmissão (WHO,
2014).
São estimados atualmente que entre 7 a 8 milhões de pessoas em todo o
mundo estejam infectadas pelo Trypanosoma cruzi, especialmente residentes na
América Latina onde a doença é endêmica (WHO 2014), e cerca de 400.000
pessoas em todo o mundo estão sob risco (PAHO, 2009).
A doença é encontrada principalmente em áreas endêmicas de 21 países
da América Latina, onde a transmissão primária para seres humanos se dá através
do contato com fezes de triatomíneos, conhecidos como "barbeiros", “chupancas”, e
outros nomes dependendo de costumes linguísticos locais (BRASIL, 2012).
Cerca de 10% das mortes em países tropicais e subtropicais são
causadas por doenças transmitidas por vetores e geram um custo anual de
aproximadamente 50 milhões de dólares, levando ao esgotamento nas finanças
destinadas à saúde dessas nações (WHO, 2010).
A doença de Chagas é considerada a quarta causa de morte no Brasil
entre as doenças infecto-parasitárias, tendo como faixa etária mais atingida aquela
acima de 45 anos (OLIVEIRA-MARQUES et al., 2005). A gravidade da infecção
humana é variável, chegando a atingir altos índices de mortalidade em crianças na
fase aguda, e severo acometimento cardíaco e/ou digestivo em adultos crônicos
(WHO, 2010). No Brasil, atualmente prevalecem os casos crônicos decorrentes com
aproximadamente
três
VP/OPAS/OMS, 2009).
milhões
de
indivíduos
infectados
(PANAFTOSA-
18
A doença de Chagas Humana até o momento atinge um grande número
de pessoas em todo o mundo, sendo que a região nordeste do Brasil tem
despertado atenção das autoridades em saúde pública, devido à presença de
triatomíneos nativos (SARQUIS et al., 2009) e moradias de baixa qualidade,
propícias a colonização de triatomíneos transmissores da Doença de Chagas
Humana - DCH (TRINDADE et al., 2009).
3.2.1 Epidemiologia em Sergipe
No estado de Sergipe, entre o ano de 1999 a junho de 2012, foram
notificados 158 casos de doença de Chagas, entretanto houve apenas 01 caso no
município de Pedrinhas notificado em 2013, não houve notificação em 2014 (SINAN,
2014).
Em 2013, doze municípios sergipanos com atividade no Programa de
Controle da Doença de Chagas investigaram em suas localidades 7.310 unidades
domiciliares, destas 251 foram positivas para presença de triatomíneos (SERGIPE,
2013).
Os municípios de Moita Bonita, Riachão do Dantas e Ribeirópolis não
realizaram captura de insetos e também não identificaram as áreas como positivas
para presença do inseto, no entanto registraram no relatório a borrifação de
unidades domiciliares, sendo interpretado como possível área de risco para
transmissão. A tabela 1 apresenta a frequência de triatomíneos capturados pelos
municípios de Sergipe em 2013; cabe ressaltar que Tobias Barreto foi o segundo
munícipio onde mais foram encontrados triatomíneos; apenas Canidé do São
Francisco e Gararu enviaram insetos para análise.
19
Tabela 1. Quantitativo de triatomíneos capturados nos municípios de Sergipe
em 2013.
MUNICÍPIO
Cumbe
Gararu
Canidé do São
Francisco
Nossa Senhora da
Glória
Simão Dias
Tobias Barreto
Poço Redondo
Total
N
01
02
26
Intradomicilio Peridomicílio Positivos Negativos
01
02
01
08
18
02
11
13
-
13
-
-
14
15
17
81
14
15
14
51
03
37
02
12
Fonte: Núcleo de Endemias, Programa de Controle da Doença de Chagas, SERGIPE, 2013.
Dados de Sergipe demonstram a falta de investimento no Programa de
Controle da Doença de Chagas, pois dos 75 municípios pertencentes ao estado, 55
são considerados endêmicos, sendo 09 apontados como de alto risco, 36 de médio
risco e 10 de baixo risco. No entanto apenas 12 municípios enviaram relatórios
referentes à pesquisa de triatomíneos em unidades domiciliares (SERGIPE, 2013).
Observa-se subnotificação da doença, tendo em vista não haver casos
agudos notificados desde 1999 em regiões do estado de Sergipe, que são
consideradas áreas endêmicas para vetores infestados com o Trypanosoma cruzi
como o município de Tobias Barreto.
3.3 Formas de Transmissão
Vários fatores contribuem para a transmissão do T. cruzi aos humanos. A
infecção está diretamente relacionada ao grau de associação entre o vetor e
parasita, colonização dos domicílios, capacidade de proliferação, quantidade de
protozoários eliminados e tempo que o inseto leva para defecar. Os triatomíneos
considerados “bons vetores” apresentam todas essas características otimizadas e
podem defecar durante ou logo após a alimentação sanguínea (ARGOLO, 2008).
A forma de transmissão vetorial é a mais frequente, seguida das formas
transfusional, congênita, transplantes de órgãos, acidentes de laboratório e oral em
20
humanos. A via transfusional é a maior rota de transmissão em zonas urbanas,
segundo Lunardelli et al., (2007) o risco de transmissão da infecção via transfusão
de sangue contaminado é cerca de 12% a 25%. Em países que realizam maior
triagem nos hemocentros a transmissão por esta via ocorre com menor frequência. A
via congênita também vem apresentando menores riscos, variando a probabilidade
de transmissão entre menos de 1% a 10%, devido à maior atividade pré-natal
desenvolvida pelos Programas de Saúde da Família (DIAS, 1994).
A via oral deve ser considerada como outro risco ocasional de
transmissão, através da ingestão de alimentos contaminados com fezes de
triatomíneos e fragmentos de insetos infestados; (BRASIL, 2008).
A doença de
Chagas aguda (DCA) por transmissão oral tem sido observada em diferentes
estados (Bahia, Ceará, Piauí, Santa Catarina, São Paulo), com maior frequência de
casos e surtos registrados na Região da Amazônia Legal (Amazonas, Maranhão,
Mato Grosso, Amapá, Pará, Tocantins), (BRASIL, 2009).
A transmissão congênita pode alcançar entre 1 a 10% de crianças
nascidas de mães infectadas com T. cruzi (BERN C. et al., 2011), e ocorrer em
qualquer fase da doença materna, aguda ou crônica, e
qualquer período da
gestação, em geral é por via transplacentária. A Bolívia é considerada endêmica,
taxa de transmissão congênita é elevada, cerca de 7,3% (MUÑOZ et al., 2009). A
transmissão por transplantes de órgãos vêm adquirindo importância nos últimos
anos, a doença por esse mecanismo de transmissão apresenta maior gravidade com
manifestações
de
fase
aguda,
já
que
o
individuo
receptor
encontra-se
imunocomprometido (BRASIL, 2010).
Os acidentes de laboratório são uma via de transmissão menos frequente,
através da contaminação com materiais infectados, manejo de triatomíneos para
análise ou experimentação, manipulação de mamíferos infectados, de culturas, e
sangue de casos agudos, porém há casos registrados na literatura por exposição às
formas do parasita durante procedimentos cirúrgicos e coleta de sangue (BRASIL,
2010). A exposição do profissional a altas cargas parasitárias deve ser tratada por
um período mínimo de trinta dias em situações de mínimo risco, como acidentes
com sangue de paciente crônico, a profilaxia medicamentosa não é indicada, sendo
recomendado o monitoramento sorológico (BRASIL, 2005).
21
Migrações
humanas
não
controladas
(guerras,
ocupações
e
assentamentos), vêm contribuindo para elevar índices da doença e alcançar áreas
não endêmicas. (BRASIL, 2009).
3.4 Ciclo Evolutivo da Doença
A doença é causada pelo protozoário flagelado Trypanossoma cruzi,
pertencente à ordem Kinetoplastida e à família Trypanosomatidae, Este infecta em
condições naturais mais de 100 espécies de mamíferos de diferentes ordens como
revisto por Devera et al., (2000).
Triatomíneos são insetos da família reduvidae, estritamente hematófagos,
e vetores essenciais do Trypanosoma cruzi. No Brasil o triatomíneo é conhecido
como barbeiro, chupança, dentre outros (COSTA; BARBOSA, 2009). A maioria das
espécies habita ambientes silvestres, ninhos de gambás, locas de tatu e uma série
de outros diferentes habitats, apresentando preferência por abrigos em pedras,
tocas de animais no solo e palmeiras, cada gênero apresentando sua especificidade
(LAZZARI, 2013).
Várias formas do parasita estão envolvidas durante o processo infecioso
seja no vetor ou no hospedeiro vertebrado (BRASIL, 2009). Após o repasto
sanguíneo em mamíferos vertebrados o triatomíneo infestado por Trypanosoma
cruzi elimina formas tripomastigotas metacíclicas nas fezes/urina próximo ao local da
picada na pele ou mucosas.
Essas formas do protozoário penetram no organismo do hospedeiro
vertebrado no ato de coçar o local da picada, introduzindo ali as formas
tripomastigotas infectantes e logo ultrapassam barreiras de defesa (WHO 2014). O
parasito não penetra a pele intacta, somente infectando o hospedeiro via mucosa ou
ferimentos na pele (GARCIA et al., 1984).
As formas tripomastigotas metacíclicos não são replicativas, após invadir
tecidos do hospedeiro, se diferenciam em formas amastigotas no citoplasma e
multiplicam - se ativamente por fissão binária preenchendo quase todo citoplasma
em curto período, e voltam a se diferenciar em tripomastigotas sendo novamente
liberados na circulação sanguínea invadindo novas células e tecidos (GARCIA et al.,
2010).
22
Em novo repasto sanguíneo o vetor ingere formas tripomastigotas
circulantes no sangue do hospedeiro vertebrado infectado, e, em alguns dias T. cruzi
se diferenciam em epimastigotas (formas replicativas), que migram para o intestino
posterior do inseto, e se diferencia em tripomastigotas metacíclicos (processo
conhecido como metaciclogênese) sendo eliminados nas fezes e urina do inseto
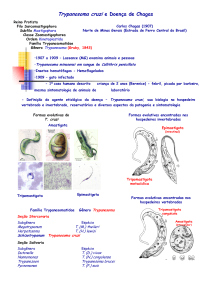
vetor (figura 1), como revisto por Brener et al., (2000).
Figura 1 – Ciclo de vida de Trypanosoma cruzi
Fonte: Center Disease Control (CDC), 2014, <disponível em
http://www.cdc.gov/parasites/chagas/biology.html> traduzido por Diana Euzébio.
3.5 Manifestações Clínicas
3.5.1 Fase Aguda
A doença de Chagas apresenta fases distintas. A fase aguda pode durar
cerca de 6 a 8 semanas (MONCAYO, 2000; WHO, 2002). Sinais da fase aguda
podem surgir aproximadamente entre 4 a 6 dias quando o T. cruzi penetra na
23
conjuntiva causando edema bipalpebral unilateral (sinal de Romanã) ou com a
presença lesão furunculóide em braços, pernas ou rosto (chagoma de inoculação).
Em muitos casos essa fase pode passar despercebida (LANA, TAFURI, 2010;
BRASIL, 2012).
A fase aguda dificilmente é identificada, devido à inespecificidade dos
sintomas, em geral só é reconhecida entre 1 a 2% dos indivíduos infectados e pode
ser confundida nesse período com outras patologias (WHO, 2012). Desse modo os
casos agudos são menos frequentemente diagnosticados (BRASIL, 2010).
Geralmente ocorre infartamento ganglionar satélite, próximo aos locais de porta de
entrada. A manifestação mais comum é a febre, em geral prolongada e não muito
elevada (BRASIL, 2012; LANA, TAFURI, 2010).
Os sinais e sintomas podem progredir para formas agudas graves, que
podem levar ao óbito (WHO, 2002), ou desaparecer espontaneamente após dois a
quatro
meses
da
infecção
inicial,
manifestando
tardiamente
sinais
de
comprometimento relacionado à doença (BRASIL, 2010).
3.5.2 Fase Indeterminada
Em geral após a fase inicial, a doença pode regredir de forma espontânea
ou avançar para forma indeterminada por vários anos, a chamada fase crônica.
Tardiamente, a fase indeterminada pode evoluir para outras formas da doença
(BRASIL, 2009).
Indivíduos com a forma indeterminada apresentam sorologia e/ou exames
parasitológicos positivos para Trypanosoma cruzi, mas não manifestam sintomas,
sinais físicos ou evidências de lesões orgânicas (cardíacas e digestivas) ao ECG e
na radiografia de tórax, bem como em outros estudos radiológicos do esôfago e
cólon (RIBEIRO, ROCHA, 1998; BRASIL, 2005; WHO, 2002).
A forma indeterminada é a mais frequente na fase crônica, atinge cerca
de 50 a 70% dos indivíduos infectados em relação às formas cardíaca, digestiva ou
mista (cardiodigestiva) (BRASIL, 2010; WHO, 2002).
Cerca de 2 a 5% dos infectados podem evoluir anualmente para uma das
formas clínicas manifestas da doença. A doença é mais grave em crianças menores
de dez anos, que sem tratamento pode levar a 10% de óbito nessa faixa etária
(DIAS,1989).
24
3.5.3 Fase Crônica
Acredita-se que em torno de 50% dos indivíduos infectados se encontrem
na forma crônica indeterminada da doença (FCI). Alguns permanecem nesta forma
indefinidamente enquanto outros, após intervalo de 10 a 20 anos, evoluem para
alguma
das
formas
crônicas
especificas
da
doença,
com
evidência
de
comprometimento cardíaco, digestivo ou neurológico (BRASIL, 2005). Estudos
epidemiológicos em áreas endêmicas demonstraram que 2 a 5% dos pacientes da
forma indeterminada evoluirão todo ano para uma das formas clínicas da doença
(RIBEIRO, ROCHA, 1998). O prognóstico na forma indeterminada é bom e os óbitos
são raros (DIAS, 1989).
No Brasil, de 20 a 30% dos pacientes desenvolvem a forma cardíaca, 5 a
8% a forma esofageana e 4 a 6% a forma intestinal (ROCHA et al., 2003). Cerca de
40% dos pacientes com a forma indeterminada da DCH poderão persistir nesta
situação clínica para sempre constituindo a forma mais frequentemente encontrada
em zonas endêmicas.
A cardiopatia crônica é a forma mais grave da DCH, em razão de sua
ocorrência frequente e das graves consequências médico-sociais resultantes da
doença. A patogenia, prognóstico, e tratamento são alvo de investigação. Apesar da
evolução lenta e progressiva, a morte súbita pode ser a primeira manifestação
clínica da cardiopatia chagásica (RASSI Jr et al., 2001).
A evolução da forma indeterminada para crônica sintomática seja por
cardiopatia e/ou megasíndromes ocorre em torno de 0 a 20 anos após a fase aguda
ocorrendo de forma lenta e progressiva.
O Consenso Brasileiro de Doença de Chagas considera como cardiopatia
chagásica crônica a presença de anormalidades eletrocardiográficas sugestivas de
comprometimento cardíaco, em indivíduo sintomático ou não.
Alterações
eletrocardiográficas constituem o elemento fundamental para caracterização de
comprometimento cardíaco significativo na doença de Chagas (ANDRADE et al.,
2011).
As manifestações cardíacas podem ser silenciosas, detectadas apenas
em exames complementares sofisticados, evoluindo até formas graves, como a
insuficiência cardíaca refratária, arritmias complexas, aneurismas de ventrículo,
tromboembolismo ou a morte súbita (MARIN-NETO et al., 2007).
25
A doença de Chagas é responsável por lesões cardíacas em adultos
jovens economicamente produtivos nos países endêmicos da América Latina (WHO,
2002), representando cerca de 752.000 dias úteis/ano perdidos devido a mortes
prematuras na América Latina (WHO 2010).
No Brasil as manifestações da doença no trato digestivo podem ocorrer
de 3,1 a 13% de acordo com a endemicidade da área estudada (PENARANDACARRILLO, 2006).
A forma digestiva é representada pelas consequências da doença no trato
gastrointestinal, dentre as quais sobressaem às alterações de motilidade do esôfago
e do cólon, resultando em megaesôfago e megacólon endêmicos. Verifica-se
aumento do diâmetro das vísceras ocas em proporção ao estádio evolutivo da
afecção.
O megacólon apresenta maior número de casos em parte do estado de
Minas Gerais, Goiás, São Paulo, Bahia, e sul do Piauí; é excepcionalmente
encontrada nos países acima da linha do Equador (MOREIRA et al., 1983).
O megaesôfago chagásico pode apresentar-se em diferentes estádios
evolutivos. A disfagia é em geral a queixa inicial, associada ou não a dor epigástrica
ou retroesternal, regurgitação, soluço, ptialismo e hipertrofia das glândulas salivares,
notadamente das parótidas, tosse e asfixia por broncoaspiração de alimentos
regurgitados (CREMA et al., 2003). Já entre os sintomas do megacólon, destacamse obstipação intestinal de instalação lenta e insidiosa e de evolução progressiva
(MOREIRA et al., 1983).
3.6 Diagnóstico Diferencial
Na fase aguda o diagnóstico diferencial da doença de Chagas deve ser
realizado entre outros agravos como leishmaniose visceral, malária, dengue, febre
tifoide, toxoplasmose, mononucleose infecciosa, esquistossomose aguda, entre
outros.
Atualmente cabe acrescentar ao diagnóstico diferencial algumas doenças
que podem cursar com eventos íctero-hemorrágicos como leptospirose, dengue,
febre amarela e outras arboviroses, meningococcemia, sepse, hepatites virais, febre
purpúrica brasileira, hantaviroses e rickettsioses, devido aos surtos de doença de
Chagas por transmissão oral (BRASIL, 2010).
26
3.7 Diagnóstico Laboratorial
Na fase aguda são considerados critérios parasitológicos, definido pela
presença de parasitos circulantes no sangue periférico, visualizados através exame
direto; por sua vez o critério sorológico é baseado na presença de anticorpos anti-T.
cruzi da classe IgM no sangue periférico, particularmente quando associada a
alterações clínicas e epidemiológicas sugestivas (BRASIL, 2009) .
O diagnóstico laboratorial da DCH pode ser feito por métodos
parasitológicos, imunológicos e biologia molecular. Para diagnóstico da DCH, não
existe “padrão ouro” imunológico para a definição da doença (OELEMANN et al.,
1998). A pesquisa do T. cruzi pode ser realizada por processos diretos e indiretos, e
mais frequentemente, pela resposta imune do hospedeiro através da detecção de
imunoglobulina G (IgG) anti-T cruzi no soro de pacientes chagásicos crônicos por
meio da realização de diversos métodos imunológicos (MEIRA et al., 2002).
O Consenso Brasileiro em Doença de Chagas recomenda o uso de no
mínimo dois testes sorológicos, com diferentes preparações antigênicas para
confirmação do diagnóstico da DCH. Indivíduos que apresentarem pelo menos dois
testes reagentes são considerados infectados (GOMES et al., 2001; MEIRA et al.,
2002; BRASIL, 2005; OLIVEIRA-MARQUES et al., 2005; BORGES et al., 2006).
Testes sorológicos convencionais são ainda a principal forma para o
diagnóstico da doença de Chagas durante a fase crônica (MEIRA et al., 2002). A
sensibilidade, especificidade e facilidade de execução do exame são relevantes para
a escolha do teste. Os testes mais utilizados atualmente são: a Imunofluorescência
Indireta (IFI), o teste imunoenzimático ELISA (Enzyme Linked ImmunoSorbent
Assay) e a Hemaglutinação Indireta (HAI), sendo este último utilizado mais em
inquéritos epidemiológicos (AMATO NETO et al., 2002).
Na fase crônica, os métodos parasitológicos mostram alta especificidade,
mas limitada sensibilidade devido à baixa parasitemia, onde são detectados
somente entre 20 a 50% dos indivíduos infectados conhecidos, resultando em
alguns falso-negativos (GOMES et al., 2001; MEIRA et al., 2002).
A negatividade sorológica é o único método significativo de cura, sendo
definida pela ausência de anticorpos específicos que estavam anteriormente
positivados quando da realização de metodologias de diagnóstico. Especialistas
apontam que o tempo necessário para a negativação sorológica é variável e
27
depende da fase da doença. Na fase crônica pode ocorrer o declínio persistente e
progressivo acima de três diluições dos títulos sorológicos, sendo sugestivo de
futura negatividade (BRASIL, 2005; CASTRO et al., 2006).
3.8 Tratamento
O tratamento específico deve ser realizado o mais precocemente possível
quando forem identificadas a forma aguda ou congênita da doença, ou a forma
crônica recente (crianças menores de 12 anos). A droga disponível no Brasil é o
Benzonidazol (comp. 100mg), que deve ser utilizado na dose de 5mg/kg/dia
(adultos) e 5-10mg/kg/dia (crianças), divididos em 2 ou 3 tomadas diárias, durante
60 dias. O Benzonidazol é contraindicado em gestantes (BRASIL, 2010).
O tratamento sintomático depende das manifestações clínicas, tanto na
fase aguda como na crônica. Para alterações cardiológicas são recomendadas as
mesmas
drogas
que
para
outras
cardiopatias
(cardiotônicos,
diuréticos,
antiarrítmicos, vasodilatadores, etc.). Nas formas digestivas, pode ser indicado
tratamento conservador (dietas, laxativos, lavagens) ou cirúrgico, dependendo do
estágio da doença (BRASIL, 2010).
A interrupção da transmissão através de imunização não é viável, bem
como controlar os inúmeros reservatórios animais, ou tratar os infectados, visto que
as drogas existentes para tratamento etiológico são comprovadamente eficazes
apenas em casos de infecção recente, e os casos agudos são na maioria das vezes
clinicamente inaparentes. Neste caso, o único elo vulnerável na cadeia de
transmissão vetorial da infecção chagásica é o próprio vetor, sendo possível a
interrupção da transmissão domiciliar em caráter mais ou menos permanente
(SILVEIRA e DIAS, 2011).
O custo de tratamento da doença humana em fase crônica costuma ser
elevado em virturde do comprometimento dos sistemas circulatório e digestivo. No
Brasil, o absenteísmo de trabalhadores portadores da doença representou custos
aproximados em torno de US$ 5,6 milhões/ano cerca de 10.000 óbitos/ano são
estimados no mundo devido a complicações da doença (WHO, 2010).
Na Colômbia em 2008, o custo anual dos cuidados médicos para todos os
pacientes com a doença foi estimado em cerca de US$ 267 milhões; em contraponto
com os custos com pulverização de inseticidas para controlar vetores que custaria
28
quase US$ 5 milhões por ano (WHO, 2014). Esses dados demostram que medidas
profiláticas em áreas endêmicas são econômicamente mais baratas do que custos
com tratamentos de saúde em chagássicos crônicos, mas nem sempre valorizadas.
4. OBJETIVO
O inquérito epidemiológico realizado na população de 0 a 85 anos,
evidenciará a frequência da doença na comunidade, com ênfase para os casos
crônicos, tendo em vista o inquérito anterior que selecionou a população na faixa
etária mais jovem não ter detectado a presença da doença.
5. HIPÓTESE
Investigar a infecção humana crônica da doença de Chagas nos
residentes dos povoados Poço da Clara e Alagoinhas, área rural de Tobias Barreto,
sul do estado de Sergipe.
6. MATERIAIS E MÉTODOS
6.1 Delineamento da Pesquisa
Foi realizado um estudo transversal no período de outubro de 2013 a
setembro de 2014, estruturado como levantamento epidemiológico na população de
0 a 85 anos, com o objetivo de evidenciar a infecção pelo Trypanosoma cruzi. A
amostra foi constituída de 255 indivíduos de 700 habitantes residentes nos
povoados de Alagoinhas e Poço da Clara, município de Tobias Barreto. Os
participantes foram escolhidos de forma aleatória, após participarem de palestras
sobre os riscos da doença.
29
6.2 Localização da Área de Estudo
O município de Tobias Barreto possui uma área de aproximadamente
1.021,304 Km² e está localizado na região sul do Estado de Sergipe, na mesorregião
do agreste sergipano, com uma distância de 105 km da capital Aracaju.
Tobias Barreto apresenta como limites territoriais os municípios de: Poço
Verde, Simão Dias, Riachão do Dantas, Itabaianinha, Tomar do Geru e Itapicuru (em
terreno baiano). A sede do município está localizada a 180 metros de altitude e
coordenadas geográficas 11°10’46” de latitude sul e 38°00’00” de longitude oeste
(IBGE, 2010).
Segundo dados do censo do Instituto Brasileiro de Geografia e Estatística
(IBGE), em 2012, a população foi estimada em cerca de 48.776 habitantes. De
acordo com o último censo foram contados no município 23.459 homens e 24.581
mulheres; os residentes na zona rural pesquisada compreendem cerca de 700
indivíduos (IBGE, 2010). A localização das áreas estudadas está demonstrada na
figura 2.
30
Figura 2 – Mapa do Brasil com destaque para o estado de Sergipe. Mapa de
Sergipe com destaque para o município de Tobias Barreto. Mapa do município
de Tobias Barreto e localização dos povoados Poço da Clara e Alagoinhas
onde foi realizada a pesquisa, 2014.
Fonte: Márcio Bezerra Santos
6.3 Seleção e Recrutamento dos Indivíduos
Foi realizada visita à Secretaria Municipal de Saúde de Tobias Barreto,
sendo manifestado interesse na continuação da pesquisa realizada por Janicelma
Lins, sob a orientação da Drª Ângela Maria da Silva, que investigou a ocorrência da
doença na faixa etária de zero a trinta anos, nas duas localidades citadas, sendo
oferecida colaboração ao município para diagnóstico da doença de Chagas e
realização de encaminhamentos necessários para tratamento dos casos positivos.
Após a visita à sede municipal, foi feito o reconhecimento da área a ser
estudada e contato com agentes de saúde das duas localidades explicando a
finalidade da pesquisa. Os indivíduos foram recrutados e participaram de forma
espontânea, em seguida foram ministradas palestras de sensibilização sobre o risco
31
de transmissão, agravos da doença e explicação sobre os benefícios do estudo
conforme figura 3.
Figura 3 - Recrutamento de participantes da pesquisa, Pov. Poço da Clara,
Tobias Barreto, 2014.
Fonte: Diana Euzébio.
Após as palestras, os participantes e/ou responsáveis assinaram o Termo
de Consentimento Livre e Esclarecido (Apêndice A), e em seguida, foram realizadas
coletas de sangue para análise diagnóstica conforme ilustrado na figura 4.
Em todos os participantes da pesquisa foram aplicados questionários
contendo dados clínicos, epidemiológicos, socioeconômicos e demográficos
(Apêndice B).
32
Figura 4 – Coleta de sangue dos pesquisados, Pov. Alagoinhas, Tobias
Barreto, 2014.
Fonte: Diana Euzébio.
6.3.1 Amostra Populacional
Levando-se em conta que o último inquérito sorológico, finalizado em
2008 e publicado em 2011, não contemplou o município de Tobias Barreto (apenas
o primeiro inquérito realizado no período de 1975-1980), selecionamos a população
de habitantes dos referidos povoados com idade entre 0
a 85 anos (N= 700
indivíduos).
O resultado do cálculo amostral correspondeu a 249 indivíduos, levando
em conta a frequência desconhecida da doença na região. No entanto o total de
participantes voluntários válidos na pesquisa atingiu 255 indivíduos. Foi utilizada a
fórmula apresentada a seguir para cálculo mínimo da amostra:
n=
N x Z 2 x p x (1 – p)
Z 2 x p x (1 – p) + e 2 x (N – 1)
33
Onde:
n= amostra calculada
N = população
Z = variável normal padronizada ao nível de confiança
p = verdadeira probabilidade do evento
e = erro amostral
6.3.2 Critérios de Inclusão
Foram incluídos na pesquisa os indivíduos com faixa etária entre 0 e 85
anos, habitantes dos povoados de Alagoinhas e Poço da Clara, no município de
Tobias Barreto, que tenham assinado o TCLE e devolvido questionário para
identificação das amostras.
6.3.3 Critérios de Exclusão
Foram excluídos os indivíduos não residentes nas localidades estudadas,
e que não concordaram em participar da pesquisa e nem devolvido o questionário.
Das 257 amostras de sangue coletadas, duas foram desconsideradas a primeira não
possuía questionário portando não sendo possível identificar o individuo para
seguimento dos exames; e a segunda não era residente dos povoados estudados,
portanto permanecendo total de 255 amostras válidas.
6.4 Considerações Éticas
Um estudo inicial foi realizado pela pesquisadora Janicelma dos Santos
Lins, aprovado pelo Comitê de Ética em Pesquisa do HU/UFS, em 03 de dezembro
de 2010 com parecer número CAAE- 6165.0.000.107-10. (Anexo C). O nosso
trabalho é uma continuação tendo sido com autorizado pela pesquisadora e sua
orientadora e anuência do Conselho de Ética e Pesquisa (Anexo D).
Foram consideradas as diretrizes e normas regulamentadoras de
pesquisas envolvendo seres humanos contidas na Resolução 466/2012 do Conselho
Nacional de Saúde, no sentido de salvaguardar os direitos e o bem estar dos
indivíduos estudados. Os exames propostos foram realizados após obtenção do
34
consentimento por escrito dos indivíduos que aceitaram participar do estudo. Ao fim
da avaliação, todos os participantes do estudo receberam os resultados dos exames
realizados e aqueles que apresentaram soropositividade para a doença de Chagas
foram acompanhados no ambulatório de infectologia do HU/UFS.
Nos casos dos participantes por lei considerados incapazes, foi
necessária a presença de responsável legal para a assinatura do Termo de
Consentimento Livre e Esclarecido - TCLE (Apêndice A).
6.5 Características da Área de Estudo
Após coletar amostras de sangue, os povoados foram percorridos a fim
de verificar as características das habitações. Foi observado melhoria na estrutura
física dos imóveis, com paredes de alvenaria e teto coberto com telhas nas
construções mais recentes; porém as instalações antigas em taipa foram mantidas
junto às casas, ora servindo para depósito de alimentos e materiais, ora como abrigo
para pequenos animais domésticos, tornando-se ambiente ideal para triatomíneos
visto que, além de local para instalações de colônias, há também fonte alimentar
próxima favorecendo o ciclo de vida destes insetos (figura 5).
Figura 5 - Casa de alvenaria e anexo em taipa, Pov. Alagoinhas, Tobias Barreto,
2014.
Fonte: Diana Euzébio.
35
6.6 Testes Sorológicos Empregados no Estudo
No estudo, todas as amostras foram submetidas a teste imunoenzimático
(ELISA) para a análise qualitativa de IgG anti-T. cruzi e teste de anticorpos de
Imunofluorescência indireta (IFI) no soro humano.
A OMS e Ministério da Saúde (MS) preconizam o uso de no mínimo dois
testes de diferentes metodologias para confirmação do diagnóstico da doença de
Chagas. Os indivíduos que apresentarem pelo menos dois testes reagentes são
considerados infectados (GOMES et al., 2001; MEIRA et al., 2002; BRASIL, 2005;
OLIVEIRA-MARQUES et al., 2005; BORGES et al., 2006).
Em situações em que a amostra se apresente não reagente para um dos
métodos e reagente para outro, será considerada indeterminada, neste caso é
recomendado nova coleta de amostra sanguínea após 21 dias a primeira coleta. No
caso da segunda amostragem permanecer indeterminada, será considerado não
conclusivo, sendo indicado novo teste através de PCR ou Western Blot (BRASIL,
2005).
No trabalho foram utilizados os testes ELISA Chagas III, teste
imunoenzimático para detecção qualitativa de anticorpos contra T. cruzi adquiridos
do fabricante GRUPOBIOS; os testes para Imunofluorescência indireta para
diagnóstico da infecção pelo T. cruzi foram adquiridos do Instituto de Tecnologia em
Imunobiológicos Bio-Manguinhos. Foram seguidas rigorosamente as instruções e
procedimentos recomendados pelo fabricante.
6.7 Análise das Amostras Coletadas
As amostras de sangue foram coletadas pelo próprio pesquisador e
colaboradores treinados (uma enfermeira e dois técnicos de laboratório de análises
clínicas), por punção venosa periférica, com todos os cuidados de antissepsia; e
depositadas individualmente em tubos de ensaio a vácuo e a seco, com rigoroso
controle na identificação dos tubos, pelo nome de cada individuo, e número do
questionário contendo dados para eventuais confirmações.
Após período de hemossedimentação de dez minutos, as amostras foram
centrifugadas no próprio local de coleta, acondicionadas em recipientes térmicos
36
com gelo e transportadas para o Laboratório de Análises Clínicas do Hospital
Universitário da Universidade Federal de Sergipe HU/UFS.
No laboratório de análises clínicas do HU-UFS, o soro contido em tubos
foi pipetado e acondicionado em ependorffs, rigorosamente identificados com
numerações idênticas a dos questionários aplicados nos voluntários da pesquisa.
Posteriormente, este material foi encaminhado ao Laboratório Central de
Saúde Pública de Sergipe (LACEN) onde foram realizadas as análises sorológicas
para teste imunoenzimático (ELISA) para a análise qualitativa de IgG anti-T. cruzi no
soro humano, e Imunofluorescência indireta (IFI) para diagnóstico da infecção pelo
T. cruzi.
Todas as amostras foram submetidas à pesquisa sorológica pelo método
ELISA numa só etapa, pois este método permitia ser automatizado conferindo
rapidez aos resultados; um único profissional foi responsável pela execução desse
teste.
Já o processamento das amostras pelo método IFI foi realizado em
etapas por ser manual, e demandar longo tempo de preparo. As laminas foram
preparadas conforme a sequência numérica dos ependorffs, sendo realizada cerca
de seis leituras por dia por um único profissional tecnicamente capacitado e com
experiência na realização do método.
Na leitura por IFI várias amostras foram
consideradas como indeterminadas, após a repetição do teste, nove indivíduos se
mantiveram como indeterminados, 04 residentes em Poço da Clara e cinco em
Alagoinhas.
Conforme o protocolo do MS, em agosto/2014 foram coletadas outras
amostras sanguíneas dos nove indeterminados e submetidas a novos testes ELISA
e IFI; três indivíduos (01 de Poço da Clara e 02 de Alagoinhas) permaneceram
reagentes ao IFI, neste caso o resultado foi considerado como não conclusivo. De
acordo com o protocolo do MS, as amostras destes três indivíduos foram
encaminhadas para o laboratório de referência a fim de serem submetidas ao teste
Western Blot ou PCR.
37
6.8 Análise Estatística
Os dados foram tabulados e analisados através do programa Epi Info
versão 7.1.4.
Das variáveis quantitativas, foram extraídas frequências e desvio
padrão. Já as variáveis nominais foram cruzadas utilizando os testes Qui-Quadrado
de Pearson. Em todos os testes, foi utilizada a probabilidade de significância (p)
menor que 0,05 como necessários para rejeição da hipótese nula.
7. RESULTADOS
Poucos municípios realizam atividades de controle da doença de Chagas
em Sergipe; as ações se restringem a procura do vetor nas unidades domiciliares,
eventual captura, e borrifação das áreas positivas para presença de triatomíneos.
Em 2013, no município de Tobias Barreto, 2489 domicílios e anexos de várias
localidades foram visitados, sendo que destes, 208 residências foram consideradas
positivas para a presença do vetor, no entanto não houve captura de insetos.
A população do estudo foi composta da amostra de 255 indivíduos com
idade média de 38,55, sendo a mínima de zero e máxima de 85 anos. As respostas
sobre o nível de escolaridade pelos pesquisados foram de 46,52 % com ensino
fundamental do 1º ao 5º ano seguido por 17,25% de analfabetos; 10,58 % com
ensino fundamental do 6º ao 9º ano; médio completo 9,01%, e médio incompleto
com 6,66%.
Um indivíduo da pesquisa residente no povoado Alagoinhas foi reagente
para T.cruzi pelos dois métodos, nove foram considerados não reagentes pelo
método ELISA e indeterminados pelo método IFI (quatro residentes em poço da
Clara e cinco em Alagoinhas). Foi realizada nova sorologia destes indivíduos com o
mesmo soro pelo método de IFI e novamente mantiveram a condição de
indeterminados. Estes pesquisados concordaram em efetuar nova coleta de sangue,
e conforme protocolo do MS foram repetidas as sorologias por ELISA e IFI; desta
vez três indivíduos mantiveram a condição sorológica anterior, sendo considerados
agora como não conclusivos.
Na figura 6 observa-se a relação de frequência quanto às sorologias entre
os participantes.
38
Figura 6 - Frequência da doença de Chagas nos Povoados Poço da Clara e
Alagoinhas, 2014.
O indivíduo infectado é do gênero masculino, faixa etária de 60 anos,
analfabeto, não fez uso de transfusão sanguínea, convivia com animais no domicílio,
é lavrador, e residia há mais de dez anos no local. Informou no questionário não ter
encontrado o triatomíneo no domicílio, nem ter sido picado pelo inseto.
Os indivíduos não conclusivos eram do gênero masculino, com média de
idade de 48,66, em relação ao grau de instrução, um era analfabeto e dois possuíam
do 1º ao 5º ano do ensino fundamental, apenas um fez uso de transfusão
sanguínea, todos conviviam com animais no domicilio, residiam há mais de cinco
anos na localidade. Dentre estes, um era estudante, o segundo aposentado e outro
lavrador. Nenhum dos três encontrou o triatomíneo no domicilio ou em torno dele;
nem havia sido picado. Não apresentaram sintomas cardíacos ou digestivos.
Entre os demais participantes do estudo apenas um afirmou ter sido
picado pelo inseto, era residente em casa de taipa no povoado Alagoinhas, convivia
com animais no domicilio, não realizou hemotransfusão e informou ter encontrado o
triatomíneo em casa, fora do quarto. Suas sorologias para T. cruzi não foram
reagentes.
Foi realizada relação entre os dados do sororeagente e não conclusivos a
fim de evidenciar fatores que predispõem o indivíduo a infecção conforme visto na
tabela 2 abaixo.
39
Tabela 2. Fatores de risco para doença de Chagas entre sororeagente e não
conclusivos dos povoados Poço da Clara e Alagoinhas de Tobias Barreto - SE,
2014.
VARIÁVEIS
SOROGENTE
(n)
NÃO CONCLUSIVOS
(n)
TRANSFUSÃO SANGUÍNEA
Sim
-
01
Não
01
02
Sim
01
02
Não
-
-
Não Respondeu
-
01
Sim
-
-
Não
01
03
Sim
-
-
Não
01
03
TIPO DE PAREDES ALVENARIA
01
03
TIPO DE TELHADO TELHA
01
02
-
01
TEMPO DE RESIDÊNCIA > 5 ANOS
01
03
CONVIVIA COM ANIMAIS NO DOMICILIO
01
03
CONHECE O TRIATOMÍNEO
ENCONTROU O INSETO NA HABITAÇÃO
FOI PICADO PELO TRIATOMÍNEO
Não respondeu
Neste estudo o sororeagente não referiu queixas, nem apresentou nos
exames alterações graves do sistema cardiovascular e digestivo. A fim de evidenciar
alterações pertinentes ao quadro crônico o sororeagente realizou eletrocardiograma,
ecocardiograma, Rx de tórax, esofagograma e enema opaco. O exame de
eletrocardiograma com traçado considerado dentro da normalidade demonstrou
ritmo sinusal com frequência cardíaca média estimada em 71 batimentos por minuto;
foi demonstrado distúrbio de condução pelo ramo direito do feixe de His associado à
hipertensão arterial sistêmica pregressa do pesquisado. O ecocardiograma
apresentou fração de ejeção de 0,66; as valvas mitral, aórtica, tricúspide e pulmonar
40
estavam normais, o relaxamento do ventrículo esquerdo apresentou alteração. A
radiografia de tórax estava normal com silhueta cárdio aórtica com configuração
anatômica.
Em relação ao sistema digestivo o reagente não relatou queixa quanto à
disfagia nem a obstipação, O enema opaco apresentou cólon de topografia,
contornos e calibres normais com acentuação das flexuras descendente/sigmóidea
com cefalização do ceco. Já no esofagograma apresentou alteração da motilidade
esofageana de discreto grau, evidenciando discreto comprometimento do esôfago
por doença de Chagas.
Na tabela 3 estão registrados os principais fatores sociodemográficos da
população estudada, com predominância do gênero feminino e características da
habitação, a maioria dos investigados possui paredes de alvenaria e teto revestido
com telha e não convive com animais no domicílio.
41
Tabela 3. Características socioeconômicas e demográficas dos habitantes
avaliados sorologicamente para doença de Chagas dos povoados Poço da
Clara e Alagoinhas de Tobias Barreto – SE, 2014.
VÁRIÀVEL
GÊNERO
Feminino
Masculino
Total
TIPO DE HABITAÇÃO
Paredes alvenaria
Paredes madeira
Paredes taipa
Paredes mistas
Não respondeu
Total
N
%
145
110
255
56,87
43,13
100
212
7
14
5
17
255
83,14
2,74
5,50
1,96
6,66
100
Telhado telha
Telhado palha
Não respondeu
Total
CONHECIMENTO DO TRIATOMÍNEO
Não
164
11
80
255
64,31
4,31
31,40
100
131
51,37
Sim
Não Respondeu
Total
CONVÍVIO COM ANIMAIS NO DOMICILIO
Não
Sim
Não Respondeu
123
1
255
48,23
0,39
100
152
99
4
59,60
38,82
1,57
TOTAL
255
100
Quanto à renda mensal, mais da metade da população estudada recebe
menos de um salário mínimo 54,90%, um salário mínimo 28,23%, dois salários
8,23% e três ou mais salários 078%; não responderam este item 7,84%.
O tempo de residência médio da população nas localidades foi de 27
anos; cem por cento das residências estavam ligadas à rede elétrica, e 89,80%
possuíam abastecimento de água canalizado. A maioria dos domicílios possuía
sanitário (90,58%), porém não há sistema de coleta e tratamento de esgoto, os
dejetos são coletados em fossa séptica.
A presença de vetores encontrados no domicilio e anexos elevam ainda
mais o risco de infecção humana pelo T. cruzi, conforme retratado na figura 7, 30,19
% indivíduos encontraram o triatomíneo.
42
Figura 7 - Triatomíneos encontrados em habitações e peridomicílio de Poço da
Clara e Alagoinhas, 2014.
* Foram utilizados valores absolutos nesta figura.
** Fonte: Diana Euzébio
Sabe-se que a transfusão sanguínea é um fator de risco para infecção, a
figura 8 retrata o percentual de hemotransfusão entre os indivíduos pesquisados.
Figura 8 - Transfusão de sangue pelos residentes de Poço da Clara e
Alagoinhas, 2014.
Fonte: Diana Euzébio
43
8. DISCUSSÃO
A região estudada
é considerada endêmica
para presença
de
triatomíneos infestados. A frequência de sororeagente para Chagas foi de 0,39%,
obtiveram sorologia como indeterminados 1,18% da população mesmo após dois
testes sorológicos. Em relação ao povoado de residência, o sororeagente e dois
indivíduos indeterminados residem em Alagoinhas; o terceiro indeterminado reside
em Poço da Clara evidenciando que existe transmissão vetorial nas duas
localidades e a doença não está sob controle. Os três pesquisados indeterminados
aguardam um terceiro exame confirmatório em laboratório de referência, conforme
protocolo do MS.
De acordo com informações do inquérito sorológico realizado 1975 e
1980, a prevalência da doença de Chagas para área rural no Brasil é 4,2%
(SILVEIRA et al., 2011). A soroprevalência estimada para a região nordeste é de
3,05% de acordo com (DIAS et al., 2000). Os dados obtidos no estudo demostram
haver subnotificação da doença evidenciada pela presença do triatomíneo e
condições precárias de moradia.
Ações do Programa de Controle da Doença de Chagas humana na
década de 1980 com grande campanha nacional resultaram em diminuição dos
casos nos últimos anos, porém a falta de recursos em diversos municípios
brasileiros levou a desativação do programa, concorrendo para falta de controle
vetorial em regiões endêmicas para triatomíneos e recrudescimento da doença
(DIAS, 2007; BRASIL, 2005).
O controle da doença vem sofrendo falta de investimento diante da
emergência de outros eventos de saúde de rápida disseminação e gravidade em
muitos estados brasileiros (BRASIL, 2010). Em 2013, entre os 75 munícipios do
estado de Sergipe, apenas 12 realizaram algum tipo de ação para o controle da
doença de Chagas. Em Tobias Barreto foi relevante a quantidade de domicílios
investigados, sendo 208 considerados positivos, fato que confirma a presença do
vetor na região e risco de transmissão; no entanto foi baixo número de insetos
capturados, não houve encaminhamento destes para análise entomológica, nem
avaliação dos moradores quanto à doença (SERGIPE, 2013). O controle da doença
em Sergipe ficou limitado a ações de busca pelo vetor, com a investigação de
44
colônias e borrifação dos ambientes considerados positivos. Percebe-se que estas
ações isoladas não são suficientes para evitar a transmissão da doença, sendo
necessário o acompanhamento sorológico.
A soropositividade para T. cruzi encontrada no indivíduo em idade adulta,
com histórico de tempo de habitação no local superior a dez anos, tendo sido
relatado pelo mesmo ter residido em casa de taipa, sugere se tratar de um caso
crônico ocorrido a partir de transmissão vetorial domiciliar.
O perfil clínico do sororeagente neste estudo mostrou que ele se encontra
na fase crônica, forma digestiva da doença com discreto comprometimento do
esôfago. A prevalência para forma digestiva é de 36,1% segundo Almeida (2007),
não é muito estudada devido às dificuldades operacionais. Entre as manifestações
que envolvem o trato digestivo o megaesôfago é geralmente tardia cerca de 5 a 8%
dos chagásicos desenvolvem a forma esofageana (ROCHA et al. 2003; RASSI,
2012).
A prevalência encontrada em indivíduos com faixa etária mais avançada
indica se tratar de casos crônicos, como observado no voluntário infectado da nossa
pesquisa, que se encontrava na faixa etária de 60 anos. O parasita persiste no
organismo do indivíduo durante toda a vida, quanto maior o tempo de exposição aos
fatores de risco, aumentam as chances do parasita infectar seus hospedeiros, e
desenvolver a infecção. O que justifica ser encontrado maior número de pessoas
infectadas pela doença na população acima dos 40 anos de idade (OLIVEIRAMARQUES et al. 2005).
Dentre as variáveis de risco para a doença entre sororeagente e não
conclusivos (Tabela 2), houve correlação quanto à convivência com animais no
domicílio, e tempo de residência maior que cinco anos, aumentando a chance de
exposição ao vetor já que a área é endêmica para triatomíneos. Embora o tipo de
habitação com paredes de alvenaria e telhado com telhas não concorra para
domicialização do vetor, a presença de pequenos animais garantindo fonte alimentar
permanente pode justificar a manutenção do ciclo doméstico da doença.
O sororeagente relatou ter habitado anteriormente por mais de dez anos
em casa de taipa, revelando como fator de risco, o tipo de habitação para a
transmissão vetorial. Esse fato não foi constatado no questionário, pois a pergunta
sobre o tipo de habitação subentendia a moradia atual e não mencionava anteriores.
O tipo de habitação dos indivíduos não conclusivos não se constituía em fator de
45
risco, as paredes eram de alvenaria e telhado com telhas, já as variáveis, presença
de animais no domicilio e tempo de residência maior que cinco anos foram fatores
em comum entre os três.
A manutenção do ciclo silvestre da doença está relacionada à associação
de triatomíneos e pequenos animais silvestres que são fonte alimentar natural
destes vetores e reservatórios para o Trypanosoma cruzi. Segundo Villela (2009), a
existência de focos silvestres de espécies vetoras do T. cruzi e potenciais
reservatórios em áreas endêmicas favorece a infestação de unidades domiciliares,
que ocorre de maneira contínua e a longo prazo.
Dentre a população geral estudada 146 eram do gênero feminino, e 109
pertenciam ao masculino; o sororeagente e não conclusivos eram do gênero
masculino, de acordo com Silva et al. (2007), não há correlação entre a prevalência
da infecção e o gênero de indivíduos acometidos.
Entre os participantes foi observado como tipo de habitação mais
frequente aquelas com paredes de alvenaria, seguidas de taipa, madeira, e algumas
mistas. Quanto à cobertura do teto observou-se um predomínio maior de telha e em
menor proporção de palha. A baixa qualidade de moradias, muitas vezes mistas,
mesclando construções mais recentes em alvenaria com outras em taipa ou madeira
contribui para domiciliação de vetores, e consequente aumento no risco de
transmissão vetorial (SILVEIRA, 2000); populações residentes em área rural com
baixas condições sociais e econômicas, habitações precárias, e deslocamento de
triatomíneos do seu ambiente silvestre encontram-se sob maior risco de infecção,
nos povoados pesquisados observamos essas características.
A respeito do conhecimento sobre o triatomíneo, 131 indivíduos
afirmaram não conhecer; a relevância a cerca dessas informações pelos indivíduos
podem contribuir com ações de busca local visando o controle vetorial. A
desinformação a respeito do vetor e riscos da doença aumentam a probabilidade de
transmissão em áreas endêmicas para o triatomíneo (COURA e BORGESPEREIRA, 2012).
Apenas um indivíduo afirmou ter sido picado pelo inseto, era residente em
casa de taipa no povoado Alagoinhas, informou ter encontrado o triatomíneo em
casa, fora do quarto, e convivia com animais no domicílio, porém suas sorologias
para T. cruzi foram não reagentes. Trabalho recente demonstrou alto índice de
infestação (17,5%) de Panstrongylus megistus capturados em domicílios de
46
município da região centro sul de Sergipe, o estudo corrobora com outros trabalhos
que destacam a influência de animais domésticos e pequenos criadouros no
peridomicilio para manutenção do ciclo de transmissão vetorial da doença de
Chagas (LIMA et al. ,2012).
A presença de animais em domicílio foi citada por 38,82% dos
pesquisados, inclusive o sororeagente. A convivência com animais no domicilio pode
servir de fonte alimentar constante para estes vetores estritamente hematófagos,
garantindo-lhes a manutenção do ciclo de vida.
Estudo recente demostrou a associação entre Panstrongylus megistus, e
pequenos mamíferos silvestres, apesar de não terem sido encontrados focos de
infestação domiciliares, mas a proximidade entre as habitações e focos naturais
poderia contribuir para tal infestação (SANTOS JR., 2013).
Em outro trabalho, Lima et al. (2012), refere que a substituição de áreas
de florestas para cultivo e uso de defensivos químicos tendem a afastar pequenos
mamíferos e roedores fonte alimentar natural de triatomíneos silvestres de seus
ecótopos; por outro lado currais, chiqueiros, galinheiros com estrutura improvisadas
oferecem abrigo a esses insetos favorecendo a manutenção do ciclo de vida do
hemíptero e proximidade com humanos.
Foi observado baixa escolaridade na população estudada, apenas 9,01 %
concluiu o fundamental, 11,37% o ensino médio e 17,25% eram analfabetos, o que
se reflete em atividades econômicas no campo como lavradores para subsistência
familiar em concordância com o estudo de Dias et al., 2002; Oliveira - Marques et al,
2005.
Em relação à transfusão sanguínea, 15 pesquisados afirmaram terem
sido submetidos a este procedimento, apenas um, considerado não conclusivo fez
uso deste procedimento há dois anos, não sendo considerada causa da provável
infecção diante da melhoria recente na avaliação sorológica de doadores. Trabalho
recente demonstrou prevalência de 0,17% em população de doadores de Recife PE confirmando melhorias na qualidade da triagem dos serviços de hemoterapia
(MELO et al., 2009).
Estudo recente realizado em Nova York de 2007 a 2010 confirmou a
baixa soroprevalência de 0,0083% em população de doadores de sangue (ZANIELO
et al., 2012), em comparação a população de doadores do México com 0,75%
(KIRCHHOFF et al. 2006), e Espanha 0,62% (PIRON. et al., 2008). É preocupante o
47
risco de transmissão em países endêmicos como Bolívia cuja soroprevalência da
infecção em doadores é de 15% (COGO et al., 2014).
A relação entre a positividade e transmissão na região ainda não está
definida, visto que as análises ainda não foram concluídas; as amostras dos
indivíduos que apresentaram sorologia não conclusiva foram encaminhadas para
análise por um terceiro teste em laboratório de referência da rede pública (FUNED)
para conclusão da investigação.
A PAHO (2008) estima 400.000 novos casos/ano por transmissão vetorial
que poderiam ser interrompidos com a redução do índice de infestação triatomínea.
O estudo trouxe uma nova visão da doença de Chagas com os casos
descobertos no estado e será utilizado para propor aos gestores de saúde
mudanças na política de controle da doença.
Os dados obtidos demostram subnotificação da doença evidenciada pela
presença do triatomíneo e condições precárias de moradia. A domicialização de
espécie silvestre da região estudada assumindo o papel do Triatoma infestans pode
ser responsável pela manutenção da transmissão, sendo necessário novas
estratégias para vigilância permanente e diagnóstico precoce.
9. CONCLUSÃO
1 - Há infecção humana crônica da doença de Chagas na área rural de
Tobias Barreto, sul do estado de Sergipe.
2 - Existe transmissão vetorial na área estudada. O percentual de
infecção não está definido, sendo aguardado o resultado das análises dos testes
Western Blot/PCR nos individuos com resultados não conclusivo em laboratório de
referência.
3 - Os resultados obtidos no estudo confirmam que a doença não está
sendo diagnosticada e que
transmissão vetorial não está interrompida,
demonstrando a necessidade de mudanças nas políticas de prevenção e controle da
doença.
48
REFERÊNCIAS
ALMEIDA E. A. et al. Apresentação clínica da doença de Chagas crônica em
indivíduos idosos. Rev. Soc. Bras. Med. Trop., v. 40, n. 3, 2007.
AMATO-NETO, V. et al. Avaliação da sensibilidade da diluição 1:20 pela reação de
imunofluorescência indireta, no diagnóstico sorológico da doença de Chagas.
Revista da Sociedade Brasileira de Medicina Tropical, v. 35, n. 2, p. 195-196,
2002.
ANDRADE, J. A. et al. Sociedade Brasileira de Cardiologia. I Diretriz Latino
Americana para o Diagnóstico e Tratamento da Cardiopatia Chagásica. Arquivo
Brasileiro de Cardiologia, v. 97, n. 2, p. 1-48, 2011.
ARGOLO, A. M.; FELIX, M. E.; PACHECO, R. S.; COSTA, J. Doença de Chagas e
seus principais vetores no Brasil. Imperial novo Milênio, Rio de Janeiro, p. 64,
2008.
BERN, C. et al. Trypanosoma cruzi e Doença de Chagas nos Estados Unidos.
Clinical Microbiology Reviews, v. 24, n. 4, p. 655-68, Outubro. 2011.
BORGES, J. D. et al. Seroprevalence of Chagas disease in schoolchildren from two
municipalities of Jequitinhonha Valley, Minas Gerais, Brasil; six years following the
onset of epidemiological surveillance. Revista do Instituto de Medicina Tropical,
São Paulo, v. 48, n. 2, p. 81-86, 2006.
BRASIL. Constituição (1988). Constituição da República Federativa do Brasil.
Senado Federal, Brasília, 1988.
BRASIL. Ministério da Saúde, Secretaria de Vigilância em Saúde. Consenso
Brasileiro em Doença de Chagas. Revista da Sociedade Brasileira de Medicina
Tropical, v. 38, n. 3, p.3 -29, 2005.
BRASIL. Ministério da Saúde, Fundação Osvaldo Cruz. Ministério da Saúde,
Brasília.
72008.
Disponível
em
<www.fiocruz.br/chagas/cgi/cgilua.exe/sys/start.htm?sid=130>.
Acesso
em:
20/08/2013.
BRASIL. Ministério da Saúde. Secretaria de Atenção à Saúde. Departamento de
Atenção Básica. Vigilância em saúde: zoonoses / Ministério da Saúde, Secretaria
de Atenção à Saúde, Departamento de Atenção Básica. Brasília: Ministério da
Saúde, 2009.
49
BRASIL. Ministério da Saúde. Secretaria de Vigilância em Saúde. Departamento de
Vigilância Epidemiológica. Doenças infecciosas e parasitárias: Guia de bolso /
Ministério da Saúde, Secretaria de Vigilância em Saúde, Departamento de Vigilância
Epidemiológica. 8. ed. Brasília: Ministério da Saúde, 2010.
BRASIL, Ministério da Saúde. Fundação Osvaldo Cruz. Brasília. 2012. Disponível
em <www.fiocruz.br/chagas/cgi/cgilua.exe/sys/start.htm?sid=130>. Acesso em 15 de
agosto de 2014.
BRASIL, Ministério da Saúde. Portal da Saúde. Brasília. 2014. Disponível em
<http://portalsaude.saude.gov.br/index.php/oministerio/principal/secretarias/svs/doen
ca-de-chagas>. Acesso em 10 de outubro de 2014.
BRENER, Z.; ANDRADE, Z.A.; BARRAL-NETTO, M. Trypanosoma cruzi e Doença de
Chagas. 2ª Edição. Rio de Janeiro: Guanabara Koogan, p. 431, 2000. CDC – Center
Disease
Control.
Disponível
em:
<http://www.dpd.cdc.gov/dpdx/HTML/TrypanosomiasisAmerican.htm>. Acesso em
20 de Agosto de 2013.
CDC - Center Disease Control., imagem.Disponível em: <disponível em
http://www.cdc.gov/parasites/chagas/biology.html>. Acesso em 16 de Julho de 2014.
COSTA, M. M. R.; BARBOSA, R. D. M. Levantamento de casos de doenças de
chagas no sertão do Alto Pajeú – Pernambuco - Brasil. Revista da Sociedade
Brasileira de Medicina Tropical, v. 42, p. 384, 2009.
COGO, A. et al. Perfil epidemiológico de doadores de sangue soropositivos para
Doença de Chagas na Região Sul. Revista Saúde, Santa Maria, v. 40, n. 1, p.125132, Jan./Jul. 2014.
COURA, J. R. The discovery of Chagas disease (1908-1909): great successes and
certain misunderstandings and challenges. Revista da Sociedade Brasileira de
Medicina Tropical, v. 46, n. 4, p. 389-390, 2014. Disponível em:
<http://www.scielo.br/scielo.php?script=sci_arttext&pid=S003786822013000400389&
lng=en. http://dx> . Acesso em 13 de maio de 2013. doi.org/10.1590/0037-86820143-2013.
CREMA, E. et al. Correlação manométrico-radiológica e sua importância no
tratamento cirúrgico do megaesôfago chagásico. Revista da Sociedade Brasileira
de Medicina Tropical, v. 36, n. 6, p. 665-669, 2003.
DEVERA, R.; FERNANDES, O.; COURA, J. R. Should Trypanosoma cruzi be called
"cruzi" complex? A review of the parasite diversity and the potential of selecting
population after in vitro culturing and mice infection. Memórias do Instituto
Oswaldo Cruz, v. 98, p. 1-12, 2003.
DIAS, J. C. P. Doença de Chagas. J. Bras. Med, v. 55, p. 58-82, 1989.
50
DIAS, J. C. P. Avanços e Perspectivas na avaliação do paciente chagásico. Revista
da Sociedade Brasileira de Medicina Tropical, v. 27, n. 2, p. 41-43, 1994.
DIAS, J. C. P. Chagas disease: success and challenges, ions of Triatoma infestans.
Caderno de Saúde Pública, Rio de Janeiro, v. 22, n. 10, p. 2020-2021, 2006.
DIAS, J. C. P. Globalização, iniqüidade e doença de Chagas. Caderno de Saúde
Pública, Rio de Janeiro, v. 23, n. 1, p. 513-522, 2007.
DIAS, J. C. P. Southern Cone Initiative for the elimination of domestic populations of
Triatoma infestans and the interruption of transfusional Chagas disease. Historical
aspects, present situation, and perspectives. Memórias do Instituto Oswaldo Cruz,
v. 102, n. 1, p. 11-18, 2007.
DIAS, J. C. P.; AMATO-NETO, V. Prevenção referente às modalidades alternativas
de transmissão do trypanosoma cruzi no Brasil. Rev. Soc. Bras. Med. Trop.,
Uberaba,
v.
44, n.
2, 2011.
Disponível
em
http://www.scielo.br/scielo.php?script=sci_arttext&pid=S003786822011000800011&l
ng=en&nrm=iso. Acesso em 21 Nov. 2014.
BRASIL. Código Tributário Nacional, Lei nº 9.393 de 25 de outubro de 1966. Dispõe
sobre o Sistema Tributário Nacional e institui normas gerais de direito tributário
aplicáveis
à
União,
Estados
e
Municípios.
Disponível
em:
<http://www.receita.fazenda.gov.br/legislacao/leis/ant2001/lei939396.htm>. Acesso
em 08 de setembro de 2014.
BRASIL, MINISTÉRIO DA SAÚDE. Fundação Osvaldo Cruz. Brasília. 2012.
Disponível
em
<www.fiocruz.br/chagas/cgi/cgilua.exe/sys/start.htm?sid=130>.
Acesso em 08 de outubro de 2014.
BRASIL. Lei n. 4.504 de 30 de novembro de 1964. Dispõe sobre o Estatuto da Terra,
e
dá
outras
providências.
Disponível
em:
http://www.planalto.gov.br/ccivil_03/leis/l4504.htm>. Acesso em 08 de setembro de
2014.
BRASIL. Ministério da Saúde. Portal da Saúde, 2013. Disponível
<http://portal.saude.gov.br/portal/saude/profissional/area.cfm?id_area=1530>.
Acesso em 20 de agosto de 2013.
em:
BRASIL, Ministério da Saúde. Sistema de Vigilância em Saúde, Sistema de
Informação de Agravos de Notificação - Sistema de Informação de Agravos de
Notificação - Sinan Net, 2014.
COURA, J.R.; BORGES-PEREIRA, J. Chagas disease. What is known and what
should be improved: a systemic review. Revista da Sociedade Brasileira de
Medicina Tropical, v. 45, n. 3,p. 286-296, 2012.
51
GARCIA, E. L.; VIEIRA, E.; GOMES, J. E. P. L.; GONÇALVES, A. M. Molecular
biology of the interaction Tripanosoma cruzi invertebrate host. Memórias do
Instituto Oswaldo Cruz, v. 79, p. 33-37, 1984.
GARCIA, E. L et al. Interactions between intestinal compounds of triatomines and
Trypanosoma cruzi. Trends in Parasitol, v. 20, p. 499-505, 2010.
GOMES, Y. M. et al. Serodiagnosis of chronic Chagas infection by using
EIErecombinant-Chagas-Biomanguinhos kit. Memórias do Instituto Oswaldo Cruz,
v. 96, n. 4, p. 497–501, 2001.
FERREIRA, F. L.; JANSEN, M. A.; ARAUJO, A. Chagas disease in prehistory.
Academia Brasileira de Ciências, Rio de Janeiro, v. 83, n. 3, Setembro. 2011.
Disponível
em:
<http://www.scielo.br/scielo.php?script=sci_arttext&pid=S000137652011000300022&lng=en&nrm=iso>. Acesso em 12 de novembro de 2014.
HENAO-MARTÍNEZ A. F.; SCHWARTZ D. A.; YANG I. V. Chagasic cardiomyopathy,
from acute to chronic: is this mediated by host susceptibility factors? Elsevier Royal
Society of Tropical Medicine and Hygiene, p. 106, 2012. Disponível em <
http://dx.doi/10.1016/j.trstmh.2012.06.006>.Acesso em 25 de julho de 2014.
IBGE - Instituto Brasileiro de Geografia e Estatística – censo demográfico, 2010.
Disponível em URL< http://www.ibge.gov.br/brasil_em_sintese>. Acesso em 19 de
outubro de 2012.
IBGE - Instituto Brasileiro de Geografia e Estatística, imagem, 2014. Adaptado
disponível
em
<http://cidades.ibge.gov.br/painel/painel.php?lang=&codmun=280740&search=||infog
r%E1ficos:-dados-gerais-do-munic%EDpio>, acesso em 10 de outubro de 2014.
IBGE - Instituto Brasileiro de Geografia e Estatística.
Disponível
em<http://www.ibge.gov.br/home/estatistica/populacao/mapa_mercado_trabalho/not
astecnicas.shtm> acesso em 17 de outubro de 2014.
KIRCHHOFF, L. V. et al. Transfusion-associated Chagas disease (American
trypanosomiasis) in Mexico: implications for transfusion medicine in the United
States. Transfusão. PubMed, v. 46, p.298, 2006.
LANA, M.; TAFURI, W. L. Trypanosoma cruzi e Doença de Chagas. In: NEVES,
D.P. Parasitologia Humana. 10° ed. São Paulo: Atheneu, p. 73-96, 2000.
LAZZARI, C. R.; PEREIRA, M. H.; LORENZO, M. G. Behavioural biology of Chagas
disease vectors. Memórias do Instituto Oswaldo Cruz, Rio de Janeiro, v. 108, n. 1,
2013.
Disponível
em:http://www.scielo.br/scielo.php?script=sci_arttext&pid=S00740276201300090003
4&lng=en&nrm=iso acesso em 12 de julho de 2014.
52
LESCURE, X. F. et al. Chagas disease: changes in knowledge and management.
Publication Journal The Lancet Infectious Diseases, Paris, v. 10, n. 8, p. 556570, Agosto. 2010.
LIMA, R. F. A. et al. Triatomines in dwellings and outbuildings in an endemic area of
Chagas disease in northeastern Brazil. Rev. Soc. Bras. Med. Trop., Uberaba, v.
45, n.
6,
Dezembro.
2012.
Disponível
em
http://www.scielo.br/scielo.php?script=sci_arttext&pid=S003786822012000600009&l
ng=en&nrm=iso> acesso em 16 de julho de 2014.
LINS, J. S. Taxa de infecção triatomínica e pesquisa de infecção humana por
Trypanosoma cruzi em uma área rural de Sergipe.22-03-2013. 65 pag. (Dissertação
– Mestrado em Ciências da Saúde). Sergipe: UFS, 2013.
LUNARDELLI, A. et al. Soroprevalência da doença de Chagas em candidatos a
doadores de sangue. Revista Brasileira de Análises Clínicas, v. 39, n.2, p. 139141, abr.-jun. 2007.
MARIN-NETO, J. A. Cardiopatia Chagásica. Arquivos Brasileiros de Cardiologia,
v. 72, p. 247-263, 1999.
MEIRA, W. S. F. et al. Tripanosoma cruzi recombinant complement regulatory
protein: a novel antigen for use in an enzyme-linked immunosorbent assay for
diagnosis of Chagas disease. Journal of Clinical Microbiology, v. 40, n. 10, p.
3735-3740, 2002.
MELO, S. A. et al . Prevalência de infecção chagásica em doadores de sangue no
estado de Pernambuco, Brasil. Rev. Bras. Hematologia Hemoterapia, São Paulo,
v.
31, n.
2, Apr.
2009.
Disponível
em
<http://www.scielo.br/scielo.php?script=sci_arttext&pid=S151684842009000200006&
lng=en&nrm=iso> acesso em 17 de julho de 2014.
MONCAYO, A. Chagas Disease: Current Epidemiological Trends after the Interruption of
Vectorial and Transfusional Transmission in the Southern Cone Countries. Mem Inst
Oswaldo Cruz, v. 98, n.5, p. 577-591, 2003.
MOREIRA, H.; REZENDE, J. M.; SEBBA, F., AZEVEDO, I. F.; LEITE, A. C. A.; SOARES, E.
P. Megacólon Chagasico. Rev. Bras. Colo Proct., v. 3, n.4, p. 152-162, 1983.
PIRON, M. et al. Soroprevalência de Trypanosoma cruzi infecção em risco doadores
de sangue na Catalunha (Espanha). Transfusão, v. 48, p. 1862-8, 2008.
MUÑOZ J. et al. Perfil clínico de Trypanosoma cruzi infecção em um ambiente nãoendêmica: imigração e doença de Chagas. Clinical Infectious Diseases, v. 48,
n.12, p. 1736-1740, 2009.
53
OELEMANN, W. M. R. et al. Evaluation of three commercial enzyme-linked
immunosorbent assays for diagnosis of Chagas’ disease. Journal of Clinical
Microbiology, v. 36, n. 9, p. 2423-2427, 1998.
OLIVEIRA-MARQUES, D. S. et al. The epidemiologic profile and prevalence of
cardiopathy in Trypanosoma cruzi infected blood donor candidates, Londrina,
Paraná, Brazil. Revista do Instituto de Medicina Tropical de São Paulo, v. 47, n.
6, p. 321-326, 2005.
PAHO/HSD/CD. Epidemiological Profiles of Neglected Diseases and Other Infections
Related to Poverty in Latin America and the Caribbean. Presented at the
Consultation on a Latin American and Caribbean Trust Fund for the Prevention,
Control and Elimination of Neglected and Other Infectious Diseases. Washington,
DC,
15-16
de
dezembro
de
2008.
Disponível
em:
http://new.paho.org/hq/index.php?option=com_joomlabook&Itemid=259&task=displa
y&id=37.
PRATA, A. Clinical and epidemiological aspects of Chagas disease. The Lancet
Infectious Diseases, v. 1, n. 2, p. 92-100, Sep. 2001.
PEREIRA, B. A. C. et al. Arritmias e a forma indeterminada da Doença de Chagas.
Arquivo Brasileiro de Cardiologia, v. 47, p. 197-9, 1986.
PENARANDA-CARRILLO, R.; CASTRO, C.; REZENDE, J.; PRATA, A.; MACEDO,
V. Estudo radiológico do esôfago de chagásicos, em 25 anos do Projeto Mambaí
Revista da Sociedade Brasileira de Medicina Tropical, v. 39,n.2, p.152-155,
2006.
PINTO, D. C. J. Tendencias sociales de la enfermedad de Chagas para las próximas
décadas.
Salud
Colectiva, Lanús, 2012.
Disponível
em:
http://www.scielosp.org/scielo.php?script=sci_arttext&pid=S18518265201200030001
0&lng=es&nrm=iso acesso em 23 de agosto de 2013.
RASSI-JUNIOR, A.; RASSI, S. G.; RASSI, A. Morte súbita na doença de Chagas.
Arquivo Brasileiro de Cardiolgia, v. 76, p. 75-78, 2001.
RASSI, A.; REZENDE, J. M.; RASSI, J. R. A. Advanced megaesophagus (Group III)
secondary to vector-borne Chagas disease in a 20-month-old infant. Revista da
Sociedade Brasileira de Medicina Tropical, v. 45, p. 266-8, 2012.
RIBEIRO, A. L.; ROCHA, M. O. C. Inderminate form of Chagas disease:
considerations about diagnosis and prognosis. Revista da Sociedade Brasileira de
Medicina Tropical, v. 31, n. 3, p. 301-314, 1998.
ROCHA, M. O. C.; RIBEIRO, A. L.; TEIXEIRA, M. M. Clinical managment of chronic
Chagas cardiomyopathy..Front Biosci, v. 8, p. 44 e 54, 2003.
54
SANTOS-JUNIOR, E. J. et al. Evaluation of natural foci of Panstrongylus megistus in
a forest fragment in Porto Alegre, State of Rio Grande do Sul, Brasil. Revista da
Sociedade Brasileira de Medicina Tropical, Uberaba, v. 46, n. 5, Outubro. 2013.
Disponível
em
http://www.scielo.br/scielo.php?script=sci_arttext&pid=S003786822013000500575&lng=en&nrm=iso> acesso em 16 de julho de 2014.
SARQUIS, O. L. et al. Avaliação epidemiológica e conhecimento sobre a Doença de
Chagas e seus vetores, de uma comunidade de assentados em área endêmica do
Nordeste Brasileiro. Rev. Bras. de Medicina Tropical, v. 42, p. 385, 2009.
SERGIPE, Secretaria de Estado da Saúde, Diretoria de Vigilância Epidemiológica,
Núcleo de Sistema de Informação, Relatório de atividades, Junho, 2013 a.
SERGIPE, Secretaria de Estado da Saúde, Núcleo de Endemias, Programa de
Controle da Doença de Chagas, 2013b.
SILVA, S. A.; GONTIJO, E. D.; AMARAL, C. F. S. Case-control study of factors
associated with chronic Chagas heart disease in patients over 50 years of age.
Memórias do Instituto Oswaldo Cruz, v. 102, n.7, p.845-851, 2007.
SILVEIRA, A. C. Situação do controle da transmissão vetorial da doença de Chagas
nas Américas. Cad. Saúde Pública, v. 16, n. 2, p. 35-42, 2000.
SILVEIRA, A. C. Os novos desafios e perspectivas futuras do controle. Revista da
Sociedade Brasileira de Medicina Tropical, v. 44, n. 2 , 2011.
TRINDADE, R. L. et al. Triatomíneos do Seridó Potiguar: ecótopos naturais e
peridomiciliar. Rev. Bras. De Medicina Tropical, v. 42, p. 388, 2009.
VILLELA, M. M. et al. Avaliação do Programa de Controle da doença de Chagas em
relação à presença de Panstrongylus megistus na região centro oeste do estado de
Minas Gerais, Brasil. Cad. Saúde Pública, Rio de Janeiro, v 25, n. 4, abril, 2009.
Disponível
em:
<http://www.scielo.br/scielo.php?script=sci_arttex&pid=S0102311X2009000400022&
Ing=en&nrm=iso>. Acesso em 18 de agosto de 2013.
WORLD HEALTH ORGANIZATION. Control of Chagas` disease. Report of a WHO Expert
Committee Geneva. WHO Technical Report Series. n. 905, 2002.
WORLD HEALTH ORGANIZATION. Research priorities for Chagas disease, human
African trypanosomiasis and leishmaniasis. WHO Technical Report Series n. 975,
ISSN 0512-3054; Geneva 2012.
WORLD HEALTH ORGANIZATION. First WHO report on neglected tropical diseases.
Working to overcome the global impact of neglected tropical diseases, 2010.
55
WORLD HEALTH ORGANIZATION. Chagas disease (American trypanosomiasis)
Fact
sheet
N°340,
Updated
March
2014,
disponível
em
<http://www.who.int/mediacentre/factsheets/fs340/en/>. Acesso em 24 de novembro
de 2014.
ZANIELLO, B. A. et al. Seroprevalence of Chagas Infection in the Donor Population.
PLOS ONE, v. 6, n. 7, p. 1771, 2012.
56
APÊNDICE 1
TERMO DE CONSENTIMENTO LIVRE E ESCLARECIDO
Eu,_______________________________________________________,
abaixo assinado, autorizo a pesquisadora: Diana Matos Euzébio (1), sob a
orientação da Drª. Ângela Maria da Silva (2), a desenvolver a pesquisa abaixo
descrita:
Título do Experimento: “Aspectos Epidemiológicos da Doença de Chagas
em Área Rural do Município de Tobias Barreto, Sergipe”.
O estudo será realizado nos povoados Poço da Clara e Alagoinhas,
localizados em Tobias Barreto, na região Sul do Estado de Sergipe. Serão
investigadas famílias, onde inicialmente a pesquisadora (enfermeira) e um estudante
de medicina farão o cadastro das famílias e serão coletadas as amostras de sangue
para realizar as sorologias para a Doença de Chagas. Para as sorologias positivas,
além da entrevista clínica, demográfica e do exame físico, serão agendados os
exames radiológicos, o xenodiagnóstico, o eletrocardiograma e o ecocardiograma
(serão realizados no Hospital Universitário).
Benefícios esperados: Contribuir com a manutenção da Saúde da
Comunidade.
Informações: Os participantes têm a garantia que receberão respostas a
qualquer pergunta e esclarecimento de qualquer dúvida quanto aos assuntos
relacionados à pesquisa. Também a pesquisadora supracitada assume o
compromisso de proporcionar informações atualizadas obtidas durante a realização
do estudo.
Retirada do consentimento: O voluntário tem a liberdade de retirar seu
consentimento a qualquer momento e deixar de participar do estudo, não
acarretando nenhum dano ao voluntário.
Aspecto Legal: Elaborado de acordo com as diretrizes e normas
regulamentadas de pesquisa envolvendo seres humanos atende à Resolução nº.
196, de 10 de outubro de 1996, do Conselho Nacional de Saúde do Ministério de
Saúde - Brasília – DF.
Confiabilidade: Os voluntários terão direito à privacidade. A identidade
(nomes e sobrenomes) do participante não será divulgada. Porém os voluntários
57
assinarão o termo de consentimento para que os resultados obtidos possam ser
apresentados em congressos e publicações.
Quanto à indenização: Não há danos previsíveis decorrentes da pesquisa,
mesmo assim fica prevista indenização, caso se faça necessário.
Informações dos nomes, endereços e telefones dos responsáveis pelo
acompanhamento da pesquisa.
1 - Diana Matos Euzébio, enfermeira, especialista em saúde pública pela
UNAERP, Mestranda da Universidade Federal de Sergipe. Residente a Rua B, Nº
71, Anexo 4, Conj. Santa Lúcia, Bairro Jabutiana, Aracaju – SE, Telefone (79) –
8827 4282.
2 - Ângela Maria Silva, Profª. Drª do Departamento de Medicina da
Universidade Federal de Sergipe. Rua Cláudio Batista S/N Br. Sanatório Aracaju SE.
Aracaju, _____de ____________________de 2013.
_____________________________________________________
58
APÊNDICE 2
PROTOCOLO DE COLETA DE DADOS Nº ________ Data
/
/ 2014
Questionário para pesquisa em DOEN ÇA DE CHAGAS e DIABETES
Nome:
Idade:
Naturalidade:
Endereço:
Data Nasc.:
Procedência:
Telefone:
Gênero
( ) Masculino
( ) Feminino
raça: branca ( ) negra ( ) pardo ( ) indio ( ) amarela ( )
Profissão:
Renda mensal familiar ( ) menos de 1 salário ( ) 1 salário ( ) 2 salários 3 ou mais
salários ( )
Quanto tempo reside no domicilio: ( ) meses ou ( ) anos
Número de pessoas no domicilio:
Residências Anteriores: ( ) zona rural
()
cidade
Animais convivem no domicilio: ( ) sim ( ) não; se sim, quais?
__________________________
Fez transfusão sanguínea : ( ) sim Há quanto tempo? ________ ( ) não ( ) não sabe
Estuda: ( ) Sim
( ) Não
Grau de Instrução: 1˚ ao 5º ano do ensino fundamental ( )
6° ao 9° ano do ensino fundamental ( )
Ensino médio completo
( )
Ensino médio incompleto
( )
Analfabeto
( )
Conhece o barbeiro?
( ) Sim
( ) Não
Onde encontrou? ( ) No quarto ( ) Fora do quarto, em casa ( ) Peridomicílio
( )Outro __________________
Já foi picado(a) pelo barbeiro? ( ) Sim se sim, quantas vezes?______ ( ) Não
Outra pessoa no domicilio já foi picada pelo barbeiro ?
Se sim há quanto tempo? _____
Tipo de moradia:
paredes:( ) taipa ( ) madeira ( )alvenaria
telhado: ( ) palha ( ) telha ( ) outros
Possui sanitário: ( ) sim
( ) não
Presença de energia elétrica: ( ) sim
( ) não
Abastecimento de água canalizada:( )sim ( ) não
( ) Sim
( ) Não
( ) mista ___________
59
Se não, qual?________________________
Tabagista
( ) Sim
Etilista
( ) Sim
Possui Doença Renal
( ) Sim
( ) Não Se sim, maços/dia: ______________
( ) Não
( ) Não
frequência ___________
( ) Não Sabe Informar
Diabetes Melitus
( ) Sim
( ) Não ( ) Não Sabe Informar
Hipertensão Arterial Sistêmica
( ) Sim ( ) Não ( ) Não Sabe Informar
Problemas cardíacos
( ) Sim
( ) Não
( ) Não Sabe Informar
Glicemia Capilar:________Pressão Arterial:________IMC: _________________
Histórico de diabetes na família? ( ) Nenhum ( ) Pais ( ) Avós
Comorbidades relacionadas ao diabetes? ( ) Problemas visuais( ) Úlcera ( )Amputação
Sintomatologia para diabetes: ( ) Poliuria ( ) Polidpsia ( ) Perda de Peso
Pratica Atividade Física? ( )Sim ( ) Não
Faz uso de medicação hipoglicemiante?
Se sim, qual?
( ) Sim ( )Não
Se sim, qual?
Horário da ultima refeição:____:_____
Dados Laboratoriais:
Glicemia de Jejum:_______Hemoglobina Glicada: ______
Lipidograma: Colesterol Total: _________ LDL:______________ HDL: _____________
Triglicerídeos: __________________
60
APÊNDICE 3
Fotos das localidades Poço da Clara e Alagoinhas
Figura xx
61
ANEXO 1
Termo de Aprovação pelo Comitê de Ética da Universidade Federal de Sergipe, em 03 de
outubro de 2010 da pesquisa que será dado seguimento:
62
ANEXO 2
Declaração do Conselho de Ética em Pesquisa autorizando a pesquisa.