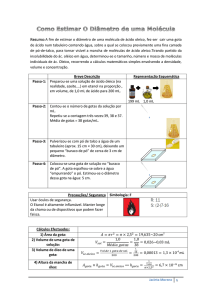
Universidade do Estado de Santa Catarina – UDESC
Centro de Ciências Tecnológicas – CCT
Departamento de Química – DQM
ILQ0001
Introdução ao Laboratório de Química
Exp. 12
EQUILÍBRIO QUÍMICO
01. OBJETIVOS:
No final desta experiência o aluno deverá ser capaz de:
Dada a equação química de um equilíbrio escrever a expressão para a constante
de equilíbrio;
Avaliar as influências das concentrações e da temperatura no
equilíbrio(Princípio de LeChatelier);
02. INTRODUÇÃO:
A maioria das reações químicas são reversíveis. Os reagentes, A e B, reagem
formando os produtos, C e D, e no mesmo tempo os produtos reagem restituindo os
reagentes. Qual destas reações será favorecida depende das condições termodinâmicas.
Os principais fatores são:
1. A reatividade das substâncias envolvidas. Esta pode ser expressa em energia ou, sob
condições de pressão constante em entalpia, que é liberada ou consumida durante a
reação.
2. A ocorrência ou disponibilidade das substâncias envolvidas. Em reações
homogêneas, como as deste experimento, a ocorrência é determinada pela concentração.
Em soluções heterogêneas (p.ex. reações na superfície de substâncias sólidas) é
necessário respeitar, além disso, a posição do centro reativo da molécula.
Para sabermos quantitativamente para que lado tende uma reação em equilíbrio,
definimos uma constante de equilíbrio, K, que pode ser determinada em termos de
concentração molar (Kc) ou em termos de pressão parcial (Kp) das substâncias
participantes da reação. Assim, para a reação equilibrada:
aA + bB ⇔cC + dD , com ΔH > 0 ( = reação endotérmica)
defini-se a constante de equilíbrio como:
O princípio de Le Chatelier descreve como o equilíbrio químico pode ser
manipulado por fatores externos, sendo eles a concentração das substâncias
participantes da reação, pressão e temperatura. Alguns exemplos do princípio de Le
Chatelier serão examinados a seguir.
Universidade do Estado de Santa Catarina – UDESC
Centro de Ciências Tecnológicas – CCT
Departamento de Química – DQM
ILQ0001
Introdução ao Laboratório de Química
Exp. 12
03. MATERIAIS:
Pipetas
Conta-gotas
Tubos de ensaio
Cromato de potássio: K2CrO4, 0,10 mol/L
Dicromato de potássio: K2Cr2O7, 0,10 mol/L
HCl, 1,0 mol/L
NaOH, 1,0 mol/L
Ba(NO3)2, 0,10 mol/L
04. PROCEDIMENTO:
A . Equilíbrio dos íons cromato (CrO42-) e dicromato (Cr2O72-)
A reação do cromato CrO42- (amarelo) para o dicromato Cr2O72- (laranja) é totalmente
reversível. Formulamos a reação e vemos que a concentração de prótons faz parte do
equilíbrio.
2 CrO42- + 2 H+
Cr2O72- + H2O
1. Coloque 20 gotas de cromato de potássio K2CrO4 em um tubo de ensaio, e 20 gotas
de dicromato de potássio K2Cr2O7 em um outro tubo. Anote a cor de cada solução.
2. Em outros dois tubos de ensaio coloque 10 gotas de K2CrO4 e K2Cr2O7,
respectivamente, uma solução em cada tubo. Acrescente gota a gota, NaOH
alternadamente em cada um dos tubos até a mudança de cor em um deles. Anote as
cores neste momento. Guarde essas soluções para a etapa 5.
3. Repita o procedimento anterior, mas acrescente HCl gota a gota, alternadamente em
cada um dos tubos, até a mudança de cor em um deles. Guarde essas soluções para a
etapa 4.
4. Acrescente gota a gota, NaOH a um dos tubos da etapa 3 até a mudança de cor. Anote
a cor final.
5. Em um dos tubos da etapa 2 acrescente, gota a gota, HCl até a mudança de cor. Anote
a cor final.
B. Equilíbrio de cromato de bário, BaCrO4(s) com uma solução saturada de seus
íons.
BaCrO4 (s)
Ba2+(aq) + CrO42- (aq)
1. Em um tubo de ensaio coloque 10 gotas de K2CrO4 e acrescente, gota a gota, nitrato
de bário, Ba(NO3)2 até perceber alguma alteração. Guarde este tubo para a etapa 3.
Universidade do Estado de Santa Catarina – UDESC
Centro de Ciências Tecnológicas – CCT
Departamento de Química – DQM
ILQ0001
Introdução ao Laboratório de Química
Exp. 12
2. Em outro tubo de ensaio, coloque 10 gotas de K2Cr2O7. Acrescente 2 gotas de HCl e
depois 10 gotas de Ba(NO3)2. Anote se houve mudança de cor e/ou formação de
precipitado. Guarde esse tubo de ensaio para o item 4.
3. Ao tubo de ensaio da etapa 1 acrescente, gota a gota, HCl até notar alguma alteração.
Anote o que observou.
4. Ao tubo de ensaio da etapa 2 acrescente NaOH até notar alguma modificação.
5. Sugira uma maneira de inverter as observações nas etapas 3 e 4. Teste suas sugestões.
6. Em outro tubo de ensaio coloque 20 gotas de K2CrO4 e em outro tubo 20 gotas de
K2Cr2O7. Acrescente algumas gotas de Ba(NO3)2 a cada um dos tubos. Anote as suas
observações na folha de dados.
Ao terminar, descarte o conteúdo de cada tubo de ensaio na pia e lave os tubos e deixe
os sobre papel toalha para escorrer a água.
05. QUESTIONÁRIO:
01. Qual a influência de H+(aq) sobre o equilíbrio CrO4 2Cr2O7 2-? Complete a
+
equação, acrescentando no lado adequado o número de íons H e moléculas de H2O
respectivamente.
02. Qual a influência da concentração de OH- sobre o equilíbrio CrO42Cr2O72-?
Complete e balanceie a equação acrescentando íons e moléculas OH de H2O.
03. A partir das equações balanceadas nas questões anteriores, explique os resultados
observados nas etapas: A-3, A-4 e A-5.
04. Calcule K para a reação PCl3 + Cl2
PCl5, sabendo-se que, no equilíbrio as
pressões parciais são: p(PCl3) = 0,2 atm, p(Cl2) = 0,1 atm e p(PCl5) = 1,2 atm. Admita
que a temperatura seja 0,0oC. Qual a unidade para essa constante de equilíbrio?
Universidade do Estado de Santa Catarina – UDESC
Centro de Ciências Tecnológicas – CCT
Departamento de Química – DQM
ILQ0001
Introdução ao Laboratório de Química
Exp. 12
FOLHA DE DADOS
EQUIPE:_______________________________________________________________
____________________________________________________TURMA:___________
DATA____/____/_______
A) Cor das soluções:
1- CrO42-(aq)______________________, Cr2O72-
(aq)____________________________.
2- CrO42-(aq) + OH- (aq) ________________, Cr2O72-(aq) + OH-(aq) ________________.
3- CrO42-(aq) + H+(aq)_______________,Cr2O72-(aq) + H+(aq) ____________________.
4- Tubo da etapa 3 + OH-(aq) ________________.
5- Tubo da etapa 2 + H+(aq) _______________.
B) Equilíbrio do Cromato de bário. (anote mudanças de precipitado).
1- CrO42-(aq) + Ba2+(aq)_____________________________________.
2- Cr2O72-(aq) + H+(aq) + Ba2+(aq)_______________________________.
3- Tubo da etapa B.1 + H +(aq) _____________________________.
4- Tubo da etapa b.2 + OH -(aq) ____________________________.
5- 1) Inversão da reação b.3________________________________.
2) Inversão da reação b.4__________________________________.
6- CrO42-(aq) + Ba2+(aq)_______________,Cr2O72-(aq) + Ba2+(aq)_____________________.