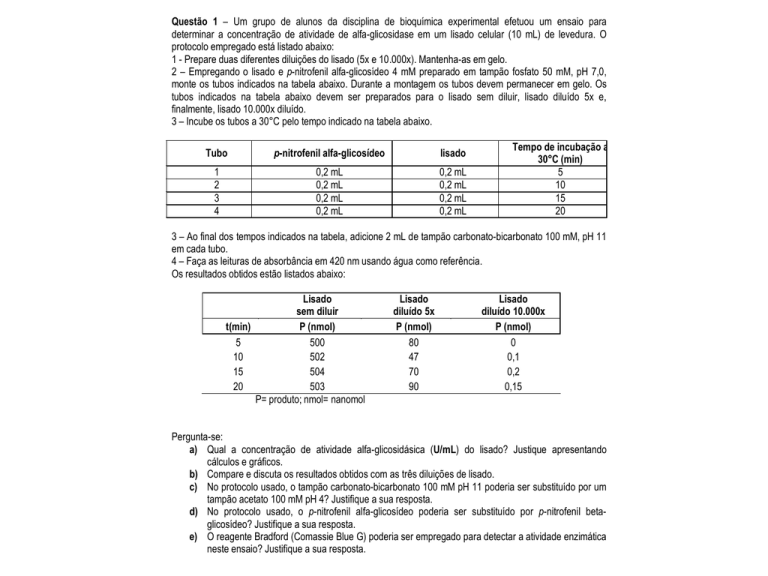
Questão 1 – Um grupo de alunos da disciplina de bioquímica experimental efetuou um ensaio para
determinar a concentração de atividade de alfa-glicosidase em um lisado celular (10 mL) de levedura. O
protocolo empregado está listado abaixo:
1 - Prepare duas diferentes diluições do lisado (5x e 10.000x). Mantenha-as em gelo.
2 – Empregando o lisado e p-nitrofenil alfa-glicosídeo 4 mM preparado em tampão fosfato 50 mM, pH 7,0,
monte os tubos indicados na tabela abaixo. Durante a montagem os tubos devem permanecer em gelo. Os
tubos indicados na tabela abaixo devem ser preparados para o lisado sem diluir, lisado diluído 5x e,
finalmente, lisado 10.000x diluído.
3 – Incube os tubos a 30°C pelo tempo indicado na tabela abaixo.
Tubo
p-nitrofenil alfa-glicosídeo
lisado
1
2
3
4
0,2 mL
0,2 mL
0,2 mL
0,2 mL
0,2 mL
0,2 mL
0,2 mL
0,2 mL
Tempo de incubação a
30°C (min)
5
10
15
20
3 – Ao final dos tempos indicados na tabela, adicione 2 mL de tampão carbonato-bicarbonato 100 mM, pH 11
em cada tubo.
4 – Faça as leituras de absorbância em 420 nm usando água como referência.
Os resultados obtidos estão listados abaixo:
Lisado
sem diluir
t(min)
P (nmol)
5
500
10
502
15
504
20
503
P= produto; nmol= nanomol
Lisado
diluído 5x
P (nmol)
80
47
70
90
Lisado
diluído 10.000x
P (nmol)
0
0,1
0,2
0,15
Pergunta-se:
a) Qual a concentração de atividade alfa-glicosidásica (U/mL) do lisado? Justique apresentando
cálculos e gráficos.
b) Compare e discuta os resultados obtidos com as três diluições de lisado.
c) No protocolo usado, o tampão carbonato-bicarbonato 100 mM pH 11 poderia ser substituído por um
tampão acetato 100 mM pH 4? Justifique a sua resposta.
d) No protocolo usado, o p-nitrofenil alfa-glicosídeo poderia ser substituído por p-nitrofenil betaglicosídeo? Justifique a sua resposta.
e) O reagente Bradford (Comassie Blue G) poderia ser empregado para detectar a atividade enzimática
neste ensaio? Justifique a sua resposta.
Diluído 5x
100
90
80
70
60
50
40
30
20
10
0
sem diluir
y = 4.3x + 4.5
R² = 0.9984
diluído 1000x
490
10
420
8
350
y = 0.22x + 499.5
R² = 0.6914
280
6
210
4
140
0
0
5
10
15
20
0
0
s/ diluir
nmol P
500
502
504
503
diluído 5x
nmol P
80
47
70
90
diluído 10000x
nmol P
0
0,1
0,2
0,15
Cálculo
nmol/min mU/mL
4,3
21,5
sem diluir
107,5
U/mL
0,1075
t(min)
5
10
15
20
/ 0,2 mL
5x
y = 0.011x - 0.025
R² = 0.6914
2
70
5
10
Conversão para unidades
15
20
0
5
10
15
20
sem diluir: os valores são altos e estáveis. Reação atingiu equilíbrio
com o substrato sendo consumido. Alternativamente o limite
de leitura foi atingido. Não é possível calcular velocidade
inicial
10000x Há quantidade muito pequena de enzima no ensaio.
As leituras são muito pequenas e o cálculo de
velocidade inicial não é possível.
c) A substituição não é viável, pois além de interromper a reação catalisada
pela enzima através de desnaturação deste catalisador, a função do tampão
carbonato-bicarbonato também é favorecer a conversão de p-nitrofenol em
p-nitrofenolato, produto que absorve em 420 nm. Esta desprotonação não
ocorrerá em pH ácido. Logo, o tampão carbonato-bicarbonato facilita a
detecção do produto por espectrofotometria.
d) As nomenclaturas alfa e beta referem-se a configuração do carbono
anomérico (C1), ou seja, do carbono que participa da ligação glicosídica. A
geometria (forma) destes dois tipos de ligação é totalmente distinta (Lembrar
do amido e da celulose). Logo, um substrato tipo beta não se ligará ao sítio
ativo de uma alfa-glicosidase.
e) O experimento visa medir atividade enzimática através da velocidade da
reação. Logo, é preciso medir a formação de produtos. Contudo, o reagente
de Bradford não detecta a formação dos produtos desta reação. Portanto, a
substituição não é viável.












