Departamento de Física - ICE/UFJF
Laboratório de Física II
Prática 10: Calor Específico
1. Introdução:
Quando dois corpos com temperaturas diferentes entram em contato (direto ou não) este sistema tende a
chegar ao equilíbrio, através de um fluxo de calor. A noção de calor é também útil em outras situações na
descrição de fenômenos térmicos. Como o calor é uma forma de transferência da energia, ele pode ser medido
em unidades de energia como o joule. Entretanto, historicamente, foi adotado uma unidade independente de
quantidade de calor, a caloria, cujo uso persiste até hoje. A caloria é definida atualmente como a quantidade
de calor necessária para elevar de 14,5oC a 15,5oC a temperatura de 1g de água. Para outros tipos de
substâncias as quantidades de calor podem ser diferentes. A quantidade de calor necessária para elevar de um
grau a temperatura de 1g de uma substância qualquer, chama-se calor específico c. A unidade para c é
cal/goC. Pela definição de caloria, o calor específico da água entre 14,5oC e 15,5 oC é c= 1 cal/g oC. O calor
específico varia geralmente com a temperatura. Por exemplo, no intervalo entre 0oC e 1oC, o calor específico
da água é 1,008 cal/g oC; na prática, podemos desprezar tal variação.
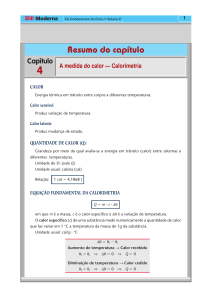
Se tivermos m gramas de uma substância pura de calor específico c, a quantidade de calor ∆Q
necessária para elevar sua temperatura de ∆T é
∆Q = mc ∆T = C ∆T
onde C = mc chama-se capacidade térmica da amostra considerada, cuja unidade é cal/oC.
A capacidade térmica de um sistema formado de m1 gramas de uma substância de calor específico
c1, m2 de calor específico c2, etc...., é:
C = m1c1 + m2c2 + ...
Suponhamos que uma amostra A de uma massa mA de uma substância de calor específico cA,
aquecida a uma temperatura TA, é mergulhada dentro de uma massa m de água, de calor específico c, contida
num recipiente de paredes adiabáticas e de capacidade térmica C. A água e o recipiente estão inicialmente à
temperatura Ti < TA. Após estabelecer-se o equilíbrio térmico, o sistema atinge a temperatura Tf, medida pelo
termômetro. Como as paredes adiabáticas não permitem trocas de calor com o exterior, a quantidade de calor
∆Q = ma ca (TA- Tf) perdida pela amostra é inteiramente cedida à água [mc (Tf-Ti)] e ao recipiente [C(Tf Ti)], ou seja:
mA cA (TA - Tf) = (mc + C) (Tf - Ti)
(1)
Observações:
i) A fórmula (1) permite achar ao calor específico cA , caso a capacidade térmica C, o calor específico c e
as massas sejam conhecidas.
ii) A fórmula (1) também permite achar capacidade térmica C quando os calores específicos cA c e as
massas são conhecidas. Esta tarefa torna-se mais simples quando cA = c.
iii) Caso cA = c, sabendo-se a capacidade térmica C, a fórmula (1) permite achar o calor específico c.
No procedimento experimental a seguir, realizaremos todas possibilidades i) – iii) para medir a
capacidade térmica de uma garrafa térmica e para achar os calores específicos de um metal.
27
2- Procedimento Experimental
Materiais:
garrafa térmica
termômetro
balança
manta de aquecimento
amostras de sólidos
água
I - Determinação da capacidade calorífica C da garrafa térmica.
1- Coloque na garrafa térmica uma certa massa mo de água a uma temperatura To abaixo da temperatura
ambiente e deixa-se o sistema entrar em equilíbrio.
2 - Aqueça outra quantidade de água m1 à temperatura T1 acima da temperatura ambiente.
3 - Introduza rapidamente esta massa m1 de água no calorímetro e lê-se a temperatura T máxima que o
conjunto atinge.
4 - Repita a experiência 6 vezes e calcule C, realizando o tratamento estatístico.
II - Calor específico de sólidos
1 - Coloque na garrafa térmica uma massa de água mo à temperatura To.
2 - Aqueça separadamente o corpo cujo valor específico se quer determinar: Considere a temperatura T1 da
água onde o corpo está imerso, como a temperatura do mesmo.
3 - Introduza rapidamente o corpo no calorímetro. A temperatura do conjunto se uniformiza até que o
termômetro atinja o máximo. Faça então a leitura desta temperatura T ; (To<T<T1)
4 - Repita a experiência pelo menos 3 vezes; calcule o calor específico c.
Referências:
Curso de Física Básica - vol. 2, H. Moysés Nussenzveig ; Fundamentos de Física - vol. 2, Halliday-Resnick;
Notas de Laboratório de Física Básica - Instituto de Física da USP
28