FÍSICA - PROJETO REVISÃO 2015
MW
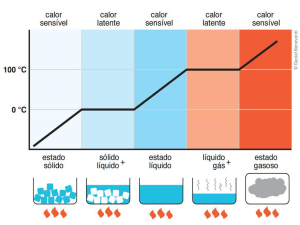
TROCA DE CALOR
SENSÍVEL
PROFESSOR JOSÉ LUIZ
Calorímetro
Recipiente termicamente isolado
que evita troca de calor entre o
seu conteúdo e o meio externo.
Em princípio, um calorímetro
ideal não deveria trocar calor
com os corpos de seu interior,
mas na prática isso ocorre.
Portanto, em alguns casos,
vamos considerar a capacidade
térmica do calorímetro no
equacionamento da troca de
calor.
Imagem: Akshat Goel / Creative Commons
Attribution-Share Alike 3.0 Unported
Calorímetro
A garrafa térmica é um tipo de
calorímetro.
Com a finalidade de isolar termicamente o
conteúdo de uma garrafa térmica do meio
ambiente, adotam-se os seguintes
procedimentos:
• As paredes internas são feitas de vidro,
que, por ser mau condutor, atenua a
troca de calor por condução;
• as paredes internas são duplas,
separadas por uma região de vácuo, cuja
função é evitar a condução do calor que
passa pelas paredes de vidro.
Imagem: Henna / Creative
Commons Attribution-Share Alike
1.0 Generic
Calorímetro
•
O vidro de que são feitas as paredes internas
da garrafa é espelhado, para que o calor
radiante seja refletido, atenuando assim as
trocas por irradiação.
•
Para evitar as possíveis trocas de calor por
convecção, basta fechar a garrafa, pois dessa
forma as massas fluidas internas não
conseguem sair do sistema.
•
É evidente que não existe o isolamento
térmico perfeito; assim, apesar dos cuidados
citados, após um tempo relativamente grande
(várias horas), o conteúdo da garrafa térmica
acaba atingindo o equilíbrio térmico com o
meio ambiente.
Imagem: Henna / Creative Commons
Attribution-Share Alike 1.0 Generic
A garrafa térmica é um tipo de
calorímetro.
Trocas de calor - ∑Q = 0
Aparelho
utilizado em
laboratório com
o objetivo de
realizar
experiências
envolvendo
trocas de calor
entre corpos ou
substâncias,
evitando a perda
de calor.
Trocas de calor
Num sistema de vários corpos, termicamente isolados do meio
externo, a soma das quantidades de calor por eles trocados é
igual a zero.
Para um sistema de n corpos, escrevemos:
No caso de o sistema não estar termicamente isolado ou de o
calorímetro não ser ideal, devemos levar em conta a troca de
calor dos corpos com o ambiente.
Vamos
Exercitar?
Trocas de calor
Um recipiente termicamente isolado contém 500g de
água na qual se mergulha uma barra metálica
homogênea de 250g. A temperatura inicial da água é
25,0°C e a da barra 80,0°C. Considerando o calor
específico da água igual a 1,00 cal/g.°C, o do metal
igual a
0,056 cal/g.°C e desprezando a
capacidade térmica do recipiente, determine a
temperatura do equilíbrio térmico.
Exercício 01
Massas iguais de cinco líquidos distintos, cujos calores
específicos estão dados na tabela adiante, encontram-se
armazenadas, separadamente e à mesma temperatura, dentro
de cinco recipientes com boa isolação e capacidade térmica
desprezível. Se cada líquido receber a mesma quantidade de
calor, suficiente apenas para aquecê-lo, mas sem alcançar
seu ponto de ebulição, aquele que apresentará temperatura
mais alta, após o aquecimento, será:
a) a água.
b) o petróleo.
c) a glicerina.
d) o leite.
e) o mercúrio.
Tabela
Líquido
Água
Petróleo
Glicerina
Leite
Mercúrio
Calor Específico
(J/9°C)
4,19
2,09
2,43
3,93
0,14
Resolução
Resposta:
e) o mercúrio: c = 0,14 J/g.ºC
Pela equação geral da calorimetria (Qs = m.c.∆T),
percebemos que a variação de temperatura é inversamente
proporcional ao calor específico da substância. Ou seja, vai
sofrer MAIOR VARIAÇÃO DE TEMPERATURA aquela
substância que apresentar MENOR CALOR ESPECÍFICO.
Resposta: e)
Exercício 02
Um bloco de massa 2,0 kg, ao receber toda energia
térmica liberada por 1000 g de água que diminuem
a sua temperatura de 1°C, sofre um acréscimo de
temperatura de 10°C. O calor específico do bloco,
em cal/g.°C, é: (Adote: cágua: 1,0 cal/g.°C)
a) 0,2
b) 0,1
c) 0,15
d) 0,05
e) 0,01
Resolução
Sabemos que:
Substituindo os valores,
obtemos:
Como todo calor liberado
pela
água
vai
ser
aproveitado para aquecer o
bloco, temos que:
Resposta: d)
Exercício 03
Um frasco contém 20 g de água a 0°C. Em seu
interior é colocado um objeto de 50 g de alumínio
a 80°C. Os calores específicos da água e do
alumínio são respectivamente 1,0 cal/g°C e 0,10
cal/g°C.
Supondo não haver troca de calor com o frasco e
com o meio ambiente, a temperatura de equilíbrio
dessa mistura será:
a) 60°C
b) 16°C
c) 40°C
d) 32°C
e) 10°C
Resolução
Substituindo os valores, obtemos:
Sabemos
que:
Como não vai haver troca de
calor com o meio externo,
temos que:
Resposta: b)
Exercício 04
Quando dois corpos de tamanhos diferentes estão em contato
e em equilíbrio térmico, e ambos isolados do meio ambiente,
pode-se dizer que:
a) o corpo maior é o mais quente.
b) o corpo menor é o mais quente.
c) não há troca de calor entre os corpos.
d) o corpo maior cede calor para o corpo menor.
e) o corpo menor cede calor para o corpo maior.
Resolução
Como os corpos estão em equilíbrio térmico, não vai existir
calor, visto que CALOR É A ENERGIA TÉRMICA EM
TRÂNSITO devido a diferenças de temperatura entre os
corpos.
Resposta: c)
Exercício 05
É preciso abaixar de 3°C a
temperatura da água da bacia,
para que o nosso amigo possa
tomar banho
confortavelmente. Para que
isso aconteça, quanto calor
deve ser retirado da água?
O caldeirão contém 10 kg de
água e o calor específico da
água é 1 cal/g°C.
Imagem: Richfife / Domínio Público
a) 20 kcal
b) 10 kcal
c) 50 kcal
d) 30 kcal
e) Precisa-se da temperatura inicial da água para determinar
a resposta.
Resolução
Sabemos que:
Da equação geral da calorimetria, temos
Substituindo os valores, obtemos:
O sinal negativo indica que o
calor foi retirado da água.
Resposta: d)
BOM ESTUDO!