Clapeyron
CALOR é uma forma de energia em transito
de um ponto a outro do espaço.
TRANSFERÊNCIA DE CALOR
CONDUÇÃO
CONVECÇÃO
RADIAÇÃO
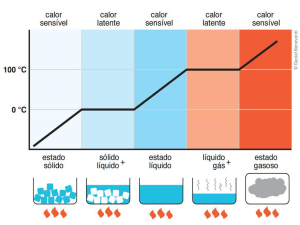
Alterar a temperatura
Alterar a temperatura
Alterar o estado físico
Alterar a temperatura
Calor
SENSÍVEL: Altera a
temperatura do corpo
LATENTE: NÃO altera a
temperatura do corpo
Quantidade de Calor (Q)
É a medida da energia
térmica transferida de um
corpo para outro.
•Usualmente medida em CALORIAS
•No SI é medida em Joules
1 cal = 4,18 J
A variação na temperatura de um
corpo depende de:
• Quantidade de calor recebida (Q);
• Do material que constitui o corpo (c);
• Massa do corpo (m);
Q
T
m
Quantidade de Calor (Q)
trocada entre dois ou mais corpos
Q = m.c.T
Onde
Q é a quantidade de calor recebido (Q>0) ou cedido (Q<0);
m é a massa do material;
T é a variação de temperatura;
c é o CALOR ESPECÍFICO DA SUBSTÂNCIA.
Num determinado estado físico
Quantidade de Calor (Q)
Q = m.c.T
Que macete!
Unidade do calor específico
Q = m.c.T
como
Q
c
,
m.T
cal J
ou, então
no SI [c][c]
g.Kg
C .K
substância em cal/g oC substância
em cal/g oC
água
1,00
gelo
0,50
alumínio
0,22
latão
0,094
areia
0,20
mercúrio
0,033
cobre
0,093
ouro
0,032
chumbo
0,031
prata
0,056
estanho
0,055
vapor de água
0,48
ferro
0,11
vidro
0,20
éter
0,56
álcool
0,58
acetona
0,52
concreto
0,20
etanol
0,59
metanol
0,61
silício
0,17
titânio
0,054
POTÊNCIA Térmica
Potência térmica (pot) ou Fluxo de
calor () é a medida da velocidade
com a qual o calor se propaga
Q
pot t
Para um objeto...
MAIÚSCULO
Capacidade Térmica (C)
Q = m.c.T
c é o calor específico característico do
material (elemento ou substância).
Q
C
m.c
T
C
Q
T
cal
C
o
Sistema Térmicamente Isolado
Sistema Térmicamente Isolado
Para isolar o sistema utiliza-se um
CALORÍMETRO
Calorímetro é um aparelho utilizado em
laboratório com o objetivo de minimizar
as trocas de calor com o meio externo.
Q
C
m.c
T
Cobertura
METÁLICA
Dizemos que o
calorímetro
ideal é aquele
que tem
CAPACIDADE
TÉRMICA
desprezível
(próxima a
zero!)
Sistema Térmicamente Isolado
Energia Térmica se conserva
Q = 0
Q1 + Q2 + ... + Qn = 0
Ex.
Num calorímetro ideal misturam-se
200g de água a 0oC com 250g de um
determinado líquido a 40oC, obtendose o equilíbrio a 20oC. Qual o calor
específico do líquido, em cal/g.oC?