Professor:
CPMG – MAJOR OSCAR ALVELOS
Me. Diego Rodrigues – Química Geral
Aluno(a):
Data:
/
/
ESPECÍFICAS CMPG-MOA 2017
LISTA 1 DE QUÍMICA
Ementa do Curso Química Geral
1 – Introdução a Química.
2 – Propriedades da matéria.
3 – Substâncias e misturas.
4 – Separação de misturas.
5 – Modelos atômicos.
6 – Distribuição eletrônica e aspectos quânticos.
7 – Radioatividade.
8 – Tabela periódica e propriedades periódicas.
9 – Ligações Iônicas e ligações metálicas.
10 – Ligações covalentes (hibridizações, polaridade, solubilidade,
geometria, ressonância, alotropia e forças intermoleculares).
11 – Reações químicas (balanceamento e oxirredução).
12 – Funções inorgânicas.
13 – Grandezas químicas.
14 – Leis ponderais.
15 – Cálculos estequiométricos.
16 – Gases.
Linguagem Química
1. Água no interior da Bahia está contaminada com urânio.
“Em meio à secura do sertão, moradores têm de escolher entre passar
sede ou arriscar a saúde. Ao todo, 22 pontos de abastecimento
foram examinados por técnicos do governo da Bahia. Os
resultados comprovaram que oito deles estão contaminados,
inclusive um poço de uma comunidade rural. O nível de radiação
encontrado na água foi sete vezes maior que o tolerado pela
Organização Mundial de Saúde.As fontes contaminadas ficam
perto da mina de urânio explorada pela empresa estatal Indústrias
Nucleares do Brasil (INB).”
tabela abaixo, relativos a propriedades específicas de amostras de
alguns materiais.
Considerando os dados da tabela, analise as afirmações seguintes.
I. À temperatura de 25°C os materiais C e D estão no estado líquido.
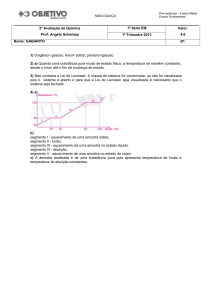
II. Massa e volume são propriedades específicas de cada material.
III. Se o material B for insolúvel em D, quando for adicionado a um
recipiente que contenha o material D ele deverá afundar.
IV. Se o material A for insolúvel em D, quando for adicionado a um
recipiente que contenha o material D ele deverá flutuar.
V. À temperatura de 20°C, a densidade do material C é igual a 0,74
g/mL.
Das afirmações acima, são corretas, apenas:
a) I, III e V.
b) II, III e IV.
c) III, IV e V.
d) I e V.
e) I, III e IV.
5.
Pentano
Fenol
Clorofórmio
Cloro
Escreva o símbolo do elemento químico responsável pela contaminação
da água no sudoeste da Bahia e discuta como essa contaminação
poderia ser evitada.
2.
(FGV) Assinale a alternativa que preenche corretamente as
lacunas.
“Sendo C4H8O a fórmula molecular da butanona, pode se afirmar que há
treze ....................... em cada ............................da referida
substância.”
a) átomos – molécula
b) moléculas - átomo
c) íons – molécula
d) moléculas – íon
e) átomos – íon
Dada a seguinte tabela:
Ponto de
fusão
(ºC)
-130
43
-63
-101
Ponto de
ebulição (ºC)
36,1
182
61
-34,5
De cima para baixo, os estados físicos dos compostos,a uma
temperatura de 25ºC são, respectivamente:
a)
b)
c)
d)
e)
líquido, sólido, líquido, gás
sólido, sólido, gás, gás
líquido, líquido, sólido, gás
sólido, sólido, gás, líquido
líquido, líquido, líquido, gás
6.
A tabela abaixo apresenta os valores de algumas propriedades
físicas de 3 substâncias:
Propriedades da matéria
3.
Gálio e rubídio são dois metais visualmente parecidos, que
apresentam as seguintes propriedades físicas:
Considerando esses dados, responda:
a) Qual o estado físico dos dois metais num dia com temperatura de 25
ºC?
b) Qual o estado físico dos dois metais num deserto, onde a
temperatura chega a 45 ºC?
c) Como você identificaria os metais, sem dispor de nenhum
equipamento, num dia com temperatura de 25 ºC?
4.
Na Química, para se caracterizar um determinado material são
utilizadas, dentre outras, quatro constantes físicas: ponto de fusão,
ponto de ebulição, densidade e solubilidade que constituem um
“quarteto fantástico”. Em um laboratório, foram obtidos os dados da
Analisando-se os dados contidos na tabela, é correto afirmar-se que
a) a acetona evapora mais dificilmente que o álcool.
b) as 3 substâncias encontram-se no estado líquido a 60 ºC.
c) a pressão normal 1kg de água entraria em ebulição com maior
dificuldade que 1kg de álcool.
d) a densidade é a propriedade mais adequada, para distinguir o álcool
da acetona.
e) a naftalina, a temperatura ambiente, ficaria boiando na superfície da
água.
7.
Para a Ciência, matéria é tudo aquilo que tem massa e ocupa lugar
no espaço. A matéria é possuidora de uma série de propriedades,
______________________________________________________________________________________________________________
Rua 2011, Unidade 201, Parque Atheneu, Goiânia – GO
Fone: (62) 3273-6524
E-mail: [email protected]
que, em conjunto, servem para identificá-la. Analise o seguinte
experimento: determinação do ponto de fusão de uma substância
X; observação de um valor abaixo do tabelado para essa
substância. Isso pode significar que
a) a porção de substância utilizada na determinação foi menor que o
necessário.
b) a porção de substância utilizada na determinação foi maior que o
necessário.
c) uma fração da substância não pode ser fundida.
d) a substância é possuidora de impurezas.
e) a substância possui um grau 100% puro.
8.
(ENEM) Pelas normas vigentes, o litro do álcool hidratado que
abastece os veículos deve ser constituído de 96% de álcool puro e
4% de água (em volume). As densidades desses componentes são
dadas na tabela.
11. (FUVEST) Dois copos, A e B, contendo respectivamente 100 mL e
200 mL de água destilada, são aquecidos uniformemente com a
mesma fonte de calor.
Sendo tA e tB os tempos gastos para se iniciar a ebulição nos copos A e
B; TEA e TEB as temperaturas de ebulição nos copos A e B,
podemos afirmar:
a) tA = tB; TEA = TEB
b) tA<tB; TEA < TEB
c) tA>tB; TEA > TEB
d) tA>tB; TEA = TEB
e) tA<tB; TEA = TEB
Fenômenos Químicos e Físicos
Um técnico de um órgão de defesa do consumidor inspecionou cinco
postos suspeitos de venderem álcool hidratado fora das normas.
Colheu uma amostra do produto em cada posto, mediu a
densidade de cada uma, obtendo:
12. Para ser uma potência mundial uma nação deve possuir
tecnologia, ou seja, esta nação deve estar à frente das outras em
várias áreas do conhecimento. Uma área de conhecimento muito
importante é a das ciências. Quando transformamos matérias, ou
seja, quando reagimos materiais diferentes para obtermos outras
substâncias estamos observando um tipo de fenômeno.
Esse fenômeno recebe o nome de:
a) Fenômeno químico
b) Fenômeno físico
c) Fenômeno meteorológico
d) Fenômeno biológico
A partir desses dados, o técnico pôde concluir que estavam com o
combustível adequado somente os postos:
a) I e II.
d) III e V.
9.
b) I e III.
e) IV e V.
c) II e IV.
(ENEM) O controle de qualidade é uma exigência da sociedade
moderna na qual os bens de consumo são produzidos em escala
industrial. Nesse controle de qualidade são determinados
parâmetros que permitem checar a qualidade de cada produto. O
álcool combustível é um produto de amplo consumo muito
adulterado, pois recebe a adição de outros materiais para aumentar
a margem de lucro de quem comercializa. De acordo com Agência
Nacional de Petróleo (ANP), o álcool combustível deve ter
densidade entre 0,805 g/cm3 e 0,811 g/cm3. Em algumas bombas
de combustíveis a densidade do álcool pode ser verificada por
meio de um densímetro similar ao desenhado abaixo, que consiste
em duas bolas com valores de densidade diferentes e verifica
quando o álcool está fora da faixa permitida. Na imagem, são
apresentadas situações distintas para três amostras de álcool
combustível. A respeito das amostras ou densímetro, pode-se
afirmar que:
a) A densidade da bola escura deve ser igual a 0,811 g/cm3.
b) A amostra 1 possui densidade menor do que a permitida.
c) A bola clara tem densidade igual à densidade da bola escura.
d) A amostra que está dentro do padrão estabelecido é a de número 2.
e) O sistema poderia ser feito com uma única bola de densidade entre
0,805 g/cm3 e 0,811 g/cm3.
10. Observe os fatos abaixo:
I) Uma pedra de naftalina deixada no armário.
II) Uma vasilha com água deixada no freezer.
III) Uma vasilha com água deixada no sol.
IV) O derretimento de um pedaço de chumbo quando aquecido.
Nesses fatos estão relacionados corretamente os seguintes fenômenos:
a) I. Sublimação; II. Solidificação; III. Evaporação; IV. Fusão.
b) I. Sublimação; II. Sublimação; III. Evaporação; IV. Solidificação.
c) I. Fusão; II. Sublimação; III. Evaporação; IV. Solidificação.
d) I. Evaporação; II. Solidificação; III. Fusão; IV. Sublimação.
e) I. Evaporação; II. Sublimação; III. Fusão; IV. Solidificação.
13. Uma possível definição de lixo é que são os restos das atividades
humanas, consideradas por aqueles que o produzem (geradores)
como inúteis, indesejáveis ou descartáveis. O Brasil produz
atualmente mais de 100 mil toneladas de lixo por dia e a maioria
desse material fica em grandes depósitos denominados lixões,
amontoados a céu aberto. O lixo, com o passar do tempo, sofre
uma série de transformações. Durante o processo de
transformação do lixo, ou de qualquer material, verificamos que
algumas características tais como cheiro, cor e aparênciapodem
mudar. Ou seja, o conjunto final de características do material
depois da transformação será diferente do conjunto inicial. Um
bom exemplo desse processo é a degradação de alimentos. Não
há dúvida de que as características de um alimento mudam depois
que ele se estraga.
O texto acima refere-se a um (a):
a) Fenômeno físico.
b) Fenômeno químico.
c) Sublimação.
d) Condensação.
14. Os alimentos são misturas químicas (mas o que não é uma mistura
química no nosso ambiente?) e as qualidades que buscamos
modificar pelo cozimento são manifestações das propriedades
químicas dessas misturas; quando compostos aromáticos se
formam na superfície de um assado é o resultado de uma reação
química, quando os cogumelos escurecem após terem sido
cortados é o fruto de uma reação química (enzimática); quando o
arroz integral amolece no cozimento é ainda uma reação química.
(Trecho do livro Um cientista na cozinha)
De acordo com a análise do texto, podemos concluir que se trata:
a) Fenômeno físico.
b) Fenômeno biológico.
c) Fenômeno químico.
d) Processo de separação.
15. Considere os fatos representados a seguir.
I. Um pedaço de isopor flutuando na água.
II. O açúcar se tornando caramelo quando aquecido acima do seu ponto
de fusão.
III. O ferro dissolvendo em ácido clorídrico com liberação de gás.
IV. Um sal se dissolvendo quando colocado em um copo com água
quente.
V. Um prego sendo atraído por um ímã.
São fenômenos químicos:
a) 3 e 4
b) 1, 3 e 5
c) 2 e 3
d) 2 e 4
______________________________________________________________________________________________________________
Rua 2011, Unidade 201, Parque Atheneu, Goiânia – GO
Fone: (62) 3273-6524
E-mail: [email protected]
16. (Fuvest SP) Considere os processos de obtenção de:
I. chumbo a partir da galena;
II. sal de cozinha a partir da água do mar;
III. querosene a partir do petróleo;
IV. álcool a partir do açúcar de cana.
São exemplos de transformações químicas os processos:
a) I e II.
c) II e III.
e) I, II e III.
b) I e IV.
d) II e IV.
17. (UFPB) Quando a matéria sofre uma transformação qualquer, dizse que ela sofreu um fenômeno, que pode ser físico ou químico.
Nesse sentido, considere as seguintes transformações:
- derretimento das geleiras;
- degradação dos alimentos no organismo;
- ação de um medicamento no organismo;
- produção de energia solar.
Com relação a essas transformações, é correto afirmar:
a) Todas são fenômenos químicos.
b) Todas são fenômenos físicos.
c) O derretimento das geleiras e a degradação dos alimentos no
organismo são fenômenos químicos.
d) A ação de um medicamento no organismo e a produção de energia
solar são fenômenos físicos.
e) O derretimento das geleiras e a produção de energia solar são
fenômenos físicos.
18. (PUC MG) Considere os experimentos equacionados:
I. água
II. gelo
III. papel
gás hidrogênio + gás oxigênio
água líquida
gás carbônico + água
IV. iodo(s)
V. vinho
Iodo(g)
vinagre
VI. barra de ferro
ferrugem
Assinale os experimentos que representam fenômenos químicos.
a) I, II, III e IV.
c) II, III, V e VI.
b) I, III, V e VI.
d) I, IV, V e VI.
19. (EFEI SP) Considere um churrasco de fim de semana, numa turma
de amigos e amigas, na beira de uma piscina. Dois entusiasmados
convidados estão conversando sobre:
I. A melhor técnica para operar a chopeira, de modo a encher um copo
de vidro com chope e formar uma boa camada de espuma
(colarinho).
II. O gelo derretendo em um copo de uísque “onthe rocks”, já
devidamente esvaziado.
III. A melhor maneira de acender o carvão na churrasqueira.
IV. O “ponto ideal” para assar a picanha.
Dos assuntos gastronômicos acima, pode-se afirmar que são exemplos
de reações químicas:
a) I e II.
c) III e IV.
b) II e III.
d) I e IV.
20. (UMG) As seguintes mudanças de cor são evidências de reações
químicas em todos os casos, exceto:
a) o bombril úmido passa, com o tempo, de acinzentado para
avermelhado.
b) o filamento de uma lâmpada acesa passa de cinza para amarelo
esbranquiçado.
c) uma fotografia colorida exposta ao sol se desbota.
d) água sanitária descora uma calça jeans.
e) uma banana cortada escurece com o passar do tempo
21. (UFG GO) A região Centro-Oeste é caracterizada por apresentar
um período de estiagem que vai de abril a setembro. Nessa época,
a umidade relativa do ar é bastante baixa, e as perdas de água por
evaporação são bastante elevadas.
Sobre evaporação, é correto afirmar-se que:
a) no período de abril a setembro, o ponto de ebulição da água diminui
constantemente;
b) durante a evaporação, as ligações químicas entre o Hidrogênio e o
Oxigênio da molécula de água são rompidas;
c) o processo de evaporação da água é um tipo de reação química, que
tem sua velocidade aumentada pela baixa umidade relativa do ar;
d) a evaporação da água é uma passagem do estado líquido para o
estado gasoso e, portanto, só ocorre a 100 oC, que é o seu ponto
de ebulição;
e) considerando-se dois hidrocarbonetos lineares, a uma mesma
temperatura, evaporará primeiro o de menor massa molar.
22. (PUCCamp-SP) Considere a seguinte receita caseira para o
preparo de um bolo de fubá:
I. Misture bem 3 ovos, 2 xícaras de açúcar, 1 1/2 xícara de fubá, 1
xícara de leite, 6 colheres (das de sopa) de óleo, 1 colher (das de
sopa) de fermento químico e bata bem até ficar uma massa
uniforme.
II. Acrescente erva-doce a gosto e despeje na assadeira previamente
untada.
III. Leve ao forno pré-aquecido até que o bolo esteja assado e corado.
Há ocorrência de transformação química em
a) I, somente.
b) II, somente.
c) III, somente.
d) I e III, somente.
e) I, II e III.
23. (UNESP SP) - A elevação da temperatura de um sistema produz,
geralmente, alterações que podem ser interpretadas como sendo
devidas a processos físicos ou químicos. Medicamentos, em
especial na forma de soluções, devem ser mantidos em recipientes
fechados e protegidos do calor para que se evite:
I. a evaporação de um ou mais de seus componentes;
II. a decomposição e conseqüente diminuição da quantidade do
composto que constitui o princípio ativo;
III. a formação de compostos indesejáveis ou potencialmente
prejudiciais à saúde.
A cada um desses processos – I, II e III – corresponde um tipo de
transformação classificada, respectivamente, como:
a) física, física e química.
b) física, química e química.
c) química, física e física.
d) química, física e química.
e) química, química e física.
24. (PUCPR–2010) Os fenômenos a seguir são exemplos de
fenômenos químicos.
I. O vinho, que é transformado em vinagre pela ação da bactéria
Acetobacteracetil. O leite, que é transformado em coalhada pela a
ação
dos
micro-organismos
Lactobacillusbulgaricus
eStreptococcusthemophilus.
II. A planta captura CO2 da atmosfera e o transforma em seiva, liberando
O2.
III. O processo de digestão dos alimentos.
IV. O ímã atrai a limalha de ferro sob a ação magnética.
V. É possível transformar o metal cobre em fios e em lâminas.
A) Apenas as assertivas I e II estão corretas.
B) Apenas a assertiva I está correta.
C) Todas as assertivas estão corretas.
D) Apenas a assertiva II está correta.
E) Apenas as assertivas I, II e III estão corretas.
Substâncias e misturas
25. (SUPL-SP) Qual a afirmação verdadeira?
a) uma substância pura é sempre simples.
b) uma substância composta é sempre impura.
c) uma substância simples pode ser composta.
d) uma substância composta pode ser pura.
26. (UFF-RJ) Assinale a opção que apresenta apenas substâncias
simples:
a) H2, Cl2, N2, CH4
b) MgCl2, H2O, H2O2, CCl4
c) Na2O, NaCl, H2, O2
d) CCl4, H2O, Cl2, HCl
e) H2, Cl2, O2, N2
______________________________________________________________________________________________________________
Rua 2011, Unidade 201, Parque Atheneu, Goiânia – GO
Fone: (62) 3273-6524
E-mail: [email protected]
27. (CESGRANRIO-RJ) Das alternativas abaixo, indique a única onde
são mencionadas apenas substâncias compostas:
36. (Uniube-2001) Os sólidos: bronze (Cu(s)+Sn(s)), cal virgem
(CaO(s)) e diamante (C(s)) são, respectivamente, exemplos de:
A) mistura, substância composta e substância simples.
B) mistura, substância simples e substância composta.
C) substância composta, substância simples e substância composta.
D) mistura, substância simples e substância simples.
a) He, Ne, Ar, Kr, Xe
b) S8, Cl2
c) F2, Cl2, Br2, I2
d) O3, I2
e) H2O, H2S, H2Se
28. A menor quantidade de clorofórmio (CHCl3) onde podem ser
reconhecidas suas propriedades é:
37. Considerando três recipientes distintos que possuem, no seu
interior, exclusivamente, água mineral, etanol e soro fisiológico, é
correto afirmar que os conteúdos são, respectivamente:
a) mistura heterogênea, substância composta e substância simples.
b) mistura homogênea, mistura homogênea e mistura homogênea.
c) substância composta, substância composta e mistura heterogênea.
d) mistura homogênea, substância composta e mistura homogênea.
a) um átomo de clorofórmio
b) um mol de clorofórmio
c) um átomo de carbono
d) uma molécula de clorofórmio
e) uma molécula de cloro
38. (Ufes) Em um sistema, bem misturado, constituído de areia, sal,
açúcar, água e gasolina, o número de fases é:
29. (FUVEST) Ar, gás carbônico, naftaleno, iodo, latão, ouro 18
quilates.Se esses materiais forem classificados em substâncias
puras e misturas, pertencerão ao grupo das substâncias puras:
a) 2
b) 3
c) 4
d) 5
e) 6
39. (Ufes) Observe a representação dos sistemas I, II e III e seus
componentes. O número de fases em cada um é, respectivamente:
a) ar, gás carbônico e latão.
b) iodo, ouro 18 quilates e naftaleno.
c) gás carbônico, latão e iodo.
d) ar, ouro 18 quilates e naftaleno.
e) gás carbônico, iodo e naftaleno.
30. (MACK-SP) O número de substâncias simples com atomicidade
par entre as substâncias de fórmula O3, H2O2, P4, I2, C2H4, CO2 e
He é:
a) 5
b) 4
c) 3
d) 2
e) 1
a) 3, 2 e 4
b) 3, 3 e 4
31. (ITA) Assinale a alternativa ERRADA:
a) Tanto oxigênio gasoso como ozônio gasoso são exemplos de
substâncias simples.
b) Um sistema monofásico tanto pode ser substância pura quanto uma
solução.
c) Existem tanto soluções gasosas, como líquidas, como ainda soluções
sólidas.
d) Substância pura é aquela que não pode ser decomposta em outras
mais simples.
e) No ar atmosférico encontramos substâncias simples e substâncias
compostas.
32. (PUC Minas) Considere as seguintes proposições.
I. Não existe sistema polifásico formado de vários gases ou vapores.
II. A água é uma mistura de hidrogênio e oxigênio.
III. Todo sistema homogêneo é uma mistura homogênea.
IV. Existe sistema monofásico formado por vários sólidos.
V. Todo sistema polifásico é uma mistura heterogênea.
São VERDADEIRAS as afirmações:
A) I, II e III.
C) I e IV, apenas.
B) I e II, apenas.
D) III, IV e V.
33. (U.GAMA FILHO-RJ) Como "critérios de pureza", podemos
assinalar:
a) volume, densidade e brilho.
b) ponto de fusão, tenacidade e cor.
c) ponto de ebulição, oxidação e massa.
d) massa específica, ponto de fusão e ebulição.
e) forma, dureza e ductilidade.
34. (PUC-MG-2001) Uma substância pura é caracteriza por:
c) 2, 2 e 4
d) 3, 2 e 5
e) 3, 3 e 6
40. (UFG-GO) No sistema representado pela figura a seguir, os
números de fases e componentes são, respectivamente:
a) 2 e 2
b) 2 e 3
c) 3 e 2
d) 3 e 3
e) 3 e 4
41. (Vunesp) O rótulo de uma garrafa de água mineral está
reproduzido a seguir.
Com base nessas informações, podemos classificar a água
mineral como:
a) substância pura.
b) substância simples.
c) mistura heterogênea.
d) mistura homogênea.
e) suspensão coloidal.
42. (Fatec-2005) Um estudante construiu, em um mesmo diagrama, as
curvas da temperatura em função do tempo resultantes do
aquecimento, sob pressão normal, de três líquidos em três
béqueres distintos.
a) ser um sistema homogêneo.
b) ter composição e propriedades físicas constantes.
c) ser constituída de átomos de um mesmo elemento.
d) ser constituída de átomos de elementos diferentes.
35. Água e sal de cozinha dissolvido formam uma mistura homogênea
que é sempre um sistema:
a) monofásico
b) tetrafásico
c) bifásico
d) pentafásico
e) trifásico
Com base na análise das curvas de aquecimento, são feitas as
seguintes afirmações: o líquido do béquer 1apresentou uma
temperatura de ebulição constante, igual a 100°C; portanto, esse
líquido é ou uma substância pura ou uma mistura azeotrópica; o
______________________________________________________________________________________________________________
Rua 2011, Unidade 201, Parque Atheneu, Goiânia – GO
Fone: (62) 3273-6524
E-mail: [email protected]
líquido do béquer 2 apresentou uma faixa de temperaturas de
ebulição entre 101°C a 103°C; portanto, esse líquido é uma
mistura; o líquido do béquer 3 apresenta o mesmo soluto e a
mesma concentração que o líquido do béquer 2 .
Está correto o contido em
a)
b)
c)
d)
e)
I apenas.
I e II apenas.
I e III apenas.
II e III apenas.
I, II e III.
43. (Cesgranrio-RJ) Um cientista recebeu uma substância
desconhecida, no estado sólido, para ser analisada. O gráfico
abaixo representa o processo de aquecimento de uma amostra
dessa substância.
Analisando o gráfico, podemos concluir que a amostra apresenta:
(A) duração da ebulição de 10 min.
(B) duração da fusão de 40 min.
(C) ponto de fusão de 40 °C.
(D) ponto de fusão de 70 °C.
(E) ponto de ebulição de 50 °C.
44. (UFPA) Dado o diagrama de aquecimento de um material:
A alternativa correta é:
(A) o diagrama representa o aquecimento de uma substância pura.
(B) a temperatura no tempo zero representa o aquecimento de um
líquido.
(C) 210 °C é a temperatura de fusão do material.
(D) a transformação de X para Y é um fenômeno químico.
(E) 80 °C é a temperatura de fusão do material.
______________________________________________________________________________________________________________
Rua 2011, Unidade 201, Parque Atheneu, Goiânia – GO
Fone: (62) 3273-6524
E-mail: [email protected]