Físico-Química Experimental FQE001
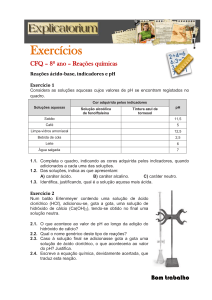
Exp. 04
Tensão Superficial
1. Introdução
A tensão superficial surge nos líquidos como resultado do desequilíbrio entre as forças
intermoleculares (atração de van der Waals) que agem sobre as moléculas da superfície em
relação àquelas que se encontram no interior da solução. As moléculas situadas no interior de
um líquido estão sujeitas a forças de atração em todas as direções. Por outro lado, as
moléculas situadas na superfície de separação líquido – ar estão submetidas a forças de
atração não balanceadas, produzindo uma força resultante para o interior do líquido,
conforme ilustrado na Figura 1. O maior número possível de moléculas se deslocará da
superfície para o interior do líquido, e a superfície tenderá a contrair espontaneamente.
Portanto, todas as superfícies líquidas tendem a reduzir sua superfície limite a um valor
mínimo, adquirindo a forma esférica, que apresenta a condição de volume máximo numa
superfície de área mínima.
Figura 1: Forças de atração atuando sobre as moléculas da interface água / ar e no
interior do líquido.
A tensão superficial () – ou energia livre superficial – de um líquido é definida como a
força resultante da atração entre as moléculas do interior do líquido pelas moléculas na sua
superfície, que atua ortogonalmente na superfície do líquido. É quantificada determinando o
trabalho necessário para aumentar a superfície em uma unidade de área, por um processo
isotérmico reversível. A magnitude desta força, que atua perpendicularmente sobre um ponto
a uma distância longitudinal plano da superfície, é dada por:
(1)
onde l é o comprimento sobre o qual a força F age perpendicularmente. A Tabela 1 mostra
alguns valores de tensão superficial para líquidos puros.
Tabela 1: Tensões superficiais para líquidos a 20 oC.
Líquido
/ 10-3 N.m-1
Água
72,75
Benzeno
28,88
Ácido acético
27,6
Acetona
23,7
CCl4
26,8
Líquido
/ N.m-1
Etanol
22,3
n-Octanol
27,5
n-Hexano
18,4
n-Octano
21,8
Mercúrio
485
Físico-Química Experimental FQE001
Exp. 04
A tensão superficial da maioria dos líquidos diminui com o aumento da temperatura,
de maneira quase linear, e se torna muito pequena nas proximidades da temperatura crítica,
onde as forças coesivas intermoleculares tendem a zero.
1.1 Atividade Superficial
A tensão superficial da água pura a 20 °C em relação ao ar é igual a 72.10 -3 N/m (72,0
dyn/cm). Esse valor é alterado pela presença de solutos na água, que podem apresentar
diferentes efeitos de acordo com a sua natureza química. Por exemplo, os sais inorgânicos têm
a tendência de aumentar a tensão superficial com o aumento da concentração, enquanto que
substâncias conhecidas como surfactantes diminuem a tensão superficial até uma
concentração limite, acima da qual mais nenhuma alteração é observada.
Substâncias como ácidos graxos de cadeias curtas e alcoóis são solúveis tanto em água
como em óleo (parafinas e outros hidrocarbonetos). A cadeia de carbonos da molécula é
responsável pela sua solubilidade em óleo, enquanto que os grupos polares –COOH e –OH
apresentam afinidade pela água suficiente para arrastar cadeias curtas e constituir uma
solução aquosa. Se essas moléculas se localizarem numa superfície de separação óleo – água
ou ar – água, elas se orientam de maneira a manter os grupos hidrofílicos na fase aquosa e as
cadeias carbônicas lipofílicas (ou hidrofóbicas) na fase oleosa ou no vapor (Figura 2). Essa
situação é energeticamente mais favorável que a dissolução completa em qualquer uma das
fases.
Figura 2: Distribuição de moléculas tensoativas nas interfaces ar – água e óleo – água.
A parte circular das moléculas representa a parte polar hidrofílica, e a parte retangular
representa a cadeia carbônica não-polar.
A forte adsorção de materiais desse tipo em superfícies de líquidos ou na superfície de
separação ente dois líquidos imiscíveis, formando camadas monomoleculares orientadas
(monocamadas) é chamada de atividade superficial. Dá-se o nome de agentes tensoativos,
agentes de superfície, surfactantes ou simplesmente tensoativos, às substâncias que,
colocadas em solução, são capazes de modificar as propriedades superficiais do solvente. A
atividade superficial destas substâncias é consequência de sua estrutura química. Todas elas
possuem, em uma mesma molécula, grupos polares e grupos não polares, ou seja, uma parte
hidrofílica e outra hidrofóbica. A porção hidrofóbica é, geralmente, constituída por cadeias
alifáticas ou, menos frequentemente, por heterocíclicos ou sistemas de anéis aromáticos. A
porção hidrofílica pode ser constituída por grupamentos funcionais, cuja estrutura condiciona
a afinidade pela água (carboxilas, hidroxilas, grupamentos sulfúricos, etc.). A tendência de
moléculas tensoativas de se acumularem numa interface favorece uma expansão da interface,
que deve ser equilibrada frente à tendência de se contrair sob a ação de forças normais de
Físico-Química Experimental FQE001
Exp. 04
tensão superficial. Se for a pressão causadora da expansão de uma camada na qual houve
adsorção de uma substância tensoativa, a tensão superficial será diminuída em um valor igual
a:
(2)
A Figura 3 mostra o efeito dos membros inferiores da série homóloga dos alcoóis
saturados de cadeia normal sobre a tensão superficial da água. Quanto maior a cadeia
carbônica, maior a tendência de adsorção das moléculas do álcool na superfície de separação
ar – água, e portanto, menor a tensão superficial.
Figura 3: Tensão superficial de soluções aquosas de alcoóis a 20 oC.
Os tensoativos tendem a migrar até a superfície da solução e originar ali películas
orientadas. Quando a concentração aumenta, certas moléculas tendem a tomar a mesma
orientação que na superfície, formando verdadeiros agregados coloidais, as micelas.
Normalmente o filme superficial formado é bem homogêneo e não aceita mais nenhuma
molécula quando a solução atinge uma determinada concentração, chamada de concentração
micelar crítica (CMC). Se continuarmos a aumentar a concentração, acima dessa concentração
crítica, notaremos que a tensão superficial continuará constante, conforme mostra o gráfico
da Figura 4.
Figura 4: Variação da tensão superficial com a concentração de detergente.
Físico-Química Experimental FQE001
Exp. 04
Em certos casos, como nas soluções de eletrólitos, são notados pequenos aumentos da
tensão superficial, provocados por adsorção negativa. Nessas situações, as forças de atração
soluto / solvente são maiores que as forças de atração solvente / solvente, e as moléculas de
soluto tendem a migrar da superfície para o interior do líquido. Em soluções de eletrólitos, um
íon está cercado por íons de carga oposta, mas na superfície da solução, há íons que não estão
completamente envolvidos por cargas opostas. Isto causa uma força de desbalanceamento
eletrostático que tende a atrair estes íons para o interior da solução, causando uma redução
da concentração do soluto na superfície do líquido em relação ao seio da solução.
2. Objetivos
Medir a tensão superficial de diferentes substâncias utilizando o método da gota, a
partir do valor conhecido de tensão superficial da água.
Medir a influência de eletrólitos presentes numa solução nos valores de tensão
superficial
Observar a variação da tensão superficial em soluções contendo surfactante.
3. Metodologia: Determinação da Tensão Superficial pelo Método da Gota
Adaptado
A tensão superficial é uma propriedade de interface. Desta maneira, ela é medida
fazendo-se um balanceamento entre a força de atração superficial numa linha limítrofe contra
uma força igual que se pode medir. São três os métodos mais utilizados para a determinação
de : o método do arrancamento (onde é medida a força necessária para romper um filme
líquido), o método capilar (onde se mede a ascensão capilar do líquido contra a ação da
gravidade) e o método da gota.
No método da gota geralmente emprega-se uma vidraria especial, o estalagmômetro,
conforme desenho apresentado na Figura 5a, de modo a poder regular através da quantidade
de líquido o tempo de formação da gota. Este método pode ser adaptado com o uso de uma
bureta (Fig. 5b). Deixa-se formar uma gota na extremidade do tubo vertical, cujo raio externo
(2πr) é considerado como linha limítrofe. A gota cai exatamente no momento em que seu peso
gera uma força de atração gravitacional (mg) maior que a força decorrente da tensão
superficial aplicada à linha de contato da mesma com o perímetro do bico do qual ela cai
(2πrγ). Ou seja, neste momento:
(3)
sendo m a massa da gota ideal, g a aceleração da gravidade e r o raio da ponta da bureta.
Figura 5: (a) Estalagmômetro e (b) bureta acoplada ao erlenmeyer, sistema empregado
na determinação da tensão superficial.
Físico-Química Experimental FQE001
Exp. 04
Para o cálculo da tensão superficial do líquido a partir do volume da gota, basta utilizar
a relação entre volume e massa, ou seja, a densidade do líquido ():
(4)
Na prática, o peso da gota obtido é sempre menor que o peso da gota ideal. A razão
disto torna-se evidente, quando o processo de formação da gota é observado mais de perto,
conforme ilustra a Figura 5. Observa-se que somente a porção mais externa da gota é que
alcança a posição de instabilidade e cai. Perto de 40% do líquido que forma a gota permanece
ligado ao tubo. Assim, torna-se ainda necessário acrescentar à equação acima um fator de
correção devido que:
i – a gota não se desprende completamente do tubo; e
ii – as forças de tensão superficial não ocorrem numa única direção.
Desta forma:
(5)
onde f apresenta uma relação não linear que envolve o raio e o volume da gota.
Figura 6: Processo de formação de uma gota até seu desprendimento pela ação da
gravidade.
O raio (r) da circunferência da gota, na Equação 5, será idêntico ao raio interno da
vidraria utilizada, quando esta não tocar a superfície do líquido. Há uma relação linear entre a
massa de uma gota e o raio da extremidade do tubo onde esta se formou, determinada
experimentalmente e apresentada abaixo. A partir desta Equação 6 determina-se o raio (r)
necessário para o cálculo da tensão superficial exclusivamente a partir da massa (m) de uma
gota.
(6)
Conforme já mencionado, somente uma fração da gota se desprende do tubo durante
o experimento, não formando uma circunferência perfeita. À medida que o orifício do tubo
torna-se menor, a fração que se desprende torna-se maior e, a extrapolação para um tubo de
diâmetro zero indica que, nestas condições, a gota se desprenderia integralmente. Harkins e
Brown2 propuseram que o fator de correção (f) na Equação 5 depende da razão
, onde r é
o raio na extremidade do tubo e V o volume de uma gota. Assim, utilizando-se a mesma
bureta, basta medir o volume de 1 gota do líquido que deseja-se medir a tensão superficial
para obter a razão
,. Para esta razão, os valores de f encontram-se tabelados na Tabela 2.
Físico-Química Experimental FQE001
Exp. 04
4. Procedimento Experimental
Materiais
Água destilada
NaCl
Solução de Dodecilsulfato de sódio
(SDS), 50 mmol/L
Vidro de relógio
06 balões volumétricos de 50 mL
Proveta de 50 mL
Bureta de 25 mL ou 50 mL
Balança de precisão
Procedimento
Inicialmente, determina-se o raio da bureta medindo-se a massa de uma gota de água
destilada e aplicando este resultado na relação linear entre o raio e a massa da gota. Para isso,
pesa-se o vidro de relógio vazio, adiciona-se 20 gotas de água destilada através da bureta, e
pesa-se o vidro de relógio novamente. Anote também o volume das 20 gotas na bureta.
Prepare 6 soluções de NaCl nas concentrações entre 2% e 16% (m/V) utilizando os
balões volumétricos e a proveta.
Repita os procedimentos anteriores para determinar as tensões superficiais das
diferentes soluções de NaCl. Comece da solução mais diluída para a mais concentrada.
Adicione água destilada nos volumes indicados na Tabela 1 para cada balão e pese-os
novamente, anotando os valores medidos na Tabela 1.
A partir da solução mais concentrada de SDS (0,050 mol/L), prepare 5 diluições
diferentes nos balões de 50 mL. Meça a tensão superficial da água pura e das soluções diluídas
e da solução inicial utilizando o mesmo método utilizado para as soluções de NaCl.
5. Discussão dos Resultados
Para determinar o raio da bureta é preciso conhecer a massa de uma gota de água
destilada e aplicar este resultado na relação linear entre o raio e a massa da gota (Equação 6).
Para isso, pesa-se o vidro de relógio vazio, adiciona-se aproximadamente 20 gotas de água
destilada utilizando a bureta que se quer medir o raio, e pesa-se o vidro de relógio novamente.
Utiliza-se o da massa de gotas pesadas na balança para calcular a massa média de 1 gota.
Observe na bureta o volume das gotas de água pesadas e utilize o volume médio de 1 gota
para calcular a relação
. Em seguida, utilize os valores da Tabela 2 para determinar f.
Use a Equação 5 para calcular a tensão superficial da água destilada e compare com o valor da
literatura: 72,75.10-3 N.m-1 ou 72,75 dyn.cm-1, a 20 oC.
Tabela 2: Valores experimentais de correção do peso da gota
Físico-Química Experimental FQE001
Exp. 04
Utilize sempre a mesma bureta para não precisar recalcular r nos demais
experimentos.
Para cada solução salina ou de detergente, determine a massa e o volume médio de
uma gota (utilize no mínimo 20 gotas, deixando-as se formar lentamente na bureta), o fator de
correção f, e a tensão superficial .
Represente graficamente os valores de tensão superficial pela concentração através de
gráficos de vs. c e vs. ln c, onde c é a concentração em % de massa. Observe como a tensão
superficial varia para soluções salinas e para soluções de detergentes.
___________________________
1. J.L.Behring, M.Lucas, C.Machado, I.O.Barcellos; Quim. Nova, v. 27, 492, 2004.
2. W.D.Harkins, F.E.Brown; J. Am. Chem. Soc., v.41, 499, 1919.
Físico-Química Experimental FQE001
Exp. 04
Volume Parcial Molar
Resultados Experimentais
Nomes:
1. Cálculo da tensão superficial da água destilada
Massa do vidro de relógio vazio / g
no. de gotas adicionadas
Massa do vidro de relógio + água / g
Massa total de água / g
Massa de 1 gota de água / g
Raio da bureta (r) / cm
Volume gasto na bureta / mL
Volume de 1 gota / mL (cm3)
Razão
Fator de correção (f)
Tensão superficial da água () / dyn.cm-1
Observações:
Físico-Química Experimental FQE001
Exp. 04
2. Tensão superficial de soluções salinas.
Tabela 1: Valores de massa e volume de gotas de diferentes soluções de NaCl para a
determinação da tensão superficial.
Concentração de NaCl / %
m/g
___ gotas 1 gota
V / mL
___ gotas 1 gota
f
/ dyn.cm
-1
Figura 1: Variação da tensão superficial de soluções salinas com a concentração de
NaCl.
Observações:
Físico-Química Experimental FQE001
Exp. 04
3. Tensão superficial de soluções de surfactante.
Tabela 2: Valores de massa e volume de gotas de diferentes soluções de surfactante
para a determinação da tensão superficial.
Concentração / mol.L
-1
m/g
___ gotas 1 gota
V / mL
___ gotas 1 gota
f
/ dyn.cm
-1
Figura 2: Variação da tensão superficial de soluções de detergente com a
concentração.
Observações:
Físico-Química Experimental FQE001
Exp. 04
Utilize esta folha e mais quantas forem necessárias para apresentar os cálculos
efetuados.
Físico-Química Experimental FQE001
Exp. 04
Tensão Superficial
Pré-Laboratório
Nome:
1. Explique o que são tensoativos e procure como eles são classificados.
2. Procure por tesoativos aniônicos, catiônicos e não-iônicos comerciais e indique onde são
utilizados.