ISSN 0103-8559
Volume 26 • Nº 1 • Janeiro/Março 2016
Novos Rumos da Terapia Intensiva em Cardiologia
Estágio C
Estágio D
NYHA IIIb/IV
NYHA IV
% 1 ano de sobrevida
100%
50%
7
NYHA III
6
25%
5
10%
4
0%
3
2
Limitaçâo Intolerância “Frequent Estável com Piora clínica
ao exercício ao exercício
Flyer”
dobutamina progressiva
1
DMOS/
Óbito
TX e DAV
Não Indicados
Bem Estabelecido
Intervenção baseada
em variáveis:
nutrição e disfunção
orgânica progressiva
Elegível em
semanas
ou meses
Elegível em
poucas
semanas
Ponte p/ Decisão
Intervenção
nos próximos
dias
• INDICAÇÕES DE DISPOSITIVOS
MECÂNICOS DE SUPORTE NA
INSUFICIÊNCIA CARDÍACA
REFRATÁRIA
“Crash and
burn”
Benefício de DAV
Não Estabelecido
• ATUALIZAÇÃO NO MANEJO CLÍNICO
DO CHOQUE CARDIOGÊNICO
Intervenção
nas próximas
horas
• TERAPIA DO CONTROLE DA
TEMPERATURA PÓS-PARADA
CARDIORRESPIRATÓRIA
• TERAPIA DIALÍTICA NO PACIENTE
CARDIOPATA
• ABORDAGEM CLÍNICA DA
CONGESTÃO PULMONAR AGUDA
NO CARDIOPATA
• ATUALIZAÇÃO DO DIAGNÓSTICO
E TRATAMENTO DO
TROMBOEMBOLISMO PULMONAR
Editora Chefe: Maria Cristina de Oliveira Izar
www.socesp.org.br
Plenance, agora
com 90 comprimidos:
ficou mais fácil viver
uma vida plena.
s
rimido
comp
1-5
Economia e conveniência
para o paciente: maior
adesão ao tratamento
e garantia dos melhores
benefícios de Plenance.
6-8
Plenance: a potência que só 1-4
o equipamento certo garante.
PLENANCE - rosuvastatina cálcica - 10 mg em embalagens com 10 ou 30 comprimidos revestidos. 20 mg em embalagens com 30 comprimidos revestidos. Uso oral e uso adulto e
pediátrico (acima de 10 anos de idade). Indicações: na hipercolesterolemia para reduzir os níveis de LDL-colesterol, colesterol total e de triglicérides, e aumentar o HDL-colesterol em pacientes
com hipercolesterolemia primária, familiar e na dislipidemia mista. Em crianças e adolescentes (entre 10 e 17 anos de idade), Plenance® está indicado para pacientes com hipercolesterolemia
familiar heterozigótica (HeFH). Contraindicações: contraindicado no caso hipersensibilidade à rosuvastatina, ou a qualquer componente da formulação; insuficiência hepática avançada. Não deve
ser utilizado por pacientes grávidas, que estejam amamentando ou pretendam engravidar mas não utilizem método contraceptivo apropriado. Precauções e Advertências: Pacientes em uso de
ciclosporina devem evitar o uso concomitante de Plenance®. Deve ser utilizado com cuidado na presença de: doença hepática leve a moderada; abuso de álcool; e com os seguintes medicamentos:
varfarina, genfibrozila, inibidores da protease, ácido fusídico e antiácidos. É necessário cautela no uso concomitante de Plenance® com cetoconazol, espironolactona e cimetidina. Deve-se iniciar com
dose menor de rosuvastatina, que deve ser titulada com cuidado. Não exceder 5 mg de Plenance® com ciclosporina, 10 mg com ritonavir/atazanavir e 20 mg com genfibrozila. Não se espera que
Plenance® afete a capacidade de dirigir veículos e operar máquinas. Informe imediatamente seu médico se durante o tratamento sentir dores musculares não explicadas, sensibilidade ou fraqueza,
particularmente se acompanhada de mal-estar ou febre, ou se há histórico de dor muscular. A rosuvastatina pode aumentar os níveis de glicose e a hemoglobina glicada no sangue, e induzir diabetes.
Podem ocorrer alterações nos exames laboratoriais referentes às funções muscular e do fígado. Pode ser recomendado o monitoramento de enzimas do fígado ou musculares de acordo com a
orientação médica. Em caso de doença grave ou internação, avise seu médico que está tomando Plenance®. Se você engravidar, deve parar o Plenance® imediatamente e comunicar seu médico.
Este medicamento contém lactose (0,0916 g/comprimido de 10 mg e 0,1832 g/comprimido de 20 mg). Informe seu médico caso você tenha problemas de intolerância à lactose. Gravidez e lactação:
categoria de risco: X. Este medicamento não deve ser utilizado por mulheres grávidas ou que possam ficar grávidas durante o tratamento. A segurança da rosuvastatina durante a gravidez e
a lactação não foram estabelecidas. Mulheres com potencial de engravidar devem usar métodos contraceptivos apropriados. Interações com medicamentos, alimentos e álcool: a rosuvastatina
não tem interação significativa com o citocromo P450. Mas, é substrato do transportador hepático de captação OATP1B1 e do de efluxo BCRP. A administração concomitante com inibidores destas
proteínas pode resultar em maior concentração plasmática de rosuvastatina e em risco de miopatia. Interação com outros medicamentos: Antiácidos: a coadministração com hidróxido de alumínio
e hidróxido de magnésio diminuiu a concentração plasmática da rosuvastatina em cerca de 50%. ácido fusídico: eventos musculares, incluindo rabdomiólise, foram relatados na experiência póscomercialização pela administração concomitante de rosuvastatina e ácido fusídico. Efeito da rosuvastatina sobre medicamentos coadministrados; varfarina: a coadministração pode resultar em
aumento da razão internacional normalizada (INR). Recomenda-se a monitoração do INR. Fenofibratos / derivados do ácido fíbrico e ácido nicotínico: podem aumentar o risco de miopatia quando
são em concomitância com estatinas; ciclosporina: a coadministração não resultou em alterações significativas na concentração plasmática de ciclosporina; outros medicamentos: não houve
interação significativa com contraceptivo oral, anti-hipertensivos, antidiabéticos orais, terapia de reposição hormonal, digoxina, ezetimiba e fenofibrato. Reações Adversas e alterações de exames
laboratoriais: Os eventos adversos observados são geralmente leves e transitórios. Reações comuns (≥ 1% e < 10%): cefaleia, mialgia, astenia, constipação, vertigem, náusea e dor abdominal;
Reações incomuns (≥ 0,1% e < 1%): prurido, exantema e urticária. Reações raras (≥ 0,01% e < 0,1%): miopatia e miosite, reações de hipersensibilidade, angioedema, rabdomiólise e pancreatite.
Efeitos laboratoriais: foi observado aumento das transaminases hepáticas, da CK, da HbA1c e de proteinúria pelo uso de Rosuvastatina Experiência pós-comercialização: as seguintes reações
adversas foram relatadas após a comercialização. Distúrbios hematológicos: trombocitopenia. Distúrbios hepatobiliares: icterícia e hepatite. Distúrbios musculoesqueléticos: artralgia, miopatia
necrotizante imunomediada. Distúrbios do sistema nervoso: perda de memória, neuropatia periférica. Distúrbios psiquiátricos: depressão e distúrbios do sono. Distúrbios do sistema reprodutivo
e mamas: ginecomastia. Crianças e adolescentes de 10 – 17 anos de idade: elevações de CK > 10 x LSN e sintomas musculares após exercício físico foram observados com maior frequência em
crianças e adolescentes. Posologia: a dose usual é de 10 a 40 mg, administrados por via oral em dose única diária. A dose máxima diária é de 40 mg. O ajuste de dose pode ser feito em intervalos
de duas a quatro semanas. Crianças e adolescentes de 10 a 17 anos de idade: em crianças e adolescentes com hipercolesterolemia familiar heterozigótica, a dose usual não deve exceder 20
mg uma vez ao dia por via oral. A segurança e eficácia de doses maiores não foram estudadas nessa população. Populações especiais - idosos: utiliza-se a dose habitual; insuficiência renal:
na insuficiência renal grave, a dose de Plenance® não deve exceder 10 mg uma vez ao dia; doença hepática: a dose habitual se aplica na insuficiência hepática leve e na moderada. Foi observado
aumento da exposição sistêmica à rosuvastatina em pacientes com insuficiência hepática grave; o uso de doses acima de 10 mg deve ser cuidadosamente avaliado.Etnia: a dose máxima de 20 mg
de rosuvastatina deve ser considerada para asiáticos e descendentes. Foi observado aumento da concentração plasmática de rosuvastatina em asiáticos. Polimorfismo genético: para pacientes
com genótipo c.521CC ou c.421AA, recomenda-se a dose máxima de 20 mg/dia de Rosuvastatina. Conduta em caso de esquecimento de dose: Se o paciente se esquecer de tomar uma dose de
Plenance®, não é necessário tomar a dose esquecida; orientar que tome apenas a próxima dose no horário habitual. Nunca deve ser usada uma dose dobrada para compensar uma dose perdida. Este
medicamento não deve mastigado. Reg.MS 1.0033.0170/Farm. Resp.: Cintia Delphino de Andrade CRF-SP nº 25.125. LIBBS FARMACÊUTICA LTDA/ CNPJ 61.230.314/0001-75/Rua Alberto
Correia Francfort, 88/Embu-das Artes - SP/Indústria Brasileira /PLENANCE-MB01-14/Serviço de Atendimento LIBBS: 0800-135044. VENDA SOB PRESCRIÇÃO MÉDICA. A persistirem os
sintomas, o médico deve ser consultado. Documentação Científica e informações adicionais estão à disposição da classe médica, mediante solicitação.
Referências: 1.ROSENSON, R.S. Statins: actions, side effects, and administration. UptoDate[Online]. New York: Wolters Kluwer: Last uptodate Feb 05, 2015. 2.JONES, P.H. et al. Comparison of the
efficacy and safety of rosuvastatin versus atorvastatin, simvastatin, and pravastatin across doses (STELLAR Trial). Am J Cardiol., v.92, p.152–60, 2003. 3.STONE, N.J. et al. 2013 ACC/AHA Guideline on
the Treatment of Blood Cholesterol to Reduce Atherosclerotic Cardiovascular Risk in Adults, J Am Coll Cardiol, Nov 7, n.13, pii: S0735-1097, 2013. 4.FAERGEMAN, O. et al. ECLIPSE Study Investigators.
Efficacy and tolerability of rosuvastatin and atorvastatin when force-titrated in patients with primary hypercholesterolemia: results from the ECLIPSE study. Cardiology, v.111, n.4, p.219-28, 2008. 5.RIDKER,
P.M. et al. Rosuvastatin to prevent vascular events in men and women with elevated C-reactive protein. N Engl J Med., v.359, n.21, p.2195-207, 2008. 6.OHSFELDT, R.L. et al. Cost-effectiveness of
rosuvastatin 20 mg for the prevention of cardiovascular morbidity and mortality: a Swedish economic evaluation of the JUPITER trial. J Med Econ, v.15, n.1, p.125-33, 2012. 7.VODONOS, A. et al. Statin
adherence and LDL cholesterol levels. Should we assess adherence prior to statin upgrade? Eur J Intern Med, v.26, n.4, p.268-72, 2015. 8.GUIA DA FARMÁCIA. São Paulo: Contento, v.22, n.277, 2015.
Suplemento Lista de Preços.
Contraindicação: Doença hepática ativa. Interações: Não deve
ser usado em associação com a genfibrozila.
Responsável Técnico
Dr. Luiz Carlos V. de Andrade – CRM 48277
Sala de cirurgia híbrida cardiovascular, para o tratamento de cardiopatias
complexas com imagens tridimensionais altamente apuradas.
HCor – Hospital do Coração/Diagnóstico – Unidade Paraíso: Rua Desembargador Eliseu Guilherme, 147 – São Paulo – SP
HCor – Edifício Dr. Adib Jatene: Rua Desembargador Eliseu Guilherme, 130 – São Paulo – SP
HCor Onco – Clínica de Radioterapia: Rua Tomás Carvalhal, 172 – São Paulo – SP
HCor Diagnóstico – Unidade Cidade Jardim: Av. Cidade Jardim, 350 – 2º andar – São Paulo – SP
Tels.: Geral: (11) 3053-6611 • Central de Agendamento: (11) 3889-3939 • Pronto-socorro: (11) 3889-9944 • www.hcor.com.br
Todo o apoio que você precisa:
uma equipe multidisciplinar e os mais
avançados recursos tecnológicos.
O HCor foi o hospital pioneiro na América Latina a conquistar duas
certificações pela JCI para os Programas Clínicos de Infarto Agudo de
Miocárdio (IAM) e de Insuficiência Cardíaca (IC).
Essa mesma excelência também está presente na nova unidade do HCor,
o edifício Dr. Adib Jatene. Agora, você e seus pacientes têm uma das
mais completas e sofisticadas estruturas totalmente à disposição para
que obtenham os melhores resultados em todos os tratamentos.
Nós colocamos o coração em tudo.
ESTEJA PREPARADO PARA
SITUAÇÕES DE EMERGÊNCIA
Participe dos cursos do Centro de Treinamento
Com objetivo de treinar profissionais da saúde e a população leiga
para reconhecer e lidar com situações de emergência cardíaca, os
treinamentos ministrados pelo centro utilizam equipamentos e salas
modernas, o que garante o máximo realismo à situação simulada.
Os instrutores são altamente capacidados e credenciados, de acordo
com as regras e especificações da American Heart Association (AHA).
Conheça mais sobre os cursos e inscreva-se!
ACLS – Suporte Avançado de Vida em Cardiologia
ACLS EP (EXPERIENCED PROVIDER)
BLS – Suporte Básico de Vida
FIRST AID – Primeiros Socorros e Salva-Corações com DEA / DAE
PALS – Suporte Básico de Vida em Pediatria
SAVIC – Suporte Avançado de Vida em Insuficiência Cardíaca
Saiba mais e inscreva-se em:
WWW.SOCESP.ORG.BR/CENTRO_TREINAMENTO/
Credenciamento:
ISSN 0103-8559
Indexada em:
LILACS – Literatura Latino-Americana e do Caribe em Ciências da Saúde (www.bireme.br)
Latindex – Sistema Regional de Información em Línea para Revistas Científicas de América Latina, El Caribe, España y Portugal
(www.latindex.unam.mx)
Editora Chefe: Maria Cristina de Oliveira Izar
Álvaro Avezum
Instituto Dante Pazzanese de Cardiologia São Paulo, SP, Brasil
Amanda G. M. R. Sousa
Instituto Dante Pazzanese de Cardiologia São Paulo, SP, Brasil
Angelo Amato V. de Paola
Escola Paulista de Medicina da Universidade Federal de São
Paulo - Unifesp São Paulo, SP, Brasil
Antonio Augusto Lopes
Instituto do Coração (InCor) do Hospital das Clínicas da Faculdade de
Medicina da Universidade de São Paulo-HCFMUSP São Paulo, SP, Brasil
Antonio Carlos Pereira-Barretto
Instituto do Coração (InCor) do Hospital das Clínicas da Faculdade de
Medicina da Universidade de São Paulo-HCFMUSP São Paulo, SP, Brasil
Antonio de Pádua Mansur
Instituto do Coração (InCor) do Hospital das Clínicas da Faculdade de
Medicina da Universidade de São Paulo-HCFMUSP, São Paulo, SP, Brasil
Ari Timerman
Instituto do Coração (InCor) do Hospital das Clínicas da Faculdade de
Medicina da Universidade de São Paulo-HCFMUSP, São Paulo, SP, Brasil
Benedito Carlos Maciel
Faculdade de Medicina de Ribeirão Preto, Ribeirão Preto,SP,Brasil
Bráulio Luna Filho
Escola Paulista de Medicina da Universidade Federal de
São Paulo / Hospital Brasil, ABC São Paulo, SP, Brasil
Bruno Caramelli
Instituto do Coração (InCor) do Hospital das Clínicas da Faculdade de
Medicina da Universidade de São Paulo-HCFMUSP, São Paulo, SP, Brasil
Caio de Brito Vianna
Instituto do Coração (InCor) do Hospital das Clínicas da Faculdade
de Medicina da Universidade de São Paulo-HCFMUSP, São Paulo,
SP, Brasil
Carlos Alberto Buchpiguel
Faculdade de Medicina da Universidade de São Paulo
(Vinculação Acadêmica) São Paulo, SP, Brasil
Carlos Costa Magalhães
Cardioclin - Clinica e Emergência Cardiologica
São José dos Campos , SP, Brasil.
Carlos Eduardo Rochitte
Instituto do Coração (InCor) do Hospital das Clínicas da Faculdade
de Medicina da Universidade de São Paulo-HCFMUSP / Hospital do
Coração, HCOR / Associação do Sanatório Sírio, São Paulo, SP, Brasil
Carlos V. Serrano Jr.
Instituto do Coração (InCor) do Hospital das Clínicas da Faculdade de
Medicina da Universidade de São Paulo-HCFMUSP São Paulo, SP, Brasil
Celso Amodeo
Instituto Dante Pazzanese de Cardiologia, São Paulo, SP, Brasil
Dalmo Antonio R. Moreira
Instituto Dante Pazzanese de Cardiologia, São Paulo, SP, Brasil
Daniel Born
Escola Paulista de Medicina da Universidade Federal de
São Paulo - UNIFESP São Paulo, SP, Brasil
Dante Marcelo Artigas Giorgi
Instituto do Coração (InCor) do Hospital das Clínicas da Faculdade
de Medicina da Universidade de São Paulo (HC FMUSP), São Paulo,
SP, Brasil
Dirceu Rodrigues Almeida
Escola Paulista de Medicina da Universidade Federal de São Paulo UNIFESP, São Paulo, SP, Brasil
Edson Stefanini
Escola Paulista de Medicina da Universidade Federal de
São Paulo -UNIFESP, São Paulo, SP, Brasil
Expedito E. Ribeiro
Instituto do Coração (InCor) do Hospital das Clínicas da Faculdade deMedicina da Universidade de São Paulo-HCFMUSP São Paulo, SP, Brasil
Fabio B. Jatene
Instituto do Coração (InCor) do Hospital das Clínicas da Faculdade de
Medicina da Universidade de São Paulo-HCFMUSP São Paulo, SP, Brasil
Fausto Feres
Instituto Dante Pazzanese de Cardiologia São Paulo, SP, Brasil
Felix J. A. Ramires
Instituto do Coração (InCor) do Hospital das Clínicas da Faculdade
de Medicina da Universidade de São Paulo-HCFMUSP, São Paulo,
SP, Brasil
Conselho Editorial
Fernanda Marciano Consolim Colombo
Instituto do Coração (InCor) do Hospital das Clínicas da Faculdade de
Medicina da Universidade de São Paulo-HCFMUSP, São Paulo, SP, Brasil
Fernando Bacal
Instituto do Coração (InCor) do Hospital das Clínicas da Faculdade de
Medicina da Universidade de São Paulo-HCFMUSP, São Paulo, SP, Brasil
Fernando Nobre
Hospital das Clínicas da Faculdade de Medicina da Universidade de
São Paulo-HCFMUSP, Ribeirão Preto, SP , Brasil
Flavio Tarasoutchi
Instituto do Coração (InCor) do Hospital das Clínicas da Faculdade
de Medicina da Universidade de São Paulo-HCFMUSP, São Paulo,
SP, Brasil
Francisco A. Helfenstein Fonseca
Escola Paulista de Medicina - Universidade Federal de São Paulo
São Paulo, SP, Brasil
Francisco R. M. Laurindo
Instituto do Coração (InCor) do Hospital das Clínicas da Faculdade deMedicina da Universidade de São Paulo-HCFMUSP, São Paulo, SP, Brasil
Henry Abensur
Beneficência Portuguesa de São Paulo - Setor de ensino, São Paulo,
SP, Brasil
Ibraim Masciarelli F.pinto
Instituto Dante Pazzanese de Cardiologia, São Paulo, SP, Brasil
Ieda Biscegli Jatene
Hospital do Coração - HCOR São Paulo, SP, Brasil
João Fernando Monteiro Ferreira
Instituto do Coração (InCor) do Hospital das Clínicas da Faculdade de
Medicina da Universidade de São Paulo-HCFMUSP, São Paulo, SP, Brasil
João Manoel Rossi Neto
Instituto Dante Pazzanese de Cardiologia, São Paulo, SP, Brasil
João Nelson R. Branco
Escola Paulista de Medicina da Universidade Federal de São Paulo
-UNIFESP, São Paulo, SP, Brasil
Jorge Eduardo Assef
Instituto Dante Pazzanese de Cardiologia, São Paulo, SP, Brasil
José Carlos Nicolau
Instituto do Coração (InCor) do Hospital das Clínicas da Faculdade de
Medicina da Universidade de São Paulo-HCFMUSP, São Paulo, SP, Brasil
José Carlos Pachón Mateos
Instituto Dante Pazzanese de Cardiologia, Universidade de São
Paulo - USP, Hospital do Coração, Hospital Edmundo Vasconcelos,
São Paulo, SP, Brasil
José Francisco Kerr Saraiva
Hospital e Maternidade Celso Pierro, São Paulo, SP, Brasil
José Henrique Andrade Vila
Hospital de Beneficência Portuguesa, São Paulo, SP, Brasil
José L. Andrade
Instituto de Radiologia (InRad) - Hospital das Clínicas - Faculdade de
Medicina- USP, São Paulo, SP, Brasil
José Soares Jr.
Instituto do Coração (InCor) do Hospital das Clínicas da Faculdade de
Medicina da Universidade de São Paulo-HCFMUSP, São Paulo, SP, Brasil
Katashi Okoshi
Faculdade de Medicina de Botucatu, UNESP, Botucatu, SP, Brasil
Kleber G. Franchini
Departamento de Clínica Médica UNICAMP - Universidade
Estadual de Campinas, Campinas, SP, Brasil
Leopoldo Soares Piegas
Instituto do Coração (InCor) do Hospital das Clínicas da Faculdade de
Medicina da Universidade de São Paulo-HCFMUSP, São Paulo, SP, Brasil
Lilia Nigro Maia
Faculdade de Medicina de Rio Preto (FAMERP)/Hospital de Base
São José do Rio Preto, SP, Brasil
Luiz A. Machado César
Instituto do Coração (InCor) do Hospital das Clínicas da Faculdade de
Medicina da Universidade de São Paulo-HCFMUSP, São Paulo, SP, Brasil
Luiz Mastrocola
Hospital do Coração da Associação do Sanatório Sírio (HCOR) e Instituto Dante Pazzanese de Cardiologia, São Paulo, SP, Brasil
Luiz Felipe P. Moreira
Instituto do Coração (InCor) do Hospital das Clínicas da Faculdade de
Medicina da Universidade de São Paulo-HCFMUSP São Paulo, SP, Brasil
Marcelo Jatene
Instituto do Coração (InCor) do Hospital das Clínicas da Faculdade de
Medicina da Universidade de São Paulo-HCFMUSP, São Paulo, SP, Brasil
Marcelo Chiara Bertolami
Instituto Dante Pazzanese de Cardiologia, São Paulo, SP, Brasil
Marcelo Luiz Campos Vieira
Instituto do Coração (InCor) do Hospital das Clínicas da Faculdade de
Medicina da Universidade de São Paulo-HCFMUSP, São Paulo, SP, Brasil
Marcus Vinicius Simões
Faculdade de Medicina de Ribeirão Preto - Universidade de São Paulo,
Ribeirão Preto, SP - Brasil
Maria Cristina Oliveira Izar
Escola Paulista de Medicina da Universidade Federal de São Paulo
-UNIFESP, São Paulo, SP, Brasil
Maria Teresa Nogueira Bombig
Escola Paulista de Medicina da Universidade Federal de São Paulo
-UNIFESP, São Paulo, SP, Brasil
Dra. Maria Virgínia Tavares Santana
Instituto Dante Pazzanese de Cardiologia, São Paulo, SP, Brasil
Mauricio Ibrahim Scanavacca
Instituto do Coração (InCor) do Hospital das Clínicas da Faculdade de
Medicina da Universidade de São Paulo-HCFMUSP, São Paulo, SP, Brasil
Max Grinberg
Instituto do Coração (InCor) do Hospital das Clínicas da Faculdade de
Medicina da Universidade de São Paulo-HCFMUSP, São Paulo, SP, Brasil
Miguel Antonio Moretti
Instituto do Coração (InCor) do Hospital das Clínicas da Faculdade de
Medicina da Universidade de São Paulo-HCFMUSP, São Paulo, SP, Brasil
Nelson Kasinsky
Escola Paulista de Medicina da Universidade Federal de São Paulo
-UNIFESP, São Paulo, SP, Brasil
Orlando Campos Filho
Escola Paulista de Medicina da Universidade Federal de São Paulo
-UNIFESP, São Paulo, SP, Brasil
Otavio Rizzi Coelho
Disciplina de Cardiologia do Departamento de Clinica Médica da
FCM UNICAMP, São Paulo, SP, Brasil
Paola Emanuela Poggio Smanio
Instituto Dante Pazzanese de Cardiologia São Paulo, SP, Brasil
Paulo Andrade Lotufo
Faculdade de Medicina e Centro de Pesquisa Clínica
Epidemiológica da USP, São Paulo, SP, Brasil
Paulo J. F. Tucci
Escola Paulista de Medicina da Universidade Federal de
São Paulo -UNIFESP, São Paulo, SP, Brasil
Paulo M. Pêgo Fernandes
Instituto do Coração (InCor) do Hospital das Clínicas da Faculdade de
Medicina da Universidade de São Paulo-HCFMUSP, São Paulo, SP, Brasil
Pedro Silvio Farsky
Instituto Dante Pazzanese de Cardiologia, São Paulo, SP, Brasil
Raul Dias Dos Santos Filho
Faculdade de Medicina da Universidade de São Paulo, São Paulo,
SP, Brasil
Renato Azevedo Jr
Hospital Samaritano São Paulo, São Paulo, SP, Brasil
Romeu Sérgio Meneghelo
Instituto Dante Pazzanese de Cardiologia/Hospital Israelita
Albert Einstein, São Paulo, SP, Brasil
Rui Póvoa
Universidade Federal de São Paulo, São Paulo, SP, Brasil
Ulisses Alexandre Croti
Hospital da Criança e Maternidade de São José do Rio Preto (FUNFARME) / Faculdade de Medicina de São José do Rio Preto (FAMERP),
São José do Rio Preto, SP, Brasil
Valdir Ambrosio Moises
Escola Paulista de Medicina da Universidade Federal de São Paulo UNIFESP/Fleury Medicina e Saúde, São Paulo, SP, Brasil
Valter C. Lima
Escola Paulista de Medicina da Universidade Federal de São Paulo UNIFESP, São Paulo, SP, Brasil
William Azem Chalela
Instituto do Coração (InCor) do Hospital das Clínicas da Faculdade de
Medicina da Universidade de São Paulo-HCFMUSP, São Paulo, SP, Brasil
DIRETORIA DA SOCIEDADE DE CARDIOLOGIA DO ESTADO DE SÃO PAULO / Biênio 2016 - 2017
Presidente
Ibraim Masciarelli Francisco Pinto
Vice-Presidente
João Fernando Monteiro Ferreira
1° Secretário
Ieda Biscegli Jatene
2° Secretário
Roberto Kalil Filho
1° Tesoureiro
José Luiz Aziz
2° Tesoureiro
Juan Carlos Yugar Toledo
Diretor Científico
Álvaro Avezum Junior
Diretora de Publicações
Maria Cristina de Oliveira Izar
Diretora de Regionais
Lilia Nigro Maia
Diretor de Qualidade Assistencial
Múcio Tavares de Oliveira Junior
Diretor de Tecnologia da Informação
Ricardo Pavanello
Diretor de Relações Institucionais
Luciano Ferreira Drager
Diretor de Promoção e Pesquisa
Pedro Alves Lemos Neto
Diretor do Centro de Emergências
Agnaldo Pispico
Coordenador de Pesquisa
Otavio Berwanger
Coordenador de Educação Virtual
Pedro Silvio Farsky
Coordenadores de Políticas de Saúde
Edson Stefanini
Jose Francisco Kerr Saraiva
Coordenador de Memórias
Alberto Francisco Piccolotto Naccarato
A Revista da Sociedade de Cardiologia do Estado de São Paulo (INSS 0103-8559) é Órgão Oficial da Sociedade de
Cardiologia do Estado de São Paulo, editada trimestralmente pela Diretoria de Publicações da SOCESP.
Avenida Paulista, 2073 – Horsa I, 15° andar Conjunto 1512 - Cerqueira Cesar – São Paulo, SP
CEP 01311-940 / Tel: (11) 3179-0045 / E-mail: [email protected]
Website: www.socesp.org.br
As mudanças de endereço, a solicitação de números atrasados e as cartas ao Editor
deverão ser dirigidas à sede da SOCESP.
É proibida a reprodução total ou parcial de quaisquer textos constantes desta edição
sem autorização formal e expressa de seus editores.
Para pedidos de reprints, por favor contate: SOCESP – Sociedade de Cardiologia do Estado de São Paulo /
Diretoria de Publicações
Tel: (11) 3179-0045 / E-mail: [email protected]
Impressão: Duograf
Tiragem: 4.750 exemplares
Coordenação editorial, criação, diagramação, revisão e tradução
Atha Comunicação e Editora
Tel.: 11 5087 9502 - [email protected]
Revista da Sociedade de Cardiologia do Estado de São Paulo
São Paulo – SP, Brasil. V . 1 – 1991 –
Substitui Atualização Cardiológica, 1981 – 91
1991,
1992,
1993,
1994,
1995,
1996,
1997,
1998,
1999,
2000,
2001,
2002,
2003,
2004,
2005,
2006,
2007,
2008,
2009,
2010,
2011,
2012,
2013,
2014,
2015,
2016,
: 1 (supl A), 2 (supl A), 3 (supl A)
1 (supl A), 2 (supl A), 2 (supl B), 3 (supl A), 4 (supl A), 5 (supl A), 6 (supl A)
: 1 (supl A), 2 (supl A), 2 (supl B), 3 (supl A), 4 (supl A), 5 (supl A), 6 (supl A)
: 1 (supl A), 2 (supl A), 3 (supl A), 3 (supl B), 4 (supl A), 5 (supl A), 6 (supl A)
: 1 (supl A), 2 (supl A), 3 (supl B), 4 (supl A), 5 (supl A), 6 (supl A)
: 1 (supl A), 2 (supl A), 3 (supl A), 3 (supl B), 4 (supl A), 5 (supl A), 6 (supl A)
: 1 (supl A), 2 (supl A), 3 (supl A), 3 (supl B), 4 (supl A), 5 (supl A), 6 (supl A)
: 1 (supl A), 2 (supl A), 3 (supl A), 4 (supl A), 4 (supl B), 5 (supl A), 6 (supl A)
: 1 (supl A), 2 (supl A), 3 (supl A), 3 (supl B), 4 (supl A), 5 (supl A), 6 (supl A)
: 1 (supl A), 2 (supl A), 3 (supl A), 3 (supl B), 4 (supl A), 5 (supl A), 6 (supl A)
: 1 (supl A), 2 (supl A), 3 (supl A), 3 (supl B), 4 (supl A), 5 (supl A), 6 (supl A)
: 1 (supl A), 2 (supl A), 2 (supl B), 3 (supl A), 4 (supl A), 5 (supl A), 6 (supl A)
: 1 (supl A), 2 (supl A), 2 (supl B), 3 (supl A), 4 (supl A), 5 (supl A), 6 (supl A)
: 1 (supl A), 2 (supl A), 2 (supl B), 3 (supl A), 4 (supl A), 5 (supl A), 6 (supl A)
: 1 (supl A), 2 (supl A), 3 (supl A), 4 (supl A), 5 (supl A), 5 (supl B), 6 (supl A)
: 1 (supl A), 2 (supl A), 2 (supl B), 3 (supl A), 4 (supl A)
: 1 (supl A), 2 (supl A), 2 (supl B), 3 (supl A), 4 (supl A)
: 1 (supl A), 2 (supl A), 2 (supl B), 3 (supl A), 4 (supl A)
: 1 (supl A), 2 (supl A), 2 (supl B), 3 (supl A), 4 (supl A)
: 1 (supl A), 2 (supl A), 2 (supl B), 3 (supl A), 4 (supl A)
: 1 (supl A), 2 (supl A), 2 (supl B), 3 (supl A), 4 (supl A)
: 1 (supl A), 2 (supl A), 2 (supl B), 3 (supl A), 4 (supl A)
: 1 (supl A), 2 (supl A), 2 (supl B), 3 (supl A), 4 (supl A)
: 1 (supl A), 2 (supl A), 2 (supl B), 3 (supl A), 4 (supl A)
: 1 (supl A), 2 (supl A), 2 (supl B), 3 (supl A), 4 (supl A)
: 1 (supl A)
ISSN 0103-8559CDD16616.105
RSCESP 72594NLM W1
WG100
CDU 616.1(05)
DIRETORIA DAS REGIONAIS DA SOCIEDADE DE CARDIOLOGIA DO ESTADO DE SÃO PAULO
Biênio 2016 - 2017
ABCDM
CAMPINAS
RIBEIRÃO PRETO
Presidente
Rogerio Krakauer
Presidente
Alessandro Franjotti Chagas
Presidente
Moyses de Oliveira Lima Filho
Diretor Científico
Roberto Andres Gomez Douglas
Diretor Científico
Fernando Piza de S. Cannavan
Diretor Científico
Marcelo Garcia Leal
1° Secretário
Fernando Mello Porto
1° Secretária
Samira Ubaid Girioli
2° Secretário
Tiago Porto Di Nucci
2° Secretário
Flavio Cantarelli Hiss
FRANCA
SANTOS
Presidente
Eduardo Maniglia Puccinelli
Presidente
Luiz Fernando Muniz Pinheiro
Diretor Científico
Rodrigo Tavares Silva
Diretor Científico
Carlos Alberto Cyrillo Sellera
1° Secretário
Luiz Alfredo Husemann Patti
1° Secretário
William da Costa
2° Secretário
Hélio Rubens Crialezi
2° Secretário
Sergio Paulo Almeida B. Camargo
JUNDIAÍ
SÃO CARLOS
Presidente
Luiz Anibal Larco Patino
Presidente
Hélio Araújo Cardoso
Diretor Científico
Marco Antonio Dias
Diretora Científica
Ana Cândida Arruda Verzola de Castro.
1° Secretário
João Paulo de Mello Medeiros
1° Secretária
Meliza Goi Roscani
2° Secretária
Fatima Aparecida Lopes Pinto Denardi
2° Secretário
Sergio Luis Berti
MARILIA
SÃO JOSÉ DO RIO PRETO
Presidente
Alexandre Rodrigues
Presidente
Adriana Pinto Bellini Miola
Diretor Científico
Pedro Beraldo de Andrade
Diretor Científico
Gilmar Valdir Greque
1° Secretário
Ronaldo de Oliveira Jr
1° Secretária
Maria Helena Mani Dias Sardilli
2° Secretário
André dos Santos Moro
2° Secretária
Eliana Migliorini Mustafa
PIRACICABA
SOROCABA
Presidente
Juliana Barbosa Previtalli
Presidente
Fernando Cortes Remisio Figuinha
Diretora Científica
Celise Alessandra Sobral Denardi
Diretor Científico
Pericles Sidnei Salmazo
1° Secretário
Rafael Prota
1° Secretária
Juliana Buchmann Pereira
BOTUCATU
2° Secretário
Davi Bizetti Pelai
2° Secretário
Marcelo Demarchi
Presidente
Ricardo Mattos Ferreira
PRESIDENTE PRUDENTE
VALE DO PARAÍBA
Presidente
Mozart Alves Gonçalves Filho
Presidente
Jorge Zarur Neto
Diretor Científico
Fernando Pierin Peres
Diretor Científico
Pedro Henrique Duccini Mendes Trindade
1° Secretário
Osmar Marchiotto Junior
1° Secretária
Fabiana Goulart Marcondes Braga
2° Secretário
Adriano Oliveira Cavalheiro
2° Secretário
André Zeraik Lima Chammas
1° Secretária
Carla Janice Baister Lantieri
2° Secretário
Kamal Yazbek Jr.
ARAÇATUBA
Presidente
Celso Biagi
Diretor Científico
Carlos Roberto Bortoluci Etto
1° Secretário
Paulo Francisco de Mesquita Barros
2° Secretária
Monica Neri Shinsato
ARARAQUARA
Presidente
Antonio Carlos Braga de Moraes
Diretor Científico
José Geraldo Bonfá
1° Secretário
Hélio Marques Malavolta
2° Secretário
José Candido M. da S. Machado
ARARAS
Presidente
Antonio Carlos Assumpção
Diretor Científico
José Joaquim Fernandes Raposo Filho
1° Secretário
Fernando Candido Martins
2° Secretário
Agnaldo Pispico
BAURU
Presidente
Alexandre Volney Villa
Diretor Científico
Plinio de Almeida Barros Neto
1° Secretário
Nilcelio Leite Melo
2° Secretário
João Quialheiro Abreu
Diretor Científico
Danieliso Renato Fusco
1° Secretário
Marcos Mitsuo Seki
2° Secretário
Guilherme de Castro Ribeiro
NORMAS DE PUBLICAÇÃO
A Revista da Sociedade de Cardiologia do Estado de São
Paulo (Rev Soc Cardiol Estado de São Paulo) é o órgão oficial
de divulgação da Sociedade de Cardiologia do Estado de São
Paulo (SOCESP).
O Suplemento da Revista Sociedade de Cardiologia do Estado de São Paulo é parte integrante da Revista da Sociedade
de Cardiologia do Estado de São Paulo e publica artigos nas
áreas de saúde como enfermagem, fisioterapia, educação
física, nutrição, odontologia, psicologia, serviço social, farmacologia, entre outras).
Trata-se de uma publicação trimestral indexada no LILACS
(Literatura Latino-Americana e do Caribe em Ciências da
Saúde) e no Latindex (Sistema Regional de Información en
Línea para Revistas Científicas de América Latina, el Caribe,
España y Portugal).
Com o objetivo de disseminar o conhecimento na área
de cardiologia e de outras áreas de saúde a Revista da
SOCESP e seu Suplemento passam a partir de 2015 a ter
acesso aberto.
A publicação segue os requisitos de uniformização recomendados pelo Comitê Internacional de Editores de Revistas
Médicas (www.icmje.org.br).
Os artigos, para serem aprovados, são submetidos à avaliação de uma comissão de revisores (peer review) que recebem
o texto de forma anônima e decidem se haverá sua publicação,
sugerem modificações, requisitam esclarecimentos aos autores
e efetuam recomendações ao Editor Chefe.
Os conceitos e declarações contidos nos trabalhos são de
total responsabilidade dos autores.
A Revista da Sociedade de Cardiologia do Estado de São
Paulo segue na íntegra a tendência internacional do estilo Vancouver, disponível (www.icmje.org.br).
Categorias de Artigos
A Revista da Sociedade de Cardiologia do Estado de São
Paulo recebe para publicação artigos de Revisão, Revisão Sistemática e Meta-análise.
O Suplemento da Revista da Sociedade de Cardiologia do
Estado de São Paulo recebe para publicação: Artigo Original,
Revisão, Revisão Sistemática, Meta-análise, Artigo de Opinião,
Artigo de Atualização e Relato de Caso.
No caso de estudos clínicos e experimentais deverá haver referência explícita quanto ao cumprimento das normas éticas, incluindo
o nome do Comitê de Ética em Pesquisa que aprovou o estudo.
LIMITES POR TIPO DE PUBLICAÇÃO (Extensão):
Os critérios abaixo recomendados devem ser observados
para cada tipo de publicação. A contagem eletrônica de palavras deve incluir a página inicial, resumo, texto e referências.
Os manuscritos enviados deverão estar em padrão PC com
arquivos TXT ou DOC, espaço duplo, com margem larga, acompanhados pela carta de autorização de publicação assinada
pelo autor, declarando que o mesmo é inédito e que não foi,
ou está sendo submetido à publicação em outro periódico.
Certifique-se de que o manuscrito se conforma inteiramente
às instruções.
Ensaios clínicos: O periódico apoia as políticas para registro de ensaios clínicos da Organização Mundial de Saúde
(OMS) e do Comitê Internacional de Editores de Diários Médicos (ICMJE), reconhecendo a importância dessas iniciativas
para o registro e divulgação internacional de informação sobre
estudos clínicos, em acesso aberto. Sendo assim, somente
serão aceitos para publicação, os artigos de pesquisas clínicas que tenham recebido um número de identificação em um
dos Registros de Ensaios Clínicos validados pelos critérios
estabelecidos pela OMS e ICMJE. Os endereços para esses
registros estão disponíveis a partir do site do ICMJE (www.
icmje.org). O número de identificação deve ser declarado no
final do resumo.
Conflito de interesses: Conforme exigências do Comitê
Internacional de Editores de Diários Médicos (ICMJE), grupo
Vancouver e resolução do Conselho Federal de Medicina nº
1595/2000 os autores têm a responsabilidade de reconhecer e
declarar conflitos de interesse financeiros e outros (comercial,
pessoal, político, etc.) envolvidos no desenvolvimento do trabalho apresentado para publicação. Devem declarar e podem
agradecer no manuscrito todo o apoio financeiro ao trabalho,
bem como outras ligações para o seu desenvolvimento.
Correção de provas gráficas: Logo que prontas, as provas
gráficas em formato eletrônico serão enviadas, por e-mail, para
o autor responsável pelo artigo. Os autores deverão devolver,
também por e-mail, a prova gráfica com as devidas correções
em, no máximo, 48 horas após o seu recebimento. O envio e
o retorno das provas gráficas por correio eletrônico visa agilizar
o processo de revisão e posterior publicação das mesmas.
Direitos autorais: Todas as declarações publicadas nos
artigos são de inteira responsabilidade dos autores. Entretanto,
todo material publicado torna-se propriedade da Revista, que
passa a reservar os direitos autorais. Portanto, nenhum material
publicado na Revista da Sociedade de Cardiologia do Estado
de São Paulo poderá ser reproduzido sem a permissão por
escrito. Todos os autores de artigos submetidos deverão assinar
um Termo de Transferência de Direitos Autorais, que entrará em
vigor a partir da data de aceite do trabalho.
Organização do arquivo eletrônico: Todas as partes do
manuscrito devem ser incluídas em um único arquivo. O mesmo
deverá ser organizado com a página de rosto, em primeiro
lugar, o texto, referências seguido pelas figuras (com legendas)
e ao final, as tabelas (com legendas).
Página de rosto: A página de rosto deve conter:
a. o tipo do artigo (artigo original, de revisão ou atualização);
b. o título completo em português e inglês com até 90 caracteres deve ser conciso, porém informativo;
c. o nome completo de cada autor (sem abreviações); e a
instituição a que pertence cada um deles;
d. o local onde o trabalho foi desenvolvido;
e. nome, endereço, telefone e e-mail do autor responsável
para correspondência.
Resumo: O Resumo deve ser estruturado em caso de
artigo original e deve apresentar os objetivos do estudo
Recomendações para Artigos submetidos à Revista da SOCESP:
Tipo de Artigo
Resumo
Número de Palavras
Referências
Figuras
Tabelas
Original
Estruturado com até
250 palavras
2.500 - Excluindo o resumo, referências,
tabelas e figuras
20
10
6
Atualização /
Revisão
Não é estruturado com
até 250 palavras
4.000 - Excluindo o resumo, referências,
tabelas e figuras
60
3
2
Editorial
0
500
0
0
0
com clareza, dados históricos, métodos, resultados e as
principais conclusões em inglês e português, não devendo
ultrapassar 250 palavras.
Resumos Gráficos (graphical abstract) serão aceitos. A
informação deverá ser composta de imagem concisa , pictórica e visual das principais conclusões do artigo. Pode ser
tanto a figura de conclusão do artigo ou uma figura que é
especialmente concebida para este fim, que capta o conteúdo
do artigo para os leitores em um único olhar . As figuras incluem
todas as ilustrações, tais como fotografias, desenhos, mapas,
gráficos, etc, e deve ser identificado com o nome do artigo.
O envio de resumo gráfico (graphical abstract) é opcional
e deve ser encaminhado em arquivo separado e identificado.
O arquivo deve ter extensão .tif e/ou jpg. Também são aceitos
arquivos com extensão .xls (Excel); .eps; .psd para ilustrações
em curva (gráficos, desenhos e esquemas).
Descritores: Deve conter no mínimo três palavras chaves baseadas nos Descritores de Ciências da Saúde (DeCS)
-http://decs.bireme.br. No inglês, apresentar keywords baseados no Medical Subject Headings (MeSH) - http://www.nlm.
nih.gov/mesh/meshhome.html, no mínimo três e no máximo
seis citações.
Introdução: Deve apresentar o assunto e objetivo do estudo, oferecer citações sem fazer uma revisão externa da matéria.
Material e método: Deve descrever o experimento (quantidade e qualidade) e os procedimentos em detalhes suficientes
que permitam a outros pesquisadores reproduzirem os resultados ou darem continuidade ao estudo.
Ao relatar experimentos sobre temas humanos e animais,
indicar se os procedimentos seguiram as normas do Comitê Ético sobre Experiências Humanas da Instituição, na qual
a pesquisa foi realizada ou de acordo com a declaração de
Helsinki de 1995 e Animal Experimentation Ethics, respectivamente. Identificar precisamente todas as drogas e substâncias
químicas usadas, incluindo os nomes genéricos, dosagens e
formas de administração. Não usar nomes dos pacientes, iniciais, ou registros de hospitais. Oferecer referências para o
estabelecimento de procedimentos estatísticos.
Resultados: Apresentar os resultados em sequência lógica
do texto, usando tabelas e ilustrações. Não repetir no texto
todos os dados constantes das tabelas e ou ilustrações. No
texto, enfatizar ou resumir somente as descobertas importantes.
Discussão: Enfatizar novos e importantes aspectos do estudo. Os métodos publicados anteriormente devem ser comparados com o atual para que os resultados não sejam repetidos.
Conclusão: Deve ser clara e concisa e estabelecer uma
ligação entre a conclusão e os objetivos do estudo. Evitar conclusões não baseadas em dados.
Agradecimentos: Dirigidos a pessoas que tenham colaborado intelectualmente, mas cuja contribuição não justifica
coautoria, ou para aquelas que tenham provido apoio material.
Referências: Citar as referências, restritas à bibliografia essencial ao conteúdo do artigo. Numerar as referências de forma
consecutiva de acordo com a ordem em que forem mencionadas pela primeira vez no texto, utilizando-se números arábicos
sobrescritos. Incluir os seis primeiros autores seguidos de et al.
Os títulos de periódicos deverão ser abreviados de acordo
com o Index Medicus.
a. Artigos: Autor(es). Título do artigo. Título do Periódico. ano;
volume: página inicial - final
Ex.: Campbell CJ. The healing of cartilage deffects. Clin
Orthop Relat Res. 1969;(64):45-63.
b. Livros: Autor(es) ou editor(es). Título do livro. Edição,
se não for a primeira. Tradutor(es), se for o caso. Local
de publicação: editora; ano. Ex.: Diener HC, Wilkinson
M, editors. Drug-induced headache. 2nd ed. New York:
Spriger-Verlag; 1996.
c. Capítulos de livros: Autor(es) do capítulo. Título do capítulo
Editor(es) do livro e demais dados sobre este, conforme o
item anterior.Ex.: Chapman MW, Olson SA. Open fractures.
In: Rockwood CA, Green DP. Fractures in adults. 4th ed.
Philadelphia: Lippincott-Raven; 1996. p.305-52.
d. Resumos: Autor(es). Título, seguido de [abstract]. Periódico
ano; volume (suplemento e seu número, se for o caso):
página(s) Ex.: Enzensberger W, Fisher PA. Metronome in
Parkinson’s
disease [abstract]. Lancet. 1996;34:1337.
e. Comunicações pessoais só devem ser mencionadas no
texto entre parênteses.
f. Tese: Autor, título nível (mestrado, doutorado etc.), cidade:
instituição; ano. Ex.: Kaplan SJ.Post-hospital home health care:
the elderley’s access and utilization [dissertation]. St. Louis:
Washington Univ.; 1995.
g. Material eletrônico: Título do documento, endereço na internet, data do acesso. Ex: Morse SS. Factors in the emergence of infectious diseases. Emerg Infect Dis. [online] 1995
Jan-Mar [cited 1996 Jun 5];1(1):[24 screens]. Available
from: URL: http://www.cdc.gov/ncidod/EID/eid.htm
Tabelas: As tabelas devem ser numeradas por ordem de
aparecimento no texto com números arábicos. Cada tabela
deve ter um título e, se necessário, uma legenda explicativa.
As tabelas deverão ser enviadas através dos arquivos originais
(p.e. Excel).
Figuras (fotografias e ilustrações): As figuras devem ser
apresentadas em páginas separadas e numeradas sequencialmente, em algarismos arábicos, conforme a ordem de aparecimento no texto. Para evitar problemas que comprometam
o padrão da revista, o envio do material deve obedecer aos
seguintes parâmetros: todas as figuras, fotografias e ilustrações devem ter qualidade gráfica adequada (300 dpi de resolução) e apresentar título e legenda. Em todos os casos, os
arquivos devem ter extensão.tif e/ou jpg. Também são aceitos
arquivos com extensão .xls (Excel), .eps, .psd para ilustrações
em curva (gráficos, desenhos e esquemas). As figuras incluem
todas as ilustrações, tais como fotografias, desenhos, mapas,
gráficos, etc, e devem ser numeradas consecutivamente em
algarismos arábicos.
Vídeos: O envio de vídeo é opcional, e irá acompanhar a
versão online do artigo. Deve ser encaminhado junto com o
artigo em arquivo separado e acompanhado de legenda. Os
vídeos devem ser enviados em formato digital MP4.
Legendas: Digitar as legendas usando espaço duplo,
acompanhando as respectivas figuras (gráficos, fotografias e
ilustrações). Cada legenda deve ser numerada em algarismos
arábicos, correspondendo a cada figura, e na ordem em que
foram citadas no trabalho. Abreviaturas e Siglas:Devem ser
precedidas do nome completo quando citadas pela primeira
vez no texto. No rodapé das figuras e tabelas deve ser discriminado o significado das abreviaturas, símbolos, outros sinais
e informada fonte: local onde a pesquisa foi realizada. Se as
ilustrações já tiverem sido publicadas, deverão vir acompanhadas de autorização por escrito do autor ou editor, constando a
fonte de referência onde foi publicada.
Reprodução: Somente a Revista da Sociedade de Cardiologia do Estado de São Paulo poderá autorizar a reprodução
dos artigos nelas contidos. Os casos omissos serão resolvidos
pela Diretoria da Revista da Sociedade de Cardiologia do Estado de São Paulo. Os artigos enviados passarão a ser propriedade da Revista da Sociedade de Cardiologia do Estado
de São Paulo.
Submissão de artigos: A partir de janeiro de 2015 os
artigos deverão ser enviados para Submissão para o email:
revista @socesp.org.br para a Atha Comunicação e Editora a/c
Flávia M. S. Pires e/ou Ana Carolina de Assis.
Caso ocorra a necessidade de esclarecimentos adicionais,
favor entrar em contato com a Atha Comunicação e Editora - Rua
Machado Bittencourt, 190 - 4º andar - CEP: 04044-903 - São
Paulo/SP, Brasil Tel: +55 11 5087-9502 / Fax: +55 11 5579 5308.
Todo o conteúdo do periódico, exceto onde identificado, está licenciado sob uma Licença Creative Commons
Atribuição-tipo BY-NC.
editorial
Aos leitores da Revista da SOCESP
Nesta primeira edição de 2016, o tema escolhido foi “Novos Rumos da
Terapia Intensiva em Cardiologia”. A revista conta com revisões de aspectos relevantes sobre o manejo clínico do choque cardiogênico, as indicações
para o uso dos dispositivos mecânicos de suporte em insuficiência cardíaca
refratária, a terapia do controle da temperatura pós-parada cardiorrespiratória,
a terapia dialítica no paciente cardiopata, a abordagem clínica da congestão
pulmonar aguda no cardiopata e a atualização do diagnóstico e tratamento do
tromboembolismo pulmonar. Estes temas são abordados por especialistas de
elevado gabarito científico de forma didática, abrangente e atualizada. Temos
certeza de que esta edição será de grande interesse para o cardiologista que
se depara com um paciente crítico.
Como parte das mudanças que vem ocorrendo no processo de indexação
da Revista da SOCESP, e visando uma revista de qualidade crescente, além
da revisão por pares, estamos iniciando processo de modificação na forma de
convite aos autores. Nas próximas edições, os temas centrais também serão
divulgados por meio de chamadas para publicações de artigos, ou call for
papers. Estas chamadas serão enviadas por correio eletrônico, com antecedência, sendo, no entanto, mantida a forma tradicional de convite individualizado.
Acreditamos que com isto a Revista da SOCESP tenha uma abertura maior,
com maior alcance na promoção e divulgação do conhecimento científico, mas
mantendo o seu caráter em publicar artigos de revisão sobre temas relevantes
em cardiologia, que agrada ao nosso associado. Outras inovações são o envio opcional de resumo ou abstract gráfico, e de vídeo de algum aspecto de
interesse dentro do tema abordado, para uso exclusivo na versão eletrônica.
As submissões continuam sendo realizadas pelo email: [email protected].
Aproveito a oportunidade para desejar a todos um feliz 2016 e convido-os
para esta agradável leitura.
Maria Cristina de Oliveira Izar
Editora Chefe
SUMÁRIO/CONTENTS
Novos Rumos da Terapia Intensiva em Cardiologia
ATUALIZAÇÃO NO MANEJO CLÍNICO DO CHOQUE CARDIOGÊNICO......................................................................................................14
UPDATE ON CLINICAL MANAGEMENT OF CARDIOGENIC SHOCK
Claudia Bernoche, Liliane Kopel, Leonardo Nicolau Geisler, Daud Lopes, Milena Frota Macatrão-Costa, Silvia G. Lage
INDICAÇÕES DE DISPOSITIVOS MECÂNICOS DE SUPORTE NA INSUFICIÊNCIA CARDÍACA REFRATÁRIA..............................................21
INDICATIONS OF MECHANICAL SUPPORT DEVICES IN REFRACTORY HEART FAILURE
Elias Knobel, Bruno Biselli, Paulo Manuel Pêgo Fernandes
TERAPIA DO CONTROLE DA TEMPERATURA PÓS-PARADA CARDIORRESPIRATÓRIA. . ........................................................................... 27
TEMPERATURE CONTROL THERAPY AFTER CARDIORESPIRATORY ARREST
Claudia Bernoche, Liliane Kopel, Natali Schiavo Gianetti, Silvia G. Lage, Sergio Timerman
Terapia dialítica no paciente cardiopata. . .....................................................................................................................................34
Dialysis therapy in patients with heart disease
Celso Amodeo, Antonio Carlos Cordeiro, Saulo Barbosa Vasconcelos de Alencar
ABORDAGEM CLÍNICA DA CONGESTÃO PULMONAR AGUDA NO CARDIOPATA. . ...................................................................................39
CLINICAL APPROACH TO ACUTE PULMONARY CONGESTION IN HEART DISEASE
Edson Stefanini, Juscélio Trajano Filho
ATUALIZAÇÃO DO DIAGNÓSTICO E TRATAMENTO DO TROMBOEMBOLISMO PULMONAR.. .........................................................46
UPDATE ON DIAGNOSIS AND TREATMENT OF PULMONARY THROMBOEMBOLISM
Antonio Cláudio do Amaral Baruzzi, Giuliano Generoso, Carlos Eduardo Prazeres, Renata Hames, Fernanda de Andrade Cardoso, Valter Furlan
revisão/review
ATUALIZAÇÃO NO MANEJO CLÍNICO
DO CHOQUE CARDIOGÊNICO
UPDATE ON CLINICAL MANAGEMENT OF CARDIOGENIC SHOCK
Resumo
Claudia Bernoche1
Liliane Kopel1
Leonardo Nicolau Geisler
Daud Lopes1
Milena Frota
Macatrão-Costa1
Silvia G. Lage2
1. Instituto do Coração do Hospital
das Clínicas da Faculdade de
Medicina da Universidade de São
Paulo (FMUSP), Unidade Clínica de
Terapia Intensiva.
2. Faculdade de Medicina da
Universidade de São Paulo (FMUSP).
Instituto do Coração do Hospital das
Clínicas da FMUSP, Unidade Clínica de
Terapia Intensiva.
14
Correspondência:
Claudia Bernoche. Unidade Clínica
de Terapia Intensiva, Av. Éneas de
Carvalho Aguiar 44, 2° andar sala 10.
CEP 05403-000 São Paulo – SP
E-mail: [email protected]
O choque cardiogênico é uma síndrome clínica caracterizada por hipoperfusão tecidual secundária à disfunção cardíaca, na ausência de hipovolemia. A etiologia principal
é o infarto agudo do miocárdio com falência de ventrículo esquerdo, embora existam
outras causas relevantes, como complicações mecânicas do infarto, miocardites, evolução de cardiomiopatias, valvopatias agudas não isquêmicas e cardiomiopatia induzida pelo estresse, por exemplo. Apesar dos avanços terapêuticos, persiste como uma
afecção de elevada mortalidade e sua incidência não se modificou significativamente
nas últimas décadas. A instalação do choque em pacientes com síndromes coronarianas agudas ocorre mais frequentemente após a internação hospitalar, ressaltando
a importância da identificação de preditores e da monitorização de sinais precoces de
hipoperfusão tecidual para pronta intervenção. O diagnóstico é essencialmente clínico e
alguns exames subsidiários, como eletrocardiograma, marcadores de necrose miocárdica, ecocardiograma e cineangiocoronariografia, que são importantes para a definição
da etiologia, estratificação da gravidade e do prognóstico. O manejo adequado dos pacientes requer avaliação dos parâmetros de macro e micro-hemodinâmica. Os principais
objetivos terapêuticos incluem a restauração precoce da perfusão tecidual sistêmica e
a recuperação da função ventricular. O tratamento inclui medidas gerais para pacientes
com choque como ajuste de volemia e adequação da perfusão tecidual com uso de
inotrópicos, vasopressores e dispositivos de assistência ventricular, além de medidas
específicas, direcionadas para a etiologia do choque, como a revascularização precoce
nas síndromes coronarianas agudas.
Descritores: Balão Intra-Aórtico; Infarto do Miocárdio; Choque Cardiogênico.
Abstract
Cardiogenic shock is a clinical syndrome characterized by tissue hypoperfusion
secondary to cardiac dysfunction, in the absence of hypovolemia. Left ventricular failure complicating acute myocardial infarction is the main cause, although other relevant causes include mechanical complications of infarction, myocarditis, progression
of cardiomyopathies, acute non-ischemic valvular heart disease, and stress-induced
cardiomyopathies, for example. Despite therapeutic advances, it persists as a condition
of high mortality, and its incidence has not changed significantly in the last decades.
The onset of cardiogenic shock in patients with acute coronary syndromes frequently
occurs after hospital admission, reinforcing the importance of identifying predictors and
monitoring early signs of tissue hypoperfusion for prompt intervention. The diagnosis
is essentially clinical plus some additional tests such as electrocardiogram, myocardial
necrosis markers, echocardiogram, and coronary angiography, which are important for
defining the etiology, stratification of severity and prognosis. Proper management of
patients requires assessment of macro- and micro-hemodynamic parameters. The main
therapeutic goals include early restoration of tissue perfusion and recovery of ventricular
function. Treatment includes general medical care for patients with shock as optimizing
volemia and adjusting of tissue perfusion with inotropic agents, vasopressors and ventricular assist devices, as well as specific interventions focused on the shock etiology,
like early revascularization in acute coronary syndromes.
Descriptors: Intra-Aortic Balloon Pumping; Myocardial Infarction; Cardiogenic Shock.
Rev Soc Cardiol Estado de São Paulo 2016;26(1):14-20
ATUALIZAÇÃO NO MANEJO CLÍNICO DO CHOQUE CARDIOGÊNICO
Introdução
O choque cardiogênico é uma síndrome clínica caracterizada por hipoperfusão tecidual consequente à falência
cardíaca, associada à alta mortalidade. O coração, na
ausência de hipovolemia, é incapaz de manter o fluxo
sanguíneo adequado para atender as necessidades
metabólicas dos tecidos, ocorrendo disfunção orgânica
progressiva e potencialmente irreversível. É a causa mais
comum de morte após o infarto agudo do miocárdio (IAM).
Apesar dos avanços terapêuticos na cardiologia atual, não
houve redução significativa da sua incidência.
Historicamente, a taxa de mortalidade do choque cardiogênico pós-infarto era de 80%-90%. Estudos recentes
mostram redução significativa da mortalidade hospitalar
para aproximadamente 50%. Acredita-se que esta melhora
do prognóstico possa estar relacionada a terapias de reperfusão coronária precoce, promovendo redução no tamanho
da área isquêmica.1 O reconhecimento de fatores reversíveis
e o tratamento agressivo e precoce da fase aguda do quadro
são de grande importância para melhora do prognóstico.2
Definição
A definição do choque cardiogênico é determinada
pela combinação de parâmetros clínicos e hemodinâmicos.
Quando disponíveis, os dados hemodinâmicos obtidos com
a utilização de cateter de artéria pulmonar são importantes.
Os critérios mais utilizados são:
• Pressão arterial sistólica (PAS) < 80-90 mmHg (ou um
valor de 30 mmHg inferior ao nível basal, por 30 minutos
sem resposta a reposição volêmica).
• Índice cardíaco (IC) < 2-2,2 l/min/m2 com suporte inotrópico ou 1,8 l/min/m2 sem suporte terapêutico.
• Pressão de oclusão da artéria pulmonar (POAP) >
18 mmHg.
• Diferença arteriovenosa de oxigênio (CAV) > 5,5 ml/dL.
A utilização de metodologia não invasiva empregando-se
o ecocardiograma pode ser útil na ausência de monitorização
invasiva com o cateter de artéria pulmonar. Permite o diagnóstico de aumento das pressões de enchimento e mensuração
do grau de disfunção ventricular esquerda e direita.
Os parâmetros clínicos evidenciam sinais de má perfusão periférica, incluindo oligúria, extremidades frias e alterações neurológicas.
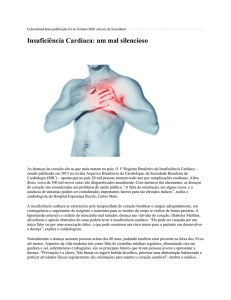
Mais recentemente, uma classificação criada a partir
do registro americano INTERMACS (Interagency Registry
for Mechanically Assisted Circulatory Support), definiu sete
perfis clínicos para portadores de insuficiência cardíaca,
tendo como objetivo melhor caracterizar esses pacientes
e identificar aqueles com doença avançada que possam
se beneficiar de suporte circulatório mecânico. Pacientes
em choque cardiogênico podem ser enquadrados nos
seguintes perfis:3,4
INTERMACS 1: choque cardiogênico crítico com hipotensão persistente, necessidade crescente de suporte
inotrópico, presença de hipoperfusão tecidual crítica e
acidose metabólica.
INTERMACS 2: situação de deterioração clínica progressiva, apesar de suporte inotrópico endovenoso, podendo
haver piora da função renal, retenção de fluidos e comprometimento do estado nutricional.
Rev Soc Cardiol Estado de São Paulo 2016;26(1):14-20
INTERMACS 3: pacientes estáveis, porém, dependentes de suporte inotrópico endovenoso para manter pressão
arterial, perfusão tecidual e estado nutricional. Demonstram
falências repetidas nas tentativas de retirada dos inotrópicos
com hipotensão sintomática.
Etiologia
Diversas causas podem comprometer o desempenho
cardíaco com consequente redução da oferta de oxigênio
aos tecidos e surgimento do estado de choque cardiogênico (Tabela 1).
A etiologia mais comum do choque cardiogênico é o
IAM com incidência estimada de 5 a 8%. Esta complicação
poderá ocorrer consequente a qualquer tipo de síndrome
coronária aguda, porém mais frequentemente no IAM com
elevação do segmento ST.5
A extensão do infarto, com comprometimento maior
que 40% da massa muscular do ventrículo esquerdo está
associada ao surgimento de choque cardiogênico. Complicações mecânicas do infarto também são causa de choque.
Ruptura do septo interventricular, ruptura da parede livre
do ventrículo esquerdo e ruptura do músculo papilar com
instalação de insuficiência mitral aguda. Os diagnósticos
destas complicações mecânicas são muito importantes
uma vez que medidas terapêuticas específicas devem ser
instituídas imediatamente.
Tabela 1: Principais etiologias do choque cardiogênico
Infarto Agudo do Miocárdio
Perda de massa ventricular
Falência de ventrículo direito
Complicações mecânicas
Ruptura de músculo papilar com insuficiência mitral aguda
Ruptura do septo interventricular
Ruptura da parede livre do ventrículo esquerdo
Cardiomiopatia
Descompensação aguda
Evolução da doença
Miocardite
Disfunção miocárdica
Pós-circulação extracorpórea
Pós-retorno à circulação espontânea
Sepse
Obstrução de via de saída do ventrículo esquerdo
Estenose aórtica
Cardiomiopatia hipertrófica obstrutiva
Obstrução de via de entrada do ventrículo esquerdo
Estenose mitral
Mixoma de átrio esquerdo
Insuficiência aórtica aguda
Tromboembolismo pulmonar
Hipertensão pulmonar evolutiva ou aguda
Taquiarritmias
Taquicardiomiopatias
Bradiarritmias
15
O reconhecimento da participação da falência do ventrículo direito como contribuinte do choque cardiogênico
é fundamental, pois nestes casos há uma dependência
hemodinâmica de pré-carga adequada para melhor desempenho cardíaco.
Em paciente portadores de insuficiência cardíaca
crônica, a instalação do choque cardiogênico pode estar
associada à presença de fatores de descompensação, tais
como infecções, arritmias, embolia pulmonar, isquemia,
insuficiência renal, anemia dentre outros, ou ser a manifestação da evolução da doença de base.
Outras causas de choque cardiogênico devem ser destacadas: valvopatias agudas secundarias a dissecção da
aorta (insuficiência aórtica), endocardite infecciosa, afecções degenerativas (insuficiência mitral aguda em prolapso
da valva mitral), cardiomiopatia induzida pelo estresse emocional ou respiratório (Takotsubo), que se apresenta com dor
torácica, elevação do segmento ST e aumento de enzimas
cardíacas na ausência de lesão coronária obstrutiva.6,7
FISIOPATOLOGIA
16
O choque cardiogênico é uma situação clínica na qual
existe progressiva deterioração da função cardíaca juntamente com má perfusão sistêmica e insuficiência funcional
de órgãos. Trata-se de uma síndrome que envolve todo o
sistema circulatório, com complexos mecanismos neuro-hormonais participando da gênese de sintomas. A disfunção miocárdica que se instala (sistólica e diastólica) ocasiona hipotensão, redução do débito cardíaco e redução da
pressão de perfusão coronária, com perda progressiva da
função miocárdica e aumento da pressão diastólica final do
ventrículo esquerdo com consequente congestão pulmonar
e hipóxia. Estabelece-se assim um ciclo vicioso com queda
progressiva do débito cardíaco, piora da perfusão tecidual e
do próprio coração, particularmente na presença de doença
coronária obstrutiva. Dentro deste ciclo vicioso, há também
a participação de mecanismos neuro-hormonais ativados
com objetivo inicial de manutenção da perfusão para órgãos vitais. Há aumento da atividade do sistema nervoso
simpático e do sistema renina-angiotensina-aldosterona,
desencadeando vasoconstricção periférica e aumento da
pós-carga além de retenção de sal e água aumentando
o volume intravascular e a pré-carga. Nesta condição, os
mecanismos ativados tornam-se inapropriados e acarretam
piora progressiva do desempenho ventricular.5,8,9
Novas evidências sugerem que, paralelamente, ocorre
uma resposta inflamatória sistêmica, com ativação do sistema do complemento, liberação de citocinas inflamatórias,
produção de óxido nítrico e inapropriada vasodilatação periférica, sendo este mais um fator envolvido na redução da
perfusão sistêmica e coronária.2
Vale ressaltar também que em situações de choque ha
priorização de fluxo sanguíneo para o coração e o cérebro,
em detrimento de órgãosesplâcnicos, gerando isquemia
da mucosa intestinal. Este componente facilita a translocação bacteriana e o surgimento de infecção. A ocorrência
de culturas positivas pode chegar a mais de 70% nestes
pacientes, devendo ser considerados valores diminuídos
da resistência vascular sistêmica como sinalizadores de
sepse adicional.
FATORES DE RISCO
Os fatores associados a maior chance de evolução para
choque cardiogênico pós IAM são: idade, infarto da parede
anterior, presença de elevação do ST, história prévia de angina, infarto e/ou insuficiência cardíaca, doença coronária
multiarterial, pacientes com diabetes mellitus. Nos estudos
GUSTO I10 e GUSTO III,11 os principais fatores preditores
de choque cardiogênico foram: idade, frequência cardíaca, pressão arterial sistólica e classe funcional de Killip.12
Com relação ao tempo como fator de ocorrência de choque
cardiogênico, vale ressaltar que apenas 20% dos choques
pós-infarto estão presentes na admissão hospitalar. Por isso,
durante a internação deve-se manter contínua observação
do paciente, visando o reconhecimento precoce de sinais
clínicos e laboratoriais indicadores de choque.13
Algumas vezes, pacientes com IAM apresentam durante
a evolução inicial complicações como arritmias, congestão
pulmonar, hipertensão arterial sistêmica e dor. O tratamento
instituído para estas complicações poderá precipitar a instalação do choque nos pacientes de risco.
ASPECTOS CLÍNICOS
O quadro clínico é de insuficiência cardíaca associada à
hipotensão arterial, na ausência de hipovolemia. O diagnóstico
do choque cardiogênico é essencialmente clínico. Exames
complementares podem oferecer indícios da existência de
cardiopatia de base e da presença de isquemia miocárdica,
além de fornecerem informações prognósticas. Na avaliação
clínica, algumas características, apesar de não específicas,
são importantes:2
• Distensão venosa jugular importante sugere aumento da
pré-carga cardíaca e elevação de pressões de enchimento.
• Pacientes com insuficiência cardíaca crônica podem
apresentar pulmões sem estertores crepitantes, mesmo
em situações de congestão e elevadas pressões de enchimento. Este fenômeno é explicado por mecanismos
compensatórios do sistema linfático pulmonar.
• Cianose de extremidades pode refletir baixo débito cardíaco e aumento da resistência vascular periférica.
• Redução da pressão de pulso (diferença entre as pressões sistólica e diastólica), podem refletir estados de
baixo débito cardíaco.
A hipotensão arterial sistêmica é um dos aspectos mais
importantes na caracterização da síndrome do choque cardiogênico. Os valores de corte mais comumente utilizados para definição de hipotensão são PAS<80 - 90 mmHg. A repercussão dos
níveis pressóricos é decorrente da condição cardíaca de base
do indivíduo e também do método de mensuração da pressão
arterial, tendo em vista que, em pacientes críticos, a pressão não
invasiva pode subestimar os valores em até 40 mmHg.
O diagnóstico de choque cardiogênico pode ser realizado
em paciente com sinais de hipoperfusão tecidual associado à
pressão arterial sistólica > 90 mmHg em algumas situações:
• Necessidade de medicações e/ou dispositivos são necessários para manter parâmetros hemodinâmicos dentro da normalidade.
• Presença de hipoperfusão sistêmica associada a baixo débito com pressão arterial preservada devido à vasoconstrição.
• Queda 30 mmHg da pressão arterial média em pacientes previamente hipertensos.
Rev Soc Cardiol Estado de São Paulo 2016;26(1):14-20
ATUALIZAÇÃO NO MANEJO CLÍNICO DO CHOQUE CARDIOGÊNICO
MONITORIZAÇÃO HEMODINÂMICA E
METABÓLICA
Associada à anamnese e ao exame físico detalhado,
os parâmetros hemodinâmicos e metabólicos são de grande utilidade para avaliação do choque de origem cardíaca
(Tabela 2). A monitorização hemodinâmica deve incluir a
mensuração invasiva da pressão arterial sistêmica, medida
de pressão venosa central, medidas do cateter de artéria
pulmonar. O conjunto de dados obtidos da monitorização
hemodinâmica e laboratorial pode ser agrupado em parâmetros de macro-hemodinâmica e micro-hemodinâmica
global, esta última refletindo o estado perfusional e metabólico do paciente.
Parâmetros de Macro-hemodinâmica
• Pressão arterial.
• Perfusão periférica/tempo de enchimento capilar.
• Diurese.
• Pressão venosa central.
• Débito cardíaco.
• Pressão de oclusão de artéria pulmonar.
Parâmetros de Micro-hemodinâmica
• Saturação venosa central.
• Lactato arterial.
• Excesso de bases.
• CAV.
Macro-hemodinâmica
Apesar da decrescente utilização, a monitoração invasiva com cateter de artéria pulmonar (Swan-Ganz) ajuda no
diagnóstico diferencial de causas de baixo débito, auxiliando
no manejo dos pacientes, além de fornecer informações
quanto ao prognóstico. Os parâmetros com maior impacto
prognóstico são o débito cardíaco e a POAP. Muitos estudos
clínicos utilizam parâmetros obtidos pelo cateter de Swan-Ganz para definição e diagnóstico de choque cardiogênico,
com valores muitas vezes variáveis. Podemos considerar
como valores discriminatórios de choque cardiogênico o
índice cardíaco (IC) 2,2 l/min/m2 para os pacientes com
algum suporte circulatório (inotrópico, vasopressor ou dispositivo circulatório) e IC 1,8 l/min/m2 para aqueles sem
suporte. A Tabela 2 sumariza os critérios hemodinâmicos
mais utilizados para definição de choque cardiogênico. Vale
lembrar que cerca de 20% dos pacientes com choque cardiogênico pós IAM apresentavam características de inflamação sistêmica, sendo a baixa resistência vascular sistêmica
não relacionada à infecção.1,13,14
O uso do cateter de artéria pulmonar no manejo do
choque cardiogênico não tem indicação rotineira, mas
pode auxiliar em alguns casos: pacientes com hipotensão
persistente, pacientes com refratariedade ao tratamento
farmacológico, quando as pressões de enchimento do
ventrículo esquerdo são incertas, e no diagnóstico de
complicações mecânicas associadas às síndromes coronárias agudas.
Estudo clínico randomizado, multicêntrico, avaliou 433
pacientes com insuficiência cardíaca grave e comparou um
grupo com estratégia guiada pela cateterização da artéria
pulmonar e outro, guiado apenas pelos dados clínicos. Foi
observado que a mortalidade ao final de 30 dias e após
seis meses não foi diferente entre grupos. Assim, o uso
do cateter pulmonar foi tão seguro quanto o tratamento
baseado em dados clínicos, porém, não melhorou os resultados finais.15
O ecocardiograma com Doppler permite o diagnóstico
diferencial das etiologias do choque cardiogênico. Identifica valvopatias, pericardiopatias, miocardiopatias, comprometimento da função do ventrículo direito, muitas vezes
responsável por quadros de choque secundário a tromboembolismo pulmonar.13
Micro-hemodinâmica
A saturação venosa central de oxigênio reflete o balanço
entre oferta e consumo de oxigênio a nível sistêmico. Quando o consumo estiver aumentado e o conteúdo arterial de
oxigênio for normal, uma saturação venosa de oxigênio baixa
expressa maior taxa de extração de oxigênio do leito arterial
para suprir a demanda aumentada e manter a homeostase
celular. A saturação venosa de oxigênio diminui quando a
oferta de oxigênio está reduzida ou a demanda sistêmica se
eleva, excedendo a oferta, sendo um marcador indireto de
fluxo e não um marcador de disóxia. Esta pode ser obtida
da veia cava superior (ScvO2) ou da artéria pulmonar (SvO2)
com valores de normalidade de 65% e 70%, respectivamente.
Nos cardiopatas crônicos, os valores de normalidade podem
variar entre 50%-60% devido ao aumento da taxa de extração
pelos tecidos, sem representar hipoperfusão tecidual. Para
melhor interpretação da SvcO2 ou da SvO2 é necessária
complementação da análise metabólica com o lactato sérico
e déficit de bases.16,17 Em estados de choque persistente, a
má perfusão miocárdica e dos tecidos periféricos desencadeia um desequilíbrio entre a oferta e consumo de oxigênio
o que favorece o metabolismo anaeróbico e resulta acidose
Tabela 2. Sinais clínicos e parâmetros hemodinâmicos no choque cardiogênico.
Baixo débito
Congestão
Sinais clínicos
Confusão mental
Agitação psicomotora
Diminuição da diurese
Pele fria
Cianose de extremidades
Sudorese
Enchimento capilar lento
Parâmetros hemodinâmicos
PAS < 90 mmHg
Exame físico
Hipotensão
IC 1,8 l/min/m2
Taquicardia
RVS > 2000 dyn s/cm5
Pulsos finos
CAV > 5,5 ml/dl
Dispneia
- POAP > 18 mmHg
B3
Taquipneia
Estertores pulmonares
Estase jugular
PAS: pressão arterial sistêmica, IC: índice cardíaco, RVS: resistência vascular sistêmica, CAV: diferença arteriovenosa de oxigênio, POAP: pressão de oclusão da artéria pulmonar.
Rev Soc Cardiol Estado de São Paulo 2016;26(1):14-20
17
lática. O lactato sérico é produzido a partir do metabolismo
celular intermediário da glicose e é um marcador de estresse metabólico. Níveis de lactato séricos elevados (acima de
2-4 mmol/l) são indicadores de pior prognóstico e refletem
a cascata final do desacoplamento entre oferta e demanda
de oxigênio. O excesso de bases padrão obtido a partir de
gasometrias fornece informações do equilíbrio ácido básico.18 Na vigência de função renal normal, a ocorrência de
negativação progressiva do excesso de bases é decorrente
da hipoperfusão tissular e consequente metabolismo anaeróbico, acumulando ânions fortes e ácidos. Valores abaixo
de -4 estão relacionados a pior prognóstico.
TRATAMENTO
Medidas Gerais
18
Choque cardiogênico é uma emergência médica, requerendo tratamento imediato pelo potencial de irreversibilidade das lesões aos órgãos vitais. Além das medidas
de suporte geral imediato, é necessária a identificação da
causa do choque para que medidas específicas sejam aplicadas. Outras intervenções também são importantes, como
a profilaxia de trombose venosa profunda e de sangramento
gastrointestinal (especialmente quando o paciente estiver
em ventilação mecânica por mais de 48 horas ou com
discrasia de coagulação). Inicialmente, deve-se proceder
como a conduta em qualquer choque: realizar reposição
volêmica - desde que não há congestão pulmonar clínica
e radiológica - visando a correção da hipovolemia e da hipotensão, oferecer oxigenoterapia e ventilação adequadas,
corrigir possíveis distúrbios eletrolíticos e/ou metabólicos e
arritmias potencialmente comprometedoras do débito cardíaco. A glicemia deve ser mantida entre 150-180 mg/dL.
O uso de inotrópicos no choque cardiogênico deve ser
iniciado nos pacientes com inadequada perfusão tecidual e
volemia adequada. A droga mais utilizada é a dobutamina,
que possui ação inotrópica positiva pelo efeito beta-adrenérgico predominante e a dose a ser empregada pode alcançar
até 20mcg/kg/min. Nos pacientes muito hipotensos, usar
inicialmente um agente vasopressor (dopamina ou noradrenalina) porque a ação de vasodilatação periférica da
dobutamina pode piorar a perfusão coronariana. De maneira
geral, os inotrópicos promovem melhora hemodinâmica em
curto prazo; porém, intensificam a isquemia e o consumo
de oxigênio no miocárdio.19
No caso de hipotensão arterial grave (PAS < 70 mmHg),
o agente a ser empregado é a noradrenalina, pois sua ação
beta-adrenérgica promove aumento da contratilidade miocárdica, do cronotropismo e, devido ao efeito alfa-agonista preponderante, há incremento significativo da resistência arterial
sistêmica, com elevação da pressão arterial média, apesar de
elevar o consumo de oxigênio e aumentar o trabalho cardíaco.
Recentemente, foi publicado um estudo20 que comparou
a eficácia entre dopamina e noradrenalina em diversos tipos
de choque. No subgrupo com choque cardiogênico houve
melhores desfechos com o uso da noradrenalina, sendo
ainda necessários estudos adicionais para esta validação.
Os inibidores da fosfodiesterase (milrinone) possuem
efeito inotrópico semelhante à dobutamina, porém, com efeito
vasodilatador associado. Por isso, atenção especial deve ser
dada ao risco de piora da hipotensão e aumento da ocorrência de arritmias. Alguns estudos avaliaram os efeitos da
administração do levosimendan, droga sensibilizadora de cálcio, no baixo débito pós-infarto com resultados favoráveis.21
Os vasodilatadores atuam de forma benéfica na fisiopatologia do choque cardiogênico pela redução da pós-carga
aumentando, assim, o débito cardíaco. Quando a pressão
estiver estabilizada (PAS > 85-90 mmHg) considerar o uso
de vasodilatadores sistêmicos, principalmente os de ação
arterial e venosa, como o nitroprussiato de sódio. Eles são
a principal estratégia terapêutica no paciente com volemia
otimizada. Nos casos de pacientes com síndromes isquêmicas agudas preferir o uso de nitroglicerina.
Na evidência de edema pulmonar com a perfusão adequada, associar diuréticos, sempre lembrando que diurese
excessiva pode resultar em depleção intravascular grave,
mantendo hipotensão, hipoperfusão, extensão do infarto,
isquemia, acrescentando disfunção ao já comprometido
ventrículo esquerdo.
Dentre os dispositivos de assistência circulatória mecânica, o balão intra-aórtico (BIA) é o dispositivo mais utilizado
e disponível na prática clínica. Seu efeito hemodinâmico
ocasiona diminuição da pós-carga ao ventrículo esquerdo,
aumento do débito cardíaco, aumento da pressão de perfusão diastólica coronária e consequente melhora do fluxo
sanguíneo coronariano. Ao contrário dos agentes inotrópicos e dos vasopressores, o benefício da terapia com BIA
ocorre sem aumento do consumo de oxigênio miocárdico.
O BIA é indicado para pacientes com volemia ajustada,
em uso de doses plenas de inotrópicos (muitas vezes com
associação de inotrópicos), e que persistem com sinais de
má perfusão tecidual. Pode ser usado como suporte até a
realização de terapia definitiva (revascularização miocárdica,
transplante cardíaco, por exemplo), ou como suporte até a
resolução dos fatores precipitantes, tratamento cirúrgico de
valvopatias ou complicações mecânicas do IAM.
Apesar da utilização rotineira do BIA há décadas no
tratamento do IAM complicado com choque cardiogênico,
não se pode afirmar que esta estratégia está associada à
melhora da sobrevida destes pacientes.22,23
O estudo retrospectivo de 223 pacientes com insuficiência cardíaca refratária que foram tratados com BIA na
Unidade Clínica de Terapia Intensiva do Instituto do Coração, HC-FMUSP, no período de 5 anos, evidenciou que em
93% dos casos a indicação foi síndrome do baixo débito
cardíaco. O BIA foi utilizado por um tempo médio de 19
dias em pacientes com disfunção do ventrículo esquerdo
importante, fração de ejeção média de 24%. Após 48 horas
da passagem do BIA, houve melhora significativa dos parâmetros laboratoriais de avaliação micro-hemodinâmica, com
redução do lactato sérico, aumento da SvO2 e dos níveis
de bicarbonato. O BIA mostrou ser importante intervenção
terapêutica como ponte para o transplante cardíaco.24
Nos pacientes que persistem com quadro de hipoperfusão tecidual apesar do uso de inotrópicos, vasodilatadores, BIA e de procedimento de revascularização miocárdica, quando houver indicação, há a opção do uso de outro
dispositivo de assistência ventricular, considerado ponte
para transplante cardíaco, para recuperação, para decisão
terapêutica, ou ainda, servir como terapia de destino.
Rev Soc Cardiol Estado de São Paulo 2016;26(1):14-20
ATUALIZAÇÃO NO MANEJO CLÍNICO DO CHOQUE CARDIOGÊNICO
Medidas Específicas
Como a principal causa de choque cardiogênico é o IAM,
a abordagem fundamental é a rápida terapia de reperfusão
miocárdica, por angioplastia ou via abordagem cirúrgica. Esta
medida foi bem estabelecida no estudo SHOCK1. Neste,
pacientes com idade inferior a 75 anos, que se encontravam
dentro das primeiras 36 horas do início do IAM e em até 18
horas do início do choque cardiogênico se beneficiaram da
terapia de reperfusão miocárdica, com aumento da sobrevida em 13% após um ano de seguimento.
Sabe-se que 40% dos pacientes com choque cardiogênico pós-infarto apresentam idade acima de 75 anos. Porém,
para esta população de idosos, há controvérsias quanto a
melhora da sobrevida com revascularização precoce quando
comparada a estratégia conservadora do tratamento clínico
inicial. No estudo SHOCK não houve diferença de mortalidade no subgrupo de pacientes com idade acima de 75 anos.
O julgamento clínico é importante na decisão da indicação
de intervenção coronária percutânea nos idosos com IAM e
choque cardiogênico. Devemos considerar a presença de
comorbidades com disfunção orgânica como insuficiência
renal crônica, insuficiência cardíaca, doenças hematológicas
e quadros demências para melhor decisão terapêutica.1,2
A escolha entre angioplastia percutânea ou cirurgia de
revascularização miocárdica é um tema controverso na
vigência de choque cardiogênico. A cirurgia representa a
opção nos casos com complicações mecânicas (comunicação interventricular, insuficiência mitral aguda e rotura
de parede livre de ventrículo esquerdo) e naqueles com
contraindicação ou falha do tratamento percutâneo. Entretanto, a análise do estudo SHOCK1 mostrou evolução
semelhante entre os grupos submetidos à revascularização,
apesar dos pacientes do grupo cirúrgico terem apresentado
maior incidência de diabetes, lesão de tronco de coronária
ou lesões triarteriais.
Em centros onde não há serviço de angiografia de emergência, é recomendada a transferência do paciente para
locais com disponibilidade do procedimento. Se para isso
houver uma longa demora, principalmente nos casos com
menos de 3 horas de evolução do IAM, é aconselhável o
início precoce de trombolíticos, apesar do impacto na mortalidade de pacientes com choque cardiogênico pós-IAM não
estar claramente definido com o uso destas medicações.
Quando agentes trombolíticos são utilizados, associar drogas vasoativas e/ou BIA na tentativa de normalizar pressão
de perfusão coronária, já que a trombólise é relativamente
ineficaz quando administrada em pacientes hipotensos.
Medidas rotineira no tratamento do IAM como uso do
ácido acetilsaliscílico, clopidrogel, outros antiagregantes
plaquetários, terapias como o uso de heparinas devem
ser instaladas de acordo com as diretrizes do tratamento
do IAM. Betabloqueadores e antagonistas dos canais de
cálcio não devem ser utilizados em pacientes em choque
cardiogênico devido efeito inotrópico negativo.5,25,26
CONSIDERAÇÕES FINAIS
A melhora do prognóstico de pacientes com choque
cardiogênico secundário ao IAM foi obtida com a utilização de estratégias de reperfusão coronária precoce e vem
incentivando cada vez mais uma abordagem agressiva na
população de risco para o desenvolvimento de choque
cardiogênico, para que, desta forma, talvez se consiga, no
futuro, a redução da incidência e das ainda elevadas taxas
de mortalidade deste quadro clínico.
Conflitos de interesse
Os autores declaram não possuir conflitos de interesse na realização deste trabalho.
Referências
1. Hochman JS, Sleeper LA, Webb JG, Sanborn TA, White HD, Talley JD, et al. Early revascularization in acute myocardial infarction
complicated by cardiogenic shock. SHOCK Investigators. Should
We Emergently Revascularize Occluded Coronaries for Cardiogenic Shock. N Engl J Med. 1999;341(9):625-34.
2. Reynolds HR, Hochman JS. Cardiogenic shock: current concepts and improving outcomes. Circulation. 2008;117(5):686-97.
3. Dutt DP, Pinney SP. Clinical variability within the INTERMACS
1 profile: implications for treatment options. Curr Opin Cardiol. 2014;29(3):244-9.
4. Stevenson LW, Pagani FD, Young JB, Jessup M, Miller L, Kormos RL, et al. Interagency Registry of Mechanically Assisted
Circulatory Support. J Heart Lung Transplant. 2009;28(6): 535-41.
5. Hollenberg SM, Kavinsky CJ, Parrillo JE. Cardiogenic shock. Ann
Intern Med. 1999,131(1):47-59.
6. V Diretriz da SociedadeBrasileira de Cardiologia Sobre o Tratamento do Infarto Agudo do Miocárdio com Supradesnível do
Segmento ST. Arq Bras Cardiol. 2015;105(2):1-105.
7. Templi C, Ghadri JR, Diekmann J, Napp LC, Bataiosu DR, Jaguszewski M, et al. Clinical Features and outcomes of Takotsubo
(stress) cardiomyopathy. N Engl J Med. 2015;372:929-38.
8. Califf RM, Bengtson JR. Cardiogenic shock. N Engl J Med.
1994;330:1724-30.
Rev Soc Cardiol Estado de São Paulo 2016;26(1):14-20
9. Barry WL, Sarembock IJ. Cardiogenic shock: therapy and prevention. Clin Cardiol. 1998;21:72-80.
10.Berger PB, Holmes DR Jr, Stebbins AL, Bates ER, Califf RM, Topol
EJ. Impact of an aggressive invasive catheterization and revascularization strategy on mortality in patients with cardiogenic shock
in the Global Utilization of Streptokinase and Tissue Plasminogen Activator for Occluded Coronary Arteries (GUSTO-I) trial.
An Observational study. Circulation. 1997;96(1):122-7.
11.A comparison of reteplase with alteplase for acute myocardial infarction. The Global Use of Strategies to Open Occluded Coronary Artery (GUSTO-III) Investigators. N Engl J Med.
1997;337(16):1118-23.
12.Killip T 3rd, Kimball JT. Treatment of myocardial infarction in a
coronary care unit. A two year experience with 250 patients. Am
J Cardiol. 1967;20(4):457-64.
13.Pfisterer M. Right ventricular involvement in myocardial infarction
and cardiogenic shock. Lancet. 2003;362(9381):392-4.
14.Swan HJ, Ganz W, Forrester J, Marcus H, Diamond G, Chonette
D. Catheterization of the heart in man with use of a flow direct
balloon-tipped catheter. N Engl J Med. 1970;283:441-51.
15.Shah MR, O’Connor CM, Sopko G, Hasselblad V, Califf RM, Stevenson LW. Evaluation Study of Congestive Heart Failure and
Pulmonary Artery Catheterization Effectiveness (ESCAPE): de-
19
sign and rationale. Am Heart J. 2001;141(4):528-35.
16.Vincent JL, Rhodes A, Perel A, Martin GS, Della Rocca G, Vallet
B, et al. Clinical review: update on hemodynamic monitoring – a
consensus of 16. Crit Care. 2011;15(4):229.
17.Walley KR. Use of central venosus oxygen saturation to guide
therapy. Am J Respir Care Mod. 2011;184: 514-20.
18.Amaral AC, Park M. Monitorização do balanço entre oferta e
consume de oxigênionasíndrome do choque. Uma revisãosobresignificadofisiopatológico e clínico da saturaçãovenosa central
(ScvO2) e da saturaçãomista de oxigênio (SvO2). Rev Bras Ter
Intensiva. 2004;16(4):271-5.
19.McMurray JJ, Adamopoulos S, Anker SD, Auricchio A, Böhm
M, Dickstein K, et al.; ESC Committee for Practice Guidelines.
ESC Guidelines for the diagnostic and treatment of acute and
chronic heart failure 2012: The Task Force for the Diagnosis
and Treatment of Acute and Chronic Heart Failure 2012 of the
European Society of Cardiology. Developed in collaboration with
the Heart Failure Association (HFA) of the ESC. Eur Heart J.
2012;33(14):1787-847.
20.De Backer D, Biston P, Devriendt J, Madl C, Chochrad D, Aldecoa
C, et al. Comparison of dopamine and norepinephrine in the
treatment of shock. N Engl J Med. 2010;362(9):779-89.
21.Follath F, Cleland JG, Just H, Papp JG, Scholz H, Peuhkurinen
K, et al. Committee and Investigators of the Levosimendan In-
fusion versus dobutamine (LIDO) Study. Efficacy and safety of
intravenous levosimendan compared with dobutamine in severe
low-output heart failure (the LIDO study) a randomized double-blind trial. Lancet. 2002;360:196-202.
22.Thiele h, Zeymer U, Neumann FJ, Ferenc M, Olbrich HG, Hausleiter J, et al. For the IABP-SHOCK II trial Investigators. Intraortic
balloon support for myocardial infarction with cardiogenic shock.
N engl J Med. 2012;367:1287-96.
23.Thiele h, Zeymer U, Neumann FJ, Ferenc M, Olbrich HG, Hausleiter J, et al. Intra-aortic balloon counterpulsation in acute myocardial infarction compliated by cardiogenic shock (IABP-SHOCK II):
final 12 month results of a randomised, open-label trial. Lancet.
2013;382:1638-45.
24.Bezerra CG, Adam EL, Baptista ML Terapia de contrapulsação
aórtica em pacientes com insuficiência cardíaca avançada:
análise do registro TBRIDGE. Arq Bras Cardiol, (no prelo) 2015.
25.Sakai K, Nakagawa Y, Soga Y, Ando K, Yokoy H, Iwabuchi M,
et al. Comparison of 30-day outcome in patientsor=75 years of
age with acute myocardial infarction treated by primary coronary
angioplasty. Am J Cardiol. 98(8):1018-21.
26.Chen ZM, Jiang LX, Chen YP, Xie JX, Pan HC, Peto R, et al.;
COMMIT (ClOpidogrel and Metoprolol in Myocardial Infarction
Trial) collaborative group. Addition of clopidogrel to aspirin in
45,852 patients with acute myocardial infarction: randomized
placebo-controlled trial. Lancet. 2005;366(9797):1607-21.
20
Rev Soc Cardiol Estado de São Paulo 2016;26(1):14-20
revisão/review
INDICAÇÕES DE DISPOSITIVOS MECÂNICOS DE
SUPORTE NA INSUFICIÊNCIA CARDÍACA REFRATÁRIA
INDICATIONS OF MECHANICAL SUPPORT DEVICES IN REFRACTORY HEART FAILURE
Resumo
Elias Knobel1
Bruno Biselli2
Paulo Manuel Pêgo
Fernandes2
1. Hospital Israelita Albert Einstein,
São Paulo,Brasil .
2. Instituto do Coração do Hospital
das Clínicas da Faculdade de
Medicina da Universidade
de São Paulo, São Paulo, Brasil.
Correspondência:
Bruno Biselli. Endereço: Av. Dr Enéas
Carvalho de Aguiar, 44.
[email protected].
A insuficiência cardíaca refratária e o choque cardiogênico estão relacionados a
elevadas taxas de mortalidade e a baixa qualidade de vida. As estratégias de tratamento
para esses pacientes foram limitadas, nos últimos anos, às terapias farmacológicas que
pouco modificaram a evolução da doença. Entretanto, com o desenvolvimento tecnológico em dispositivos mecânicos de suporte circulatório, diversas modalidades terapêuticas
utilizando diferentes tipos de tecnologia proporcionam melhor suporte hemodinâmico,
diminuição e reversão de disfunções orgânicas causadas pela insuficiência cardíaca.
Esses dispositivos quando indicados corretamente melhoram os desfechos clínicos de
pacientes que aguardam transplante cardíaco e dos que não são candidatos a transplante. Atualmente, observam-se indicações cada vez mais precoces de dispositivos de
suporte circulatório, tornando-os uma terapia essencial no manejo de pacientes com
insuficiência cardíaca refratária ou choque cardiogênico. Esta revisão abordará os principais tipos de dispositivos disponíveis em nosso país e suas indicações.
Descritores: Coração Auxiliar, Circulação Assistida, Suporte Circulatório Mecânico, Insuficiência Cardíaca, Choque Cardiogênico, Transplante de Coração.
21
Abstract
The refractory heart failure and cardiogenic shock are related to high rates of mortality and
poor quality of life. Treatment strategies for these patients have been limited in the last years
to pharmacological therapies that change only slightly the evolution of the disease. However,
with technological advances in mechanical devices for circulatory assistance, various therapeutic modalities using different types of technology provide better hemodynamic support,
reduction and reversal of organic dysfunction caused by heart failure. When properly indicated, these devices can provide better clinical outcomes of patients on heart transplantation
waiting list and those who are not candidates for transplantation. Contemporarily, indications
for mechanical support devices are occurring increasingly earlier, making them an essential
therapy in the management of patients with refractory heart failure or cardiogenic shock.
This review covers the different types of devices available in our country and its indications.
Descriptors: Heart-Assist Devices, Assisted Circulation, Mechanical Circulatory Support,
Heart Failure, Cardiogenic Shock, Heart Transplantation
Introdução
Nos últimos 20 anos diversas terapias farmacológicas
e dispositivos como cardiodesfibrilador implantável e terapia de ressincronização melhoraram significativamente
o prognóstico dos pacientes com insuficiência cardíaca
(IC) crônica. Porém, apesar dessa terapia otimizada, nota-se em alguns pacientes uma progressão de sintomas e
refratariedade ao tratamento, com comprometimento hemodinâmico e múltiplas hospitalizações.1
Essa refratariedade ao tratamento clínico otimizado é
referida como IC refratária ou avançada e seus critérios são
descritos na Tabela 1.2
Rev Soc Cardiol Estado de São Paulo 2016;26(1):21-6
A IC avançada representacerca de 10% dos pacientes
com insuficiência cardiaca e está relacionada a uma baixa
qualidade de vida e múltiplas internações. Nos últimos 15
anos, nenhuma droga nova mostrou beneficio em reduzir a mortalidade desse tipo de paciente e a progressão
da doença ainda parece ser inevitável acarretando um
prognóstico pior em relação aos pacientes com IC estáveis.3 A taxa de mortalidade desses pacientes gira em
torno de 50% em 1 ano e o cenário é ainda mais dramático
naqueles internados e dependentes de inotrópicos cuja a
mortalidade anual chega a mais de 75%.4,5
O transplante cardíaco (TC) é o único tratamento definitivo
Tabela 1. Critérios de insuficiência cardíaca avançada.
Em pacientes com terapia farmacológica otimizada são
necessários que todos abaixo estejam presentes:
IC classe funcional da New York Heart Association III ou IV.
Congestão pulmonar e/ou sistêmica; e/ou de redução de débito
cardíaco em repouso com hipoperfusão periférica.
Evidência objetiva de disfunção cardíaca importante: Fração de
ejeção de ventrículo esquerdo < 30%, ou Comprometimento
importante diastólico do ventricular esquerdo com padrão restritivo ou pseudonormal, ou Pressão média de enchimento de
ventrículo esquerdo (capilar pulmonar) > 16 mm Hg ou pressão
média de átrio direito > 12 mm Hg, ou Aumento importante dos
níveis de BNP ou NT-ProBNP.
Importante comprometimento de capacidade física com incapacidade para realizar exercício: Teste de caminhada de 6 minutos
< 300m, ou Consumo de oxigênio durante exercício máximo
< 14 ml/kg/minuto.
História de pelo menos uma hospitalização nos últimos 6 meses.
IC: insuficiência cardíaca
22
para esses pacientes com IC refratária. Está associado a uma
melhora significativa da qualidade de vida, com taxas de sobrevida próximas a 85% em 1 ano e sobrevida média maior
que 10 anos. Entretanto, a falta de doadores limita o número
de procedimento no mundo inteiro tornando-o estável nos
últimos 25 anos e muito aquém da necessidade em relação
ao número de pacientes com IC avançada.3,6
Nesse cenário, cresceu o interesse por dispositivos mecânicos de suporte circulatório (DMSC) que em pacientes
candidatos a TC mantêm a estabilidade hemodinâmica, revertem disfunções orgânicas causadas pela IC avançada
e aumentam a sobrevida enquanto aguardam um doador
compatível, resultando em diminuição do risco de complicações peri-operatórias do transplante.5,6 Além disso, os
DMSC são utilizados em pacientes possivelmente candidatos ao TC; em situações com potencial melhora da função
cardíaca após a descompressão do ventrículo esquerdo
(VE); e em pacientes selecionados não elegíveis ao TC com
objetivo de melhora na qualidade de vida e sobrevida.7
Uma crescente melhoria na tecnologia e na disponibilidade dos DMSC, tornaram esses equipamentos menores,
mais duráveis e fáceis de serem implantados. Nos últimos
anos, observa-se uma mudança no perfil de implante de
dispositivos para pacientes com IC avançada havendo
uma tendência de serem indicados em estágios mais
precoces da doença.
Tipos de dispositivos mecânicos
De maneira geral, os DMSC podem ser divididos em dispositivos temporários e dispositivos de longa permanência
de acordo com o tempo de uso do suporte.
Os dispositivo temporários são utilizados para o
resgate e suporte hemodinâmico em pacientes com
choque cardiogênico refratário. Os objetivos de terapia dos
dispositivos temporários são:
Ponte para TC: pacientes com choque cardiogênico refratário e candidatos ou em fila de espera para TC na qual
a expectativa de transplante não seja prolongada;
Ponte para recuperação: destinado a pacientes com
choque cardiogênico refratário nos quais existe possibilidade de recuperação da função ventricular como por
exemplo: após infarto agudo do miocárdio (IAM), miocardite
fulminante, miocardiopatia por stress (Takotsubo), periparto
e pós cardiotomia;
Ponte para decisão: quando há necessidade de suporte
circulatório hemodinâmico imediato por choque cardiogênico refratário e alto risco de mortalidade precoce, porém
ainda não é possível definir qual estratégia de tratamento.
Ou quando o paciente é um potencial candidato a TC ou
implante de um dispositivo de longa permanência, porém
apresenta no momento da indicação da assistência circulatória, condições clinicas proibitivas (ex: hipertensão pulmonar, neoplasias com potencial cura, disfunção orgânica
significativa) e que se forem modificadas poderiam permitir
a candidatura desse paciente ao transplante ou ao dispositivo de longa permanência;
Procedimentos de alto risco: alguns dispositivos como
balão intra-aórtico (BIA), Impella® e Tandem Heart® podem
ser utilizados como terapia de suporte hemodinâmico
adjuvante durante procedimentos cardíacos de alto risco
(cirurgia cardíaca, procedimentos percutâneo coronariano,
valvares ou ablativos). As situações que elevam o risco de
procedimentos percutâneos nos quais se deve considerar
o uso desse tipo de DMSC são pacientes de alto risco
(ex: idade avançada, disfunção ventricular importante),
lesões coronarianas importantes (ex: lesões de tronco de
coronária esquerda, lesões ostiais, lesões de bifurcações)
e procedimentos durante apresentação clínica de choque
cardiogênico ou IC descompensada8.
Os dispositivos temporários disponíveis no Brasil e suas
principais características estão descritos na Tabela 2.
Os dispositivos de longa permanência são utilizados para
estabilização hemodinâmica, melhora na qualidade de vida e
sobrevida de pacientes com IC avançada. Esses dispositivos
possibilitam a reversão de disfunções orgânicas, normalizam
a ativação neuro-hormonal, permitem a desospitalização e
podem diminuir a hipertensão pulmonar, evitando a progressão da disfunção do ventrículo direito (VD) e melhorando a
probabilidade de sucesso de um futuro TC6 .
Tabela 2: Tipos e características de dispositivos temporários disponíveis no Brasil.
BIA
Mecanismo
ECMO
Tandem Impella
Centrimag® Excor®
Heart® CP®
Pneu- Centrífu- CentrífuAxial
mático go
go
Centrífugo
Percutâneo /
Cirúrgico
Via de Percu- Cirúrgi- Percutâ- Percupor toracoAcesso tâneo co por neo
tâneo
tomia
toracotomia
Suporte
0,5 l/
hemodimin
nâmico
3,7 l/
> 4,5 l/
4 l/min
min
min
Tempo Dias Dias
de Su- -sema- -Sema- Dias
porte nas
nas
Dias
Pulsátil
Cirúrgico por
toracotomia
Até 8 – 10 Até 8 l/
l/min
min
Semanas
-meses
Semanas
-meses
BIA: balão intra-aórtico; ECMO: oxigenação por membrana extracorpórea.
Rev Soc Cardiol Estado de São Paulo 2016;26(1):21-6
INDICAÇÕES DE DISPOSITIVOS MECÂNICOS DE SUPORTE NA INSUFICIÊNCIA CARDÍACA REFRATÁRIA
Os objetivos de implante de dispositivos de longa permanência são:
Ponte para TC: em pacientes com IC avançada e expectativa de espera em fila de TC prolongada. Em centros experientes, devido o tempo de espera em fila de
TC longo e os resultados positivos de implante de DSCM
de longa permanência, muito pacientes com IC avançada são referenciados para o implante destes ao invés de
suporte circulatório mecânico de curta permanência como
ponte para TC. Dados recentes reportam que as taxas de
sobrevida em 1 ano com o dispositivo de fluxo continuo
de longa permanência HeartMate II como ponte para TC
giram em torno de 85%9.
Terapia de destino: para pacientes selecionados não elegíveis para TC devido idade ou comorbidades com objetivo
de promover suporte circulatório permanente, melhorar a
qualidade de vida, sobrevida e prognóstico em relação o tratamento clínico exclusivo.10 O estudo ADVANCE, utilizando
o dispositivo de fluxo contínuo HeartWare como terapia de
destino, reportou uma sobrevida de 92% em seis meses
e 84% em 1 ano em pacientes com IC avançada.11
Graças a melhora de tecnologia e resultados de
desfechos superiores em relação ao tratamento clínico, um número crescente desses dispositivo de longa
permanência vêm sendo implantados, principalmente
nos países desenvolvidos, superando inclusive o número
anual de TC realizados.12 Atualmente, mais de 95% dos
dispositivos de longa permanência implantados são de
fluxo contínuo. No Brasil, a experiência com esses dispositivos ainda é incipiente.13
Os DMSC podem ser classificados ainda em univentricular (esquerdo ou direito) ou biventricular. O suporte
biventricular está indicado quando há disfunção ventricular
direita importante prévia a um implante de suporte mecânico esquerdo ou quando o paciente evolui com disfunção de VD após o implante da assistência esquerda. Na
ECMO veno-arterial o suporte circulatório é biventricular
e o dispositivo permite o suporte ventilatório por uso de
membrana de oxigenação.8
Classificação INTERMACS
No contexto da IC avançada, a classificação clinica da
New York Heart Association (NYHA) deixa de ser útil em
relação ao prognóstico e indicação de terapias avançadas
como DMSC, visto que abrange uma grande variedade
de situações clínicas (desde pacientes ambulatoriais estáveis até internados com choque cardiogênico refratário).
Assim, com o objetivo de classificar mais adequadamente
os pacientes com IC avançada, facilitando o entendimento
do estado hemodinâmico, predizendo o tempo em que a
intervenção deve ser realizada e estratificando o risco do
implante, a Interagency Registry of Mechanically Assisted
Circulatory Support (INTERMACS) criou a classificação
INTERMACS composta de 7 perfis clínicos (Figura 1).14
Apesar de prático, observou-se que a classificação
INTERMACS nem sempre caracterizava o perfil hemodinâmico proposto em alguns pacientes. Assim, com objetivo de melhorar essa classificação, sugeriu-se aplicar aos
perfis três variáveis clínicas que potencialmente aumentam
a gravidade dos pacientes: arritmias ventriculares/presença
Rev Soc Cardiol Estado de São Paulo 2016;26(1):21-6
de CDI (cardioversor desfibrilador implantável), presença de
DMSC de curta permanência e hospitalizações frequentes.14,15
O ultimo registro INTERMACS aponta que a maioria
dos pacientes que implantaram DMSC de longa permanência estavam em perfil hemodinâmico 2 (38,4%). Cerca
de 28% em perfil 3 e 14% em perfis 1 e 4. Entretanto,
nota-se que existe uma tendência nos últimos anos de
aumento de número de implantes em pacientes menos
graves (perfis 3 e 4).12
Indicações de dispositivos
mecânicos de suporte
circulatório
A indicação de implante de dispositivos temporários
(extracorpóreo ou percutâneo) ou longa permanência é
determinada pela progressão da IC, o estado clínico do
paciente e a expectativa em relação a indicação (ponte
para TC, ponte para recuperação, ponte para decisão ou
terapia de destino).
Em algumas circunstâncias, como no caso de um choque cardiogênico súbito (ex: pós infarto agudo do miocárdio, pós parada cardiorrespiratória, miocardite fulminante),
não é possível determinar a elegibilidade para um TC ou
a expectativa de recuperação ventricular. Nessas situações, os DMSC temporários são preferíveis, possibilitando
a estabilização hemodinâmica, reversão de disfunções
orgânicas e recuperação neurológica, sendo indicados
com ponte para decisão ou recuperação. Eventualmente,
pacientes elegíveis ao TC em que a expectativa de espera
por um doador compatível seja rápida, o suporte com
DMSC temporários pode ser utilizado com ponte para
TC (Figura 2).16
Apesar de não haver critérios hemodinâmicos específicos para o implante de um DMSC, pacientes com
índice cardíaco < 2,0 L/min/m2, apesar do uso de inotrópicos, devem ser considerados para o suporte mecânico prontamente. Outros parâmetros como piora clínica hemodinâmica, necessidade de aumento de doses
de inotrópicos ou necessidade de vasopressores para
manter pressão arterial em pacientes com IC avançada
são importantes para uma decisão rápida em relação ao
implante de um DMSC.3
Em cenários de choque cardiogênico grave com hipotensão refratária e disfunção orgânica múltipla, é menos
provável que o BIA propicie suporte hemodinâmico necessário, devendo-se considerar rapidamente a instalação de
outros dispositivos circulatórios percutâneo que permitem
maiores fluxos (ex: Impella®, Tandem Heart® ou ECMO).8
Dispositivos de longa permanência devem ser considerados em pacientes com IC avançada em que a recuperação
de função ventricular é improvável e o estado do paciente
não possibilite a manutenção hemodinâmica normal e função orgânica preservada sem um dispositivos de assistência
ventricular7 ECMO Critérios utilizados para o implante de dispositivos de longa permanência em estudos randomizados
foram pacientes com disfunção sistólica de VE importante,
com limitação funcional significativa (classe funcional NYHA
IIIb ou IV persistente ou VO2 pico < 14 ml/kg/min) ou aqueles
internados com dependência de inotrópicos por mais de 14
dias, uso de BIA por mais de 7 dias.3,5,10
23
Estágio C
Estágio D
NYHA IV
NYHA IIIb/IV
% 1 ano de sobrevida
100%
50%
7
25%
6
NYHA III
5
Limitaçâo
ao exercício
Intolerância
ao exercício
10%
4
“Frequent
Flyer”
3
Estável com
dobutamina
0%
2
Piora clínica
progressiva
1
DMOS/
Óbito
“Crash and
burn”
Benefício de DAV
Bem Estabelecido
Não Estabelecido
TX e DAV
Não Indicados
Intervenção baseada
em variáveis:
nutrição e disfunção
orgânica progressiva
Elegível em
semanas ou
meses
Elegível em
poucas
semanas
Ponte p/ Decisão
Intervenção
nos próximos
dias
Intervenção
nas próximas
horas
Figura 1: Classificação INTERMACS.
IC avançada
Listado para transplante
Choque
cardiogênico
ou elegibilidade
para TC incerta
Inelegível para transplante
BIA, ECMO,
CENTRIMAG
TAMDEN HEART,
IMPELLA
24
Ponte
para tc
Terapia
de destino
DMSC de curta
permanência
Ponte
para
decisão
Recuperação
DMSC de longa permanência
Transplante possível
terapia de destino
Recuperação
Terapia de destino
Possível transplante
Figura 2: Fluxograma de implante de DMSC
A figura 2 mostra uma sugestão de fluxograma para
implantes de DMSC.16
Nos últimos anos, além de um maior número de implantes de DMSC de longa permanência em pacientes menos
graves (INTERMACS 3 e 4), existe uma tendência de aumento de número de implantes como terapia de destino (14,7%
dos implantes entre 2006-2007 versus 41,6% entre 20112013), ocorrendo também uma diminuição de pacientes
em fila de transplante suportados por DMSC nesse período
(42,4% versus 21,7% respectivamente).12
Devido ao prognóstico da doença, pacientes com critérios de IC avançada devem ser considerados para avaliação
de DSCM e TC. Entretanto, não existe critérios validados e
nem consenso sobre o momento exato de implante de um
dispositivo. Critérios prognósticos para IC como VO2 pico,
Heart Failure Survival Score e Seattle Heart Failure Model,
juntamente com avaliação do status do pacientes, presença de disfunções orgânicas (incluindo caquexia cardíaca),
dependência de inotrópicos e parâmetros hemodinâmicos
invasivos podem ajudar a predizer os pacientes que se beneficiariam de um DMSC.4,5,7,17
Recentemente o estudo ROADMAP avaliou o implante
do dispositivo HeartMate II em indivíduos com IC avançada,
ambulatoriais, classe funcional NYHA IIIb-IV (INTERMACS 4 a
7) comparado com terapia farmacológica otimizada. O desfecho primário, teste de caminhada de 6 minutos em 1 ano, foi
significativamente melhor no grupo DMSC comparado com a
terapia farmacológica (39% versus 21%; p = 0,012). As taxas
de mortalidade também foram menores no grupo dispositivo
(80 ± 4% versus 63 ± 5%; p = 0,022), apesar do número
maior de eventos adversos.18 Os resultados desse estudo
podem ampliar ainda mais as indicações de implante de
DMSC de longa permanência para pacientes com IC avançada ambulatoriais.
A tabela 3 resume as principais indicações de DMSC.
De modo geral, as contraindicações para implante de
DMSC incluem condições extra-cardíacas que limitam o
prognóstico do indivíduo como neoplasias com expectativa de vida curta, doença hepática ou pulmonar crônicas
irreversíveis, doenças neurológicas ou psiquiátricas e impossibilidade de anticoagulação. A presença de insuficiência
arterial periférica significativa é uma contraindicação para os
dispositivos percutâneos. Outras contraindicações específicas de cada tipo de dispositivo estão descrita na tabela 4.
Seleção do candidato a DSCM
O fator mais importante no sucesso do implante de
DMSC é a seleção adequada do paciente. Naqueles candidatos ao suporte circulatório, além de excluir potenciais
causas reversíveis de IC, deve-se realizar conjuntamente
toda a avaliação para TC, salvos os pacientes considerados
para terapia de destino por contraindicação formal ao transplante (ex: idade). Uma avaliação psicossocial direcionada
deve ser sempre realizada em candidatos a implante de
DSCM de longa permanência.
A seleção do candidato a DMSC deve envolver uma
avaliação criteriosa de aspectos que influenciarão no sucesso do implante. Preditores de pior prognostico pós
-operatório como INTERMACS 1 e 2, idade, desnutrição,
Rev Soc Cardiol Estado de São Paulo 2016;26(1):21-6
INDICAÇÕES DE DISPOSITIVOS MECÂNICOS DE SUPORTE NA INSUFICIÊNCIA CARDÍACA REFRATÁRIA
Tabela 3. Indicações de implante de DMSC.
DMSC de curta permanência8 DMSC de longa permanência7, 16
Choque cardiogênico refratário a Choque cardiogênico sem possibiliterapia farmacológica em
dade de recuperação ventricular ou
pacientes com IC crônica
recuperação ventricular improvável
descompensada.
sem DMSC de longa permanência.
Choque cardiogênico pós-IAM. Choque cardiogênico suportado
com DMSC de curta permanência,
sem possibilidade de descontinuação do suporte mecânico ou inotrópico.
Choque cardiogênico por
Dependência de inotrópico (> 14
cardiomiopatias reversíveis
dias) e expectativa de espera em fila
(miocardite fulminante, miocar- de TC prolongada.
diopatia por stress, periparto)
INTERMACS 1-2 como ponte Dependência de inotrópico em papara TC ou ponte para implante ciente não elegível para TC (terapia
de DMSC de longa permanência. de destino).
Complicações mecânicas
IC avançada com sobrevida menor
pós-IAM .
que 1 ano por modelos prognósticos.
Procedimentos cardíacos ou
Disfunção orgânica devido IC (inpercutâneo coronariano, valvar cluindo caquexia cardíaca).
ou ablativos de alto risco.
Pós-cardiotomia.
VO2 pico < 14 ml/kg/min.
Disfunção aguda de enxerto
Critérios de IC avançada (Tabela1).
cardíaco pós TC.
Disfunção aguda de VD (TEP, IAM
de VD, Pós-implante de DSCM
esquerda).
Arritmias refratárias.
DMSC: dispositivos mecânicos de suporte circulatório; IAM: infarto agudo do miocárdio; TC: transplante cardíaco; VD: ventrículo direito; TEP: trombo embolismo pulmonar.
Tabela 4. Contraindicações específicas para implante de DMSC.
DMSC de curta permanência8 DMSC de longa permanência7, 16
BIA
Choque cardiogênico com
Insuficiência aórtica moderada impossibilidade de recuperação de
ou importante.
disfunção orgânica.
Dissecção de aorta.
Impella®
Prótese valvar aórtica.
Presença de trombo em
ventrículo esquerdo.
Estenose ou insuficiência
aórtica.
Defeito de septo
interventricular.
Limitação psicossocial (ex: não
aderência medicamentosa prévia,
abuso de substâncias ilícitas,
ausência de suporte familiar/
social).
ECMO
Insuficiência aórtica.
Idade > 80 anos para terapia de
destino.
Disfunção de VD importante.
Obesidade ou desnutrição.
Malformação vascular intestinal
que predispõe a sangramentos.
Infecção sistêmica ativa.
BIA: balão intra-aórtico; ECMO: oxigenação por membrana extracorpórea; VD: ventrículo direito
Rev Soc Cardiol Estado de São Paulo 2016;26(1):21-6
disfunção hepática e renal, disfunção de ventrículo direito,
coagulopatias, infecção ativa, insuficiência respiratória e
uso suporte mecânico de curta permanência devem ser
considerados durante a seleção.3,4
A avaliação estrutural cardíaca é de extrema importância. O ecocardiograma deve avaliar existência de valvopatias
aórtica, mitral e tricúspide, presença de shunts e trombos
intracavitários, e a função do ventrículo direto.
Diversos escores de risco identificaram variáveis preditoras de morte após implante de DMSC de longa permanência. Alguns desses estão descritos na tabela 5.19-21 Esses
escores identificam pacientes de alto risco cirúrgico e possibilitam a otimização terapêutica visando essa diminuição
de risco (ex: melhora de função de VD, melhora nutricional,
de função renal). Assim, um indivíduo com risco proibitivo
no inicio de uma avaliação, após otimização terapêutica e
melhora clínica, pode se tornar um candidato aceitável. Por
outro lado, se não apresentar melhora do escore de risco
Tabela 5. Escores preditores de risco pós-implante de DMSC.
Escore
Escore de risco HeartMate II Escore de risco póspara terapia escore de risco -operatório em UTI
de destino
Referência Lietz et al.19
Cougar J et al.20 Klots et al.21
Preditores Plaq < 148.000/ Idade (por 10 Transfusão > 10 CH e/
anos): OR: 1.32 ou PFC: 6 pts
µl: 4 pts
Albumina < 3.3 Albumina: OR: Inotrópico: 5 pts
Lactato>3 mg/dl: 5 pts
0.49
mg/dl: 2 pts
INR > 1.1: 2 pts Creatinina: OR: LDH>500 U/L ou CK>
200 e/ou Troponina >
Uso de vasodi- 2.1
latador: 1 pto INR: OR: 3.11 20 ng/ml: 5 pts
PCR > 8 e/ou Leuco >
Volume de
PMAP < 25
mmHg: 1 pto implantes do 13000: 4 pts
Re-esternotomia: 4pts
AST > 45 U/mL: centro < 15:
DMSC pré-op: 4pts
OR: 2.24
1 pto
Ventilação mecânica:
Ht < 34%: 1
4 pts
pto
Creatinina > 1,5 ml/dL
Ureia > 109
e/ou Ureia > 85 mg/dl
mg/dl: 1 pto
e/ou HD: 3 pts
Sem InotrópiImplante de
cos: 1 pto.
emergência: 3 pts
Parada cardiorrespiratória pre-implante:
2 pts
Miocardiopatia
isquêmica : 2 pts
FC >100 bpm: 1 pto
Plaq < 100.000 µl:
1 pto
Hb< 12 g/dL e/ou HT
< 35%: 1 pto
Idade > 50 anos:1 pto
Risco
Sobrevida em Mortalidade 90 Mortalidade em UTI.
1 ano.
dias após
implante.
≤ 15 pontos: 15, 8%
0-8 pts: 81%
Baixo risco:
16-30 pontos: 48,2 %
9-16: 62%
4-8%
> 30 pontos: 65,2 %
17-19: 28%
Moderado
>19: 11%
risco: 11-16%
Alto risco:
25-29%
Plaq: plaquetas, pts: pontos, INR: índice internacional normalizado, PMAP: pressão média de artéria pulmonar, AST: aspartato transaminase, HT: hematócrito, OR: odds ratio, CH: concentrado de hemácias, PFC:
plasma fresco congelado, LDH: desidrogenase láctica, CK: creatina quinase, PCR: proteína C reativa, DMSC:
dispositivo mecânico de suporte circulatório, HD: hemodiálise, FC: frequência cardíaca, Hb: hemoglobina
25
com tratamento agressivo, a sobrevida após o implante do
dispositivo de longa permanência é improvável.
Considerações finais
O manejo contemporâneo de pacientes com IC refratária
e avançada condiciona o uso de diversos tipos de DMSC,
que comparados com o tratamento medicamentos exclusivo, possibilitam um melhor restabelecimento hemodinâmico,
diminuição e reversão de disfunções orgânicas causas pela
IC e possibilitam em ultima análise um melhor prognóstico
para pacientes que aguardam por um TC ou em pacientes
não candidatos ao transplante, uma melhora na qualidade
de vida e sobrevida.
A seleção apropriada de um candidato a suporte circulatório é o principal fator para o sucesso de um implante de
DMSC. Para isso, uma avaliação minuciosa das indicações
(tabela 3), contraindicações (tabela 4), fatores e escores de
risco (tabela 5) e condições que interferem nos desfechos
após implante de um dispositivo (principalmente a avaliação
função do VD) deve ser sempre realizada.
A indicação precoce de implante de DMSC de curta
permanência ou longa permanência em IC avançada é
uma tendência nos últimos anos. No nosso meio, com a
melhora na tecnologia, maior disponibilidade e experiência
na indicação e manejo de pacientes com desses dispositivos, a terapia com suporte mecânico será fundamental
no tratamento de pacientes com IC avançada e choque
cardiogênico.
Conflitos de interesse
Os autores declaram não possuir conflitos de interesse na realização deste trabalho.
Referências
26
1. Bocchi EA, Marcondes-Braga FG, Bacal F, Ferraz AS, Albuquerque D, Rodrigues de A, et al. [Updating of the Brazilian
guideline for chronic heart failure - 2012]. Arq Bras Cardiol.
2012;98(1 Suppl 1):1-33.
2. Metra M, Ponikowski P, Dickstein K, McMurray JJ, Gavazzi A,
Bergh CH, et al. Advanced chronic heart failure: A position statement from the Study Group on Advanced Heart Failure of the
Heart Failure Association of the European Society of Cardiology.
Eur J Heart Fail. 2007;9(6-7):684-94.
3. Miller LW, Guglin M. Patient Selection for Ventricular Assist Devices. J Am Coll Cardiol. 2013;61:1209–21.
4. Lund LH, Matthews J, Aaronson K. Patient selection for left ventricular assist devices. Eur J Heart Fail. 2010;12:434–43.
5. Rose EA, Gelijns AC, Moskowitz AJ, Heitjan DF, Stevenson LW,
Dembitsky W, et al. Long-term mechanical left ventricular assistance for endstage heart failure. N Engl J Med. 2001;345:1435–43.
6. Lund LH, Edwards LB, Kucheryavaya AY, Dipchand AI, Benden
C, Christie JD, et al. The Registry of the International Society
for Heart and Lung Transplantation: Thirtieth Official Adult Heart
Transplant Report--2013; focus theme: age. J Heart Lung Transplant. 2013;32(10):951-64.
7. Feldman D, Pamboukian SV, Teuteberg JJ, Birks E, Lietz K, Moore SA, et al. The 2013 International Society for Heart and Lung
Transplantation Guidelines for mechanical circulatory support:
executive summary. J Heart Lung Transplant. 2013;32(2):157-87.
8. Rihal CS, Naidu SS, Givertz MM, Szeto WY, Burke JA, Kapur
NK, et al. 2015 SCAI/ACC/HFSA/STS Clinical Expert Consensus
Statement on the Use of Percutaneous Mechanical Circulatory
Support Devices in Cardiovascular Care: Endorsed by the American Heart Assocation, the Cardiological Society of India, and
Sociedad Latino Americana de Cardiologia Intervencion; Affirmation of Value by the Canadian Association of Interventional Cardiology-Association Canadienne de Cardiologie d’intervention.
J Am Coll Cardiol. 2015;65(19):e7-e26.
9. Starling RC, Naka Y, Boyle AJ, Gonzalez-Stawinski G, John
R, Jorde U, et al. Results of the post-U.S. Food and Drug
Administration-approval study with a continuous flow left ventricular assist device as a bridge to heart transplantation: a
prospective study using the INTERMACS (Interagency Registry for Mechanically Assisted Circulatory Support). J Am Coll
Cardiol. 2011;57:1890–8.
10.Slaughter MS, Rogers JG, Milano CA, Russell SD, Conte JV, Feldman D, et al. Advanced heart failure treated with continuous-flow
left ventricular assist device. N Engl J Med. 2009;361:2241–51.
11.Slaughter MS, Pagani FD, McGee EC, Birks EJ, Cotts WG,
Gregoric I, et al. HeartWare ventricular assist system for bridge to transplant: combined results of the bridge to transplant
and continued access protocol trial. J Heart Lung Transplant.
2013;32(7):675-83.
12.Kirklin JK ND, Pagani FD, Kormos RL, Stevenson LW, Blume ED,
Miller MA, et al. Sixth INTERMACS annual report: a 10,000-patient database. J Heart Lung Transplant. 2014;33(6):555-64.
13.Biselli B, Ayub-Ferreira SM, Avila MS, Gaiotto FA, Jatene FB,
Bocchi EA. Left ventricular assist device followed by heart transplantation. Arq Bras Cardiol. 2015;104(3):e22-4.
14.Kirklin JK, Naftel DC, Kormos RL, Stevenson LW, Pagani FD, Miller
MA, et al. Third INTERMACS Annual Report: The evaluation of destination Therapy in the US. J Heart Lung Transplant. 2011;30:115-23.
15.Stevenson LW, Pagani FD, Young JB, Jessup M, Miller L, Kormos RL, et al. INTERMACS profiles of advanced heart failure:
the current picture. J Heart Lung Transplant. 2009;28(6):535-41.
16.Peura JL, Colvin-Adams M, Francis GS, Grady KL, Hoffman TM,
Jessup M, et al. Recommendations for the use of mechanical
circulatory support: device strategies and patient selection: a
scientific statement from the American Heart Association. Circulation. 2012;126(22):2648-67.
17.Levy WC, Mozaffarian D, Linker DT, Farrar DJ, Miller LW. Can the
Seattle heart failure model be used to risk-stratify heart failure
patients for potential left ventricular assist device therapy? J
Heart LungTransplant. 2009;28:231-6.
18.Estep JD, Starling RC, Horstmanshof DA, Milano CA, Selzman
CH, Shah KB, et al. Risk Assessment and Comparative Effectiveness of Left Ventricular Assist Device and Medical Management
in Ambulatory Heart Failure Patients: Results From the ROADMAP Study. J Am Coll Cardiol. 2015;66(16):1747-61.
19.Lietz K, Long JW, Kfoury AG, Slaughter MS, Silver MA, Milano
CA, et al. Outcomes of left ventricular assist device implantation
as destination therapy in the post-REMATCH era: implications
for patient selection. Circulation. 2007;116:497-505.
20.Cowger J, Sundareswaran K, Rogers JG, Park SJ, Pagani FD,
Bhat G, et al. Predicting survival in patients receiving continuous
flow left ventricular assist devices: the HeartMate II risk score. J
Am Coll Cardiol. 2013;61(3):313-21.
21.Klotz S, Vahlhaus C, Riehl C, Reitz C, Sindermann JR, Scheld
HH. Pre-operative prediction of post-VAD implant mortality using easily accessible clinical parameters. J Heart Lung
Transplant. 2010;29:45–52.
Rev Soc Cardiol Estado de São Paulo 2016;26(1):21-6
revisão/review
TERAPIA DO CONTROLE DA TEMPERATURA
PÓS-PARADA CARDIORRESPIRATÓRIA
TEMPERATURE CONTROL THERAPY AFTER CARDIORESPIRATORY ARREST
Resumo
Claudia Bernoche1
Liliane Kopel1
Natali Schiavo Gianetti2
Silvia G. Lage1,3
Sergio Timerman2,4
1. Instituto do Coração do Hospital
das Clínicas da Faculdade de
Medicina da Universidade de São
Paulo (FMUSP), Unidade Clínica de
Terapia Intensiva.
2. Instituto do Coração do Hospital
da Clinicas da Faculdade de
Medicina da Universidade de São
Paulo, Laboratório de Treinamento
e Simulações em Emergências
Cardiovasculares.
3. Faculdade de Medicina da
Universidade de São Paulo (FMUSP).
4. Escola de Ciências da Saúde e da
Escola de Medicina da Universidade
Anhembi Morumbi – Laureate
International Universities.
Correspondência:
Dra. Claudia Bernoche. Av. Dr. Enéas de
Carvalho Aguiar 44, 2° andar sala 10.
CEP 05403-000 São Paulo – SP.
E-mail: [email protected]
O processo fisiopatológico secundário à parada cardiorrespiratória (PCR) com retorno
da circulação espontânea (RCE), determina a síndrome pós-PCR, com lesão cerebral,
disfunção miocárdica e reperfusão, em resposta à isquemia orgânica. A terapia do
controle da temperatura (TCT) oferece mecanismos neuroprotetores, limitação da lesão
miocárdica e redução da resposta inflamatória sistêmica. Dúvidas existem em relação
aos benefícios, início e duração da TCT, porém, há evidências que apoiam a melhora da
sobrevida e do prognóstico neurológico em populações selecionadas. Recomenda-se a
TCT por 24 horas, com controle da temperatura na faixa de 32 °C a 36 °C para adultos
que sobrevivem à PCR extra-hospitalar e permanecem em coma com ritmos iniciais de
fibrilação/taquicardia ventricular, o que também é sugerido para os sobreviventes de PCR
extra-hospitalar com ritmo inicial não chocável e de PCR intra-hospitalar em qualquer
ritmo inicial. O início do resfriamento deve ser feito o mais precocemente possível, de
preferência, até 12 horas após o RCE. O controle da temperatura corpórea deve ser
incorporado aos cuidados dos pacientes críticos pós-PCR, a fim de reduzir as taxas de
mortalidade e de sequelas neurológicas.
Descritores: Hipotermia, Alterações na Temperatura Corporal, Parada Cardíaca.
Abstract
The secondary pathophysiological process to cardiorespiratory arrest (CRA) with return
of spontaneous circulation (ROSC), determines the post-cardiorespiratory arrest syndrome
with brain injury, myocardial reperfusion and dysfunction in response to systemic ischemia.
The temperature control therapy (TCT) provides neuroprotective mechanisms, limitation of
myocardial injury and reduction of systemic inflammatory response. There are still some
questions regarding the benefits, timing and duration of TCT, however, there is evidence
supporting improved survival and neurological outcome in selected populations. TCT is recommended for 24 hours, with temperature control in the range of 32 to 36 °C for comatose
adults who survive after out-of-hospital cardiorespiratory arrest with initial rates of fibrillation/
ventricular tachycardia, which is also suggested for extra-hospital cardiorespiratory arrest
survivors with early pace not shockable and intra-hospital cardiorespiratory arrest in any
initial rate. The beginning of the cooling should be done as early as possible, ideally up to
12 hours after ROSC. The control of body temperature should be incorporated into the care
of the post-CRA critically ill patients in order to reduce mortality and neurological sequelae.
Descriptors: Hypothermia, Body Temperature Changes, Cardiac arrest.
Introdução
O sucesso do retorno à circulação espontânea (RCE)
é o passo inicial na recuperação de um evento fatal. O
processo fisiopatológico que se segue a isquemia secundária a parada cardiorrespiratória (PCR), com subsequente
reperfusão durante a reanimação até o retorno a circulação,
determinam a síndrome pós-PCR.1
Trabalhos mostram que entre 15 e 46% das vítimas
de PCR se recuperam rápida e totalmente. Contribuem
Rev Soc Cardiol Estado de São Paulo 2016;26(1):27-33
para estas estatísticas programas de educação oferecidos a população para o reconhecimento de situações de
PCR, times de resposta rápida hospitalares e fácil acesso
a desfibriladores. Mas uma porcentagem significativa permanecerá sob ventilação mecânica e em uso de drogas
vasoativas.2 De acordo com a causa da PCR e a severidade da síndrome pós-PCR, muitos necessitam de cuidados intensivos visando melhor condição neurológica futura.
Após o RCE os pacientes devem ser removidos para um
27
hospital com serviço de hemodinâmica para diagnóstico
de possível síndrome coronariana aguda e com unidade
de cuidados intensivos onde o início da terapia do controle
da temperatura (TCT) deve ser considerada e se indicada,
prontamente iniciada.3
FISIOPATOLOGIA DA SÍNDROME PÓS-PCR
28
Esta condição se refere a um processo no qual pacientes que evoluem com RCE podem vir a apresentar disfunção
de múltiplos órgãos. O grau de acometimento é dependente
da causa, tempo de PCR e das doenças preexistentes. O
tempo é fator determinante na recuperação funcional do
paciente, cada 1,5 minutos de atraso no RCE acarreta uma
redução de 14% na chance de uma boa recuperação.1
O sistema nervoso central é particularmente sensível à
hipóxia, de modo que redução da perfusão por períodos
maiores que 5 minutos são suficientes para causar dano
cerebral.4 Além da lesão celular causada pela isquemia da
PCR o RCE induz a uma série de alterações fisiopatológicas
que levam a síndrome pós-PCR.4,5 Os principais mecanismos envolvidos são:
• falha na reperfusão global ou multifocal (no-reflow),
perpetuando o processo de isquemia e depleção dos
estoques de adenosina trifosfato intracelulares; desvio
do metabolismo aeróbio para glicólise anaeróbia, aumento da produção de lactato e consequente acidose
intra e extracelular;
• lesão tecidual induzida pela reperfusão: liberação de
radicais livres do oxigênio (peróxido de hidrogênio, superóxido e peroxidonitrito) com disfunção mitocondrial e
liberação de neurotransmissores excitatórios;
• discrasias sanguíneas, com formação de fibrina, bloqueio da microcirculação e déficit de perfusão tecidual.
O aumento da temperatura corporal após o RCE potencializa esses mecanismos, especialmente a liberação de glutamato no cérebro e ativação de seu receptor (N-metil-d-aspartato)
na fenda sináptica, com maior influxo de cálcio no neurônio
e posterior ativação de endonucleases e fosfolipases, levando à neurodegeneração.4,6,7 Tal fenômeno é exacerbado por
aumentos de temperatura superiores a 0,5 °C ou quando a
temperatura atinge mais de 37,0°C.4 Os radicais livres de oxigênio lesam as membranas celulares dos neurônios, o que
gera edema citotóxico e quebra da barreira hematoencefálica,
desencadeando hipertensão intracraniana em um ciclo vicioso
de isquemia cerebral. O dano oxidativo é tanto maior quanto
maior for a temperatura.7
Considerando estes dados fisiopatológicos a TCT contribui através de mecanismos neuroprotetores. Estas ações
podem ser evidenciadas por:
• diminuição da demanda metabólica neuronal e otimização da relação oferta-consumo de oxigênio; a cada 1°C
de redução na temperatura corporal, observa-se uma
redução de 6-8% no metabolismo cerebral;
• redução da pressão intracraniana com melhora na perfusão cerebral;
• menor liberação de radicais livres de oxigênio e preservação da integridade das membranas celulares;
• Inibição da biossíntese e liberação de neurotransmissores excitatórios;
• menor formação de fibrina e melhora do fluxo sanguíneo
na microcirculação;
• redução da resposta inflamatória.4,5,7
A TCT exerce uma série de efeitos em todo o organismo, sendo os principais descritos na figura 1, como
aumento da resistência vascular sistêmica e redução da
frequência cardíaca.8-10
APRESENTAÇÃO CLÍNICA DA SÍNDROME
PÓS-PCR
Nesta síndrome podem ser reconhecidos quatro componentes principais: o dano cerebral, a disfunção miocárdica,
Figura 1: Efeitos sistêmicos da Terapia do Controle da Temperatura.
Rev Soc Cardiol Estado de São Paulo 2016;26(1):27-33
TERAPIA DO CONTROLE DA TEMPERATURA PÓS-PARADA CARDIORRESPIRATÓRIA
a reperfusão orgânica em resposta ao tempo de isquemia
e a patologia precipitante do evento.1
PCR breves costumam não deixar sequelas. O grau de
comprometimento cerebral pode variar desde alterações do
comportamento e personalidade até apresentações clínicas mais graves como: mioclonias, convulsões, estados de
coma, até morte encefálica. O dano cerebral é responsável
por dois terços dos óbitos dos pacientes admitidos pós-PCR
extrahospitalar. A perda da auto-regulação, o surgimento
de edema e a neurodegeneração pós-isquêmica são os
facilitadores principais.11
A disfunção cardíaca depende da patologia precipitante do evento, como nos casos de síndromes isquêmicas
agudas secundárias a oclusão coronária e consequente
disfunção ventricular. A recuperação da função é possível,
porém, depende do tempo de oclusão da artéria coronária, tamanho do infarto e da persistência de miocárdio
viável pós-isquemia.
O binômio isquemia-reperfusão que sobrevêm a PCR
é responsável pela liberação de fatores inflamatórios, complemento, ativação da cascata da coagulação, favorecendo
um estado de disfunção multiorgânica e condições para o
desenvolvimento de infecção. Estados de supressão adrenal podem estar associados.
Na identificação da causa precipitante é importante
ressaltar que as síndromes coronárias agudas são causa
frequente de PCR extra-hospitalar. Uma prevalência de 59 a
71% de achados de lesão coronária aguda é esperada nas
vítimas de eventos, quando as causas cardíacas não podem
ser afastadas. Na evidência após o RCE no eletrocardiograma (ECG) de elevação do segmento ST ou de bloqueio
do ramo esquerdo novo, a cinecoronariografia de urgência
esta indicada. Nesses casos os achados compatíveis com
lesão coronária aguda chegam a 80%.12,13
Mas muitas vezes o ECG pode apresentar alterações
inespecíficas, como nos casos de reanimação prolongada.
Nestas situações clínicas a presença de fatores de risco
para doença coronária como idade, tabagismo e diabetes,
bem como a instabilidade hemodinâmica refratária e persistente devem ser considerados para indicar a realização
de estudo invasivo da circulação coronária.14
Entre os métodos diagnósticos o ecocardiograma a
beira leito oferece informação adicional quanto à função
ventricular, doenças valvares associadas, derrame pericárdico e afecções da aorta. Informações trazidas pelas equipes
de resgate, assim como antecedentes pessoais, uso de
medicamentos e drogas ilícitas, podem ser determinantes
na estratégia diagnóstica e na tomada de decisões.
Além das causas cardíacas para justificara a PCR,
é necessário descartar afecções primárias do sistema
nervoso. A realização de tomografia computadorizada
do crânio está indicada em todos os casos nos quais
há evidência ou suspeita de trauma crânio encefálico,
isquemia ou sangramento.
Quando a doença coronária for afastada e na falta de
evidência de lesão do sistema nervoso central, as doenças
pulmonares agudas devem ser consideradas. A avalição
clínica seguida da aquisição de uma angiotomografia das
artérias pulmonares está indicada. O tromboembolismo pulmonar agudo é causa de morte súbita com uma incidência
Rev Soc Cardiol Estado de São Paulo 2016;26(1):27-33
2 a 10%. Outras afecções pulmonares como asma, pneumopatias causadoras de hipóxia aguda e infecções podem
ser causas desencadeantes de uma PCR.15
CUIDADOS APÓS O RCE
Os cuidados oferecidos em unidades de emergência e
de terapia intensiva podem variar desde observação clínica e monitorização, até o uso de suporte neurointensivo e
dispositivos de assistência circulatória no paciente crítico.
Oxigenação e ventilação
Após o RCE a concentração de oxigênio no sangue
arterial deve ser monitorada pela saturação arterial de oxigênio a fim de manter níveis entre 94-98%. A suplementação
de oxigênio nos pacientes que tiveram rápida recuperação
pode se limitar ao uso de cateter e máscara. A hiperóxia no
período pós-PCR esta associada em modelos de estudo
em animais a um prognóstico neurológico comprometido
em relação a normoxemia.3,16,17
Em pacientes admitidos com infarto agudo do miocárdio sem hipóxia com elevação do segmento ST, onde
se comparou a manutenção em ar ambiente com a suplementação com oxigênio, o último grupo apresentou
aumento da extensão da lesão, recorrência da isquemia
e maior incidência de arritmias.3
Muitos dos sobreviventes em decorrência do estado
neurológico ou da instabilidade hemodinâmica, necessitam
de intubação orotraqueal e ventilação mecânica. A estratégia da ventilação deve ser protetora, com volume corrente
de 6 a 8 ml/kg (peso ideal) e uma pressão expiratória final
positiva de 4 a 6 cm de H2O. Limitações à dinâmica respiratória ideal podem surgir, como instabilidade da caixa
torácica secundária as manobras de ressuscitação cardiopulmonar (RCP) e distensão abdominal pelo acúmulo de
ar durante a ventilação. O risco de pneumotórax associado
deve ser prontamente descartado e se necessário drenado. Uma sonda gástrica deve ser providenciada a fim de
remover o ar acumulado no estômago.1,3,15,18
A sedação deve ser titulada com cautela para não comprometer a condição hemodinâmica nos pacientes instáveis.
O uso de bloqueadores neuromusculares pode ser considerado para adequar a sincronia com a ventilação, mas
há limitações ao seu uso, por comprometer a avaliação
neurológica continua e por mascarar complicações, como
por exemplo convulsões.
Manejo hemodinâmico
Após o RCE os cuidados devem seguir as orientações
de acordo com o fluxograma de reanimação do ACLS (Advanced Cardiac Life Support).19
Os pacientes devem ser monitorizados inicialmente de
modo não invasivo a fim de obter: ritmo cardíaco, oximetria
de pulso, pressão arterial e temperatura. Eletrocardiograma
de 12 derivações e radiografia de tórax devem ser realizados. Exames de laboratório adicionais: enzimas cardíacas
(iniciais e seriadas), níveis de lactato, gasometria, eletrólitos
e hemograma podem oferecer informações adicionais.
A disfunção miocárdica que se segue à PCR com instabilidade hemodinâmica se manifesta pela presença de
hipotensão, arritmias e baixo débito cardíaco. O grau de
29
disfunção e da reação inflamatória sistêmica são variáveis.
A volemia deve ser adequada para cada paciente. O uso
de inotrópicos deve ser iniciado nos casos de instabilidade
com sinais de baixo debito cardíaco e disfunção ventricular. Drogas vasopressoras estão indicadas na presença
de hipotensão severa, por vezes secundária à vasoplegia
pós-RCE.3,18,20,21
A monitorização invasiva deve ser ampliada de acordo
com o grau de instabilidade e inclui pressão arterial invasiva,
pressão venosa central e da saturação venosa central do
oxigênio contínua. Cateteres que ofereçam informações de
débito e saturação venosa contínuas podem ser empregados quando disponíveis.
O uso de antiarrítmicos deve estar direcionado para o
ritmo da PCR, não há evidência para o uso profilático de
amiodarona ou lidocaína endovenosas após o RCE. Nos
casos de PCR decorrente de fibrilação e/ou taquicardias
ventriculares (FV/TV) seu uso está bem indicado.15,18
Na presença instabilidade crítica à custa de disfunção, devem ser consideradas medidas adicionais como
uso de balão intra-aórtico e de dispositivos de assistência circulatória.21
Terapia do controle da temperatura
30
O dano cerebral e a instabilidade cardiovascular são
fatores determinantes da sobrevida após o RCE. O controle da temperatura tem como finalidade conter a síndrome
pós-PCR com diminuição de consumo de oxigênio cerebral,
limitação da lesão miocárdica e sistêmica.
Os estudos desenvolvidos em hipotermia terapêutica
iniciados na década de 80 e 90, apresentaram limitações
principalmente relacionadas à dificuldade no controle da
temperatura, ocorrência de sangramentos e infecções. Este
cenário apresentou mudanças com o surgimento de dispositivos e cuidados que permitem controlar a temperatura
com segurança.
Dois estudos multicêntricos desenvolvidos na Europa
e na Austrália ganharam repercussão em publicações no
inicio de 2002. A hipotermia terapêutica foi uma intervenção
que demostrou oferecer melhora na recuperação neurológica pós-PCR e na mortalidade. A hipotermia foi realizada
em sobreviventes que apresentavam incapacidade de reconhecer comandos após o RCE.9,22
O estudo europeu, conhecido como HACA (The Hipotermia After Cardiac Arrest Study Group) randomizou 275
pacientes com idades entre 18 e 75 anos, com tempo até
o início do atendimento de 5 a 15 minutos, ritmo de FV/TV,
tempo de RCE de até 60 minutos. Os sobreviventes foram
divididos em dois grupos: para receber cuidados convencionais ou serem submetidos à hipotermia com temperatura
alvo 34 a 32°C durante 24 horas. Ao termino do estudo
no grupo hipotermia 55% dos pacientes apresentaram
boa recuperação neurológica na alta hospitalar, comparados a 39% do grupo que recebeu cuidados convencionais
(p<0,05). A taxa de mortalidade na análise de subgrupos
revelou redução no grupo hipotermia (p<0,05).22
No estudo australiano, os critérios de inclusão foram
semelhantes ao europeu. Os resultados evidenciaram redução no risco de sequela neurológica (49% no grupo controle
versus 26% nos submetidos à hipotermia (p=0,046).9
Em 2010 o ILCOR (International Liaison Committee on
Resuscitation) estabelece a hipotermia dentre os cuidados
após o RCE de eventos extra-hospitalares e mantém a recomendação para o controle de temperatura ideal de de 34
a 32°C. O método vem ganhando aceitação e seu emprego
se estende para outros ritmos de PCR e para o ambiente
intra-hospitalar.23
Nielsen e colaboradores publicam em 2013 dados
de um estudo randomizado com uma coorte composta por 939 indivíduos que evoluíram comatosos após o
RCE extra-hospitalar e foram submetidos à hipotermia
com temperaturas alvo de 33°C ou de 36°C. O objetivo
primário foi avaliar a mortalidade por todas as causas em
ambos os grupos e o secundário um evento combinado
de deficiência neurológica ou morte em 180 dias. Em
termos de mortalidade o grupo submetido ao controle
tradicional de 33°C apresentou taxa de óbito de 50% comparada com 48% do grupo hipotermia a 36°C (p<0,05).
No desfecho combinado foram observadas taxas de 54%
vs 52% (p=0,78) para o controle tradicional e o controle
com temperatura de 36°C respectivamente. Portanto, o
controle mais agressivo da temperatura (33°C) não beneficiou esta população.24
Esta publicação desencadeou um posicionamento
imediato dos grupos formadores de opinião internacionais,
sendo a mais evidente apoiada no fato de ser uma publicação isolada e que abriria frente a controvérsias quanto aos
benefícios do controle de temperatura ideal, já reconhecida
e instituída. Um dos alvos das críticas vem a reforçar o
benefício do rápido reconhecimento da PCR e do inicio
das manobras de RCP, já que o estudo em questão foi
desenvolvido na Escandinávia onde a uma divulgação em
massa do suporte básico de vida resultou em uma alta taxa
de 73% de RCP pelo público em geral. Devemos ressaltar
também que neste estudo houve um controle ativo da temperatura em ambos os grupos, limitando o surgimento de
temperatura acima de 36°C.25,26
MÉTODO
A TCT mostrou ser uma intervenção capaz de oferecer
melhora na recuperação neurológica e deve ser considerada
para os paciente incapazes de atender a uma ordem verbal
após o RCE. Os critérios de seleção de pacientes que se
favorecem da TCT estão descritos na tabela 1.
Pacientes que atingirem estabilidade hemodinâmica
após o RCE, à custa de inotrópicos e vasoconstritores poderão iniciar o tratamento. Situações especiais como a da
gestação deverão ser individualizadas. Há relatos isolados
na literatura de casos bem sucedidos com idade gestacional
de até 20 semanas. É importante considerar as orientações
do ACLS quanto às decisões a serem tomadas de acordo
com a idade gestacional e o tempo de PCR.
O método para a TCT pode ser dividido em três fases:
indução, manutenção e reaquecimento.
Indução
Ao iniciar a TCT é necessário aferir e monitorar a temperatura central (termômetro esofágico, cateter vesical ou
cateter de termodiluição). Nesta fase, três cuidados fundamentais devem guiar a terapêutica: iniciar precocemente
Rev Soc Cardiol Estado de São Paulo 2016;26(1):27-33
TERAPIA DO CONTROLE DA TEMPERATURA PÓS-PARADA CARDIORRESPIRATÓRIA
Tabela 1. Criterios de seleção para Terapia do Controle da Temperatura.
Critérios de inclusão:
1. Idade: 18 a 75 anos
2. PCR presenciada
3. Tempo de reanimação < 45 minutos
4. Ausência de resposta adequada aos estímulos
5. Acesso ao atendimento primário entre 5 e 15 minutos após
o início da PCR.
6. Intervalo de tempo pós-PCR de até 12 horas
Limitações para o inicio da TCT: critérios de exclusão
1. Portadores de coagulopatias – exceto as induzidas
2. Choque cardiogênico refratário à terapêutica
3. Choque séptico.
4. Discrasias sanguíneas.
5. Recorrência de PCR prolongada após admissão
7. Pacientes conhecidamente portadores de doença terminal
8. Gestantes
PCR: parada cardiorrespiratória, TCT: terapia do controle da temperatura
o resfriamento, preferencialmente no local do evento ou
se possível no transporte - desde que não comprometa o
diagnostico e o tratamento. Na sequência, a prioridade é
a atingir a temperatura alvo o mais rapidamente possível
e para esta finalidade devem se associar ao menos dois
métodos 1,3,15,18,27.
Resfriamento de superfície:
• Uso de pacotes de gelo nas regiões axilar, inguinal e
cervical, realizando rodízio do gelo para prevenir lesões
de pele.
• Colchões e mantas térmicas;
• Roupas térmicas: perneiras, coletes e capacetes com
serpentinas de água gelada no seu interior. Cuidados
para evitar lesões de pele devem ser tomados, atender
as especificações do fabricante e cobrir ao menos 40%
da superfície corpórea.
Resfriamento por sonda gástrica:
• Instalar uma sonda gástrica, confirmar a localização e
após aspirar o conteúdo do estomago infundir solução
salina fisiológica a 4 °C em bolus de 250 ml até um
máximo de 30 ml/kg.
Resfriamento endovenoso:
• Infundir solução salina fisiológica endovenosa a 4°C, rapidamente. O volume total a ser administrado é de 30 ml/
kg até um máximo de 2000 ml. Pacientes com limitação à
oferta de volume tem restrição a este método. A infusão
deve ser interrompida se houver queda na oximetria de
pulso< 94%.
• Uso de trocadores de calor endovenosos, alocados
através de punção venosa femoral ou na veia subclávia, apresentam vantagens como a da indução rápida
e controlada.
• Uma vez atingida a temperatura alvo se inicia a fase
de manutenção e começa a contagem do tempo com
duração ideal de 24 horas.
Rev Soc Cardiol Estado de São Paulo 2016;26(1):27-33
Manutenção
Os métodos de resfriamento rápido usados na indução devem ser descontinuados e mantidos apenas
os recursos de superfície e os dispositivos endovenosos
quando disponíveis.
Os cuidados nesta fase são direcionados a fim de evitar
o hiperresfriamento (temperatura central < 32 °C) e a controlar as tentativas de reaquecimento como os tremores. A monitorização hemodinâmica, respiratória e neurológica deve
ser intensiva e os controles aferidos de hora em hora.1,3,7
A hipotermia pode facilitar surgimento de bradicardias e
poliúria, situações que devem ser evitadas para não comprometer ainda mais a condição hemodinâmica. Os distúrbios hidroeletrolíticos como hipofosfatemia, hipomagnesemia e hipocalemia podem desencadear arritmias quando
não detectados e tratados.7,18,28
O controle glicêmico deve ser rigoroso, já que há uma
perda da sensibilidade a insulina e diminuição da sua produção. Sangramentos podem estar aumentados por defeitos
na coagulação e da agregabilidade plaquetária, decorrentes
da baixa temperatura e facilitados por ação medicamentosa.
Vigilância infecciosa deve ser instituída e na ausência
de foco aparente, culturas devem ser obtidas na 12a hora.
Quanto ao suporte respiratório, é importante salientar
que a fim de viabilizar a ventilação mecânica o uso de sedativos e bloqueadores neuromusculares esta indicado. A
orientação de manter estes últimos em infusão continua
ou intermitente ainda não está determinada. O clearence
destas drogas encontra-se reduzido durante a hipotermia
em até 30%.
O surgimento de tremores é esperado como uma tentativa de reaquecimento e devem ser inibidos através do
aumento da sedação ou por meio do uso de bloqueadores
neuromusculares. Mioclonias e convulsões devem ser prontamente identificadas e tratadas. O diagnóstico diferencial
deve ser feito com eletroencefalograma e se possível manter
a análise contínua. Não há evidência para sustentar o uso
preventivo de anticonvulsivantes.1,3,18,29
Reaquecimento
Ao término das 24 horas da TCT o reaquecimento poderá ser iniciado. Os métodos usados durante a fase de
manutenção devem ser lentamente removidos considerando
que a faixa de reaquecimento ideal deve contemplar um
aumento de 0,25 a 0,5ºC por hora. A vasodilatação súbita
pode desencadear hipotensão com a necessidade do uso
de soluções endovenosas para sua reversão. As suplementações de potássio devem ser descontinuadas e um
rigoroso controle da glicemia capilar deve ser estabelecido
naqueles em uso de insulina. O controle da temperatura
rigoroso deve se estender por ao menos 72 horas do evento
para a prevenção ativa da ocorrência de febre.15,18
ESTADO ATUAL DA TCT
Dúvidas existem em relação à seleção de pacientes
que possam se beneficiar da TCT, qual o momento ideal
para seu inicio e por quanto tempo devem ser mantidas
as medidas da TCT.
Estes questionamentos foram abordados na publicação
do comitê executivo da American Heart Association em se-
31
32
tembro de 2015 e reproduzidos na publicação do Conselho
Europeu para cuidados pós-ressuscitação.3
Após cuidadosa análise de estudos multicêntricos, alguns pontos devem ser salientados:
• O uso de hipotermia atua como supressor das vias facilitadoras da morte cerebral e da apoptose;
• Há uma diminuição de 6% na taxa de metabolismo cerebral de oxigênio na redução da temperatura corpórea
a cada 1°C;
• Há evidência de uma diminuição dos radicais livres durante o controle da temperatura;
• Há um bloqueio à ação intracelular da exposição às
exitotoxinas (acionadas pelo aumento do cálcio e do
glutamato) reduzindo a resposta inflamatória na síndrome pós-PCR.
As orientações divulgadas através do The Advanced Life
Support Task Force of the International Liaison Committee on
Resuscitation se resumem:
• O termo “terapia do controle da temperatura” passou a
ser preferível ao termo “hipotermia terapêutica” anteriormente empregado.
• Manter uma faixa de 32 a 36°C quando o controle da
temperatura for indicado.
• Em algumas subpopulações, o benefício associado a
baixas temperaturas com faixas de 32 a 34°C ou a temperaturas mais elevadas de 36°C, permanece incerto e
novos estudos devem ser analisados.
• Recomenda-se o controle da temperatura para os adultos sobreviventes de PCR extra-hospitalar com ritmo
inicial FV/TV e que permanecem em coma após o RCE.
• Sugere-se o controle da temperatura para os adultos
sobreviventes de PCR extra-hospitalar com ritmo inicial
não chocável e que permaneçam em coma após o RCE.
• Sugere-se o controle da temperatura para os adultos
sobreviventes de PCR intra-hospitalar em qualquer ritmo
inicial e que permaneçam arresponsivos após o RCE.
• Se o controle da temperatura for iniciado, sugere-se
mantê-lo 24 horas.
PERSPECTIVAS
A divulgação do conhecimento ao público favorecendo
o reconhecimento das situações de PCR e da necessidade
do início das manobras de RCP, associados a estruturas que
ofereçam atendimento rápido, trouxe melhora da sobrevida
e qualidade de vida aos pacientes que evoluíram com RCE.
Apesar disto na prática, a partir dos critérios de inclusão fica
evidente que o número de pacientes elegíveis para TCT é
significativamente inferior ao total dos admitidos pós-PCR
nos serviços de emergência.
A terapia do controle da temperatura certamente é
um dos tópicos que deverá ocupar um maior espaço no
tratamento de pacientes sobreviventes a PCR. A valorização de um parâmetro simples: a temperatura corpórea
deve ser incorporada nos cuidados médicos a pacientes
críticos pós-PCR cujas altas taxas de mortalidade buscamos reduzir.
Conflitos de interesse
Os autores declaram não possuir conflitos de interesse na realização deste trabalho.
Referências
1. Neumar RW, Nolan JP, Adrie C, Aibiki M, Berg RA, Böttiger BW,
et al. Post Cardiac Arrest Syndrome: epidemiology, pathophysiology, treatment, and prognostication. A consensus statement
from the International Liaison Committee on Resuscitation (American Heart Association, Australian and New Zealand Council
on Resuscitation, European Resuscitation Council, Heart and
Stroke Foundation of Canada, InterAmerican Heart Foundation,
Resuscitation Council of Asia, and the Resuscitation Council of
Southern Africa); the American Heart Association Emergency
Cardiovascular Care Committee; the Council on Cardiovascular
Surgery and Anesthesia; the Council on Cardiopulmonary, Perioperative, and Critical Care; the Council on Clinical Cardiology;
and the Stroke Council. Circulation. 2008;118(23):2452-83.
2. Deakin CD, Fothergill R, Moore F, Watson L, Whitbread M4.
Level of consciousness on admission to Heart attack Centre
is a predictor of survival from out of hospital cardiac arrest.
Resuscitation. 2014;85:905-9.
3. Nolan JP, Soar J, Cariou A, Cronberg T, Moulaert VR, Deakin
CD, et al. European Resuscitation Council and European Society
of Intensive Care Medicine Guidelines for Post-resuscitation Care
2015, Section 5 of the European Resuscitation Council Guidelines for Resuscitation 2015. Resuscitation. 2015;95:202-22.
4. Alzaga A, Cerdan M, Varon J. Therapeutic hypothermia. Resuscitation 2006;70:369-80.
5. Holzer M, Bernard SA, Hachimi-Idrissi S, Roine RO, Sterz
F, Müllner M, et al. Hypothermia for neuroprotection after cardiac arrest: Systematic review and individual patient data meta-analysis. Crit Care Med. 2005;33:414-8.
6. Hachimi-Idrissi S, Van Hamelrijck AV, Michotte A, Smolders
I, Sarre S, Ebinger G, et al. Post ischemic hypotermia reduces
neurotransmitter release and astroglial cell proliferation during
reperfusion after asphyxia cardiac arrest in rats. Brain Res.
2004;1019:217-25.
7. Rech TH, Vieira SR. Mild Therapeutic hypothermia after cardiac
arrest: mechanism of action and protocol development. Rev
Bras Ter Intensiva. 201;22(2):196-205.
8. Bernard SA, Buist M. Induced hypothermia in critical care medicine: A review. Crit Care Med. 2003;31:2041-51.
9. Bernard SA, Gray TW, Buist MD, Jones BM, Silvester W, Gutteridge G, et al. Treatment of comatose survivors of out-of-hospital cardiac arrest with induced hypothermia. N Engl J Med.
2002;346(8):557-63.
10.Valeri CR, Mac Gregor H, Cassidy G, Tinney R, Pompei F. Effects
of temperature on bleeding time and clotting time in normal male
and female volunteers. Crit Care Med. 1995;23:698-704.
11.Laver S, Farrow C, Turner D, Nolan J. Mode of death after admission to an intensive care unit following cardiac arrest. Intensive
Care Med. 2004;30:2126-8.
12.Kern KB, Hilwig RW, Rhee KH, Berg RA. Myocardial dysfunction
after resuscitation from cardiac arrest: an example of global
myocardial stunning. J Am Coll Cardiol. 1996;28(1):232-40.
13.Larsen Jm, Ravkilde J. Acute coronary angiography in patients
resuscitated from out of hospital cardiac arrest – a systematic
review and meta analysis. Resuscitation. 2012;83:1427-33.
14.P iegas LS, Timerman A, Feitosa GS, Nicolau JC, Mattos
LAP, Andrade, et al. V Diretriz da Sociedade Brasileira de
Cardiologia sobre tratamento do infarto agudo do miocárdio com supradesnível do segmento ST. Arq Bras Cardiol.
2015;105(2):1-105.
Rev Soc Cardiol Estado de São Paulo 2016;26(1):27-33
TERAPIA DO CONTROLE DA TEMPERATURA PÓS-PARADA CARDIORRESPIRATÓRIA
15.Gonzales MM, Timerman S, Gianotto-Oliveira R, Polastri TF,
Canesin MF, Schimidt A, et al. I Diretiz de Ressuscitação
Cardioplumonar e Cuidados cardiovasculares de Emergencia da Sociedade Brasileira de Cardiologia. Arq Bras Cardiol.
2013;101(2 Supl. 3):1-221.
16.Balan IS, Fiskum G, Hazelton J, Cotto-Cumba C, Rosenthal RE. et
al. Oximetry- guided reoxygenation improves neurological outcome
after experimental cardiac arrest. Stroke. 2006;37(12):3008-13.
17.Dellinger RP, Levy MM, Carlet JM, Bion J, Parker MM, Jaeschke
R, et al. International Surviving Sepsis Campaign Guidelines
Committee; American Association of Critical-Care Nurses; American College of Chest Physicians; American College of Emergency Physicians; Canadian Critical Care Society; European
Society of Clinical Microbiology and Infectious Diseases; European Society of Intensive Care Medicine; European Respiratory
Society; International Sepsis Forum; Japanese Association for
Acute Medicine; Japanese Society of Intensive Care Medicine;
Society of Critical Care Medicine; Society of Hospital Medicine;
Surgical Infection Society; World Federation of Societies of Intensive and Critical Care Medicine. Surviving Sepsis Campaign:
international guidelines for management of severe sepsis and
septic shock: 2008. Crit Care Med. 2008;36(1):296-327.
18.Peberdy MA, Callaway CW, Neumar RW, Geocadin RG, Zimmerman JL, Donnino M, et al. Part 9: Post-Cardiac Arrest Care In:
2010 International Consensus on Cardiopulmonary Resuscitation
and Emergency Cardiovascular Care Science with Treatment and
Recommendations. Circulation. 2010;122(suppl 3):S738-S786.
19.Neumar RW, Otto CW, Link MS, Kronick SL, Shuster M, Callaway CW, et al. Part 8: Adult Advanced Vardiac Life Support.
2010 Americas Heart Association Guidelines for Cardiopulmonay
Resuscitation and Emergency Cardiovascular Care. Circulation.
2010;122(suppl3):S729-67.
20.Laurent I, Monchi M, Chiche JD, Joly LM, Spaulding C, Bourgeois
B, et al. Reversible myocardial dysfunction in survivors of out-of-hospital cardiac arrest. J Am Coll Cardiol. 2002;40(12): 2110-6.
21.Sunde K, Pytte M, Jacobsen D, Mangschau A, Jensen LP, Smedsrud C, et al. Implementation of a standardised treatment protocol for post resuscitation care after out-of-hospital cardiac arrest.
Resuscitation. 2007;73(1):29-39.
22.Zeiner A, Holzer M, Behringer W, Shörkhuber W, Müllner M, Frass
M, et al. Mild resuscitative hypothermia to improve neurological
outcome after cardiac arrest. Hypothermia after cardiac arrest
(HACA) study group. Stroke. 2000;31(1):86-94.
23.Nolan JP, Hazinski MF, Billi JE, Boettiger BW, Bossaert L, de
Caen AR,, et al. Part 1: Executive summary: 2010 International
Consensus on Cardiopulmonary Resuscitation and Emergency
Cardiovascular Care Science with Treatment recommendations.
Resuscitation. 2010;81(suppl 1):e1-e25.
24.Nielsen N, Wetterslev J, Cronberg T, Erlinge D, Gasche Y, Hassager C, et al. Target temperature management at 33 C versus
36 C after cardiac arrest. N Engl J Med2013;369(23):2197-206.
25.International Liaison Committee –ILCOR. ILCOR update: Target
temperature management. Target temperature management
following cardiac arrest: An update. ILCOR 2013. Available from:
http://www.ilcor.org/data/TTM-ILCOR-update-Dec-2013.pdf
26.Storm C. The use of hypothermia and outcome post cardiopulmonary resuscitation in 2014. Rev Bras Ter Intensiva.
2014;26(2):83-5.
27.Kliegel A, Losert H, Sterz F, Kliegel M, Holzer M, Uray T, et al.
Cold simple intravenous infusions preceding special endovascular cooling for faster induction of mild hypothermia after cardiac
arrest–a feasibility study. Resuscitation. 2005;64(3):347-51.
28.Polderman KH, Peerdeman SM, Girbes AR. Hypophosphatemia
and hypomagnesemia induced by cooling in patients with severe
head injury. J Neurosurg.2001;94(5):697-705
29.Polderman KH. Application of therapeutic hypothermia in the
intensive care unit: opportunities and pitfalls of a promising
treatment modality, part 2: practical aspects and side effects.
Intensive Care Med. 2004;30(5):757-69.
33
Rev Soc Cardiol Estado de São Paulo 2016;26(1):27-33
revisão/review
Terapia dialítica no paciente cardiopata
Dialysis therapy in patients with heart disease
Resumo
Celso Amodeo¹
Antonio Carlos Cordeiro¹
Saulo Barbosa Vasconcelos
de Alencar²
1. Seção de Hipertensão e Nefrologia
– Instituto Dante Pazzanese de
Cardiologia, São Paulo, SP.
2. Real Hospital Português de
Beneficência em Pernambuco.
Correspondência: Rua das Gardêneas,
22, São Paulo, SP. Cep 04047-010.
[email protected]
A otimização das medidas para controle volêmico tem papel preponderante na
abordagem de pacientes com disfunção cardíaca e renal combinada, uma vez que
alterações crônicas ou agudas em um desses órgãos, em geral, induzem ou perpetuam
anormalidades (funcionais e/ou estruturais) no outro. Esta revisão de literatura propõe
uma análise sobre as principais medidas terapêuticas no cardiopata com disfunção renal.
Descritores: Síndrome Cardiorrenal; Revisão; Terapêutica.
Abstract
Optimizing the methods used in the control of volemia is very important in the treatment
of patients with combined heart and renal dysfunction, as chronic or acute changes in
either of these organs generally induces or perpetuates abnormalities (functional and/or
structural) in the other. This literature review analyzes the main therapeutic methods used
in heart disease with renal dysfunction.
Descriptors: Cardio-Renal Syndrome; Review; Therapeutics.
34
Introdução
A presença de disfunção cardíaca e renal combinadas é
relativamente comum nas unidades de terapia intensiva, uma
vez que alterações crônicas ou agudas em um desses órgãos,
em geral, induzem ou perpetuam anormalidades (funcionais e/
ou estruturais) do outro; sendo esta a base fisiológica de uma
entidade clínica denominada síndrome cardiorrenal (SCR).1,2
Pacientes com SCR são classificados, de acordo com o mecanismo básico de início da síndrome, em 4 tipos:1
• SCR tipo I: Insuficiência cardíaca (IC) aguda levando à
lesão renal aguda (LRA).
• SCR tipo II: IC crônica levando à doença renal crônica (DRC).
• SCR tipo III: LRA levando à IC aguda.
• SCR tipo IV: DRC levando à IC crônica.
A incidência da síndrome cardiorrenal é bastante elevada nos doentes internados por insuficiência cardíaca,
estimando-se que 25 a 33% destes pacientes venham a
desenvolvê-la,3,4 o que além de aumentar significativamente o custo da internação também tem importante impacto
prognóstico nesta população.2 Dentro deste contexto, a
mortalidade de pacientes com SCR que desenvolvem choque cardiogênico varia de 50 a 80% em diferentes estudos5,6
e é interessante ressaltar que o risco de morte associado
à SCR é maior que o projetado para pacientes que desenvolvem insuficiência renal ou cardíaca isoladamente.2 Uma
metanálise que avaliou 16 estudos, num total de 80.098
pacientes com IC, evidenciou que a mortalidade em um
ano variou de 26% nos pacientes sem comprometimento
renal para 42% naqueles com algum grau de disfunção renal
e 51% nos pacientes com insuficiência renal moderada a
grave.7 Neste estudo, a piora da função renal se associou a
um aumento de 47% no risco de morte, calculando-se que
para cada elevação de 1 mg/dL na creatinina sérica havia
um aumento de 33% na mortalidade.7
A hipervolemia é extremamente prevalente em portadores de insuficiência cardíaca,8 mesmo naqueles aparentemente euvolêmicos,9 e impacta negativamente o prognóstico destes pacientes, além disso, é agravada sobremaneira
pelo desenvolvimento da disfunção renal. Desta forma, a
otimização das medidas para controle volêmico tem papel
preponderante na abordagem desta população. Estas medidas incluem desde o uso adequado de diuréticos até a
utilização das diferentes modalidades de terapia dialítica,
foco da presente revisão de literatura.
Ultrafiltração
A sobrecarga de volume e os sintomas congestivos são
algumas das maiores dificuldades no manejo de pacientes
com SCR aguda e crônica. Em doentes com refratariedade
ao tratamento com diuréticos, a ultrafiltração é uma estratégia alternativa para auxiliar no controle volêmico. Uma
vantagem teórica deste método é a remoção de líquido
em taxa controlada, que geralmente não deve ultrapassar
15ml/kg/min, com o intuito de permitir a retirada de líquido
do espaço intravascular de modo que haja equilíbrio com
o extravascular. Dessa maneira, pode-se evitar ativação
neuro-humoral, cujo impacto é negativo tanto na doença
Rev Soc Cardiol Estado de São Paulo 2016;26(1):34-8
Terapia dialítica no paciente cardiopata
renal quanto cardíaca. Outro benefício é a menor indução
de distúrbios hidroeletrolíticos, como hipocalemia, hipernatremia e hipomagnesemia, além de permitir maior remoção
de sódio, tendo em vista que o ultrafiltrado é isotônico em
relação ao plasma, enquanto que a urina é habitualmente
hipotônica quando do uso de diuréticos.10
Em geral, nas unidades de terapia intensiva, quando se
deseja realizar apenas a redução volêmica, emprega-se a
ultrafiltração contínua lenta (SCUF). O método consiste em
conduzir o sangue por meio de acesso venoso para circuito
extracorpóreo, removendo-se líquido por meio de gradiente
pressórico (hidrostático) entre o sangue e uma membrana
semipermeável. A SCUF não prevê o clearance de solutos
e, portanto, não utiliza soluções de diálise ou reposição.11
Diversos estudos têm sido realizados para avaliar o uso
de ultrafiltração para controle volêmico na IC. Em 2005 foi
publicado o RAPID-CHF, em que 40 pacientes com IC descompensada foram randomizados para tratamento usual ou
sessão de ultrafiltração com 8 horas de duração. O volume
removido após 24 horas foi maior no grupo submetido à ultrafiltração, tendo havido, também, tendência a maior perda
de peso neste grupo.12
Resultados semelhantes foram observados no estudo
UNLOAD, em que 200 pacientes com IC descompensada
foram randomizados para ultrafiltração ou diuréticos intravenosos, sendo observada maior perda de peso e remoção de líquidos no grupo submetido à ultrafiltração após
48 horas de tratamento; adicionalmente, a necessidade de
reinternações por IC em 90 dias também foi menor neste
grupo. Com relação à mortalidade, não houve diferença
significante entre os grupos.13
Críticas frequentes a estes estudos são não focar especificamente em doentes com síndrome cardiorrenal e a terapia
farmacológica não escalonada. Neste contexto, o CARRESS-HF randomizou 188 pacientes com IC descompensada e
LRA (definida como o aumento ≥ 0,3mg/dL na creatinina sérica em relação ao basal) e congestão persistente para receber
terapia farmacológica escalonada ou ultrafiltração. Ao final
de 96 horas houve uma piora discreta, mas significante na
creatinina sérica no grupo ultrafiltração, sem diferença significativa na perda de peso. Além disso, houve maior frequência
de eventos adversos graves, decorrentes principalmente de
sangramento e complicações relacionadas ao cateter nos
pacientes submetidos à ultrafiltração.14
Apesar de induzir perda de peso e melhora em parâmetros hemodinâmicos como pressão venosa central e índice cardíaco em pacientes com IC, a utilização da SCUF
é associada ao risco mais elevado de conversão para TRS
e mortalidade intra-hospitalar nos doentes refratários ao
tratamento medicamentoso para controle volêmico, o que
provavelmente reflete a gravidade da doença cardíaca.15
Em resumo, o uso de ultrafiltração para controle volêmico em contexto de IC descompensada é efetivo, entretanto
não existe forte evidência que seu uso resulte em melhores
resultados que aqueles obtidos com tratamento farmacológico otimizado. Visto que pode se associar a maior taxa
de complicações relacionadas ao acesso venoso, desenvolvimento de lesão renal aguda e maior custo, deve ser
encarada como ferramenta terapêutica de resgate naqueles
doentes refratários a uso de diuréticos em doses otimizadas.
Rev Soc Cardiol Estado de São Paulo 2016;26(1):34-8
Terapia hemodialítica
Métodos contínuos
Devido à alta incidência de LRA em pacientes admitidos
com IC descompensada,16 frequentemente se faz necessário, além do controle volêmico, o controle metabólico. Desta
forma, a realização de ultrafiltração exclusiva não é suficiente, sendo necessário o emprego de modalidades que
proporcionem, também, o clearance de solutos. Os métodos terapia renal substitutiva (TRS) podem ser classificados
em intermitentes ou contínuos. Apesar de seu impacto na
mortalidade de doentes com LRA ser discutível, os métodos
contínuos têm sido a forma de TRS mais frequentemente
recomendada e utilizada para doentes instáveis hemodinamicamente,17,18 pois proporcionam a remoção hídrica mais
lenta, o que se associa a maior pressão arterial média e
provavelmente menor evolução para doença renal crônica
que as modalidades convencional e estendida.19
Outro possível benefício das terapias contínuas é o uso
do clearance convectivo, em que moléculas maiores são
removidas, sendo sugerido que esse pode ser um dos mecanismos associados à melhora hemodinâmica ocasionalmente observada nessa modalidade. Em cardiopatas, existe
descrição de melhora da responsividade a diuréticos após
sessões de hemodiafiltração, que pode estar relacionada à
redução dos níveis de citocinas inflamatórias, como a interleucina-8 e a MCP-1 (monocyte chemoattractant protein-1)
nestes pacientes.20 A seleção do método, entretanto, deverá
ser sempre individualizada, observando-se as características do paciente.
A dose de efluente a ser oferecida nas terapias substitutivas contínuas deve ser de 20 a 25 ml/kg/h, levando-se
em conta que é comum haver perda de 20% entre as doses
prescrita e ofertada. Para anticoagulação do sistema extracorpóreo, é possível se usar heparina ou citrato regional,
sendo que o uso do citrato tem as vantagens de permitir a
realização de procedimentos invasivos, já que não leva a
anticoagulação sistêmica, e aumentar a sobrevida da membrana usada na terapia.18
Alguns fatores são associados a piores desfechos nos
doentes com IC que necessitam de terapia dialítica. A gravidade da LRA por si é marcador de pior prognóstico nos
doentes com SCR tipo 1. No estudo de Patarroyo, quando
apenas ultrafiltração contínua foi empregada para controle
volêmico, a mortalidade intra-hospitalar observada foi de
12%, entretanto quando houve disfunção renal com necessidade de conversão para diálise contínua no curso da
ultrafiltração, a mortalidade aumentou para 43%.15
O perfil hemodinâmico do paciente no início da terapia
dialítica também tem impacto no prognóstico. Em estudo
envolvendo 37 doentes com SCR tipo I em uso de vasopressor e/ou inotrópico e indicação de diálise contínua por
piora de função renal, foi observada mortalidade de 62% e
sobrevida média de 15,5 dias após início da terapia dialítica.
Piora hemodinâmica foi comum nestes indivíduos, sendo
necessário o aumento da dose de vasopressor em 68%
dos doentes para induzir balanço hídrico negativo. Após
correção de fatores de confusão, maior mortalidade foi
descrita em quem precisou de vasopressor após o início
da terapia contínua.21
35
36
O tratamento substitutivo renal de pacientes com IC
descompensada e lesão renal aguda que evoluem com
choque cardiogênico tem sido questionado, dada à alta
mortalidade destes doentes, que pode chegar a 88% quando há a necessidade de uso de inotrópicos e vasopressores
em contexto de terapia dialítica.21 Alguns autores sugerem
que em caso de choque cardiogênico e lesão renal aguda
grave, o tratamento substitutivo renal seja oferecido apenas
quando terapia definitiva, como transplante cardíaco, está
sendo planejada.
Nestas situações, o uso de ECMO (Extracorporeal
Membrane Oxygenation) vem aumentando como suporte
hemodinâmico no choque cardiogênico, como em doentes com miocardites e em pós-operatório de cirurgia
cardíaca, com relatos de sobrevida de 20 a 50% nestas
situações. A incidência de LRA nesse grupo de doentes
é em torno de 70-85%22,23 e a necessidade de TSR chega
a 60% dos doentes.24
A associação entre ECMO e terapia contínua foi recentemente avaliada em revisão sistemática incluindo 19 estudos. Os doentes em ECMO que precisaram de tratamento
substitutivo renal tiveram uma mortalidade intra-hospitalar
quase seis vezes maior que aqueles que estiveram apenas
em ECMO. Entre os sobreviventes que realizaram os dois
procedimentos, observou-se um menor balanço hídrico
acumulado e taxa de recuperação de função renal sem
necessidade de manutenção de diálise após a alta hospitalar superior a 90%.25
Os diferentes métodos disponíveis se diferenciam
pelos mecanismos de clearance empregados, conforme
descrito abaixo:
1. Hemodiálise venovenosa contínua (CVVHD): Baseia-se
no mecanismo de clearance por difusão e consiste na
infusão da solução de diálise em mecanismo de contra-corrente com o sangue do paciente. Desta forma, o
movimento de solutos através da membrana dialítica é
guiado pela diferença de concentração dos mesmos
entre o sangue e a solução de diálise.11
2. Hemofiltração venovenosa contíua (CVVH): Esta técnica
se baseia no mecanismo de clearance por convecção e
consiste na remoção de grandes quantidades de água
através de um gradiente de pressão transmembrana
(PTM). A água removida, leva consigo os solutos a serem
depurados. O ultrafiltrado é substituído por uma solução
de reposição que pode ser infundida na linha de influxo
(pré-diluição) ou na linha de fluxo de saída do hemofiltro
(pós-diluição).11
3. Hemodiafiltração venovenosa contínua (CVVHDF): É a
modalidade de terapia que associa os mecanismos de
clearance por difusão e convecção no mesmo procedimento, utilizando ao mesmo tempo as soluções de
diálise e de reposição.11
Métodos híbridos
Apesar dos benefícios dos métodos contínuos em
paciente instáveis hemodinamicamente, algumas peculiaridades do método como a necessidade de anticoagulação contínua, enfermagem especializada e o alto custo
envolvido para sua realização inviabilizam sua aplicação em
vários centros. Nesse contexto, desde a década de 1990,
adaptações das máquinas de hemodiálise convencionais
para métodos “semicontínuos” vêm sendo descritas, visando agregar a estabilidade cardiovascular e o clearance efetivo das terapias contínuas com as facilidades operacionais
e custos reduzidos das terapias intermitentes.26 Na literatura,
descrevem-se os seguintes métodos híbridos:
1. Hemodiálise diária estendida (EDD): Modalidade que
estende a terapia dialítica a períodos maiores do que a
hemodiálise convencional (em geral 6 a 8 horas), utilizando, também, fluxos de sangue e solução de diálise
mais baixos (respectivamente 200 ml/min e 300 ml/min).11
2. Hemodiálise estendida de baixa eficiência (SLED): O tempo de tratamento é mais longo que o da EDD (6 a 12h) e
o fluxo de sangue mais lento (50 a 200 ml/min), visando
reduzir a taxa de ultrafiltração e a eficiência de remoção
de solutos, com o objetivo, respectivamente, de otimizar
o controle hemodinâmico e minimizar o desequilíbrio
eletrolítico/metabólico.11
Diálise peritoneal
Nesta modalidade dialítica, as trocas são feitas entre
o sangue contido nos capilares peritoneais e a solução de
diálise infundida na cavidade peritoneal. As trocas ocorrem
entre os capilares peritoneais e a solução de diálise, simultaneamente, por dois mecanismos distintos: difusão (guiada
pelo gradiente de concentração entre o sangue e a solução
de diálise) e ultrafiltração (guiada pelo gradiente osmótico,
neste caso, determinado pela concentração de glicose da
solução de diálise).27 A ultrafiltração também pode ser promovida por gradiente coloidosmótico, quando em vez da
glicose é empregado um polímero de glicose com elevado
peso molecular, a icodextrina.27
O primeiro registro do emprego da diálise peritoneal
(DP) para tratamento de paciente cardiopata com hiepervolemia refratária data da década de 40,28 desde então
uma série de estudos tem demonstrado os benefícios da
DP no tratamento de pacientes com IC. Levando-se em
consideração a fisiopatologia síndrome cardiorrenal, utilização da DP é particularmente atrativa em pacientes com o
tipo 2.29,30 Nesta população, o ponto de partida da disfunção
é a redução no débito cardíaco, levando a três alterações
principais: a queda no volume sanguíneo efetivo, congestão
venosa e ativação neuro-humoral (ativação simpática, ativação do sistema renina-angiotensina-aldosterona e aumento
da liberação de arginina-vasopressina). A ativação neuro-humoral resulta no desbalanço entre fatores vasodilatadores
e vasoconstrictores que vão levar, em última instância, à
vasoconstricção renal e aumento na reabsorção tubular proximal de sódio e água, contribuindo para o desenvolvimento
da hipervolemia com consequente agravamento da IC e
redução ainda maior do débito cardíaco. Além da piora na
função cardíaca, a função renal se deteriora progressivamente, não apenas pela hipoperfusão, mas também pelo
desenvolvimento de glomeruloesclerose e fibrose intersticial
secundárias à ativação neuro-humoral.29
Os benefícios da DP em pacientes com IC têm origem
multifatorial. Em primeiro lugar, a ultrafiltração contínua e lenta
proporcionada pelo método reduz os riscos de episódios de
hipotensão.30 Outro benefício vem do fato do mecanismo
de ultrafiltração do método (no qual o ultrafiltrado vem dos
Rev Soc Cardiol Estado de São Paulo 2016;26(1):34-8
Terapia dialítica no paciente cardiopata
microvasos peritoneais) ser mais próximo do fisiológico, expandindo a superfície vascular para trocas e reduzindo de
forma mais efetiva o edema intersticial. Esta característica
em particular vai de encontro a um importante princípio
terapêutico na insuficiência cardíaca crônica, a redução da
congestão venosa renal e central.30 O terceiro benefício viria
dos efeitos metabólicos da DP, quais sejam, a absorção
da glicose presente na solução de diálise e a correção da
acidose, favorecendo a correção do estado nutricional e da
anemia.31 Em quarto lugar, a remoção de toxinas e citocinas pró-inflamatórias pelo dialisato traria efeitos benéficos
à função cardíaca.32 Por fim, por promover a UF mais lenta,
a diálise peritoneal é capaz de preservar por mais tempo
a função renal residual, uma vez que se associa ao menor
risco de hipotensões e menor ativação simpática e do sistema renina-angiotensina-aldosterona.28
Apesar da teórica vantagem de DP em comparação à
hemodiálise em pacientes com doença cardíaca, a questão é controversa, com alguns estudos evidenciando uma
maior mortalidade em pacientes com IC submetidos à
DP,33,34 contudo, há de ser ressaltado que estes estudos
avaliaram pacientes com SCR tipo 4. Por outro lado, quando
se avaliam os efeitos da DP em pacientes com SCR tipo 2
os resultados são diferentes, havendo farta evidência dos
efeitos benéficos da diálise peritoneal nesta população, entre eles: a melhora da função cardíaca e da classe funcional
(redução de 2 classes pela classificação da “New York Heart
Association” em até 65% dos pacientes),35,36 a redução no
número de hospitalizações,37-39 a redução na necessidade
de diuréticos40 e a melhora na qualidade de vida.35,41,42
As principais modalidades de DP são:
1. Diálise peritoneal ambulatorial contínua (CAPD): Caracte-
riza-se pela infusão e drenagem manuais da solução de
diálise na cavidade peritoneal. Habitualmente são realizadas três trocas diurnas com permanência de 5 a 6 horas
e uma troca noturna com permanência de 6 a 8 horas.27
2. Diálise peritoneal automatizada (APD): Caracteriza-se
pela infusão e drenagem automáticas, através de máquina cicladora acoplada ao cateter peritoneal. Em geral
são realizadas de três a seis trocas no período da noite,
enquanto o paciente dorme. Os tipos mais empregados
de DPA são:
3. Diálise peritoneal cíclica contínua (CCPD): Três a seis
trocas noturnas, mantendo-se solução de diálise na cavidade peritoneal durante o dia.27
4. Diálise peritoneal intermitente noturna (NIPD): Três a seis
trocas noturnas, como na DPCC, porém com a cavidade
peritoneal vazia durante o dia.27
5. Diálise Peritoneal de Alto Volume (HVPD): Caracteriza-se
por sessões que duram 24 horas, havendo grande número
de trocas de solução de diálise em cada sessão (entre 18
e 22 trocas com um volume de dialisato aproximado de
36 a 44 litros) e tempo de permanência de cada bolsa na
cavidade peritoneal variando entre 35 e 50 minutos, sendo
realizada na maioria das vezes por meio de cicladora. Esta
modalidade tem o objetivo de obter um clearance aumentado de pequenos solutos e é geralmente empregada em
pacientes com lesão renal aguda43.
Conflitos de interesse
Os autores declaram não possuir conflitos de interesse na realização deste trabalho.
Referências
1. Ronco C, McCullough PA, Anker SD, Anand I, Aspromonte N, Bagshaw SM, et al. Cardiorenal syndromes: an executive summary
from the consensus conference of the Acute Dialysis Quality
Initiative (ADQI). Contrib Nephrol. 2010;165:54-67.
2. Graziani G, Pini D, Oldani S, Cucchiari D, Podesta MA, Badalamenti S. Renal dysfunction in acute congestive heart failure:
a common problem for cardiologists and nephrologists. Heart
Fail Rev. 2014 Nov;19(6):699-708.
3. Ronco C, Cicoira M, McCullough PA. Cardiorenal syndrome type
1: pathophysiological crosstalk leading to combined heart and
kidney dysfunction in the setting of acutely decompensated heart
failure. J Am Coll Cardiol. 2012 Sep 18;60(12):1031-42.
4. Metra M, Davison B, Bettari L, Sun H, Edwards C, Lazzarini V,
et al. Is worsening renal function an ominous prognostic sign in
patients with acute heart failure? The role of congestion and its
interaction with renal function. Circ Heart Fail. 2012;5(1):54-62.
5. Marenzi G, Assanelli E, Campodonico J, De Metrio M, Lauri
G, Marana I, et al. Acute kidney injury in ST-segment elevation
acute myocardial infarction complicated by cardiogenic shock
at admission. Crit Care Med. 2010;38(2):438-44.
6. Koreny M, Karth GD, Geppert A, Neunteufl T, Priglinger U, Heinz
G, et al. Prognosis of patients who develop acute renal failure
during the first 24 hours of cardiogenic shock after myocardial
infarction. Am J Med. 2002;112(2):115-9.
7. Smith GL, Lichtman JH, Bracken MB, Shlipak MG, Phillips CO,
DiCapua P, et al. Renal impairment and outcomes in heart faiRev Soc Cardiol Estado de São Paulo 2016;26(1):34-8
lure: systematic review and meta-analysis. J Am Coll Cardiol.
2006;47(10):1987-96.
8. Costanzo MR, Jessup M. Treatment of congestion in heart failure
with diuretics and extracorporeal therapies: effects on symptoms,
renal function, and prognosis. Heart Fail Rev. 2012;17(2):313-24.
9. Androne AS, Katz SD, Lund L, LaManca J, Hudaihed A, Hryniewicz K, et al. Hemodilution is common in patients with advanced
heart failure. Circulation. 2003;107(2):226-9.
10.Felker GM, Mentz RJ. Diuretics and ultrafiltration in acute decompensated heart failure. J Am Coll Cardiol. 2012;59(24):2145-53.
11.Patel P, Nandwani V, McCarthy PJ, Conrad SA, Keith Scott L.
Continuous renal replacement therapies: a brief primer for the
neurointensivist. Neurocrit Care. 2010;13(2):286-94.
12.Bart BA, Boyle A, Bank AJ, Anand I, Olivari MT, Kraemer M, et
al. Ultrafiltration versus usual care for hospitalized patients with
heart failure: the Relief for Acutely Fluid-Overloaded Patients With
Decompensated Congestive Heart Failure (RAPID-CHF) trial. J
Am Coll Cardiol. 2005;46(11):2043-6.
13.Costanzo MR, Guglin ME, Saltzberg MT, Jessup ML, Bart BA,
Teerlink JR, et al. Ultrafiltration versus intravenous diuretics for
patients hospitalized for acute decompensated heart failure. J
Am Coll Cardiol. 2007;49(6):675-83.
14.Bart BA, Goldsmith SR, Lee KL, Givertz MM, O’Connor CM,
Bull DA, et al. Ultrafiltration in decompensated heart failure with
cardiorenal syndrome. N Engl J Med. 2012;367(24):2296-304.
37
38
15.Patarroyo M, Wehbe E, Hanna M, Taylor DO, Starling RC, Demirjian S, et al. Cardiorenal outcomes after slow continuous
ultrafiltration therapy in refractory patients with advanced decompensated heart failure. J Am Coll Cardiol. 2012;60(19):1906-12.
16.Roy AK, Mc Gorrian C, Treacy C, Kavanaugh E, Brennan A,
Mahon NG, et al. A Comparison of Traditional and Novel Definitions (RIFLE, AKIN, and KDIGO) of Acute Kidney Injury for the
Prediction of Outcomes in Acute Decompensated Heart Failure.
Cardiorenal Med. 2013;3(1):26-37.
17.Uchino S, Kellum JA, Bellomo R, Doig GS, Morimatsu H, Morgera
S, et al. Acute renal failure in critically ill patients: a multinational,
multicenter study. JAMA. 2005;294(7):813-8.
18.Kidney Disease: Improving Global Outcomes (KDIGO) Acute
Kidney Injury Work Group. KDIGO Clinical Practice Guideline for
Acute Kidney Injury. Kidney inter, Suppl. 2012;2:1-138.
19.Rabindranath K, Adams J, Macleod AM, Muirhead N. Intermittent
versus continuous renal replacement therapy for acute renal failure in adults. Cochrane Database Syst Rev. 2007(3):CD003773.
20.Libetta C, Sepe V, Zucchi M, Pisacco P, Cosmai L, Meloni F, et
al. Intermittent haemodiafiltration in refractory congestive heart
failure: BNP and balance of inflammatory cytokines. Nephrol
Dial Transplant. 2007;22(7):2013-9.
21.Prins KW, Wille KM, Tallaj JA, Tolwani AJ. Assessing continuous
renal replacement therapy as a rescue strategy in cardiorenal
syndrome 1. Clin Kidney J. 2015;8(1):87-92.
22.Lin CY, Chen YC, Tsai FC, Tian YC, Jenq CC, Fang JT, et al.
RIFLE classification is predictive of short-term prognosis in
critically ill patients with acute renal failure supported by extracorporeal membrane oxygenation. Nephrol Dial Transplant.
2006;21(10):2867-73.
23.Yan X, Jia S, Meng X, Dong P, Jia M, Wan J, et al. Acute kidney injury in adult postcardiotomy patients with extracorporeal
membrane oxygenation: evaluation of the RIFLE classification
and the Acute Kidney Injury Network criteria. Eur J Cardiothorac
Surg. 2010;37(2):334-8.
24.Kielstein JT, Heiden AM, Beutel G, Gottlieb J, Wiesner O, Hafer
C, et al. Renal function and survival in 200 patients undergoing
ECMO therapy. Nephrol Dial Transplant. 2013;28(1):86-90.
25.Chen H, Yu RG, Yin NN, Zhou JX. Combination of extracorporeal membrane oxygenation and continuous renal replacement
therapy in critically ill patients: a systematic review. Crit Care.
2014;18(6):675.
26.Custodio FB, de Lima EQ. Extended hemodialysis in acute kidney injury. J Bras Nefrol. 2013;35(2):142-6.
27.Abensur H. Uso da diálise peritoneal em pacientes com insuficiência cardíaca congestiva. Rev Bras Hipertens. 2008;15(3):162-5.
28.Schneierson SJ. Continuous peritoneal irrigation in the treatment of intractable edema of cardiac origin. Am J Med Sci.
1949;218(1):76-9.
29.Pego C, Rodrigues A, Ronco C. Role of peritoneal dialysis as a
chronic renal replacement therapy in cardiorenal patients. Contrib Nephrol. 2012;178:182-8.
30.Nakayama M. Nonuremic indication for peritoneal dialysis for
refractory heart failure in cardiorenal syndrome type II: review
and perspective. Perit Dial Int. 2013;33(1):8-14.
31.Silverberg DS, Wexler D, Blum M, Sheps D, Schwartz D, Yachnin T, et al. Aggressive therapy of congestive heart failure and
associated chronic renal failure with medications and correction
of anemia stops or slows the progression of both diseases. Perit
Dial Int. 2001;21 Suppl 3:S236-40.
32.Cordeiro AC, Carrero JJ, Abensur H, Lindholm B, Stenvinkel P.
Systemic and local inflammation in peritoneal dialysis: mechanisms, biomarkers and effects on outcome. Contrib Nephrol.
2009;163:132-9.
33.Stack AG, Molony DA, Rahman NS, Dosekun A, Murthy B.
Impact of dialysis modality on survival of new ESRD patients
with congestive heart failure in the United States. Kidney Int.
2003;64(3):1071-9.
34.Sens F, Schott-Pethelaz AM, Labeeuw M, Colin C, Villar E. Survival advantage of hemodialysis relative to peritoneal dialysis
in patients with end-stage renal disease and congestive heart
failure. Kidney Int. 2011;80(9):970-7.
35.Sanchez JE, Ortega T, Rodriguez C, Diaz-Molina B, Martin M,
Garcia-Cueto C, et al. Efficacy of peritoneal ultrafiltration in the
treatment of refractory congestive heart failure. Nephrol Dial
Transplant. 2010;25(2):605-10.
36.Gotloib L, Fudin R, Yakubovich M, Vienken J. Peritoneal dialysis
in refractory end-stage congestive heart failure: a challenge facing a no-win situation. Nephrol Dial Transplant. 2005;20 Suppl
7:vii32-6.
37.Tormey V, Conlon PJ, Farrell J, Horgan J, Walshe JJ. Long-term
successful management of refractory congestive cardiac failure by intermittent ambulatory peritoneal ultrafiltration. QJM.
1996;89(9):681-3.
38.Courivaud C, Kazory A, Crepin T, Azar R, Bresson-Vautrin C,
Chalopin JM, et al. Peritoneal dialysis reduces the number of
hospitalization days in heart failure patients refractory to diuretics.
Perit Dial Int. 2014;34(1):100-8.
39.Cnossen TT, Kooman JP, Konings CJ, Uszko-Lencer NH, Leunissen KM, van der Sande FM. Peritoneal dialysis in patients
with primary cardiac failure complicated by renal failure. Blood
Purif. 2010;30(2):146-52.
40.Sheppard R, Panyon J, Pohwani AL, Kapoor A, Macgowan G,
McNamara D, et al. Intermittent outpatient ultrafiltration for the
treatment of severe refractory congestive heart failure. J Card
Fail. 2004;10(5):380-3.
41.Stegmayr BG, Banga R, Lundberg L, Wikdahl AM, Plum-Wirell
M. PD treatment for severe congestive heart failure. Perit Dial
Int. 1996;16 Suppl 1:S231-5.
42.Ryckelynck JP, Lobbedez T, Valette B, Le Goff C, Mazouz O,
Levaltier B, et al. Peritoneal ultrafiltration and treatment-resistant
heart failure. Nephrol Dial Transplant. 1998;13 Suppl 4:56-9.
43.Burdmann EA, Chakravarthi R. Peritoneal dialysis in acute kidney
injury: lessons learned and applied. Semin Dial. 2011;24(2):149-56.
Rev Soc Cardiol Estado de São Paulo 2016;26(1):34-8
revisão/review
ABORDAGEM CLÍNICA DA CONGESTÃO PULMONAR
AGUDA NO CARDIOPATA
CLINICAL APPROACH TO ACUTE PULMONARY CONGESTION IN HEART DISEASE
Resumo
Edson Stefanini¹
Juscélio Trajano Filho¹
1. Escola Paulista de Medicina da
Universidade Federal de São Paulo,
Disciplina de Cardiologia
Correspondência: Rua Pintassilgo 155
ap. 61 Cep 04514030 .
[email protected]
A congestão pulmonar aguda no paciente com doença cardíaca é uma manifestação clínica de extrema gravidade, ocorrendo em aproximadamente 25% dos casos
de insuficiência cardíaca aguda. O diagnóstico é essencialmente clínico, baseado na
anamnese e exame físico. Os exames complementares não devem retardar o início
do tratamento na sala de emergência. Descontrole pressórico, progressão da doença
valvar, infarto do miocárdio e arritmias são fatores desencadeantes frequentes para
edema agudo de pulmão. O tratamento inicial fundamenta-se na suplementação de
oxigênio e suporte ventilatório, administração de opioides, diuréticos e vasodilatadores
endovenosos. Inotrópicos estão indicados na presença de instabilidade hemodinâmica
com disfunção orgânica.
Descritores: Edema Pulmonar; Insuficiência Cardíaca; Dispneia.
Abstract
Acute pulmonary congestion in patients with cardiac disease is a clinical manifestation
of extreme severity, occurring in approximately 25% of cases of acute heart failure. Diagnosis is essentially clinical, based on history and physical examination. Complementary
tests should not delay the start of treatment in the emergency room. Uncontrolled blood
pressure, progression of valvular disease, myocardial infarction, and arrhythmias are
common triggers for acute pulmonary edema. Initial treatment is based on supplemental oxygen and ventilatory support, administration of opioids, intravenous diuretics, and
vasodilators. Inotropic agents are indicated in the presence of hemodynamic instability
with organ dysfunction.
Descriptors: Pulmonary Edema; Heart Failure; Dyspnea .
INTRODUÇÃO
A congestão pulmonar aguda ou edema agudo pulmonar é caracterizada pelo aumento anormal de líquido
extravascular nos pulmões decorrente do movimento de
fluidos do intravascular para o interstício e alvéolos. É uma
situação clínica de extrema gravidade, que requer definição diagnóstica rápida, para uma conduta terapêutica
de emergência, caso contrário, ocorre deterioração clínica
progressiva do paciente e mesmo evolução para morte
imediata. Pode se apresentar no paciente já previamente
cardiopata ou que desenvolve um quadro de comprometimento agudo do coração, mas também está presente
como complicação cardíaca por disfunção ventricular esquerda nos quadros infecciosos com importante resposta
inflamatória sistêmica.
Na insuficiência cardíaca aguda, o edema agudo pulmonar está presente como a principal manifestação clínica
em aproximadamente 25% dos casos.1
Após o entendimento básico dos aspectos fisiopatolóRev Soc Cardiol Estado de São Paulo 2016;26(1):39-45
gicos, procuraremos abordar os itens fundamentais para o
diagnóstico e terapêutica desta situação clínica.
FISIOPATOLOGIA
O espaço intersticial interposto entre alvéolos e capilares, é formado por tecido conectivo que envolve os bronquíolos terminais, arteríolas e vênulas e apresenta vasos
linfáticos cuja função é remover fluidos e solutos provenientes do espaço intravascular.2
Com o aumento da pressão hidrostática capilar (para valores acima de 25 mmHg) decorrente principalmente da insuficiência ventricular esquerda aguda, ocorre a filtração de
fluidos e proteínas através do endotélio da microcirculação
até o interstício. Nestas circunstâncias, a precária drenagem
linfática, leva ao edema intersticial pulmonar. Em situações
em que a pressão oncótica intravascular é reduzida, pode
ocorrer extravasamento de fluidos para o interstício com
pressões hidrostáticas mais baixas.
A presença de líquido extravascular determina alte-
39
rações na relação ventilação/perfusão dos pulmões consequente ao aparecimento de áreas perfundidas, mas
hipoventiladas, levando à hipoxemia. A estimulação dos
receptores “J” no interstício pulmonar, leva a taquipneia
com redução da pCO2 arterial. O aumento da frequência
respiratória leva à exaustão física e pode ocorrer hipoventilação com retenção de CO2.2
ETIOLOGIA E FATORES
DESENCADEANTES
40
No cardiopata, a congestão pulmonar é decorrente da
sobrecarga pressórica do átrio esquerdo e a consequente elevação da pressão hidrostática capilar pulmonar com
extravasamento para o interstício e alvéolos pulmonares.
Quadros infecciosos, não exclusivamente nos pulmões,
com evolução ou não para sepse, podem alterar a permeabilidade capilar pulmonar e, só esse fenômeno, pode
resultar em congestão aguda. Naturalmente, ocorrendo no
cardiopata, a infecção pode se constituir num cofator para
o quadro de congestão pulmonar.
Outra ocorrência não infrequente é a hiperexpansão
volêmica no portador de cardiopatia que está no limite da
hipertensão venocapilar por dificuldade de esvaziamento do
átrio esquerdo, muito comum no idoso com complacência
prejudicada do ventrículo esquerdo.
Entre as causas mais frequentes de congestão pulmonar aguda incluem-se as síndromes isquêmicas miocárdicas agudas, particularmente o infarto agudo do
miocárdio em que o edema agudo pulmonar pode ser a
primeira manifestação clínica em 10 a 20% dos casos.
Na hipertensão arterial o quadro de congestão pulmonar
aguda caracteriza uma emergência hipertensiva. Entre
as miocardiopatias destaca-se a miocardite aguda como
causa de edema agudo pulmonar. As valvopatias, particularmente as estenoses, mitral e aórtica e também as
taquiarritmias ou bradiarritmias podem desencadear congestão pulmonar aguda.
O “flash” edema agudo pulmonar é uma forma característica de congestão pulmonar manifesta de forma súbita
por aumento rápido e importante da pressão de enchimento
diastólico do ventrículo esquerdo. Constitui cerca de 3% das
formas de apresentação clínica da insuficiência cardíaca
aguda.1 Geralmente é secundário a uma isquemia aguda
miocárdica com ou sem infarto, à insuficiência mitral aguda, à crise hipertensiva, à insuficiência aórtica aguda ou à
cardiomiopatia de estresse (cardiomiopatia de Takotsubo).
ABORDAGEM DIAGNÓSTICA
Uma criteriosa avaliação clínica do paciente que apresenta um acentuado desconforto respiratório agudo, assim
como a utilização de exames subsidiários de rápida e fácil
realização a beira do leito e de baixo custo, propicia uma
orientação diagnóstica segura na maioria dos pacientes.
A identificação do principal mecanismo desencadeante
do quadro de congestão pulmonar aguda facilita uma
adequada intervenção terapêutica no atendimento inicial
e estabelece a prioridade para a indicação de métodos
propedêuticos mais complexos, buscando um diagnóstico
definitivo.3 Habitualmente os pacientes encontram-se intensamente graves e a demora na instituição do tratamento
pode trazer prejuízos bastante significativos. Assim, ao
mesmo tempo em que se obtêm as informações, atitudes
terapêuticas imediatas devem ser tomadas, como oxigenação e ventilação.
Apresentação clínica
Os pacientes apresentam-se habitualmente adotando
uma postura de decúbito elevado ou mesmo sentado, com
intenso desconforto respiratório, taquipneia, tosse seca
que pode vir acompanhada de expectoração rósea espumosa. A saturação arterial de oxigênio neste momento
apresenta-se abaixo de 90%.4
Exame físico
No paciente com edema pulmonar agudo, apresentam-se com crepitações bilaterais, podendo estender-se
até os ápices pulmonares. Aproximadamente um terço
dos pacientes idosos com edema agudo de pulmão apresentam sibilos na ausculta, o que pode estar associado à
hipercapnia embora não determine maior mortalidade.5 Uma
acurada ausculta cardíaca pode mostrar: terceira bulha ou
ritmo de galope, diagnosticando insuficiência miocárdica;
e a presença de sopros, que pode revelar uma valvopatia
crônica ou complicações mecânicas do infarto agudo do
miocárdio, sugerindo uma insuficiência mitral aguda por
ruptura ou disfunção de músculo papilar ou uma comunicação interventricular por ruptura do septo. Outros achados
do exame físico direcionam o raciocínio, como a presença
de estase jugular, que é importante sinal de insuficiência
cardíaca congestiva.
Exames Complementares
A obtenção de informações através de exames subsidiários realizados à beira do leito e de algumas dosagens
laboratoriais, enquanto se tomam as primeiras atitudes terapêuticas, contribuem muito para o diagnóstico e para a
orientação do tratamento. Assim, com estes instrumentos e
o raciocínio clínico desenvolvido pela anamnese e o exame
físico, pode o médico socorrista prescindir, na maioria das
vezes, de métodos mais complexos, de mais alto custo, e
que podem ser realizados num momento de maior estabilidade do paciente.
A obtenção dos sinais vitais, pressão arterial e frequência cardíaca, além da monitorização do ritmo cardíaco e
ainda pela oximetria de pulso a saturação da oxihemoglobina (SatO2) no sangue arterial no início do atendimento,
fornecem informações importantes para o diagnóstico de
fatores desencadeantes e da repercussão da congestão
pulmonar aguda.
Exames Laboratoriais
Bioquímica geral: Amostras sanguíneas devem ser obtidas para realização de alguns exames bioquímicos essenciais: como o hemograma para diagnóstico de infecção ou
anemia, eletrólitos, glicemia, função renal e hepática, úteis
para complementação da avaliação das condições clínicas
gerais do paciente. Outros, como a gasometria arterial, marcadores de necrose miocárdica e o peptídeo natriurético do
tipo B (BNP) podem contribuir para o diagnóstico.
Marcadores de Necrose Miocárdica: A troponina e a
Rev Soc Cardiol Estado de São Paulo 2016;26(1):39-45
ABORDAGEM CLÍNICA DA CONGESTÃO PULMONAR AGUDA NO CARDIOPATA
CK-MB massa, contribuem para o diagnóstico e prognóstico
de uma síndrome coronária aguda particularmente o infarto
agudo do miocárdio. Apresentam alta sensibilidade e especificidade nas dez horas subsequentes ao quadro clínico,6
No entanto, devem ser analisadas com cautela, apesar de
ajudarem muito no diagnóstico dos quadros isquêmicos
miocárdicos, vale lembrar que a elevação dos mesmos revela morte celular, não necessariamente por mecanismos
isquêmicos secundários a aterosclerose coronária. Qualquer
situação em que haja sofrimento do músculo cardíaco, incluindo tromboembolismo pulmonar, taquiarritmias, insuficiência cardíaca descompensada, ou até mesmo na sepse.
BNP e NP-Pro BNP: O peptídeo natriurético do tipo B
(BNP) foi isolado primeiramente no cérebro de macacos e
por isso é também denominado peptídeo natriurético cerebral (Brain Natriuretic Peptide). O BNP e o NT-pro BNP são
liberados de forma precoce e contínua na circulação em
resposta ao aumento das pressões de enchimento e seus
níveis sanguíneos aumentam em relação direta com a expansão de volume e a sobrecarga de pressão nos ventrículos cardíacos. Apesar de auxiliar no diagnóstico diferencial
dos quadros de dispneia aguda, os peptídeos natriuréticos
ainda não têm seu papel definido no diagnóstico sindrômico
e etiológico do edema agudo pulmonar.4 Para definição de
insuficiência cardíaca aguda são considerados valores de
BNP acima de 400pg/mL. Quando se utiliza NT-pró BNP,
acima de 1800 pg/mL para pacientes com 75 anos ou mais
e acima de 900 pg/mL quando abaixo desta idade.
O valor preditivo negativo é o ponto mais forte deste
marcador, portanto, capaz de excluir as causas de origem
cardíaca nos quadros de dispneia aguda, pelo menos as
que cursam com hipervolemia e aumento das pressões de
enchimento ventriculares. Nos testes rápidos, em que os
resultados podem ser obtidos em 10 a 20 minutos, valores
acima de 400pg/mL tornam muito provável a causa cardíaca da dispneia, ao passo que valores abaixo de 100pg/
mL praticamente a exclui. Valores intermediários requerem
avaliação adicional.7
Contudo, o BNP possui algumas limitações e deve ser
utilizado com cautela, considerando todo o conjunto de
informações sobre o quadro clínico do paciente. Ema algumas situações clínicas os níveis de BNP podem estar acima
de 500 pg/mL mesmo na ausência de disfunção de ventrículo esquerdo, entre elas incluem-se: sepse, insuficiência
renal crônica, fibrilação atrial de alta frequência, hipertensão
pulmonar, entre outras.
Eletrocardiograma
O eletrocardiograma, assim como a radiografia do tórax,
é um exame que, realizado rapidamente à beira do leito,
pode trazer informações importantes, para o diagnóstico
etiológico, e mesmo para avaliação de fatores desencadeantes da congestão pulmonar aguda. A presença de alterações do segmento ST e da onda T, embora com baixa
especificidade, pode sugerir ou confirmar a presença de
uma síndrome isquêmica miocárdica aguada. Alterações
crônicas, sugestivas de sobrecargas de câmaras, arritmias,
como a fibrilação atrial, entre outras, podem revelar a presença de cardiopatia estrutural.
Rev Soc Cardiol Estado de São Paulo 2016;26(1):39-45
Radiografia do tórax
Os achados radiográficos na congestão pulmonar aguda podem variar, desde uma redistribuição da vascularização para os ápices pulmonares, até um infiltrado pulmonar
intersticial bilateral extenso, associado a uma cardiomegalia.
O achado mais característico de edema pulmonar agudo na
radiografia de tórax é o infiltrado alveolar peri-hilar bilateral,
constituindo a imagem típica de “asa de borboleta”. As chamadas linhas B de Kerley também são uma característica
da congestão pulmonar.
Ecodopplercardiograma
O ecodopplercardiograma também realizado à beira do
leito, num momento em que o paciente se encontre mais
estável, pode ser um exame de grande importância no contexto clínico de um quadro de dispneia aguda em que o
exame físico, o eletrocardiograma e o RX de tórax não são
suficientes para sugerir o diagnóstico etiológico. Através da
análise da função ventricular, das estruturas e dos fluxos
cardíacos, podemos confirmar ou até mesmo excluir uma
determinada doença. Nas síndromes isquêmicas miocárdicas agudas, as alterações segmentares da contratilidade do
ventrículo esquerdo são os achados mais característicos.
Vale ressaltar a alta concordância dos achados de disfunção
ventricular através do ecocardiograma transtorácico quando
comparados aos dados hemodinâmicos obtidos à beira do
leito.8 Quando encontramos uma fração de ejeção abaixo de
40%, está claro o diagnóstico de congestão pulmonar aguda por insuficiência sistólica de VE. Com fração de ejeção
normal, a causa do edema agudo pode ser por disfunção
diastólica do VE ou por doença valvar.
Cinecoronariografia
Dados clínicos, evidências eletrocardiográficas e a presença de alterações contráteis segmentares de no ventrículo esquerdo no ecocardiograma, podem sugerir quadro
isquêmico miocárdico agudo como causa de congestão
pulmonar aguda. Nesta situação está indicada a realização
de uma cinecoronariografia e planejamento do tratamento
definitivo, de revascularização miocárdica ou manutenção
do tratamento clínico.
TRATAMENTO
O foco do tratamento do edema agudo pulmonar deve
ser direcionado para os seguintes objetivos:4,9
1. Ações de proteção: Monitorização, acesso venoso periférico, suplementação de oxigênio.
2. Redução da pré-carga (pressão venosa central); diuréticos/ultrafiltração/vasodilatadores.
3. Redução da pós-carga (resistência vascular periférica):
vasodilatadores.
4. Suporte inotrópico nos casos de baixo débito.
5. Suporte ventilatório (quando não se consegue manter
oxigenação adequada).
Oxigenação e Ventilação
Oxigênio úmido deve ser instituído por cateter ou máscaras nasais assim que o paciente é admitido no serviço de
emergência. A finalidade é corrigir a hipoxemia que acom-
41
panha os quadros de congestão pulmonar aguda e manter
uma saturação adequada de O2c arterial.
Nas situações mais graves quando não se obtém
sucesso só com a oxigenação por cateter, deve-se proceder à assistência ventilatória não invasiva com máscaras especiais que permitem a manutenção de pressão
positiva em vias aéreas (CPAP-continuous positive airway
pressure). A ventilação não invasiva permite redução do
trabalho respiratório, e da congestão pulmonar, mantem
pérvias as vias aéreas que correm o risco de colabar pelo
excesso de líquido melhorando as trocas gasosas. Em
extensa revisão de 31 estudos, que incluiu 2916 pacientes,
Vital e colaboradores, concluíram que em pacientes com
edema agudo pulmonar, a utilização de assistência ventilatória não invasiva associada à terapia padrão, reduziu
de forma significativa a mortalidade e a necessidade de
intubação endotraqueal, com consequente redução nos
tempos de permanência em UTI e no hospital.10 Naturalmente, se ocorrer exaustão por aumento acentuado do
trabalho respiratório ou intolerância ao CPAP, é preciso
proceder à intubação endotraqueal do paciente e instalação de assistência ventilatória invasiva.
Morfina
42
A morfina atua nos receptores opioides do sistema
nervoso central produzindo sedação e analgesia, além de
apresentar efeito ansiolítico. O conjunto destas ações produz redução da atividade do sistema nervoso simpático
e consequente diminuição da pressão arterial, frequência
cardíaca e pressões de enchimento ventriculares. Este último é o principal benefício da droga em pacientes com
congestão pulmonar.11
Apesar do efeito vasodilatador, descrito na literatura
como potencial benefício do uso de morfina em paciente
com insuficiência cardíaca descompensada, os trabalhos
envolvem um número pequeno de pacientes e tem resultados controversos.12
Recomendam-se a administração de bolus intravenoso
de 2,5 a 5 mg assim que o acesso periférico for obtido.
Estas doses podem ser repetidas conforme necessidade,
tolerabilidade e evolução do paciente. Atentar para situações em que este fármaco deve ser utilizado com cautela,
ou mesmo evitado, como na presença de hipotensão ou
depressão respiratória.13,14
O maior estudo até o momento envolvendo a administração de morfina e edema agudo de pulmão é uma análise
retrospectiva com mais de 147.000 pacientes internados por
insuficiência cardíaca descompensa nos Estados Unidos.
Peacock e colaboradores verificaram que, a administração
de morfina foi um fator independente para aumento de
mortalidade [OR = 4,84 IC (95%: 4,52 - 5,18; p <0,001)].
Também foi encontrada associação significativa da administração deste fármaco com aumento da frequência de
admissão em unidade crítica, necessidade de intubação
orotraqueal e internações mais prolongadas.15
Outros estudos de menor porte publicados posteriormente, apesar de demonstrarem deterioração clínica
dos pacientes após administração de morfina, não encontraram associação significativa entre o medicamento
e mortalidade.16
Apesar de ainda recomendada para pacientes com edema agudo de pulmão, há necessidade de novos estudos
prospectivos que possam afastar as dúvidas que existem
quanto aos benefícios e risco de morte, atribuídos a morfina
nos últimos anos.17
Diuréticos
A sobrecarga de volume é um dos pontos centrais da
fisiopatologia na maioria dos episódios de insuficiência
cardíaca descompensada. Assim, o alívio da congestão
pulmonar e dos sintomas relacionados a ela dependem,
fortemente, da terapia diurética.18
Os diuréticos de alça têm destaque, em detrimento dos
demais, pois produzem significativamente mais natriurese,
mesmo em pacientes com clearance de creatina reduzido. Agem inibindo o cotransportador Na+/K+/2Cl- no
segmento espesso da alça ascendente de Henle, diminuindo a reabsorção de sódio e promovendo natriurese.
Também induzem a síntese de prostaglandinas, resultando
em relaxamento da musculatura lisa vascular, produzindo
venodilatação.19,20
A furosemida é o diurético de alça mais comumente
utilizado no cardiopata com congestão pulmonar aguda.
Inicialmente, é utilizada na dose de 1 mg/kg por via endovenosa e tipicamente resulta em rápido efeito diurético (em
torno de 30 minutos), levando a diminuição das pressões de
enchimento ventriculares e melhora dos sintomas na maioria
dos pacientes com insuficiência cardíaca descompensada.21
Até hoje prosperam dúvidas, quanto à administração de
altas doses de diurético de alça. Estudos observacionais
demonstraram no passado associação com insuficiência
renal, progressão da insuficiência cardíaca e morte. O que
ocorre é a controvérsia entre um efeito deletério do diurético
sobre a doença cardíaca versus a necessidade progressiva
no aumento da dose, devido à piora da cardiopatia.22
Além de dúvidas sobre a dose, há incerteza sobre o melhor modo de administração. Pequenos estudos sugeriram
que existem potenciais benefícios da infusão contínua, em
comparação aos bolus intermitentes, com base, principalmente, nas propiedades farmacodinâmicas e farmacocinética dos diuréticos de alça.23
O estudo propectivo e randomizado DOSE (Diuretic Optimization Strategies Evaluation) comparou a administração
de furosemida intravenosa em bolus contra infusão contínua,
bem como altas doses versus baixa dose. Não foram encontradas diferenças significativas quanto à forma de administração (bolus versus infusão contínua) e dose (alta versus
baixa). A estratégia de alta dose foi associada a uma maior
diurese e resultados mais favoráveis em algumas variáveis
secundárias, porém, com piora transitória da função renal.24
O inconveniente envolvendo o uso crônico de diuréticos
de alça, no tratamento da insuficiência cardíaca ao longo
do tempo, é a resistência desenvolvida a terapia, o que
produz a necessidade de doses cada vez mais altas. Há
adaptações funcionais e estruturais do néfron que resultam
em uma maior reabsorção de sódio e consequente redução do efeito natriurético. Neste caso, a administração de
furosemida em infusão contínua, em lugar de bolus intermitentes, ou, a adição de um diurético tiazídico, podem ser
estratégias eficazes.18,19
Rev Soc Cardiol Estado de São Paulo 2016;26(1):39-45
ABORDAGEM CLÍNICA DA CONGESTÃO PULMONAR AGUDA NO CARDIOPATA
Ultrafiltração
Vasodilatadores
Em alguns casos, a administração de diurético por
via endovenosa, em pacientes com insuficiência cardíaca
descompensada, pode contribuir diretamente para piora da
função renal.25 Neste contexto, Jaski e colaboradores apresentaram um sistema de ultrafiltração veno-venosa (UF), que
consiste na inserção de dois cateteres venosos de 16 a 18
G nos membros superiores, permitindo a remoção de até
2,6 litros de volume em menos de oito horas, sem maiores
problemas, em 21 de 26 sessões.26
O estudo UNLOAD randomizou 200 pacientes com insuficiência cardíaca descompensada (disfunção renal grave
e instabilidade hemodinâmica foram critérios de exclusão)
para receber diurético endovenoso ou UF em até 24 horas da
admissão. O grupo submetido à UF perdeu uma quantidade
maior de volume e consequentemente peso em 48 horas,
sem alterações significativas na pressão arterial ou níveis de
creatinina sérica. Houve também, uma redução de 53% no
risco de re-hospitalização.27 Os resultados positivos do UNLOAD alavancaram ainda mais a utilização da ultrafiltração,
a ponto de muitos defendê-la como terapia de primeira linha
em detrimento dos diuréticos. Pacientes com pressão arterial
sistólica abaixo de 90 mmHg ou, necessidade de droga vasoativa, foram excluídos, exatamente um grupo com potencial
de maior risco para UF. Também foi questionado o motivo
de pacientes receberem uma dose menor de diuréticos do
que a planejada inicialmente. E, apesar de não significativo,
houve uma tendência à elevação dos níveis de escórias em
pacientes submetidos a ultrafiltração.28
O estudo multicêntrico CARRESS-HF recrutou indivíduos
com insuficiência cardíaca descompensada e congestão pulmonar apesar do tratamento convencional, e os randomizou
para receberem tratamento diurético ou ultrafiltração de resgate. Os pacientes submetidos à UF, não só tiveram uma perda
de peso menor que o outro grupo, como também apresentaram um aumento significativo dos níveis séricos de creatinina
e eventos adversos graves como sepse, levando a interrupção
do estudo após os primeiros 188 pacientes incluídos.29 Muitas
dúvidas são levantadas quanto ao estudo; os pacientes do
grupo UF foram privados do uso de vasodilatadores e inotrópicos; também não puderam personalizar a taxa de UF (fixa
em 200 ml/h), diferentemente daqueles que receberam terapia
diurética, nos quais a dose e o intervalo de administração puderam ser ajustados conforme a evolução. Além disso, a perda
de peso no primeiro dia foi mais acentuada no grupo UF, o
que pode justificar o aumento dos níveis de creatinina sérica.28
A maioria dos estudos publicados posteriormente apresentam resultados conflitantes e têm deficiências graves
(pequeno número de pacientes, curto seguimento, falta de
uniformidade das amostras, protocolos diferentes de ultrafiltração ou terapia diurética não convencional) limitando a
aplicabilidade de seus achados.28
As diretrizes europeias de 2012, sugerem a utilização de
ultrafiltração apenas para pacientes com insuficiência cardíaca e congestão pulmonar que não respondem a terapia
diurética ou que apresentam resistência a esses fármacos.13
Já, nas diretrizes norte-americanas de 2013 para insuficiência cardíaca, a UF pode ser considerada para pacientes
com óbvia sobrecarga de volume (IIb B) ou com congestão
pulmonar refratária as medidas habituais (IIb C).14
A maioria dos vasodilatadores atuam via guanosina monofosfato cíclica (cGMP), resultando em aumento do cálcio
intracelular, relaxamento da musculatura lisa vascular e consequente vasodilatação, promovendo redução da pré e pós
carga e melhora da contratilidade ventricular.30
A nitroglicerina e o nitroprussiato de sódio são usados
há mais de 30 anos em pacientes com insuficiência cardíaca descompensada; na última década o nesiritide foi
acrescentado como opção a terapêutica.30
As diretrizes europeias de 2012 e as norte-americanas
de 2013, assim também como as diretrizes nacionais, orientam para o uso de vasodilatadores na insuficiência cardíaca
aguda, apenas para pacientes já em uso de diuréticos, com
congestão pulmonar e pressão arterial sistólica acima de
110 mmHg, na ausência de estenose mitral ou aórtica
importante. Durante a infusão, deve-se ter o cuidado de
monitorizar o paciente e estar atento a sinais de baixo
debito cardíaco.13,14,31
A nitroglicerina endovenosa deve ser iniciada em doses
baixas de 10 a 20 µg/min e pode ser titulada a cada três
ou cinco minutos, até a dose máxima de 200 µg/min;13 é
importante destacar que habitualmente há o desenvolvimento de tolerância ao medicamento e necessidade de ajustes
frequentes na dose após vinte e quatro horas de infusão.32
O nitroprussiato de sódio pode ser adimistrado em doses iniciais de 0,3 µg/kg/min e titulado até 5 µg/kg/min.13
Os efeitos adversos incluem hipotensão arteria, possível
roubo de fluxo coronariano – logo, evitado em pacientes
com suspeita de síndrome coronariana aguda – e roubo
de fluxo pulmonar, provavelmente devido à dilatação arteriolar pulmonar em áreas não ventiladas. É sensível à luz e
deve ser protegido com capa protetora durante a infusão.
Taquifilaxia não é uma consideração, mas toxicidade por
cianeto pode ocorrer com infusões prolongadas, alem de
72 horas, ou na presença de disfunção renal.32
O nesiritide é a forma recombinante do peptídeo natriurético atrial humano do tipo B. Caracteristicamente reduz
as pressões de enchimento ventricular, mas tem efeitos variáveis sobre o débito cardíaco, débito urinário e excreção
de sódio. Deve ser administrado inicialmente em bolus de
dois µg/kg mais infusão endovenosa de 0.01 µg/kg/min.13
O estudo VMAC demonstrou redução mais rápida da pressão de capilar pulmonar e melhora da sensação de dispneia com esse fármaco, quando comparado ao placebo,
mas não encontrou diferenças significativas em relação a
nitroglicerina. Duas metanálises publicadas posteriormente
questionaram a segurança na adminitsração do nesiritide
em pacientes com insuficiência cardiaca, atribuindo ao
medicamento pontencial risco para insuficiência renal e
mortalidade, provavelmente relacionado à hipotensão mais
persistente produzida por ela.33 Um estudo mais recente,
o ASCEND-HF, um ensaio clínico multicêntrico, randomizado e duplo-cego comparou nesiritide com placebo em
pacientes internados por insuficiência cardíaca. Embora os
pacientes que receberam nesiritide experimentaram diminuição da sensação da dispnéia, a diferença não atingiu
significância estatística. Também não foram encontradas
diferenças relevantes quanto a rehospitalização ou morte
em 30 dias, ou alteração da função renal.34,35
Rev Soc Cardiol Estado de São Paulo 2016;26(1):39-45
43
Inúmeras drogas com efeito vasodilatador estão em
avaliação para pacientes com insuficiência cardíaca descompensada. Podemos citar outros peptídeos natriuréticos
como o carperitide (semelhante ao nesiritide mas com efeito natridiurético mais pronunciado), o urodilatin (uralitide,
precursor pró-ANP, atua no tubo coletor renal aumentando
a excreção de sódio e água, além de gerar cGMP produzindo vasodilatação) e o CD-NP ou ‘‘cenderitide’’ (Quimera
sintetizada a partir do CNP e DNP, com efeito venodilatador e de natriurese). Também há inibidores do sistema
renina-angiotensina que podem ser administrados por via
endovenosa como o enalaprilat (semelhante ao enalapril).
Outro destaque é o relaxin, um peptídeo sintético análogo
recombinante a relaxin-2 que é liberado durante a gravidez
produzindo aumento do debito cardíaco, da perfusão renal
e redução da pós-carga por vasodilatação.36
Inotrópicos
Devem ser reservados apenas para pacientes com congestão pulmonar aguda com redução importante do débito
cardíaco nos quais a perfusão de órgãos vitais esteja comprometida. Em algumas situações, mesmo sem um quadro
acentuado de choque, mas o paciente evoluindo com hipotensão, fármacos inotrópicos devem ser utilizados.13,14,31
Apesar da melhora hemodinâmica alcançada, diversos trabalhos não conseguiram demonstrar redução de eventos
ou mortalidade após administração destes fármacos. Entre
os efeitos deletérios, aumentam a frequência cardíaca e
podem induzir isquemia miocárdica além de arritmias.37-39
Os agentes mais comumente utilizados são:
Dobutamina - Agonista ß1 adrenérgico com ação também em ß2 e α1. Dose 2-20 µg/kg/min.
Levosimendan – Agente sensibilizador de cálcio. Dose
bolus de 12 µg/kg em 10 minutos (opcional) e infusão contínua
de 0.1 µg/kg/min que pode ser reduzida a 0.05 µg/kg/min ou
aumentada a 0.2 µg/kg/min.
Milrinone - Inibidor da fosfodiesterase III. Dose bolus de
25 a 75 µg/kg em 10 a 20 minutos e infusão contínua de
0.375-0.75 µg/kg/min.
CONSIDERAÇÕES FINAIS
A congestão pulmonar aguda é um evento clínico muito
frequente na apresentação do paciente com insuficiência
cardíaca aguda. O diagnóstico é fundamentalmente clínico,
e o início do tratamento, com oxigenação adequada, opiaceos e diuréticos endovenosos, além de vasodilatadores,
não pode ser retardado em função da realização de exames
subsidiários, importantes para elucidação do diagnóstico
etiológico e de fatores desencadeantes. Nas situações em
que o paciente evolui com hipotensão acentuada, claramente por disfunção do ventrículo esquerdo, estão indicada a
administração de fármacos inotrópicos.
Conflitos de interesse
Os autores declaram não possuir conflitos de interesse na realização deste trabalho.
44
REFERÊNCIA
1. Weintraub NL, Collins SP, Pang PS, Levy PD, Anderson AS, Arslanian-Engoren C, et al. Acute Heart Failure Syndromes: Emergency
Department Presentation, Treatment, and Disposition: Current Approaches and Future Aims. A Scientific Statement From the American Heart Association. Circulation. 2010;122:1975-96.
2. Kasinski N. Edema Agudo Pulmonar. In: Stefanini E, Kasinski N e
Carvalho AC. Guias de Medicina Ambulatorial e Hospitalar da UNIFESP-EPM Cardiologia. 2ª Ed. Barueri, SP: Manole; 2009. p.579.
3. Stefanini E. Avaliação Cardiocirculatória Não-invasiva do Doente
Crítico. In: Terzi RGG e Araújo S. (eds). Monitorização Hemodinâmica em UTI. Série Clínicas Brasileiras de Medicina Intensiva Ano
8 Vol. 14. São Paulo: Atheneu.;2004. p.249.
4. Oliveira Jr MT, Soeiro AM, Leal TCAT. Edema Agudo de Pulmão.
In: Magalhães CC et al. Tratado de Cardiologia SOCESP. 3a Ed.
Barueri SP: Manole; 2015. p. 1065.
5. Jorge S, Becquemin MH, Delerme S, Bennaceur M, Isnard R,
Achkar R, et al. Cardiac asthma in elderly patients: incidence, clinical presentation and outcome. BMC Cardiovasc Disord. 2007;7:16.
6. Zimmerman J, Fromm R, Meyer D, Boudreaux A, Wun
CC, Smalling R, et al. Diagnostic Marker cooperative Studyfor the
diagnosis of myocardialinfarction. Circulation. 1999; 99:1671-7.
7. Morrison LK, Harrison A, Krishnaswamy P, Kazanegra R, Clopton
P, Maisel A.. A Utility of arapid B-natriuretic peptide assay in differenciating congestive heart failure from lung disease in patients
presenting with dyspnea. J Am Coll Cardiol 2002;39:202-9.
8. Ware LB, Matthay MA. Acute Pulmonary Edema N Engl J Med.
2005;353:2788-96.
9. Canesim MFOliveira Jr MT e Barreto ACP. Suporte avançado de
vida em insuficiência cardíaca-SAVIC. 3ª ed. Barueri: Manole; 2014.
10.Vital FM, Ladeira MT, Atallah NA. Non-invasive positive pressure
ventilation (CPAP or bilevel NPPV) for cardiogenic pulmonary edema. Cochrane Database Syst Rev. 2013;5:CD005351.
11.Johnson MR. Edema Pulmonar Aguda. Curr Treat Options Cardiovasc Med.1999;1:269 –76.
12.Mattu A, Martinez JP, Kelly BS. Modern management of cardiogenic
pulmonary edema. Emerg Med Clin North Am. 2005;23:1105-25.
13.McMurray JJ, Adamopoulos S, Anker SD, Auricchio A, Böhm M,
Dickstein K, et al. ESC Committee for Practice Guidelines: ESC
Guidelines for the diagnosis and treatment of acute and chronic
heart failure 2012: The Task Force for the Diagnosis and Treatment
of Acute and Chronic Heart Failure 2012 of the European Society
of Cardiology. Developed in collaboration with the Heart Failure
Association (HFA) of the ESC. Eur Heart J. 2012;33(14):1787–847.
14.Yancy CW, Jessup M, Bozkurt B, Butler J, Casey DE Jr, Drazner
MH, et al. 2013 ACCF/AHA guideline for the management of heart
failure: a report of the American College of Cardiology Foundation/
American Heart Association Task Force on Practice Guidelines.
Circulation. 2013;128(16): 1810-52.
15.Peacock WF, Hollander JE, Diercks DB, Lopatin M, Fonarow
G, Emerman CL. Morphine and outcomes in acute decompensated heart failure: an ADHERE analysis. Emerg Med
J. 2008 Apr;25(4):205-9.
16.Gray A, Goodacre S, Seah M, Tilley S. Diuretic, opiate and nitrate use in severe acidotic acute cardiogenic pulmonary o edema:
analysis from the 3CPO trial. QJM. 2010;103:573-81.
17.Iakobishvili Z, Cohen E, Garty M, Behar S, Shotan A, Sandach
A, et al. Use of intravenous morphine for acute decompensated
heart failure in patients with and without acute coronary syndromes.
Acute Care Card. 2011;13:76-80.
18.Michael Felker G. Diuretic management in heart failure. Congest
Heart Fail. 2010;16 Suppl 1:S68-72
Rev Soc Cardiol Estado de São Paulo 2016;26(1):39-45
ABORDAGEM CLÍNICA DA CONGESTÃO PULMONAR AGUDA NO CARDIOPATA
19.Trullàs JC, Morales-Rull JL, Formiga F.Diuretic therapy in heart
failure. Med Clin (Barc). 2014;142(4):163-70.
20.Chiong JR, Cheung RJ. Loop diuretic therapy in heart failure: the need for solid evidence on a fluid issue. Clin Cardiol. 2010;33(6):345-52.
21.Felker GM. Loop diuretics in heart failure. Heart Fail
Rev. 2012;17(2):305-11.
22.Felker GM, O’Connor CM, Braunwald E, et al. Loop diuretics in
acute decompensated heart failure: Necessary? Evil? A necessary
evil? Circ Heart Fail. 2009;2(1):56–62.
23.Pallazuoli A, Pellegrini M, Ruocco G, Martini G, Franci B, Campagna
MS et al. Continuous versus bolus intermittent loop diuretic infision
in acutely descompsated heart failure: a prospective randomized
trial. Critical Care. 2014;18 (3): R134.
24.Felker GM, Lee KL, Bull DA, Redfield MM, Stevenson LW, Goldsmith
SR, et al. (2011) Diuretic strategies in patients with acute decompensated heart failure. N Engl J Med. 2011 Mar 3;364(9):797-805.
25.Ronco C, Cicoira M, McCullough PA. Cardiorenal syndrome type 1:
pathophysiological crosstalk leading to combined heart and kidney
dysfunction in the setting of acutely decompensated heart failure.
J Am Coll Cardiol. 2012;60:1031-42.
26.Jaski BE, Ha J, Denys BG, Lamba S, Trupp RJ, Abraham WT. Peripherally inserted veno-venous ultrafiltration for rapid treatment of
volume overloaded patients. J Card Fail. 2003;9(3):227–31.
27.Costanzo MR, Guglin ME, Saltzberg MT, Jessup ML, Bart BA, Teerlink JR, et al. Ultrafiltration versus intravenous diuretics for patients
hospitalized for acute decompensated heart failure. J Am Coll Cardiol. 2007;49:675–83.
28.Kazory A. Cardiorenal Syndrome: Ultrafiltration Therapy for
Heart Failure - Trials and Tribulations. Clin J Am Soc Nephrol.
2013;8(10):1816–28.
29.Bart BA, Goldsmith SR, Lee KL, Givertz MM, O’Connor CM, Bull
DA, et al. Heart Failure Clinical Research Network: Ultrafiltration in
decompensated heart failure with cardiorenal syndrome. N Engl J
Med. 2012 Dec 13;367(24):2296-304.
30.Johnson W, Omland T, Hall C, Lucas C, Myking OL, Collins C, et
Rev Soc Cardiol Estado de São Paulo 2016;26(1):39-45
al. Neurohormonal activation rapidly decreases after intravenous
therapy with diuretics and vasodilators for class IV heart failure. J
Am Coll Cardiol. 2002;39:1623-9.
31.Montera MW, Almeida DR, Tinoco EM, Rocha RM, Moura
LA, Réa-Neto Á, et al. Sociedade Brasileira de Cardiologia. II
Diretriz Brasileira de Insuficiência Cardíaca Aguda. Arq Bras Cardiol. 2009;93(3 supl.3):1-65.
32.Carlson, M. D. Eckman P.M. Review of Vasodilators in Acute Deecompensated J Card Fail. 2013 Jul;19(7):478-93.
33.Publication Committee for the VMAC Investigators (Vasodilatation
in the Management of Acute CHF). Intravenous nesiritide vs nitroglycerin for treatment of decompensated congestive heart failure:
A randomized controlled trial. JAMA. 2002;287:1531-40.
34.Sackner-Bernstein JD, Kowalski M, Fox M, Aaronson K. Short-term
risk of death after treatment with nesiritide for decompensated heart
failure: a pooled analysis of randomized controlled trials. JAMA.
2005;293:1900-5.
35.O’Connor CM, Starling RC, Hernandez AF, Armstrong PW, Dickstein
K, Hasselblad V, et al. Effect of nesiritide in patients with acute
decompensated heart failure. N Engl J Med. 2011;365:32-43.
36.Alexander P, Alkhawam L, Curry J, Levy P, Pang PS, Storrow AB, et
al. Lack of evidence for intravenous vasodilators in ED patients with
acute heart failure: a systematic review. Am J Emerg
Med. 2015 Feb;33(2):133-41.
37.Follath F, Cleland JG, Just H, Papp JG, Scholz H, Peuhkurinen K,
et al. Efficacy and safety of intravenous levosimendan compared
with dobutamine in severe low-output heart failure (the LIDO study):
a randomized double-blind trial. Lancet. 2002;360 (9328):196-202.
38.Packer M. REVIVE II: Multicenter placebo-controlled trial of levosimendan on clinical status in acutely decompensated heart failure. Program and abstracts from the American Heart Association
Scientific Sessions 2005; November 13-16, 2005; Dallas, Texas.
Late Breaking Clinical Trials II.
39.Mebazaa A, Nieminen MS, Packer M, Cohen-Solal A, Kleber FX,
Pocock SJ, et al. Levosimendan vs dobutamine for patients with
acute decompensated heart failure: the SURVIVE randomized trial.
JAMA. 2007;297(17):1883-91.
45
revisão/review
ATUALIZAÇÃO DO DIAGNÓSTICO E TRATAMENTO DO
TROMBOEMBOLISMO PULMONAR
UPDATE ON DIAGNOSIS AND TREATMENT OF PULMONARY THROMBOEMBOLISM
Resumo
Antonio Cláudio do Amaral
Baruzzi1
Giuliano Generoso1
Carlos Eduardo Prazeres1
Renata Hames1
Fernanda de Andrade
Cardoso1
Valter Furlan1
1. Unidade de Terapia Intensiva,
Hospital TotalCor - São Paulo, SP Brasil
Correspondência:
Antonio Claudio do A. Baruzzi
Al. Santos 764 - Cerqueira Cesar –
São Paulo – SP. Brasil CEP: 01418-970
e-mail: [email protected]
A embolia pulmonar e a trombose venosa profunda são doenças com mesma
base fisiopatogênica, denominada tromboembolismo venoso. Em 90% dos casos, os
trombos originam-se no sistema da veia cava inferior, especialmente acima dos joelhos
e pelve, alojando-se em ramos principais e segmentares dos pulmões, geralmente
nos lobos inferiores. Nos Estados Unidos, é a terceira causa de óbito cardiovascular
(seguida do infarto do miocárdio e acidente vascular cerebral isquêmico), com incidência anual estimada de 500.000 casos e 100.000 óbitos. A mortalidade hospitalar varia
de 1% a 30%, dependendo das repercussões hemodinâmicas e da condição clínica
do paciente. O diagnóstico e tratamento precoce reduzem a mortalidade hospitalar
(disfunção e falência do ventrículo direito/hipoxemia) bem como suas principais complicações tardias: hipertensão pulmonar crônica, síndrome pós-trombótica, flegmasia alba
dolens e cerulea dolens. O prognóstico poderá ser modificado adotando-se medidas
preventivas, identificação e tratamento em tempo hábil, além da anticoagulação oral
por período adequado.
Descritores: Embolia pulmonar, tromboembolismo venoso, fibrinolíticos, anticoagulantes.
46
Abstract
Pulmonary embolism and deep vein thrombosis are diseases with same physiopathogenic base, called venous thromboembolism. In 90% of cases, thrombi originate in
the inferior vena cava system, especially above the knees and pelvis, lodging in the main
and segmental branches of the lungs, usually in the lower lobes. In the United States,
it is the third leading cause of cardiovascular death (followed by myocardial infarction
and ischemic stroke), with estimated annual incidence of 500,000 cases and 100,000
deaths. The hospital mortality rate ranges from 1% to 30%, depending on the hemodynamic effects and clinical condition of the patient. Early diagnosis and treatment reduce
hospital mortality (dysfunction and failure of the right ventricle/hypoxemia) and its main late
complications: chronic pulmonary hypertension, post-thrombotic syndrome, phlegmasia
alba dolens and cerulea dolens. The prognosis may be modified by adopting preventive
measures, identification and treatment in a timely manner, as well as oral anticoagulation
for an adequate period.
Descriptors: Pulmonary embolism, venous thromboembolism, fibrinolytics, anticoagulants.
FATORES PREDISPONENTES
Vários fatores têm sido identificados, sendo o médico
patologista Dr. Rudolf Ludwig Karl Virchow (Universidade
de Berlim) o primeiro a descrever, há mais de um século,
os principais mecanismos envolvidos no tromboembolismo
venoso: estase venosa, estados de hipercoagulabilidade e
lesão endotelial, conhecida como tríade de Virchow.1
O trombo venoso é rico em fibrina, hemácias, plaquetas
e neutrófilos, motivo pelo qual alguns autores consideram o
tromboembolismo venoso e a doença aterosclerótica uma
síndrome cardiovascular sistêmica onde mediadores pró-inflamatórios, disfunção endotelial, baixa tensão oxigênio e
o estresse oxidativo atuam de forma sinérgica na ativação
da cascata da coagulação e consequente trombose2
Os fatores predisponentes conhecidos podem ser classificados conforme odds ratio (Tabela 1).1
Mutação homo ou heterozigótica fator V Leiden, mutação do gene da protrombina, deficiência da antitrombina III,
proteína C e S, síndrome anticorpo antifosfolípide, elevada
concentração fatores VIII, IX e X.
Rev Soc Cardiol Estado de São Paulo 2016;26(1):46-55
ATUALIZAÇÃO DO DIAGNÓSTICO E TRATAMENTO DO TROMBOEMBOLISMO PULMONAR
Tabela 1. Fatores predisponentes para o tromboembolismo venoso1.
Fatores fortes (odds ratio > 10)
Fratura dos membros
inferiores
Hospitalização por insuficiência cardíaca
ou flutter/fibrilação atrial (<3 meses)
Prótese de joelho ou quadril
Traumas graves
Fatores moderados (odds ratio 2 - 9)
Artroscopia do joelho
Infarto do miocárdio
(< 3meses)
Tromboembolismo
venoso prévio
Lesão corda espinhal
Insuficiência cardíaca
e/ou respiratória
Doenças auto-imunes
Eritropoetina
Hemotransfusão
Terapia substituição
hormonal
Cateteres centrais, marca-passo, desfi- Fertilização in vitro
briladores/CDI
Quimioterapia
Infecções respiratórias,
urinárias e HIV
Doença inflamatória intestinal
Período pós-parto
Câncer
Trombose venosa
superficial
Contraceptivos orais
Trombofilias*
Imobilidade após acidente
e-trombose (várias
vascular cerebral isquêmico
horas sentado frente
ao computador)
Fatores fracos (odds ratio < 2)
Repouso no leito > 3 dias
Cirurgia laparoscópica
Diabetes mellitus
Obesidade
Hipertensão
Gravidez
Idade > 50 anos
Varizes
Poluição/tabagismo
Síndrome nefrótica
Viagens > 4 horas (posição sentado) Síndrome metabólica
*Mutação homo ou heterozigótica fator V Leiden, mutação do gene da protrombina, deficiência da antitrombina III, proteína C e S, síndrome anticorpo antifosfolípide, elevada concentração
fatores VIII, IX e X.
FISIOPATOGENIA
A embolia pulmonar determina uma série de repercussões hemodinâmicas decorrente da sobrecarga pressórica
aguda ao ventrículo direito. A depender do percentual da
área pulmonar ocluída, liberação de mediadores neuro-humorais (vaso e broncoconstritores), disfunção/dilatação do
ventrículo direito e da redução da pré-carga das câmaras
esquerdas, poderá haver um efeito cascata que se não revertido, poderá culminar com hipotensão e óbito3 (Figura 1).
MANIFESTAÇÕES CLÍNICAS
As manifestações clínicas do tromboembolismo pulmonar são inespecíficas e requerem diagnóstico diferencial
com outras doenças. Deve ser considerada quando houver
dispneia súbita ou de início recente, dor torácica tipo pleurítica e tosse. Os principais sinais e sintomas são:3
Sinais: taquipneia, taquicardia, febrícula, ritmo de galope
do ventrículo direito, hiperfonese da segunda bulha no foco
pulmonar, insuficiência tricúspide e estase jugular.
Sintomas: dispneia, tosse, dor torácica, dor e edema
na panturrilha, hemoptise e síncope.
Dentre os diagnósticos diferenciais, destacam-se: pleurite, pneumonia, pneumotórax, asma brônquica, síndrome
coronária aguda, pericardite, insuficiência cardíaca, condrites, fratura de costela, dor musculoesquelética, neoplasia
torácica, colecistite, dissecção aguda da aorta, hipertensão
pulmonar idiopática, infarto esplênico, sepse e ansiedade.4
Ressalte-se que em quase 50% dos casos, os achados
clínicos da trombose venosa profunda nem sempre estão
presentes, o que dificulta o seu diagnóstico.
EXAMES LABORATORIAIS E MÉTODOS
GRÁFICOS3
Eletrocardiograma
Os achados eletrocardiográficos são inespecíficos e
incluem: alterações do segmento ST e onda T na parede
Embolia pulmonar
Obstrução
anatômica
Fatores neurohumorais
↑ Tensão parede VD
↑ Sobrecarga
pressórica VD
↑ Consumo O2 VD
Dilatação/Disfunção VD
Isquemia/infarto
VD
Desvio SIV
D→E
↓ Débito VD
↓ Perfusão coronária
↓ Pré-carga VE
↓ Débito VE
Figura 1. Repercussões hemodinâmicas da embolia pulmonar.
VD- ventrículo direito, VE- ventrículo esquerdo, SIV- septo interventricular, D - direito, E- esquerdo.
Rev Soc Cardiol Estado de São Paulo 2016;26(1):46-55
↓ Oferta O2 VD
↓ Perfusão
sistêmica
Hipotensão/
choque
47
anterior (isquemia do ventrículo direito), arritmias atriais e
bloqueio de ramo direito. O padrão clássico de cor pulmonale agudo (S1Q3T3, P pulmonale) é um achado mais
raro5 (Figura 2).
I
aVR
v1
v4
É um subproduto da degradação da fibrina. Quando acima 500ng/mL FEU (unidades equivalentes de fibrinogênio)
apresenta alta sensibilidade (97%) para embolia pulmonar,
porém baixa especificidade (42%). Eleva-se em qualquer
condição onde há formação e lise da fibrina (gravidez,
trauma, pós-operatório, câncer, hospitalizações, estados
inflamatórios e sepse).
Um teste negativo apresenta probabilidade de 95% de
não haver tromboembolismo venoso (valor preditivo negativo), atingindo 99% quando a probabilidade clínica também
for baixa. O método por ELISA (enzyme-linked immunosorbent assay) é o de melhor acurácia.
Como nos pacientes > 50 anos é comum observar-se
elevação natural dímero-d, alguns autores sugerem aumento do cut-off multiplicando-se a idade x 10ng/mL FEU, com
incremento da especificidade entre 30% a 40% e sensibilidade acima 97%.7
II
aVL
v2
v5
Troponina, BNP/pró-BNP
Radiografia de tórax
Inespecífico para o diagnóstico de embolia pulmonar,
porém auxilia no diagnóstico diferencial. Os achados mais
comuns são a atelectasia laminar, derrame pleural, infiltrado
pulmonar e elevação de cúpula diafragmática.
Sinais clássicos: 1. Sinal de Hampton (infiltrado pulmonar em cunha com base pleural o que sugere infarto pulmonar), 2. Sinal de Westermark (oligoemia focal com artéria
pulmonar proeminente) e 3. Sinal de Palla (dilatação da
artéria pulmonar)6 (Figura 3).
III
aVF
v3
v6
II
Equip:
48
Dímero-d
Veloc: 25 mm/s
Membro: 10mm/mV Tórax 10mm/mV
F60~ 0,15-150 Hz PHOS P?
Figura 2. Cor pulmonale agudo – SiQ3T3 e inversão da onda T na
parede anterior
Elevações de troponina I ou T e do peptídeo natriurético cerebral (BNP), são biomarcadores que relacionam-se, respectivamente, com graus variados de necrose e
disfunção e do ventrículo direito. Níveis elevados conferem
pior prognóstico.
Outros biomarcadores têm sido estudados, porém
sem aplicação prática (NGAL – neutrophil gelatinase-associated lipocalin, cistatina C, HFABP – heart-type fatty
acid-binding protein).
Tomografia helicoidal do tórax
Após infusão endovenosa de contraste (90 a 120ml),
realizam-se cortes seriados para detecção de falhas de
enchimento nos diversos segmentos da luz arterial (vasos
até sexta ordem). A sua sensibilidade é de 80% e especificidade 95%.
O mesmo exame pode detectar trombos no sistema
venoso profundo dos membros inferiores, pélvis e veia cava
inferior (Figura 4).
A relação dos diâmetros diastólicos dos ventrículos
direito e esquerdo: DVD/DVE > 0,9 na imagem de quatro
câmaras estratifica os pacientes com maior risco de óbito
em 30 dias8 (Figura 5).
Cintilografia pulmonar (ventilação/
perfusão)
Figura 3. Tronco da artéria pulmonar prominente (Sinal de Palla),
hipertransparência e ausência de sombras vasculares no campo
pulmonar esquerdo (Sinal de Westermark) - vide setas.
Gasometria arterial
O padrão típico é a hipoxemia (PaO ≤ 90mmHg) de²
corrente do desequilíbrio da relação ventilação/perfusão e
hipocapnia (hiperventilação reflexa). A hipercapnia pode
ser observada nos casos de embolia pulmonar maciça. A
ausência de hipoxemia não descarta o diagnóstico.
Macroagregados de albumina marcadas com tecnécio99m são injetados em veia periférica, combinado com a
inalação gás xenônio133 ou partículas de aerossóis marcadas
com tecnécio99m. O diagnóstico é baseado na presença de
áreas hipoperfundidas, porém normoventiladas, particularmente se a radiografia do tórax for normal.
A sua especificidade é de 97% e sensibilidade de
41% naqueles com alta probabilidade clínica de embolia
pulmonar. Quando a probabilidade clínica é baixa e a cintilografia normal, exclui-se embolia pulmonar. Nos casos
intermediários, outros exames complementares auxiliarão
no diagnóstico.9
Rev Soc Cardiol Estado de São Paulo 2016;26(1):46-55
ATUALIZAÇÃO DO DIAGNÓSTICO E TRATAMENTO DO TROMBOEMBOLISMO PULMONAR
angiografia com subtração digital utiliza menor volume de
contraste e detecta falhas de enchimento em vasos periféricos de até 1 a 2mm.
É reservado quando o diagnóstico não pode ser afastado ou confirmado com exames menos invasivos (Figura 6).
A
Ultrassom doppler venoso dos membros
Exame não-invasivo, considerado positivo na presença
de trombos ou redução da compressibilidade das veias
pelo transdutor. Tem sensibilidade e especificidade acima de
90% quando a trombose venosa é proximal e certa limitação
para o diagnóstico de trombose venosa distal (abaixo dos
joelhos) pela dificuldade anatômica (Figura 7).
B
C
Figura 4. Tomografia helicoidal. A. Trombos em ambas as artérias
pulmonares, B. Veia femoral esquerda e C. Veia cava inferior (setas)
detectadas no mesmo exame.
49
Figura 6. Extenso trombo artéria pulmonar direita.
VD
VE
Figura 5. Tomografia helicoidal (quatro câmaras) - mensuração axial
das cavidades ventriculares (plano valvar). VD – ventrículo direito,
VE – ventrículo esquerdo.
Angiografia pulmonar
A angiografia confirma ou exclui o diagnóstico de embolia pulmonar com acurácia praticamente plena. É o padrão
ouro para tal diagnóstico. Com os recursos atuais, tornou-se um procedimento seguro, recomendando-se cautela naqueles com hipertensão pulmonar moderada a importante,
devido o risco de agravar a hipoxemia e causar arritmias. A
Rev Soc Cardiol Estado de São Paulo 2016;26(1):46-55
Figura 7. Trombo venoso em segmento não compressível ao transdutor.
Ecocardiograma doppler colorido
Realizado à beira-do-leito, capaz de aferir os níveis
pressóricos da artéria pulmonar e sinais de disfunção do
ventrículo direito: dilatação, alteração da contratilidade,
desvio do septo interventricular da direita para a esquerda
(efeito Boerheim inverso), regurgitação da valva tricúspide,
dilatação da veia cava inferior e sua ausência de colapso
inspiratório. Por vezes identificam-se trombos intracavitários
e nos ramos proximais da artéria pulmonar (Figura 8).
A dilatação/disfunção ventrículo direito é caracterizada por:
LA
T
RA
Tabela 2. Escore de Wells simplificado.
Parâmetros
Pontos
Não há diagnóstico alternativo mais provável que TEP
1
Sinais e sintomas de TVP (edema, dor)
1
Taquicardia (FC >100bpm)
1
Imobilização >2 dias ou cirurgia recente (< 4 semanas)
1
História de TEV
1
Hemoptise
1
Câncer ativo < 6 meses ou metástases
1
Embolia pulmonar pouco provável: 0-2 pontos
Embolia pulmonar provável: ≥ 3pontos
LA
LV
RV
T
T
H
Suspeita embolia pulmonar
História, exame físico, rx tórax, ECG
Figura 8. Ecocardiograma transesofágico em portador de cateter
venoso central de longa permanência. A e B. Trombo átrio direito.
C e D. Lise do trombo pós-trombólise.
AD – átrio direito, AE – átrio esquerdo, VD – ventrículo direito, AV – ventrículo esquerdo, T - trombo.
50
• Relação dos diâmetros diastólicos dos ventrículos: DVD/
DVE > 0,9 em imagem de quatro câmaras ou > 0,6 na
imagem no maior eixo paraesternal;
• Hipocinesia e dilatação do ventrículo direito (>30mm);
• Hipertensão pulmonar: velocidade de regurgitação tricúspide > 2,8 m/s;
• Tempo de aceleração ejetivo do ventrículo direito < 90 ms;
• Gradiente-pico da insuficiência tricúspide (GPIT) > 30mm.
Quando realizado a intervalos regulares (24/24 horas),
permite monitorar a queda dos níveis pressóricos da artéria
pulmonar, especialmente quando é utilizada a terapia fibrinolítica. Auxilia também no diagnóstico diferencial do infarto
do miocárdio, insuficiência cardíaca, pericardite, tamponamento, valvopatias e doenças da aorta.10,11
Probabilidade clínica
Probabilidade clínica não elevada
Probabilidade clínica elevada
D-dímero
< 500ng/mL
> 500ng/mL
EP excluída
Tomografia helicoidal tórax
Normal
Positiva
EP excluída
Tratar
Figura 9. Algoritmo baseado no escore de Wells simplificado.
D-dímero e tomografia helicoidal. EP – embolia pulmonar.
Embolia pulmonar
Estraficação de risco
ALGORITMO DIAGNÓSTICO
Avaliação clínica
Extrensão anatômica
Disfunção/dilatação VD
Biomarcadores cardíacos
Como a apresentação clínica e os exames laboratoriais
iniciais, tais como o ECG, radiografia do tórax e a gasometria arterial são inespecíficos para o diagnóstico de TEV,
Wells e cols.12 elaboraram e posteriormente simplificaram
um rápido escore de probabilidade pré-teste a ser aplicado
naqueles com suspeita desta doença.
Os pacientes são classificados de acordo com a pontuação aferida: probabilidade não elevada (0-2 pontos) e
probabilidade elevada (≥ 3 pontos) (Tabela 2).
O uso combinado da história clínica, exame físico, radiografia do tórax, ECG, escore de Wells, d-dímero e tomografia helicoidal do tórax aumentam a acurácia diagnóstica13 (Figura 9).
Embora os algoritmos auxiliem no diagnóstico, não devem subestimar o raciocínio clínico. A doença apresenta
elevada letalidade e a sua confirmação ou exclusão são
de suma importância.
Figura 10. Estratificação de risco conforme achados clínicos,
biomarcadores e imagem.
ESTRATIFICAÇÃO DE RISCO
Alto Risco
A estratificação de risco baseia-se em três componentes chaves: 1) critérios clínicos, 2) biomarcadores séricos
e 3) função do ventrículo direito. O objetivo é identificar
pacientes com elevado risco de óbito em 30 dias e instituir
o tratamento mais apropriado. A estratificação é dividida
em: alto risco e baixo risco14 (figura 10).
Pacientes polissintomáticos, apresentam-se com
hipotensão arterial e/ou choque obstrutivo, definido
PAS < 90mmHg ou sua queda > 40mmHg em intervalo de
tempo superior a 15 minutos e não relacionada à hipovolemia, sepse, arritmia ou medicamentos, sinais disfunção/
dilatação do ventrículo direito (ecocardiograma ou tomogra-
Alto risco
Polissintomáticos
Choque, hipotensão
Disfunção/dilatação VD
Embolia extensa
Baixo risco
O ligossintomáticos
Biomarcadores isolados +/Embolia não extensa
Ausência disfunção VD
Biomarcadores - troponina, BNP, Polissintomáticos - hipaxemia, taquicardia,
taquipnéia, DV - ventrículo direito.
Rev Soc Cardiol Estado de São Paulo 2016;26(1):46-55
ATUALIZAÇÃO DO DIAGNÓSTICO E TRATAMENTO DO TROMBOEMBOLISMO PULMONAR
fia computadorizada) e extenso comprometimento arterial.
O risco de óbito em 30 dias varia de 10 a 25%.
Tratamento
embolia pulmonar
Baixo Risco
Pacientes oligossintomáticos, ausência disfunção/dilatação do ventrículo direito, embolia pulmonar segmentar ou
periférica, biomarcadores (troponina e/ou BNP) positivos de
forma isolada ou mesmo negativos. O risco de óbito em 30
dias é abaixo 2%.
Pelo caráter dinâmico e recorrente do TEV, um determinado paciente poderá ser inicialmente classificado de
baixo risco e evoluir para um estado de alto risco. Neste
caso, a conduta terapêutica será de acordo com esta nova
condição clínica.
Alguns autores propõem a estratificação conforme o
risco de óbito em 30 dias adotando-se o escore PESI Pulmonary Embolism Severity Index15 (Tabela 3).
Tabela 3. Pulmonary Embolism Severity Index – risco óbito em 30 dias.
Parâmetro
idade
Sexo masculino
Câncer
Insuficiência cardíaca crônica
Doença pulmonar crônica
Frequência cardíaca > 100bpm
Pressão arterial sistólica <
100mmHg
Frequência respiratória > 30/min
Temperatura < 36.C
Estado mental alterado
Saturação hemoglobina < 90%
* Versão
** Versão
original
simplificada
Idade em
1 ponto
anos
(>80 anos)
+ 10 pontos
+ 30 pontos
1 ponto
+ 10 pontos
1 ponto
+ 10 pontos
+ 20 pontos
1 ponto
+ 30 pontos
1 ponto
+ 20 pontos
+ 20 pontos
+ 60 pontos
+ 20 pontos
1 ponto
*Versão original: risco de óbito tem 30 dias; Classe I (≤ 65 pontos) – muito baixo = 0 a 1,6%; Classe
II (66 – 85 pontos) – baixo = 1,7 a 3,5%; Classe III (86 – 105 pontos) – moderado = 3,2 a 7,1%; Classe
IV (106 – 125 pontos) – elevado = 4 a 11,4%; Classe V (> 125 pontos) – muito elevado = 10 a 24,5%
**Versão simplicada: risco de óbito tem 30 dias; Baixo risco (zero pontos) = 1%; Alto risco (≥ 1
ponto) = 10,9%.
TRATAMENTO
O tratamento do TEV baseia-se na anticoagulação, seja
com uma das modalidades de heparina (não-fracionada,
baixo peso molecular ou pentassacarídeo) ou algum dos anticoagulantes orais. Dentre estes, temos a varfarina (utilizada
há décadas) ou a opção de um dos novos anticoagulantes
orais (rivaroxabana, apixabana, edoxabana e dabigatrana).16
Os pacientes de alto risco são inicialmente tratados com
fibrinolíticos (estreptoquinase, alteplase ou tenecteplase).
A embolectomia percutânea ou cirúrgica estão indicadas
para os que não apresentam melhora clínica ao fibrinolítico
ou na vigência de contraindicação (p.ex. cirurgia recente).
Os de baixo risco são medicados com heparina e/ou
anticoagulação oral. A decisão baseia-se na estratificação
do risco (Figura 11).
Segundo as diretrizes da Sociedade Europeia de Cardiologia para o tratamento da embolia pulmonar, os pacientes
também podem ser classificados:17
1. Alto risco (choque ou hipotensão) – administrar fibrinolíticos.
2a.Moderado-alto risco (ausência hipotensão, porém há
Rev Soc Cardiol Estado de São Paulo 2016;26(1):46-55
Alto risco
Fibrinolítico (SK, tPA, TNK)
Embolectomia
Baixo risco
HNF, Enoxa, Fonda
Varfarina, NACOs
SK - estreptoquinase, tPA - alteplase, TNK - tenecteplase, HNF - heparina não
fracionada, NACOs - novos anticoagulantes orais.
Figura 11. Tratamento da embolia pulmonar conforme estratificação de risco.
disfunção VD e aumento troponina/ BNP) – administrar fibrinolíticos.
2b.Moderado-baixo risco (ausência hipotensão, porém associada a somente um dos seguintes: disfunção isolada
VD ou aumento isolado troponina/BNP ou ambos negativos) – administrar heparina, anticoagulação oral.
3. Baixo risco – administrar heparina, anticoagulação oral.
Alguns pacientes necessitam de assistência ventilatória, drogas vosoativas e expansores volêmicos. O rápido
restabelecimento da perfusão pulmonar deve ser prioritária.
HEPARINA NÃO FRACIONADA (HNF)
A heparina é uma mistura heterogênea de cadeias de
polissacarídeos com pesos moleculares variando entre
3.000 e 30.000 dáltons e extraída do intestino suíno. Ao ativar a antitrombina, inibe a ação dos fatores II, VII, IX, X e XI.
A infusão é endovenosa, dose ajustada mantendo-se
TTPa (Tempo de tromboplastina parcial ativada) entre 1,5 e
2,5 vezes o controle. Valores < 1,5x aumentam recorrência
de eventos embólicos. Nomograma baseado no peso do
paciente auxilia no ajuste da dose18 (Tabela 4).
Nos casos de sangramento grave, o antídoto é a protamina EV (1mg para neutralizar 100 UI HNF), acompanhandose com TTPa, para avaliar a resposta de reversão. Seu nível
terapêutico baseia-se na atividade anti-Xa (0,3 - 0,7UI/ml).
Tabela 4. Dose da heparina ajustada ao peso.
80 U/Kg (bolus), seguido de
18U/Kg/h
80 U/Kg em bolus, aumentar
TTPa < 35 s (< 1,2 x controle)
infusão em 4U/Kg/h
40 U/Kg em bolus, aumentar
TTPa 35-45 s (1,2 – 1,5 x controle)
infusão em 2U/Kg/h
TTPa 46-70 s (1,5 – 2,3 x controle) Não alterar
TTPa 71-90 s (2,3 – 3,0 x controle) Diminuir infusão em 2U/Kg/h
Parar infusão por 1 hora, diTTPa > 90 s (< 3,0 x controle)
minuir infusão em 3 U/Kg/h
Dose inicial
HEPARINA DE BAIXO PESO MOLECULAR
(HBPM)
As HBPM são fragmentos da heparina não fracionada,
produzidas por processos enzimáticos ou despolimerização
química, com peso molecular entre 4.000 e 6.000 dáltons.
51
Vantagens sobre a HNF:
• O efeito anticoagulante (atividade anti-Xa) correlacionase com o peso, permitindo efeito previsível após administração de dose fixa.
• Monitoração laboratorial do TTPa desnecessária;
• Baixa ligação às proteínas plasmáticas e células endoteliais;
• > biodisponibilidade;
• > duração do efeito, permitindo uma ou duas administrações diárias;
• Raro risco de plaquetopenia auto-imune;
Em nosso meio utilizamos a enoxaparina, na dose 1
mg/Kg 12/12 horas SC ou 1,5mg/Kg 24/24 horas SC. Não
deve ser utilizado naqueles com clearance da creatinina <
30mL/min. A atividade sérica anti-Xa, em amostra obtida 4
horas após a última administração, auxilia na monitorização
terapêutica em casos selecionados. Essa atividade varia
conforme a dose: 0,6-1,0UI/mL (1mg/Kg 12/12 h) e 1,02,0UI/mL (1,5mg/Kg 24/24 h).19
Antídoto: 1mg protamina neutraliza 1mg enoxaparina
quando esta for aplicada < 8 horas da última dose. Se
entre 8-12 horas, utilizar 0,5mg para cada 1mg enoxaparina.
PENTASSACARÍDEO (FONDAPARINUX)
52
Fondaparinux é uma heparina sintética, composto por
uma cadeia de pentassacaride, sítio ativo das heparinas.
Inibe o fator Xa, apresenta meia-vida longa (17 horas) e não
causa plaquetopenia. É administrada em dose única diária,
conforme o peso do paciente: < 50Kg = 5mg, 51-100Kg
= 7,5mg, > 100Kg = 10mg SC/dia. Não deve ser utilizada
com clearance da creatinina < 20mL/min e entre 20-50mL/
min, reduzir a dose 1,5mg/SC/dia.20
ANTICOAGULANTES ORAIS
O anticoagulante oral mais utilizado é a varfarina, o qual
inibe a síntese hepática dos fatores de coagulação dependentes da vitamina K (fatores II, VII, IX e X). É administrado
na dose diária de 5 a 15mg mantendo-se o RNI (relação
internacional normalizada) entre 2,0 - 3,0 durante dois dias
consecutivos antes de suspender qualquer uma das modalidades de heparina. A primeira dose deve ser concomitante
com a heparina, e mantida a heparina até atingir o pico
terapêutico (3-5 dias), para então retirar a heparina.
Alimentos ricos em vitamina K reduzem o seu efeito
anticoagulante, devendo-se orientar os pacientes para que
a ingestão dos mesmos se dê de maneira regular. Quando
houver risco de sangramento grave pela varfarina, a infusão de complexo protrombínico (50UI/Kg) em 30 minutos,
reverterá tal ação.
A variabilidade da dose da varfarina, observada com certa
frequência, tem sido atribuída a dois genes: citocromo CYP2C9
e epóxido redutase. Esta análise genética é reservada em
casos selecionados e carece de ampla aplicação prática.21
NOVOS ANTICOAGULANTES ORAIS
Os novos anticoagulantes orais inibem diretamente o fator
Xa (rivaroxabana, apixabana, edoxabana) ou a trombina (dabigatrana). Quando comparadas à varfarina, apresentam rápido
início de ação, curta duração, não necessitam de controle
laboratorial, não-inferiores quanto a eficácia e menor risco de
sangramentos maiores (segurança), especialmente do sistema nervoso central, embora estas observações tenham sido
descritas para pacientes com fibrilação atrial. Estas drogas
devem ser utilizadas com cautela com clearance creatinina
< 30mL/min e contraindicadas se < 15mL/min22,23 (Tabela 5).
Estas drogas foram testadas em diferentes estudos,
sendo rivaroxabana e apixabana administradas sem uso
prévio à enoxaparina ou fondaparinux. A duração do tratamento variou de 3 a 12 meses e prolongado por mais 6
a 12 meses conforme o risco de recorrência (Figura 12).
Nos casos de reversão do efeito anticoagulante,
preconiza-se:39
1. Complexo protrombínico ativado (FEIBA®) – para a reversão dabigatrana
2.Complexo protrombínico (Prothromplex®, Beriplex®) –
para a reversão rivaroxabana, apixabana, edoxabana.
Antídotos específicos têm sido desenvolvidos para a
dabigatrana (idarucizumab) e para os demais inibidores
fator X (alfa-andexanet). Embora se preconize terapêuticas
para reversão dos efeitos anticoagulantes, sua utilização é
ainda motivo de debate na literatura.
Tabela 5. Novos anticoagulantes orais.
Fator inibido
Pró-droga
Biodisponibilidade
Pico de ação (horas)
Meia-vida (horas)
Controle laboratorial
Administração diária
Absorção com alimentos
Eliminação renal
Ligação proteica
Dispepsia
Interação
warfarina
Síntese hepática II, VII, IX, X
Não
95%
72 - 96
40
Sim
Ajustada RNI
Interferência alimentos ricos
Vitamina K
Não
90%
Não
Citocromo P3A
Citocromo 1A2
Citocromo 2C9
rivaroxabana
Xa
Não
80%
2-4
7 - 11
Não
1x
apixabana
Xa
Não
65%
3
8 - 15
Não
2x
edoxabana
Xa
Não
50%
1-3
9 - 11
Não
1x
dabigatran
Ila
Sim
6%
1-2
9 - 13
Não
2x
Aumento 40%
Não interfere
Não interfere
Não interfere
35%
90%
Não
Citocromo P3A
Glicoproteína
25%
90%
Não
Citocromo P3A
35%
90%
Não
Citocromo P3A
Glicoproteína
80%
5%
5 - 10%
Glicoproteína
Rev Soc Cardiol Estado de São Paulo 2016;26(1):46-55
ATUALIZAÇÃO DO DIAGNÓSTICO E TRATAMENTO DO TROMBOEMBOLISMO PULMONAR
Estudo
Duração
5 dias
HBPM/FONDA
3 - 12 meses
Clássico
varfarina
Einstein - TVP/EP
rivaroxabana (15mg 2x/dia x 21 dias + 20mg/dia)
Prolongado
3 - 12 meses
6 meses
Amplify
apixabana (10mg 2x/dia x 10 dias + 5mg 2x/dia)
5 - 10 dias
Re-cover I - II
HBPM/FONDA
6 meses
dabigatrana (150mg 2x/dia)
5 - 10 dias
Hokusai
HBPM/FONDA
3 - 12 meses
edoxabana (60mg 2x/dia)
HBPM – heparina baixo peso molecular, FONDA - fondaparinux.
Figura 12. Esquemas terapêuticos utilizados nos diferentes estudos.
DURAÇÃO DO TRATAMENTO
Nos pacientes com TEV cujo fator etiológico é identificado e reversível a duração do tratamento preconizado
é de três meses. Nos casos idiopáticos ou recorrentes e
portadores de neoplasias, o tratamento será postergado
por anos ou por tempo indeterminado.23
Alguns autores recomendam a mensuração ambulatorial
seriada do dímero-d para a manutenção ou não da anticoagulação em portadores de eventos tromboembólicos de
causa não identificada. A elevação de seus níveis após a
suspensão do anticoagulante é forte recomendação para
seu uso continuado.41
Aqueles que não toleram ou há alguma contraindicação para anticoagulação oral, pode-se utilizar a aspirina
100mg/dia, com redução 30 a 40% de eventos em quatro anos.
Tabela 6. Dose dos fibrinolíticos.
Fibrinolítico
Ataque
Manutenção
Estreptoquinase 250.000 UI X 30min
ou 1.5000.000 UI X 2 h
(Streptase®)
100.000 UI/h x 24
a 120 h
rt-PA (Actylise®)
10 mg bolus
90 mg x 2 h
TNK (Metalyse®)
30 a 50 mg bolus*
ajustados ao peso
___
< 60kg = 30mg
≥ 60kg < 70mg = 35mg
≥ 70kg < 80mg = 40mg
≥ 80kg < 90mg = 45mg
≥ 90kg = 50mg
* Pacientes > 75 anos, reduzir a dose em 50%.
FIBRINOLÍTICOS
Indicado para o paciente de alto risco, o objetivo é reverter a pressão sistólica da artéria pulmonar para níveis ≤
40mmHg, estimado a intervalos regulares de tempo pelo
ecocardiograma à beira-leito.24,25
Quanto mais recente o evento, ou seja, trombos não
organizados, maiores as chances de sua lise. Os pacientes
com horas ou dias do evento, poderão beneficiar-se com
qualquer um dos esquemas propostos. Quando a história
de tromboembolismo venoso situa-se entre uma e quatro
semanas, preconizamos a estreptoquinase em infusão contínua por até 120 horas, promovendo a lise lenta e progressiva do trombo.
Os fibrinolíticos aumentam o risco de sangramento, inclusive os fibrino-específicos (alteplase e TNK-tenecteplase),
especialmente naqueles > 75 anos. Quando for utilizado
tenecteplase, a dose poderá ser reduzida em 50% para esta
faixa etária, conforme estudo PEITHO26 (Tabela 6).
Rev Soc Cardiol Estado de São Paulo 2016;26(1):46-55
Punções vasculares e passagem de sondas desnecessárias deverão ser evitadas, minimizando-se os riscos de
sangramento.
Ao término da trombólise, a anticoagulação é iniciada
com heparina seguida de varfarina ou com um dos novos
anticoagulantes orais, assegurando-se níveis TTPa < 1,5x
controle e o fibrinogênio > 100mg/mL.
Pacientes sexo feminino, peso ≤ 50Kg, idade ≥ 75 anos
apresentam maior risco hemorrágico cerebral (1-3%). A redução em 50% da dose tem sido sugerida, bem como a
não administração concomitante de heparina.
Embora rara, as complicações hemorrágicas graves
devem ser precocemente identificadas e tratadas:
1. Criopreciptado - 10 unidades EV (rico em fibrinogênio)
2. Plasma fresco – 4 unidades EV (rico fatores da coagulação)
3. Ácido épsilon-aminocapróico (Ipsilon®) – 4 g EV 60 min
4. Reposição hemácias – controle da anemia
53
As contraindicações dos fibrinolíticos são:
Absolutas: acidente vascular cerebral hemorrágico, acidente vascular cerebral isquêmico < 6 meses, neoplasia
sistema nervoso central, trauma ou cirurgia < 3 semanas,
sangramento interno ativo < 4 semanas.
Relativas: hipertensão arterial não controlada (PAS >
180mmHg), cirurgia, biópsia ou punção de vasos não compressíveis < 10 dias, plaquetas < 100.000/mm,3 alergia
aos fibrinolíticos, doença hepática avançada, ressuscitação
traumática, endocardite infecciosa.
FILTRO DE VEIA CAVA INFERIOR
O filtro é posicionado na veia cava inferior, abaixo das
veias renais via punção femoral ou jugular, dificultando a
migração de tromboêmbolos provenientes do sistema cava
inferior27 (Figura 13).
As principais indicações são:
1. Contraindicação absoluta aos anticoagulantes,
Embolia pulmonar recorrente em paciente sob adequada
anticoagulação.
2. Trombose do filtro e mal posicionamento são algumas
complicações descritas.
Figura 14. Angiojet®. Cateter posicionado na artéria pulmonar direita: aspiração e fibrinólise química concomitante.
EMBOLECTOMIA
54
A embolectomia percutânea ou cirúrgica está indicado
nos pacientes com embolia pulmonar de alto risco na vigência de alguma contraindicação ao fibrinolítico ou mesmo
nos casos de insucesso terapêutico.27,28
Dentre os dispositivos percutâneos disponíveis, citam-se:
Pronto® - cateter siliconizado, onde o trombo é aspirado
sob pressão negativa de uma seringa;
Aspirex® - aspiração do trombo sob alta rotação;
Trombólise ultrassônica e infusão fibrinolítico;
Angiojet® - aspiração do trombo sob efeito Venturi e infusão
concomitante de fibrinolítico (Figuras 14 e 15).
Nas tromboses iliofemorais a fibrinólise in locus via cateterização seletiva percutânea ou embolectomia (Angiojet®)
tem sido preconizado.
A embolectomia cirúrgica é reservada como resgate nos
casos de falha da terapia fibrinolítica ou da embolectomia
percutânea. Indicação precoce e equipe cirúrgica habilitada
são fatores de melhor prognóstico.
Figura 15. Trombólise mecânica - sala radiologia intervencionista
CONSIDERAÇÕES FINAIS
O tromboembolismo venoso é a terceira causa de óbito
cardiovascular em ambiente hospitalar. O seu diagnóstico
baseia-se em critérios clínicos, elevação dímero-d e angiotomografia pulmonar.
A presença de choque ou hipotensão arterial, disfunção
do ventrículo direito e elevação de BNP/troponina correlacionam-se com pior prognóstico. Nos casos mais graves,
preconiza-se a administração de fibrinolíticos ou lise mecânica na vigência de alguma contraindicação.
Os novos anticoagulantes orais apresentam eficácia
similar à varfarina e maior segurança quanto aos eventos
hemorrágicos. Apresentam meia-vida curta, não há interferência com os alimentos e nem necessidade de controle
laboratorial de seu efeito anticoagulante.
Conflitos de interesse
Figura 13. Filtro de Greenfiled na veia cava inferior
Os autores declaram não possuir conflitos de interesse na realização deste trabalho.
Rev Soc Cardiol Estado de São Paulo 2016;26(1):46-55
ATUALIZAÇÃO DO DIAGNÓSTICO E TRATAMENTO DO TROMBOEMBOLISMO PULMONAR
REFERÊNCIAS
1. Goldhaber SZ. Risk factors for venous thromboembolism. J Am
Coll Cardiol. 2010;56:1-3
2. Goldhaber SZ. Pulmonary embolism. In: Braunwald E, Zippes,
editor. Braunwald’s Heart disease: A Textbook of Cardiovascular
Medicine (15th edition). New York: Elsevier, 2015:1664-8.
3. Goldhaber SZ, Bounameaux H. Pulmonary embolism and deep
venous thrombosis. Lancet. 2012;379:1835-46.
4. Agnelli G, Becattini C. Current concepts: acute pulmonary embolism. N Engl J Med. 2010;15:266-74.
5. Vanni S, Polidori G, Vergara R, Pepe G, Nazerian P, Moroni
F, et al. Prognostic value of ECG among patients with acute
pulmonary embolism and normal blood pressure. Am J Med.
2009;122:257-64.
6. Shiva S, Bennett S, Parfitt VJ. Images in cardiovascular medicine.Westermak’s and Palla’s signs in acute pulmonary embolism.
Circulation. 2007;115:e211
7. Penaloza A, Roy PM, Kline F, Verschuren F, LE Gal G, Quentin-Georget S, et al. Performance of age-adjusted d-dimer
cut-off to rule out pulmonary embolism. J Thromb Haemost.
2012;10:1291-6.
8. Becattini C, Agnelli G, Vedovati MC, Pruszczyk P, Casazza
F, Grifoni S, et al. Multidetector computed tomography for acute
pulmonary embolism: diagnosis and risk stratification in a single
test. Eur Heart J. 2011;32:1657-62.
9. Bajc M, Olssen B, Palmer J, Jonson B. Ventilation/perfusion
SPECT for diagnostics of pulmonary embolism in clinical practice. J Intern Med. 2008;264(4):379-87.
10.Rudski LG, Lai WW, Afilalo J, Hua L, Handschumacher
MD, Chandrasekaran K, et al. Guidelines for echocardiography
assessment of the right heart in adults: a report from the American Society of Echocardiography endorsed by the European
Association of Ecchocardiography, a registred branch of the
European Society of Cardiology, and the Canadian Society of
Echocardiography. J Am Soc Echocardiogr. 2010;23(7):685-713.
11.Campos PC, Baruzzi AC, Vieira ML, Knobel E. Successful treatment of colon cancer related right heart thromboemboli with
prolonged intravenous streptokinase during serial TOE monitoring. Heart. 2005;91:390.
12.Gibson NS, Sohne M, Kruip MJ, Tick LW, Gerdes VE, Bossuyt
PM, et al. Further validation and simplification of the Wells clinical decision rule in pulmonary embolism. Thromb Haemost.
2008;99(1):229-34.
13.van Belle A, Büller HR, Huisman MV, Huisman PM, Kaasjager
K, Kamphuisen PW,, et al. Effectiveness of managing suspected pulmonary embolism using an algorithm combining clinical
probability, D-dimer testing, and computed tomography. JAMA.
2006;295(2):172-9.
14.Sanchez O, Trinquart L, Caille V, Couturaud F, Pacouret G, Meneveau N, et al. Prognostic factors for pulmonary embolism: the
prep study, a prospective multicenter cohort study. Am Respir
Crit Care Med. 2010;181(2):168-73.
15.Donze J, Le Gal G, Taneja A, Fine MJ, Roy PM, Sanchez
O, Verschuren F, et al. Prospective validation of the pulmonary
severity index. A clinical prognostic model for pulmonary embolism. Thromb Haemostat. 2008;100:943-50.
Rev Soc Cardiol Estado de São Paulo 2016;26(1):46-55
16.Van der Hulle T, Kooiman J, den Exter PL, Dekkers OM, Klok
FA, Huisman MV. Effectiveness and safety of novel oral anticoagulants as compared with vitamin K antagonists in the
treatment of acute symptomatic venous thromboembolism:
a systematic review and meta-analysis. J Thromb Haemost
2014;12(3):320-8.
17.Konstandinidis SV, Torbicki A, Agnelli G, Danchin N, Fitzmaurice D, Galiè N, et al. 2014 ESC guidelines on the diagnosis
and management of acute pulmonary embolism.. Eur Heart J
2014; 35:3033-69.
18.Raschke RA, Gollihare B, Peirce JC. The effectiveness of implementing the weight-based heparin nomogram as a practice
guideline. Arch Intern Med 1996;156(15):1645-9.
19.Garcia DA, Baglin TP, Weitz JL, Samama MM; American College
of Chest Physicians. Parenteral anticoagulants: Antithrombotic
therapy and prevention of thrombosis, 9th ed: American College
of Chest Physicians Evidence-Based Clinical Practice. Chest.
2012;141(Suppl 2):e24S-e43S.
20.Buller HR, Davidson BL, Decousus H, Gallus A, Gent M, Piovella
F, et al. Subcutaneous fondaparinux versus intravenous unfractionated heparin in the initial treatment of pulmonary embolism.
N Engl J Med. 2003;349(18):1695-1702.
21.Kimmel SE, French B, Kasner SE, Johnson JA, Anderson
JL, Gage BF, et al. A pharmacogenetic versus a clinical algorithm for warfarin dosing. N Engl J Med. 2013;369(24):2283-93.
22.Yeh CH, Gross PL, Weitz JI. Evolving use of new oral anticoagulants for treatment of venous thromboembolism. Blood.
2014;124(70):1020-8.
23.Miesbach W, Seifried E. New direct oral anticoagulants – current
therapeutic option and treatment recommendations for bleeding
complications. Thromb Haemost. 2012;108:625-32.
24.Marti C, John G, Konstantinidis S, Combescure C, Sanchez
O, Lankeit M, et al. Systematic thrombolytic therapy for acute
pulmonary embolism: a systematic review and mata-analysis.
Eur Heart J. 2014;35:332-45.
25.Chatterjee S, Chakraborty A, Weinberg I, Kadakia M, Wilensky
RL, Sardar P, et al. Thrombolysis for pulmonary embolism and
risk of all-cause mortality, major bleeding, and intracranial hemorrhage. A meta-analysis. JAMA. 2014;311(23):2414-21.
26.Meyer G, Vicaut E, Danays T, Agnelli G, Becattini C, Beyer-Westendorf J, et a. Fibrinolysis for patients with intermediate-risk pulmonary embolism. PEITHO Investigators. N Engl J Med.
2014;370(15):1402-11.
27.Takahashi H, Okada K, Matsumori M, Kano H, Kitagawa A, Okita Y.Aggressive surgical treatment of acute pulmonary embolism
with circulatory collapse. Ann Thorac Surg. 2012;94(3):785-91.
28. Kuchert N, Boekstegers P, Muller OJ, Kupatt C, Beyer-Westendorf J, Heitzer T, et al. Randomized, controlled trial
of ultrasound-assisted catheter-directed thrombolysis for
acute intermediate-risk pulmonary embolism. Circulation.
2014;129(4):479-86.
29.Faria R, Oliveira M, Ponte M, Pires-Morais G, Sousa M, Fernandes P. Trombectomia percutânea reolítica no tratamento de
tromboembolismo pulmonar de alto risco: experiência inicial de
um centro. Rev Port Cardiol. 2014;33:371-7.
55
ESTEJA PREPARADO PARA
SITUAÇÕES DE EMERGÊNCIA
Participe dos cursos do Centro de Treinamento
Com objetivo de treinar profissionais da saúde e a população leiga
para reconhecer e lidar com situações de emergência cardíaca, os
treinamentos ministrados pelo centro utilizam equipamentos e salas
modernas, o que garante o máximo realismo à situação simulada.
Os instrutores são altamente capacidados e credenciados, de acordo
com as regras e especificações da American Heart Association (AHA).
Conheça mais sobre os cursos e inscreva-se!
ACLS – Suporte Avançado de Vida em Cardiologia
ACLS EP (EXPERIENCED PROVIDER)
BLS – Suporte Básico de Vida
FIRST AID – Primeiros Socorros e Salva-Corações com DEA / DAE
PALS – Suporte Básico de Vida em Pediatria
SAVIC – Suporte Avançado de Vida em Insuficiência Cardíaca
Saiba mais e inscreva-se em:
WWW.SOCESP.ORG.BR/CENTRO_TREINAMENTO/
Credenciamento: