FUND AM ENTOS D E Q UÍMIC A I
2003/04
(Química e Bioquímica)
Exame Final (1ª Época) 2004-01-26
Nome:____________________________________________________ Curso:________________
PERGUNTAS DE DESENVOLVIMENTO
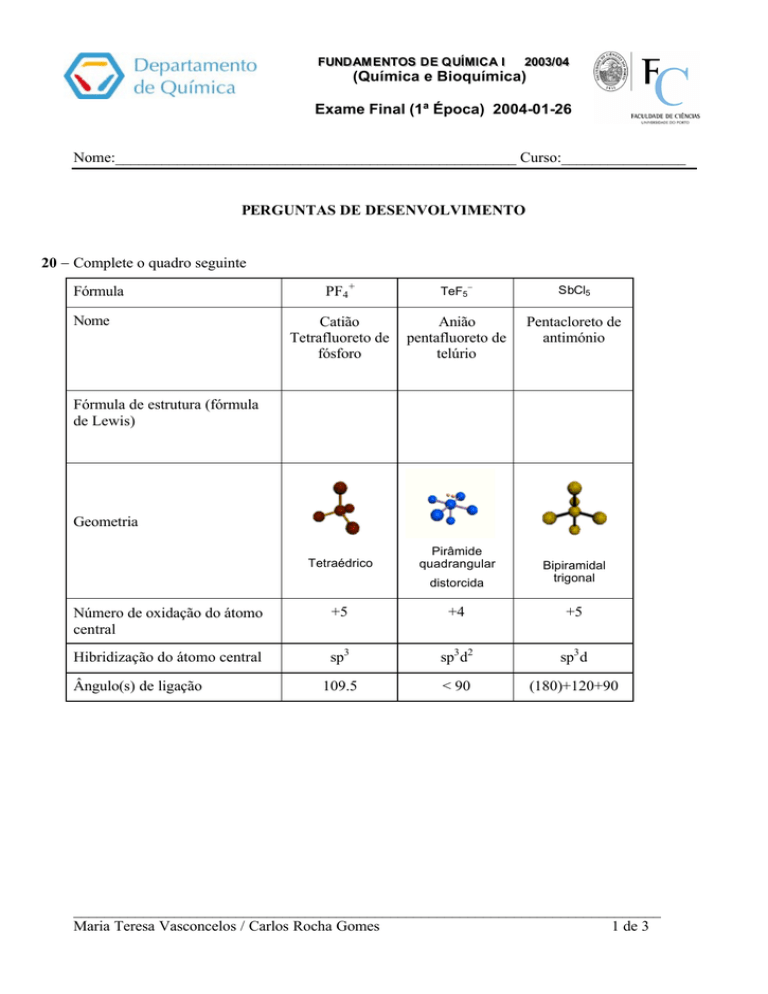
20 − Complete o quadro seguinte
Fórmula
Nome
PF4 +
TeF5−
SbCl5
Catião
Tetrafluoreto de
fósforo
Anião
pentafluoreto de
telúrio
Pentacloreto de
antimónio
Tetraédrico
Pirâmide
quadrangular
Fórmula de estrutura (fórmula
de Lewis)
Geometria
distorcida
Bipiramidal
trigonal
Número de oxidação do átomo
central
+5
+4
+5
Hibridização do átomo central
sp3
sp3 d2
sp3 d
109.5
< 90
(180)+120+90
Ângulo(s) de ligação
____________________________________________________________________________
Maria Teresa Vasconcelos / Carlos Rocha Gomes
1 de 3
21 − Considere as seguintes espécies diatómicas homonucleares: O2 2− e F2 +.
(a) Esboce o diagrama de energias de orbitais moleculares adequado para estas espécies.
σ*2p
2p
π*2p
2p
π2p
σ2p
σ*2s
2s
2s
σ2s
O2 – F2
(b) Escreva a configuração electrónica de cada uma das espécies e diga se são paramagnéticas ou
diamagnéticas.
O22− : (σ2s)2 (σ*2s)2 (σ2p )2 (π 2p )4
↑↓
↑↓
↑↓ ↑↓ ↑↓
(π*2p )4
↑↓ ↑↓ Diamagnético (zero electrões desemparelhados)
F2 + : (σ2s)2 (σ*2s)2 (σ2p )2 (π 2p )4
↑↓
↑↓
↑↓ ↑↓ ↑↓
(π*2p )3
↑↓ ↑ Paramagnético (um electrão desemparelhado)
22 − O tricloreto de boro é um catalisador importante em vários processos industriais. A sua preparação
em larga escala envolve a reacção, traduzida pela seguinte equação química (não acertada), a qual se
processa à temperatura de 500°C,
Trióxido de Diboro(s) + Carbono(s) + Dicloro(g) → Tricloreto de Boro(g) + Monóxido de Carbono(g)
Quando se faz reagir, à pressão de uma atmosfera, 1000 kg do óxido, com grau de pureza de 80%,
com excesso de carbono e cloro, obtém-se 1,36x106 L do tricloreto de boro.
Atendendo aos dados fornecidos, responda às seguintes questões
a) Escreva a equação química acertada
B2 O3 (s) + 3 C (s) + 3 Cl2 (g) → 2 BCl3 (g) + 3 CO(g)
____________________________________________________________________________
Maria Teresa Vasconcelos / Carlos Rocha Gomes
2 de 3
b) Calcule o rendimento da reacção
massa
x 0.80
massa
xM
moles
x2
moles
η
moles
B2 O3 (impuro) → B2 O3 (puro) ← B2 O3 (puro) → BCl3 → BCl3
106 g
8.00x105 g
69.62 1.15x104
2.30x104
↓ PV = nRT
(V BCl3 )
Volume
PV=nRT
moles
BCl3 → BCl3
1,36x106 L
moles
2,14x104
η
moles
BCl3 → BCl3 η = 93,2%
2.30x104
2,14x104
c) Calcule a massa de monóxido de carbono formada
moles
x3/2
moles
xM
massa
BCl3 → CO → CO
2,14x104
3,21x104
8,99x105 g
d) Calcule a variação de entalpia padrão da reacção a 298 K (por mole de trióxido de diboro) e diga
se esta é endotérmica ou exotérmica
∆Hr = 2 ∆H°f(BCl3 (g)) + 3 ∆H°f(CO (g)) – ∆H°f(B2 O3 (g))
∆Hr = 2 x (− 408 kJmol-1 ) + 3 x (– 111 kJmol-1 ) – (– 273 kJmol-1 )
∆Hr = − 816 kJmol-1 – 333 kJmol-1 + 273 kJmol-1 )
∆Hr = − 876 kJmol-1 < 0 (Reacção exotérmica)
e) Calcule o calor total envolvido na reacção
∆Hr = 1,15x104 mol x (− 876 kJmol-1 ) = − 1,01x107 kJ
Dados:
∆Hf°( trióxido de diboro (s)) 298K = − 273 kJmol-1
∆Hf°( tricloreto de boro (g)) 298K = − 408 kJmol-1
∆Hf°(monoxido de carbono (g)) 298K = − 111 kJmol-1
R = 8,314 J.K-1 .mol-1 = 8,206x10-2 L.atm.K-1 .mol-1
1 atm = 101,325 kPa = 760 Torr
____________________________________________________________________________
Maria Teresa Vasconcelos / Carlos Rocha Gomes
3 de 3