Água e
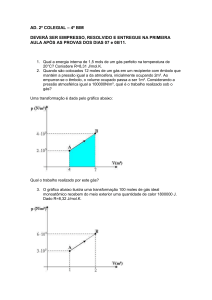
Termodinâmica
Alice Newton
Molécula de água
• covalente
• Polar
• momento dipolar
• dois pares de electrões no O
• repulsão, angulo ~ 105º
• atracção intermolecular
• ligações (pontes) de H
(Russell cap 12)
• importantes consequências
• propriedades especiais da
água
Estrutura da água
Gelo: o estado sólido
• diferentes nos estados s,l,g
• (s), gelo, estrutura cristalina
(ver folha)
densidade (s) <( l)
• na formação de gelo em
águas naturais, o sais são
inicialmente excluídos da
matriz,
portanto a concentração do
soluto no liquido aumenta
Millero & Sohn cap.4
Água no estado
liquido
• Algumas moleculas
aglomeradas
• Alguns característicos
cristalinos
• Algumas moleculas
individuais
• Estrutura mais compacta
c.f. gelo
densidade (l) > (s)
(ver folha)
Vapor: Água no
estado gasoso
• Todas as ligações
intermoleculares são
quebradas (pontes de H)
• Expansão até encher o
volume disponivel
• Pressão aumenta com
temperatura ~ leis dos gases
Propriedades
especiais da água
• efeitos globais, efeitos na
química
• termodinâmica
• soluções
• gases
• equilibrio químico
• Open University: Seawater...
• Millero & Sohn: Chemical
Oceanography
Água e água do mar
• Água é componente
principal da água do mar
• no entanto... água pura tem
um comportamente muito
diferente comparado com
água do mar
• o comportamento é alterado
pela presença de outras
substancias
• 1º estudar comportamento
de água pura
Capacidade calorifica
elevada =4,18 kJ kg -1 ºC-1
• alterações de temperatura
são lentas, efeito termoestático
do oceano
• importantes transferências
de calor por movimentos de
água, efeito climático de
correntes oceánicas
• uniformidade de
temperatura, pequena gama,
estabilidade do ambiente
marinho para orgamnismos
Pontos de fusão
• TºC
0
H2O
H2Te
H2Se
H2S
-100
Calor de fusão
elevado = 333 kJ kg -1 ºC-1
• Efeito termo-estatico durante
a formação e fusão do gelo
especialmente importante em
ambientes aquaticos de alta
latitudes
Calor de fusão da
água
• TºC
0
~ 50
Calor adicionado (cal/g)
Pontos de Ebulição
• TºC
100
H2O
H2Te
0
H2Se
H2S
Calor de evaporação
elevado =2250 kJ / kg
• Importante transferência de
calor da água á atmosfera
• Efeito moderador climático em
zonas costeiras
Calor de vaporização
da água
• TºC
100
~ 500
Calor adicionado (cal/g)
Entalpia e água
100•
Pe
~500 >
Hvap
TºC
Cc
1,0 cal/g
0
Pf
~50
Hfus
Cc
0,5 cal/g
> Cal/g
Expansão térmica
• densidade e volume do gelo
e da água
• densidade gelo < densidade max. da água
• Estratificação térmica em
ambientes aquaticos
Tensão superficial
elevada = 7,2 x 109 Nm-1
• Controla processos
superficiaís,
Processos das interfaces
água / atmosfera
água / organismo
fisiologia celular
• Importante na formação de
gotas
Constante dielectrica
elevada (80 as 20ºC)
• Importante na solubilização
de iõs de sais ionicos, e
formação de electrolítos
• água tem elevado poder de
solubilização, é considerada
“solvente universal” (no
entanto muitas substâncias
não são soluveis na água
• erosão de rochas e composição de
águas naturais
Grau de dissociação
baixo
• água contem H+ e OH- mas o
grau de dissociação é baixo
• H+ e OH- importantes em
processos geologicos e
biologicos
• água pura é neutra, no
entanto forma soluções
acidas e basicas
• efeito tampão da água do mar
Transparência elevada
• Energia absorvida nos UV e
IR (IV)
• importante em processos
físicos (optica),
químicos (fotoquímica), e
biologicos (fotossintese)
• Produção primaria, pigmentos
fotossinteticos,
macro e microalgas
Conductividade
calorifica elevada
• Só importante em processos
de microescala,
por ex. processos celulares e
organismos unicelulares
Compressibilidade
• “distância” intermolecular
• relação inversa com
temperatura (0º-50ºC)
• alteração de propriedades
termoquímicas (p.ex.
solubilidade) com
temperatura.
Capacidade calorífica
• relação inversa com
temperatura (0º-30ºC)
• propriedades térmicas
diferentes c.f. outros
solventes
• água é solvente com
propriedades especiais
Viscosidade molecular
relativa 10-3 Nsm-2
• fluído, diferenças de pressão
compensadas facilmente
• importante na física de ondas,
interfaces água/água
• importante na biologia
especialmente pequenos
organismos
Termodinâmica
Química
• Calor, movimento, química
• Abordagem: relação com
caracteristicas da água e
água do mar
• importante no estudo de
processos e espontaneidade
dos processos
• 2Na(s)+Cl(g)--->2 NaCl (s)
é espontaneo.
• 2 NaCl (s) ---> 2Na(s)+Cl(g)
não é espontaneo
Entalpia H
• Calor absorvido durante
uma transformação a pressão
constante.
• H = E + PV
• No mar a pressão varia muito
com profundidade
• Processo Endotérmico
absorve calor
+ H
• Processo Exotérmico
liberta calor
- H
Entalpia de Formação
Hf
• Variação de entalpia na
formação de 1 mole de
composto a partir de
elementos livres = Hf
• Na (s) + 1 Cl2(g)----> NaCl (s)
2
Hºf = - 412,1 kJmol-1
• Condições : T=298K
• Pressão: 1 atm
1
2
Hºf,298
Hºf de alguns
compostos
• H2 O (g)
• H2 O (l)
• NaCl (s)
• - 241,8 kJmol-1
• - 285,8 kJmol-1
• - 412,1 kJmol-1
1º Principio
• “Conservação de Energia”
• Diferenças de energia E
podem ser atribuídas ou a
• Calor adicionado:
q = E = E2 - E1 ou a
• Trabalho executado
- W= E = E2 - E1
p.ex.: trabalho de expansão
contra uma pressão externa
W = Pext V
Calor e trabalho
• As vezes ganho de calor e
execução de trabalho são
simultaneos
E = E2 - E1 = q = W
•
+Energia
Ganho de Calor
- Energia
Execução de
trabalho
Calor específico
• Calor necessário para
aumentar de 1ºC a
temperatura de 1g de
substância
H2 O (l) = 1,0 cal/g
H2 O (s) = 0,5 cal/g
• a água tem um calor
específico reletivamento
muito elevado
Capacidade de calor
molar (25ºC)
• Cp: Calor necessário para
aumentar de 1K a
temperature de 1 mole de
substância
• Cp de H2 O(l) = 75,3 JK-1mol-1
Calor de fusão molar
Hfus
• calor necessário para a fusão
de 1 mole de substância
• ponto de fusão é
temperatura onde ocorre a
mudança de estado
• H2 O (s) ----> H2 O (l)
ponto de fusão = 0ºC
Hfus
= 6008 Jmol-1
~50 cal/g
Calor de Vaporização
molar Hvap
• calor necessário para a
vaporização de 1 mole de
substância
• ponto de ebulição é
temperatura onde ocorre a
mudança de estado
• H2 O (l) ----> H2 O (g)
• ponto de ebulição = 100ºC
• Hvap = 37,56 kJmol-1
~ 500 cal g-1
2º Principio e Entropia
S
• “Entropia aumenta
constantemente”
• Entropia é uma função do
estado de ordem
ordem --->desordem
• Moléculas de um sólido
perfeito e puro a 0 K
encontram-se perfeitamente
ordenadas, Entropia = 0
• Entropia Padrão é entropia
de 1mol de substância (25ºC)
SºJK -1 mol -1
Entropia de algumas
substâncias
• H2 O (l) 69,9
-1
SºJK -1 mol
• H2 O (g) 188,7 SºJK -1 mol -1
• H2 (g) 130,6 SºJK -1 mol -1
• O2 (g) 205,1 SºJK -1 mol -1
Espontaneidade e
Energia livre
• Energia “livre” para executar
um trabalho que não seja
expansão é chamada energia
livre ou energia de Gibbs
• G=H - TS
G: energia de Gibbs
H: entalpia
T: temperatura K!!!!
S: entropia
Fusão da água
ºC
K
-TS -G
Jmol-1 Jmol-1
+1
274,15 -6030
-22
0
273,15 -6008
0
-1
272,15 -5986
Esp.
Equil.
+22 Não
esp.
Energia de Gibbs
• G<0
• G=0
• G>0
Espontaneo
Equilibrio
Não
espontaneo
• p.ex. H2 O (s) ----> H2 O (l)
é controlado pela
temperatura
Hfus = 6008 Jmol-1
S=21,99JK-1 mol-1
Lei de Hess
• variação de entalpia depende
só dos reagentes iniciais e
produtos
• não depende das etapas
• permite calcular valores de
entalpias desconhecidas a
partir de valores conhecidos
• construção de ciclos
Born-Harber
Ciclo Born-Harber
vaporização da água
• 1/2
H2 (g) + O2 (g)f
f -241,8kJmol-1
f -285,8kJmol-1
H2 O(l)
H2 O(g)
crist -6,02kJmol-1
H2 O(s)
Hvap
Ciclo Born-Harber,
entalpia reticular de NaCl
• Na+ (g)
Cl (g)
ion+496 kJmol-1
ae-349 kJmol-1
Na+ (g) + Cl- (g)
Na (g) Cl (g)
diss+122kJmol-1
Na (g)
1/
2
Cl2 (g)
sub+107kJmol-1
Hret
Na (s)
1/
2
Cl2 (g)
f- 411kJmol-1
Na+Cl- (s)
Fusão da água
ºC
K
-TS -G
Jmol-1 Jmol-1
+1
274,15 -6030
-22
0
273,15 -6008
0
-1
272,15 -5986
Esp.
Equil.
+22 Não
esp.
Lei de Hess
• variação de entalpia depende
só dos reagentes iniciais e
produtos
• não depende das etapas
• permite calcular valores de
entalpias desconhecidas a
partir de valores conhecidos
• construção de ciclos
Born-Harber
Ciclo Born-Harber
vaporização da água
• 1/2
H2 (g) + O2 (g)f
f -241,8kJmol-1
f -285,8kJmol-1
H2 O(l)
H2 O(g)
crist -6,02kJmol-1
H2 O(s)
vap
Ciclo Born-Harber,
entalpia reticular de NaCl
• Na+ (g)
Cl (g)
ion+496 kJmol-1
ae-349 kJmol-1
Na+ (g) + Cl- (g)
Na (g) Cl (g)
diss+122kJmol-1
Na (g)
1/
2
Cl2 (g)
sub+107kJmol-1
ret
Na (s)
1/
2
Cl2 (g)
f- 411kJmol-1
Na+Cl- (s)
Pontos de fusão
• TºC
0
H2O
H2Te
H2Se
H2S
-100
Pontos de Ebulição
• TºC
100
H2O
H2Te
0
H2Se
H2S
Calor de fusão da
água
• TºC
0
~ 50
Calor adicionado (cal/g)
Calor de vaporização
da água
• TºC
100
~ 500
Calor adicionado (cal/g)
Entalpia e água
100•
Pe
~500 >
Hvap
TºC
Cc
1,0 cal/g
0
Pf
~50
Hfus
Cc
0,5 cal/g
> Cal/g