11-Galassi-1740-30(4)-AF
03.12.08
15:40
Page 301
Relato de caso
Acidose Tubular Renal em Adulto com Tireoidite de Hashimoto
Renal Tubular Acidosis in Adults with Hashimoto’s Thyroiditis
Nádia Marchiori Galassi1, Ângela Cristina Bortoncello1, Renata Viana da Silva1, Fábio Rodrigo
Proni1, Márcia Ribeiro Scolfaro2
1
Clínica Médica do Hospital Municipal Dr. Mário Gatti, Campinas, São Paulo, Brasil;
Clínicas da Universidade Estadual de Campinas – UNICAMP.
2
Endocrinologia, Hospital das
Trabalho realizado no Hospital Municipal Dr. Mário Gatti, em Campinas, São Paulo, Brasil.
RESUMO
A Acidose Tubular Renal (ATR) é uma doença rara, que pode apresentar-se de forma primária, decorrente de defeitos genéticos nos mecanismos de
transporte dos túbulos renais, ou secundária, conseqüente a doenças sistêmicas ou ao uso de medicações. Há poucos casos relatados na literatura, razão
pela qual intencionamos evidenciar a importância em se conhecer essa doença, já que o diagnóstico e o tratamento tardios podem gerar graves
repercussões ao paciente. Relatamos, através deste artigo, um caso de ATR atendido no Hospital Municipal Dr. Mário Gatti (HMMG), Campinas, SP.
Descritores: Acidose tubular renal. Acidose metabólica. Hipocalemia. Tireoidite de hashimoto. Hipotireoidismo.
ABSTRACT
Renal tubular acidosis (RTA) is a rare medical condition that may be either on primary type, caused by genetical defects on transportation through the tubules
of the nephron, or secondary, resulting from sistemic diseases or also by drugs. There are few cases reported about this disorder, and for that we intend to
emphasize the importance of knowing it, as the latter diagnosis and treatment can lead to severe damage to the patient. We report in this article a case of
RTA admitted at HMMG, Campinas, SP.
Keywords: Renal tubular acidosis. Metabolic acidosis. Hypokalemia. Hashimoto ‘ s Thyroiditis. Hypothyroidism.
INTRODUÇÃO
A Acidose Tubular Renal (ATR) é uma doença
rara, que pode apresentar-se de forma primária,
decorrente de defeitos genéticos nos mecanismos de
transporte dos túbulos renais, ou secundária, conseqüente
a doenças sistêmicas ou ao uso de medicações. Existem
três tipos de ATR, classificados de acordo com aspectos
do ajuste da acidez renal e seu comprometimento. No tipo
I, há secreção inadequada de prótons no túbulo distal; no
tipo II, há uma deficiência na reabsorção do bicarbonato
no túbulo proximal e, no tipo IV, ocorre uma hiporresponsividade tubular aos mineralocorticóides1. Há poucos
casos relatados na literatura, razão pela qual intencio-
namos evidenciar a importância em se conhecer essa
doença, já que o diagnóstico e o tratamento tardios podem
gerar graves repercussões ao paciente.
Relatamos, através desse artigo, um caso de ATR
atendido no Hospital Municipal Dr. Mário Gatti (HMMG),
em Campinas, SP.
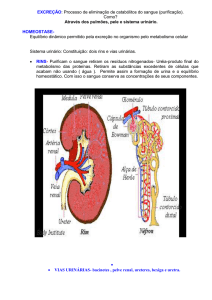
APRESENTAÇÃO DO CASO
Paciente do sexo feminino, 30 anos, natural e procedente de Campinas (SP), do lar, admitida no Pronto Socorro
(P.S.) do HMMG com história de fraqueza muscular progressiva, de início há duas semanas e piora há três dias.
Recebido em 17/07/08 / Aprovado em 17/10/08
Endereço para correspondência:
Nádia Marchiori Galassi
Rua Francisco Bueno de Lacerda 250, ap. 122 A, Jd Dom Vieira
13086-265, Campinas, SP, Brasil
E-mail: [email protected]
J Bras Nefrol 2008;30(4):301-4
11-Galassi-1740-30(4)-AF
03.12.08
15:40
Page 302
ATR em Paciente com Tireoidite de Hashimoto
302
Referia haver procurado atendimento médico
durante este período, tendo inclusive sido mantida sob
observação clínica, mas liberada em seguida. Retornou
novamente ao P.S. devido à persistência e ao agravamento
da fraqueza muscular, com dificuldade inclusive para
alimentar-se sem ajuda.
Relatava episódios de diarréia precedendo tais
sintomas, mas com melhora naquele momento. Negava
antecedentes mórbidos e episódios prévios semelhantes.
Os exames laboratoriais realizados evidenciaram hipocalemia (K+= 2,3mmol/L), sem outras alterações (Tabela 1).
Apesar de adequada reposição endovenosa de
potássio, não houve melhora significativa após cinco dias.
Nessa ocasião, foi realizada gasometria venosa, que
constatou acidose metabólica hiperclorêmica (pH= 7,23;
pCO2= 28mmHg; Bic=11mmol/L; BE= -14mmol/L;
Na+= 141mmol/L; Cl-= 125mmol/L; ânion gap= 5mmol/L).
Como a paciente apresentava função renal normal,
não estava mais em vigência de diarréia e não fazia uso de
medicações em casa, aventou-se a hipótese de ATR como
causa da acidose metabólica hiperclorêmica. Para confirmação do diagnóstico, foram então dosados o pH e o
ânion gap urinários, cujos valores estão apresentados na
tabela 2. O valor do ânion gap urinário (AGU) sugeria o
diagnóstico de ATR tipo II e, ao realizar-se o teste do
bicarbonato, os resultados confirmaram tal diagnóstico
(Tabela 3).
A fim de verificar a existência de outras perdas
pelo túbulo distal, também foram dosados aminoacidúria, fosfatúria, uricosúria e glicosúria, constatando-se,
então, que a perda de bicarbonato ocorria de forma
isolada (Tabela 4). Iniciou-se o tratamento com citrato de
potássio.
A paciente segue, há dois anos, em acompanhamento no ambulatório de clínica médica, tendo
apresentado alguns episódios de hipocalemia grave,
sendo necessário internação para compensação do quadro.
Durante sua evolução, foram descartadas colagenoses
pela ausência de critérios clínicos e laboratoriais
sugestivos, sendo diagnosticado Doença de Hashimoto confirmada laboratorialmente pela dosagem dos autoanticorpos antitireoperoxidase e antitireoglobulina.
DISCUSSÃO
A apresentação de um quadro de acidose metabólica nem sempre é evidente, com clínica de taquidispnéia,
desidratação e hálito cetônico, conforme classicamente
descritos1. Como o caso relatado ilustra, algumas vezes
torna-se necessário investigação mais detalhada, com avaliação de gasometria arterial, perfil eletrolítico, cálculo de
gap osmolares e, principalmente, que seja considerada tal
hipótese diagnóstica frente ao achado de hipocalemia.
Diagnósticos diferenciais para acidose metabólica de
ânion gap normal ou hiperclorêmica
Ânion gap (AG) é o valor que representa um aumento de ânions não mensuráveis no plasma, sendo adota-
Tabela 1. Exames laboratoriais realizados na entrada
K+ =2,3 mmol/L
(VR=3,5-5,1 mmol/L)
Hb=13,2 g%
Na+=136 mmol/L
(VR=136-145 mmol/L)
Ht=40,2%
Ca T=9,2 mg/dL
(VR=8,9-10 mg/dL)
Plaq=456000 / mm3
(VR= 11,5-15g%)
(VR= 35-47%)
(VR=150000-400000/mm3)
Cr=1,0mg/dL
U=27mg/dL
(VR=0,6-1,1mg/dL)
(VR=10-50mg/dL)
Leuco=12500 mm3
( 0% /60,7% / 0,9%/ 0,1%/ 23,8%/ 14,5%)
(VR=4000-11000/mm3)
K+ = potássio sérico; Na+ = sódio sérico; CaT= cálcio total sérico; Cr= creatinina sérica; U= uréia sérica; Hb= hemoglobina; Ht= hematócrito; plaq=
plaquetas, leuco=leucócitos; VR= valor de referência.
Tabela 2. Valores do ph urinário e AGU
Ph urinário
K+ urinário
Na+ urinário
Cl- urinário
HCO3- urinário
Ânion gap urinário*
Tabela 3. Teste do Bicarbonato
7,26
14,4 mmol/L
(VR=25-125mmol/L)
102,60 mmol/L
(VR=40-220 mmol/L)
114,5 mmol/L
(VR=170-254 mmol/L)
8 mmol/L
(VR < 1 mmol/L)
- 5,5 mmol/L
K+= potássio; Na+ = sódio; Cl-=cloro; HCO3-= bicarbonato
* Para o cálculo do ânion gap urinário , foi utilizado o HCO3- na fórmula5.
J Bras Nefrol 2008;30(4):301-4
Ph sérico
HCO3- sérico
Antes da infusão
do bicarbonato
7,24
Após a infusão
do bicarbonato
7,35
10,5 mmol/L
17,9 mmol/l
Ph urinário
HCO3- urinário *
7,26
7,53
8 mmol/L
20 mmol/L
Creatinina urinária
188 mg/L
217 mg/L
Creatinina plasmática
0,79 mg/dL
0,79 mg/dL
Fração de excreção de
bicarbonato
3,3
40,6
*O bicarbonato urinário foi dosado através do método Potenciometria Indireta.
11-Galassi-1740-30(4)-AF
03.12.08
15:40
Page 303
303
Tabela 4. Exames investigatórios para Síndrome de Fanconi
Glicose urinária
Ácido úrico urinário
Fosfato urinário
Pesquisa de aminoácidos
na urina *
Negativa
0,41 g/24h (VR=0,25-0,75 g/24h)
0,73 g/24h ( VR=0,4-1,3g/24h)
Negativa
* fenilalanina, cetoácidos, tirosina e cistina.
dos como normais valores entre quatro e 12. Esses ânions
seriam os responsáveis pela acidose metabólica do tipo
ânion gap elevado, como ocorre na cetoacidose diabética,
na qual há um aumento de acetoácidos. Já na acidose metabólica com ânion gap normal, o que ocorre é uma perda
excessiva de HCO3- ou uma inabilidade em excretar H+1.
Alterações na excreção do HCO3- podem
representar tanto transtornos do trato gastrointestinal
quanto dos rins, ao passo que distúrbios na eliminação do
H+ sempre representam defeito renal1. As principais
causas de Acidose Metabólica com Ânion Gap normal
estão dispostas na Tabela 5.
A ATR distal ou tipo I caracteriza-se pela secreção
inadequada de prótons no túbulo distal. Ela pode resultar
de diminuição da atividade da H+ ATPase (ATR I secretora); aumento da permeabilidade da membrana luminal
(ATR I por difusão retrógrada) ou diminuição da
reabsorção distal de sódio (ATR I voltagem dependente)2.
A excreção de amônio (NH4-) encontra-se reduzida em
todas as formas de ATR I3, e deve-se suspeitar desta em
presença de acidose metabólica hiperclorêmica acompanhada de um AGU positivo e da incapacidade de
manter um pH urinário inferior a 5,5. O diagnóstico pode
ser feito através de uma prova de sobrecarga ácida com
cloreto de amônio2. Outros achados que sugerem ATR
distal são hipercalciúria, hipocitratúria e gradiente urinasangue de pCO2 maior que 24-29mmHg3.
A ATR proximal ou tipo II caracteriza-se por um
defeito na reabsorção tubular proximal de HCO3-,
determinando acidose metabólica hiperclorêmica. Como
esta porção do néfron é responsável pela reabsorção da
maior parte do HCO3- filtrado, a acidose tende a ser mais
acentuada e de difícil controle2-4.
A ATR tipo II pode ocorrer isoladamente ou
associada a outras doenças ou anomalias do túbulo proximal (TP), também podendo ser parte de um defeito
generalizado do transporte no TP, o que caracteriza a
Síndrome de Fanconi2,3. Se o diagnóstico da ATR tipo II
for realizado precocemente, observa-se um pH urinário
alcalino devido às perdas excessivas de HCO3-. Com o
passar do tempo, caem os níveis séricos de HCO3-, de tal
forma que o TP é capaz de reabsorver essa carga,
ocorrendo acidificação urinária normal. O diagnóstico
pode ser feito através de uma infusão lenta de bicarbonato
Tabela 5. Principais causas de acidose metabólica com ânion
gap normal
1-Hiperalimentação parenteral
2-Inibidor de anidrase carbônica
3-Acidose tubular renal
4-Insuficiência renal
5-Diarréia
6-Inibidores da aldosterona
7-Ureterostomia
8-Fístula biliar, entérica ou pancreática
9-Insuficiência adrenal
até a normalização do pH e do bicarbonato sérico,
esperando-se uma elevação do bicarbonato urinário, uma
vez ultrapassada a capacidade reabsortiva do TP2,3.
Acreditava-se que a excreção de NH4- seria invariavelmente aumentada em ATR II. No entanto, estudos
recentes encontraram valores reduzidos de excreção de
NH4+ em casos de ATR II, devido a dois mecanismos
principais: diminuição da síntese proximal ou shunt
excessivo para a veia renal. Como o AGU é um indicador
da excreção de amônio, nesses pacientes, o valor do
mesmo apresenta-se positivo. Assim sendo, deve-se ter
cautela ao excluir o diagnóstico de ATR proximal em um
paciente com AGU positivo. É importante salientar que o
cálculo da fração de excreção do bicarbonato urinário é o
teste mais fidedigno para o diagnóstico de ATR proximal3.
A ATR tipo IV caracteriza-se pela deficiência ou
resistência à ação da aldosterona, o que irá desencadear
hipercalemia e acidose metabólica5. O cálculo do AGU,
dado pela fórmula AGU= Na+ urinário + K+ urinário – Clurinário, pode auxiliar na diferenciação do mecanismo da
acidose metabólica hiperclorêmica1-3. Um AGU negativo
sugere perda gastrointestinal de HCO3-, ou defeito na
reabsorção tubular renal de HCO3-, e um AGU positivo
indica inabilidade na excreção de H+ ou deficiência na
excreção de NH4+1-3.
O valor do AGU sofre influência do pH urinário e
dos níveis de excreção e produção de amônio. Portanto,
Smulders e colaboradores3 sugerem que, para um cálculo
mais fidedigno do AGU, seja acrescentado o bicarbonato
urinário à fórmula, sempre que o pH urinário for maior
que 6,5mmol/L.
No caso relatado, apesar de o AGU sugerir o dano
proximal e de o teste do bicarbonato comprová-lo, não é
possível excluir o acometimento distal, uma vez que não
foram realizados o teste de acidificação urinária, dosagem
de citrato urinário e gradiente urina-sangue de pCO2. Tais
exames comprovariam o acometimento distal e classificariam o caso como ATR mista, ou afastariam tal hipótese.
Os achados de pH urinário elevado (mesmo com depleção
de bicarbonato sérico) e de hipercalciúria (Cálcio urinário
= 486,45mg/24h), ambos encontrados neste caso,
J Bras Nefrol 2008;30(4):301-4
11-Galassi-1740-30(4)-AF
03.12.08
15:40
Page 304
ATR em Paciente com Tireoidite de Hashimoto
304
sugerem a presença do componente distal, mas são
insuficientes para comprová-la.
Algumas mutações genéticas envolvidas na fisiopatologia da ATR já foram descritas, principalmente nos
casos de ATR familiar6, como as mutações autossômicas
recessivas da anidrase carbônica tipo II, enzima presente
no citossol do TP e TD7, que podem levar a uma síndrome
de ATR tipo I e II.
Embora a literatura descreva como rara a apresentação isolada da ATR1, a paciente em questão não apresentou doença do colágeno associada, assim como a
pesquisa para Síndrome de Fanconi foi negativa.
O tratamento da ATR deve ser feito com suplementos alcalinos. Deve-se prescrever uma quantidade de
álcalis suficiente para titular a produção ácida diária,
geralmente 0,5 a 2mmol/kg de peso por dia para ATR tipo
I e, 5 a 15mmol/kg de peso por dia para ATR II. Os álcalis
de potássio podem ser utilizados, caso a hipocalemia seja
um problema persistente, o que freqüentemente ocorre
nos casos de ATR II. A dose de álcalis deve ser aumentada
até que a acidose e a hipercalciúria sejam eliminadas8.
Existem, ainda, relatos de ATR tipo I associada à
Doença de Graves e Doença de Hashimoto, aventando um
mecanismo auto-imune para a doença2,8-11. No caso relatado, trata-se de ATR tipo II em paciente com Tireoidite
de Hashimoto, o que ratifica a necessidade de maiores
investigações sobre a fisiopatologia da ATR e sua relação
com hormônios tireoidianos. O que pudemos constatar,
durante esses dois anos de acompanhamento, é que o
tratamento convencional da tireoidite de Hashimoto, com
reposição da levotiroxina, não alterou o curso da ATR.
Em contrapartida, Drukker e colaboradores11 relataram um caso de ATR distal e hipotireoidismo, em que,
após três anos de tratamento com levotiroxina e reposição
de álcalis, a paciente não mais necessitou de reposição de
álcalis. Essa diferença de resposta ao tratamento pode
dever-se ao fato de a ATR II freqüentemente cursar com
acidose mais grave do que a ATR I, e não, necessariamente, significar que a falta do hormônio tireoidiano
não se relaciona ao desenvolvimento da ATR proximal.
CONCLUSÃO
Consideramos que, pela diversidade de apresentação do quadro clínico, devemos estar atentos para o diagnóstico de ATR, visando ao diagnóstico precoce e conseqüente instituição breve de terapia adequada, implicando
uma melhor qualidade de vida ao portador da doença.
Acreditamos ainda que, haja vista existir associação entre ATR e Doenças do Colágeno, tais pacientes
mereçam triagem para ATR, também no intuito de trata-
J Bras Nefrol 2008;30(4):301-4
mento precoce adequado e melhor recuperação. Conforme se estabeleça melhor a relação entre ATR e tireoidites,
bem como o papel do hormônio tireoidiano nos túbulos
renais, a investigação de ATR em pacientes com
tireoidopatia poderá vir a ser recomendada.
REFERÊNCIAS
1. Jeniffer J, Casaletto MD. Differential diagnosis of metabolic
acidosis. Emerg Med Clin AM. 2005;23:771-87.
2. Silva ACS, Lima CJCA, Souto MFO. Acidose tubular em
pediatria. J Bras
Nefrol. 2007;29:38-47.
3. Smulders YM, Frissen PH, Slaats EH, Silberbush J. Renal
tubular acidosis. Pathophysiology and diagnosis. Arch Intern
Med. 1996;156:1629-36.
4. Rodriguez-Soriano J. Renal tubular acidosis: the clinical
entity. J Am Soc Nephrol. 2002;13:2160-70.
5. Kelepouris E, Agus ZS. Overview of renal tubular acidosis.
UpToDate for clinicians [acesso em abr. 2007]. Disponível
em: http://www.uptodate.com.
6. Cheidd L, Vieira TC, Lima PRM, Saad ST, Heilberg IP. A novel
mutation in anion exchanger 1 gene is associated with
familial distal renal tubular acidosis and nephrocalcinosis.
Pediatrics. 2003;112:1361-7.
7. Laing CM, Toye AM, Capasso G, Unwin RJ. Renal tubular
acidosis: developments in our understanding of molecular
basis. Int J Biochem Cell Biol. 2005;37:1151-61.
8. Asplin JR, Coe FL. Distúrbios tubulares hereditários. In:
Harrison Braunwald, Fauci, Kasper, Hauser, Longo,
Jameson. Medicina interna. 15. ed. Rio de janeiro: Mc Graw
Hill; 2002. p. 1695-97.
9. Gaarder PI, Heier HE. A human autoantibody to renal
collecting duct cells associated with thyroid and gastric
autoimmunity and possibly renal tubular acidosis. Clin Exp
Immunol. 1983;51:29-37.
10. Pimentel Filho FR, Silva EMR, Kawahara MM, Bresgunov L,
Sagretti CA, Felício JS et al. Doença de Basedow Graves
associada à acidose tubular renal e paralisia tireotóxica:
relato de um caso e revisão da literatura. Arq Bras Endocrinol
Metabol. 1994;38:35-8 .
11. Drukker A, DolbergM, Landau H. Renal tubular acidosis in a
patient with hypothyroidism due to autoimmune thyroiditisimprovement with hormone replacement therapy. Int J Pediatr
Nephrol. 1982;3:205-9.