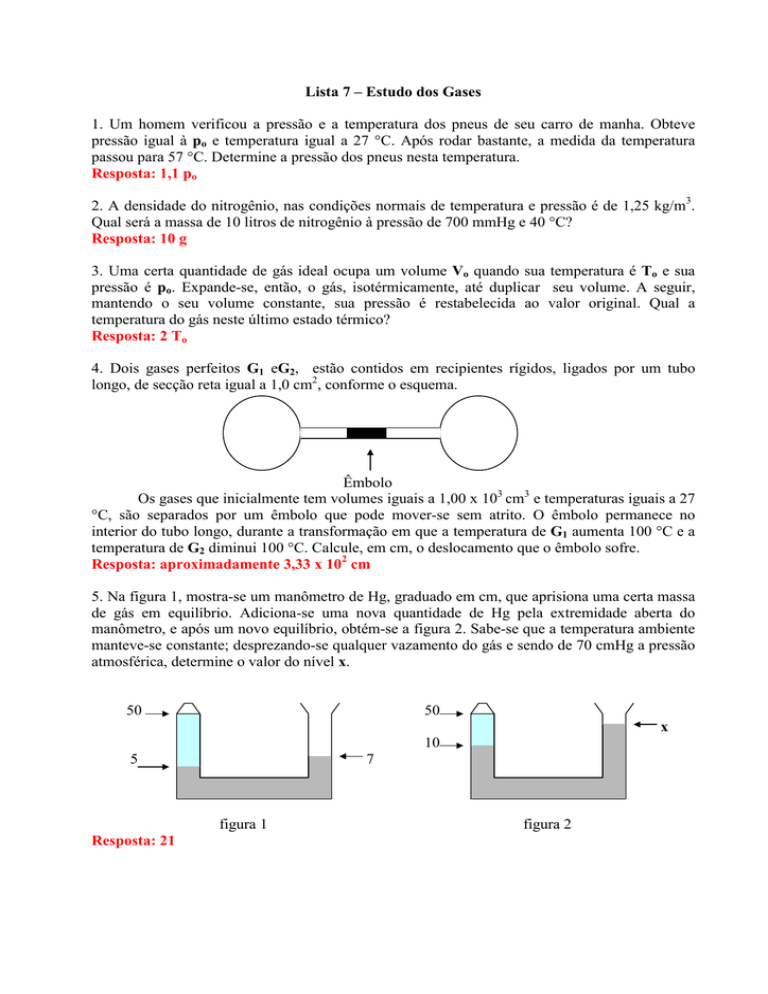
Lista 7 – Estudo dos Gases
1. Um homem verificou a pressão e a temperatura dos pneus de seu carro de manha. Obteve
pressão igual à po e temperatura igual a 27 °C. Após rodar bastante, a medida da temperatura
passou para 57 °C. Determine a pressão dos pneus nesta temperatura.
Resposta: 1,1 po
2. A densidade do nitrogênio, nas condições normais de temperatura e pressão é de 1,25 kg/m3.
Qual será a massa de 10 litros de nitrogênio à pressão de 700 mmHg e 40 °C?
Resposta: 10 g
3. Uma certa quantidade de gás ideal ocupa um volume Vo quando sua temperatura é To e sua
pressão é po. Expande-se, então, o gás, isotérmicamente, até duplicar seu volume. A seguir,
mantendo o seu volume constante, sua pressão é restabelecida ao valor original. Qual a
temperatura do gás neste último estado térmico?
Resposta: 2 To
4. Dois gases perfeitos G1 eG2, estão contidos em recipientes rígidos, ligados por um tubo
longo, de secção reta igual a 1,0 cm2, conforme o esquema.
G1
G2
Êmbolo
Os gases que inicialmente tem volumes iguais a 1,00 x 103 cm3 e temperaturas iguais a 27
°C, são separados por um êmbolo que pode mover-se sem atrito. O êmbolo permanece no
interior do tubo longo, durante a transformação em que a temperatura de G1 aumenta 100 °C e a
temperatura de G2 diminui 100 °C. Calcule, em cm, o deslocamento que o êmbolo sofre.
Resposta: aproximadamente 3,33 x 102 cm
5. Na figura 1, mostra-se um manômetro de Hg, graduado em cm, que aprisiona uma certa massa
de gás em equilíbrio. Adiciona-se uma nova quantidade de Hg pela extremidade aberta do
manômetro, e após um novo equilíbrio, obtém-se a figura 2. Sabe-se que a temperatura ambiente
manteve-se constante; desprezando-se qualquer vazamento do gás e sendo de 70 cmHg a pressão
atmosférica, determine o valor do nível x.
50
50
x
10
5
7
figura 1
Resposta: 21
figura 2
6. Um recipiente de capacidade 2 litros contém 0,02 mol de um gás perfeito a 27 °C. Mantendo o
volume constante e aquecendo-se o gás até 227 °C, determine as pressões inicial e final do gás.
Resposta: 0,246 atm e 0,41 atm
7. Observe o gráfico abaixo:
p (N/m2)
pA
A
pC
C
PB
B
VA
VB=VC
T3
T2
T1
V (m3)
A figura representa hipérboles eqüiláteras, diagramas pV = constantes, de um gás perfeito.
Ele sofre as transformações AB e Bc indicadas. Sabe-se que: VB = 2VA e T3 = 1,5 T1. Sendo
VA = 1,00 m3; pA = 2,00 x 103 N/m2 e TA = 200 K, determine pressões, volumes e temperaturas
do gás nos estados B e C.
Resposta: Estado B: 2 m3, 200 K, 1,00 x 103 N/m2
Estado C: 2 m3, 300 K, 1,5 x 103 N/m2
8. Um litro de ar nas CNTP tem massa de 1.293 g. Qual a massa deste ar sob pressão de
770 mmHg e 0 °C de temperatura?
Resposta: 1.310 g
9. Um recipiente está totalmente cheio de gás atmosférico nas CNTP. Sabendo que o recipiente
possui uma válvula de segurança cuja área da secção é de 5 cm2, sobre a qual descansa um
contrapeso de massa 9,81 kg, determine a temperatura que abrirá a válvula.
Resposta: aproximadamente 808 K
10. Da teoria cinética dos gases sabemos que: a temperatura absoluta de uma massa gasosa
corresponde à velocidade quadrática média das moléculas do gás. Se uma molécula de O2, de
massa 5,3 x 10-26 kg, está na superfície da Terra, com energia cinética correspondente a 0 °C, e
sendo a sua velocidade dirigida para cima, sem que colida com outras partículas durante a
subida, a que altitude ela chegará?
Resposta: aproximadamente 11 km