Renata Valadão Bittar – Medicina UNIT/ P3
1
PRÁTICAS LABORATORIAIS
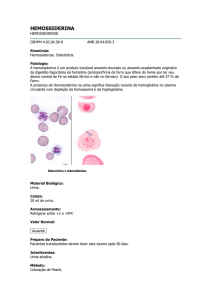
VHS (velocidade de hemossedimentação)
A) CONCEITO
É um teste simples que mede a velocidade de sedimentação das hemácias em um
tubo de vidro graduado (pipeta Westergren) num determinado período de tempo.
É inespecífico na detecção de processos inflamatórios, infecciosos ou neoplásicos.
Exame sensível e não específico.
Não mede viscosidade sanguínea.
É um exame complementar e sempre deve ser pedido junto ao hemograma e/ou
outros testes específicos.
B) FISIOPATOLOGIA
Em resposta à diferentes tipos de agressão (química, física ou biológica), o
organismo estrutura um processo inflamatório local, necessário para cura e
reconstituição dos tecidos afetados. Na fase aguda da inflamação ocorrem alterações
vasculares, humorais, neurológicas e celulares, manifestando-se por dor, calor, rubor,
edema e perda de função. A resposta de fase aguda (RFA), correspondente sistêmico
da
inflamação,
é
definida
pelas
alterações
metabólicas,
neuro-humorais
e
imunológicas, decorrentes da ativação de macrófagos e aumento da produção de
citocinas e outros mediadores. Clinicamente, a RFA pode ser caracterizada pela
presença de febre, anorexia, balanço hídrico positivo, leucocitose, anemia,
hiperglicemia, hipoalbuminemia, balanço nitrogenado negativo e aumento do VHS.
Independente da causa desencadeante, na RFA ocorre aumento da síntese
hepática e, consequentemente, dos níveis séricos das proteínas de fase aguda. Essas
proteínas, que incluem fibrinogênio, ferritina, proteína C reativa, haptoglobina,
ceruloplasmina, C3 e C4, a1-antitripsina e amilóide sérico A, aumentam de forma
proporcional à intensidade da agressão e da destruição tecidual. A sedimentação das
hemácias é facilitada por proteínas plasmáticas como o fibrinogênio, que neutraliza as
cargas negativas nas superfícies das hemácias, permitindo sua agregação sob forma
de empilhamento, mais do que de forma individual. Assim, na RFA o aumento do nível
sérico de fibrinogênio promove um aumento no VHS. Na RFA, a proteína C reativa é um
2
Renata Valadão Bittar – Medicina UNIT/ P3
exame laboratorial mais sensível, porque tem uma relação temporal muito estreita com
os níveis de IL-6 e outros marcadores da inflamação, como o fibrinogênio.
Entretanto, o VHS pode permanecer dentro da faixa normal, mesmo na vigência
de inflamação, devido a condições prévias do paciente, incluindo poliglobulia e
hemoglobinopatias.
Além disso, pacientes com hemólise ou coagulação intravascular disseminada
podem ter VHS normal, devido à redução de haptoglobina ou de fibrinogênio. Outros
fatores que a influenciam são menor síntese (insuficiência hepática) ou o aumento das
perdas (intestinal ou renal) de proteínas de fase aguda. Assim, os valores do VHS resultam
de tendências opostas, sendo muitas vezes necessária a determinação concomitante
da VHS e de diversas proteínas séricas.
A normalização do VHS pode ser um marcador de boa resposta ao tratamento
de doenças subagudas e crônicas como tuberculose, endocardite, mieloma múltiplo,
linfomas e doenças reumáticas, além de alguns tipos de câncer
O empilhamento das hemácias é característico e determinador na lâmina como
o fenômeno de Rouleaux
Resumindo: na inflamação há o aumento de proteínas de fase aguda,
produzidas pelo fígado, como o fibrinogênio e a proteína C reativa. As hemácias
possuem carga negativa e, por terem carga igual, tendem a se repelir. Essas proteínas
de defesa alteram a polaridade da membrana de algumas hemácias que e têm a
carga negativa neutralizada, fazendo com que estas passem a se atraírem umas pelas
outras (os opostos se atraem). Por sua vez, essas proteínas que se atraem se agregarão,
na forma de um empilhamento, e a sedimentação terá uma velocidade maior.
3
Renata Valadão Bittar – Medicina UNIT/ P3
OBS: o VHS só poderá estar alterado em infecções de origem bacteriana. As
viroses não causam modificação da carga das hemácias.
C) INDICAÇÕES
Avaliação do grau de atividade ou da extensão da doença de base
Avaliar as condições de saúde ou de doença
Diagnóstico e avaliação clínica de doenças como artrite reumatoide,
lúpus eritematoso sistêmico e doença reumatoide
Avaliar a gravidade/intensidade de patologias
Avaliar a resposta terapêutica instituída
D) MÉTODO DE REALIZAÇÃO
Jejum: 4 horas
Coletar sangue com EDTA (anticoagulante)
Homogeneizar o material e encher a pipeta de Westergren, acertando
na marca “0”;
Colocar na estante ou coluna apropriada para VHS;
Anotar o número do paciente em frente da pipeta;
Efetuar a leitura após uma hora, marcar mais 1 hora e depois ler a
segunda hora (fazer a leitura em mm cúbicos após uma hora e duas
horas ao nível de separação do plasma e hemácias).
E) O QUE PODE INFLUENCIAR O RESULTADO DESSE EXAME?
Dietas hiperproteicas (falso-positivo)
Ausência de jejum prévio à coleta
Anemia ferropênica: déficit de ferro = redução da quantidade de
sangue. A menor quantidade de hemácias faz com que a
sedimentação ocorra com maior velocidade.
Anemia falciforme: há uma deformação das hemácias que não
circulam adequadamente na microcirculação, obstruem vasos e são
destruídas precocemente e, mediante a lise celular, há eliminação da
hemoglobina livre, uma proteína. Esse aumento de proteínas
plasmáticas diminui a velocidade de hemossedimentação.
4
Renata Valadão Bittar – Medicina UNIT/ P3
Gravidez e a idade avançada podem ser causas não patológicas de
alteração
F) RELAÇÃO DO VHS COM A PCR
O aumento da PCR ocorre precocemente nas doenças inflamatórias e atinge um pico
entre 24 a 48 horas após o início da infecção. Quando se compara proteína C reativa
com VHS, o seu aparecimento no soro é mais precoce do que a elevação da VHS, ou
seja, a PCR é um exame mais sensível que o VHS.
Ao contrário da VHS, a dosagem da PCR não sofre interferência da presença de
anemia, policitemia, esferocitose, macrocitose, insuficiência cardíaca congestiva ou de
hipergamaglobulinemia.
Quando a PCR está elevada durante um processo inflamatório agudo, o seu valor
acompanha a situação clínica. Após um período de alguns dias, os valores elevados
começam a descer e retomam os níveis saudáveis, normais baixos, quando o processo
inflamatório já não existe. No entanto, o VHS pode encontrar-se elevado sem uma causa
inflamatória diagnosticada. Em idosos, um VHS ligeiramente aumentado pode ser
compatível com bom estado de saúde durante período prolongado de tempo.
Conclui-se que não existe teste único ideal para detectar inflamação, utilizando-se
muitas vezes múltiplas dosagens de PCR e de VHS. A interpretação levará em conta
vários fatores, dentre os quais o perfil temporal das variações e o contexto clínico.
PCR (proteína C reativa)
A) CONCEITO
A proteína C reativa (PCR) é uma das proteínas de fase aguda (PFA) que é sintetizada
pelos hepatócitos.
Seu papel como proteína de fase aguda decorre do fato de estar presente em muitos
pontos da via inflamatória. Ela eleva a fagocitose de partículas antigênicas e de
micro-organismos, ativando a via clássica do complemento.
Outra função seria a ligação e ativação seletiva das células T citotóxicas.
Renata Valadão Bittar – Medicina UNIT/ P3
5
B) FISIOPATOLOGIA
Proteínas de fase aguda são aquelas cuja concentração sérica aumenta ou diminui
pelo menos 25% durante estados inflamatórios. No entanto, apesar do nome, elas
também podem sofrer alterações durante processos inflamatórios crônicos.
Sua formação é estimulada pelas Interleucinas IL-l e IL-6, liberadas por macrófagos após
a fagocitose do antígeno.
A secreção é predominantemente hepática e começa 4 a 6 horas após o estímulo;
duplica a cada 8 horas e atinge o pico entre 36 e 50 horas. A PCR tem meia vida
plasmática de 19 horas e mesmo após estímulo único, como trauma ou cirurgia, pode
levar vários dias até retornar a níveis basais.
A dosagem da PCR é, portanto, determinação direta de uma PFA e na presença de
quadros inflamatórios suas concentrações séricas alteram-se mais rapidamente e sua
variação é mais ampla que a da VHS.
Em pós-operatório apresentam maior sensibilidade para detectar complicações do que
elevações de VHS, de leucócitos, de frequência cardíaca ou do aparecimento de
febre.
Ao contrário da VHS, a dosagem da PCR não sofre interferência da presença de
anemia, policitemia, esferocitose, macrocitose, insuficiência cardíaca congestiva ou de
hipergamaglobulinemia. Essas características têm levado a um incremento do seu uso
em detrimento da VHS, apesar da maior experiência e familiaridade com esse último
teste.
Ocorrem elevações não só em infecção, mas na presença de inflamação sistêmica por
artrite reumatoide, no infarto do miocárdio, na pancreatite necrotizante, em
politraumatismos, em neoplasias, em vasculites e até possivelmente em alguns casos de
síndrome serotoninérgica, para citar apenas algumas situações.
OBS: as concentrações séricas de PCR aumentam significativamente mediante infecções de
origem bacteriana, logo, são mais sensíveis (sensibilidade de 80 a 85%) a esses tipos de patógenos.
Entretanto, infecções virais graves também podem acarretar elevações desse valor.
OBS: PCR ULTRA- SENSÍVEL
Atualmente existe um método ultrassensível (US) para a dosagem de PCR. Ele mede
exatamente a mesma PCR que o exame convencional, mas é capaz de detectar
concentrações muito menores da PCR (limite de detecção - 0,03 mg/L).
A PCRus tem sido consistentemente associada a risco cardiovascular, e sua
determinação parece ser de utilidade na estratificação do risco de eventos
coronarianos, porém essa determinação para estimativa do risco cardiovascular não se
aplica a indivíduos fumantes, obesos, diabéticos, ou em uso de estrógenos ou
antiinflamatórios, ou à presença de infecções.
C) INDICAÇÕES
Diagnosticar e avaliar precocemente processos inflamatórios e infecciosos
Detectar precocemente complicações pós-cirúrgicas
Monitorização da resposta terapêutica à antibioticoterapia em infecções
bacterianas
Renata Valadão Bittar – Medicina UNIT/ P3
6
O acompanhamento da resposta terapêutica na artrite reumatoide
O diagnóstico diferencial entre infecção e rejeição em pacientes submetidos a
transplante de medula
Auxiliar na estratificação do risco cardiovascular
Leucograma
OBS: o hemograma estuda as células sanguíneas (hemácias, leucócitos e
plaquetas) e patologias ligadas ao mesmo.
Está dividido em: eritrograma, leucograma e plaquetograma.
a) CONCEITO
Seção do hemograma em que os leucócitos são identificados, contados e avaliados
morfologicamente.
Contagem global dos leucócitos (4000 - 10000 /mm3)
Estudo Quantitativo – contagem diferencial
Estudo Qualitativo – alterações estruturais no citoplasma e no núcleo – alterações
funcionais
WBC: Nº total de leucócitos
Neutrófilos bastões (0 a 4% ou 5%)
Neutrófilos segmentados (40% a 70%)
Linfócitos (20% a 40 %)
Monócitos (2% a 8%)
Eosinófilos (1% a 5%)
Basófilos (0 a 1%).
Leucóticos: defesa do organismo frente a estados patológicos circulam no sangue
periférico, sendo distribuídos pela medula óssea (granulócitos, alguns linfócitos e
monócitos) E órgãos linfáticos (maioria dos linfócitos): baço, timo, linfonodos, tecido
linfóide intestinal (placas de Peyer). No Sistema Monocítico Fagocitário encontram-se os
monócitos circulantes e macrófagos.
Granulócitos
(PMN)
65%
Agranulócitos
(Mononucleares)
35%
NEUTRÓFILOS:
Neutrófilos
Basófilos (bastonetes e segmentados)
Eosinófilos
Linfócitos T e B
Monócitos
7
Renata Valadão Bittar – Medicina UNIT/ P3
São microfagócitos, que englobam bactérias e pequenas partículas. Atuam
especialmente nos processos inflamatórios e bacterianos. Sua produção é estimulada
(em 2-3 dias) a partir do consumo periférico destas células (granulopoetinas secretadas
por macrófagos). Predominante na inflamação aguda.
Prómielócito Mielócitos Metamielócito Bastonetes Segmentados
Correspondem a diferentes fases de maturação do neutrófilo na medula óssea e
sangue.
Na medula: 2/3 de bastonetes
Na corrente sanguínea: 40 a 70% dos leucócitos totais são segmentados (0 a 6% são
bastonetes)
Número de neutrófilos do sangue: representa o trânsito medula tecidos.
Na infecção bacteriana há uma grande necessidade de recrutamento de neutrófilos.
Logo, as células jovens não terão tempo de se maturar e precisarão sair da medula
óssea e seguir para a corrente sanguínea. Essas células têm uma capacidade reduzida
de fagocitose e defesa imunológica. Nesse momento, pode-se notar a presença de
bastonetes (desvio à esquerda) e blastos, levando a hipótese de uma intensa infecção
bacteriana que não está conseguindo ser debelada com as células da primeira linha
de defesa.
Quando há comprometimento das 3 linhagens do hemograma (pancitopenia), devese investigar a medula óssea através do mielograma e suspeitar de patologias, como a
leucemia linfoide aguda. Há também outras desordens que desencadeiam uma
pancitopenia.
Renata Valadão Bittar – Medicina UNIT/ P3
8
EOSINÓFILOS
Sua função principal é a desintoxicação; inativam a histamina ou substâncias
semelhantes. Surgem após a “degranulação” dos basófilos e mastócitos teciduais.
Predominante em processos alérgicos, hipersensibilidade e parasitoses.
O estresse bacteriano estimula a liberação de cortisol que, por sua vez, sequestra os
eosinófilos, como consequência secundária. Logo, nos casos de infecções bacterianas,
há eosinopenia.
BASÓFILOS
Exercem função semelhante aos mastócitos teciduais, ao liberarem histamina no local
lesado, desencadeando uma reação inflamatória. Os seus grânulos possuem heparina,
para prevenir a coagulação do sangue no ponto da infecção. Atuam como
estimulantes da ação plaquetária (liberando um fator ativador) e dos eosinófilos (Fator
Quimiotáxico Eosinofílico da Anafilaxia – FQE-A).
MONÓCITOS
São macrófagos. Removem partículas maiores e restos teciduais, principalmente nos
processos inflamatórios crônicos. Secretam substâncias proteolíticas, interferon,
interleucina-1, prostaglandinas e outras. Lançam granulopoetina que atrai neutrófilos.
Processam antígenos e apresentam aos linfócitos.
Quando os monócitos são recrutados, significa que a batalha está mais difícil.
LINFÓCITOS
Os precursores destas células são formados na medula óssea, durante a vida fetal.
Existem os linfócitos Timo-dependentes (linfócitos T), produzidos na medula óssea (vida
fetal) e amadurecidos no Timo, os quais são responsáveis pela imunidade celular e os
linfócitos Timo independentes, provenientes da Bolsa de Fabrícius (aves) ou medula
óssea nos mamíferos (linfócitos b), que atuam na produção de anticorpos e se
diferenciam em plasmócitos, quando ativados. Os dois tipos de linfócitos (T e b) são
morfologicamente indistinguíveis.
B) TERMOS TÉCNICOS
Leucopenia - Leucocitose
Neutropenia - Neutrofilia
Linfopenia - Linfocitose
Atipías linfocitárias
Renata Valadão Bittar – Medicina UNIT/ P3
9
Plaquetopenias – Plaquetofilia
Eosinopenia - Eosiofilia
Monocitopenia – Monocitose
Basopenia - Basofilia
C) FATORES QUE INFLUENCIAM NO RESULTADO
Coleta
Raça do paciente: negros apresentam neutropenia racial
Idade do paciente: até 6-8 anos: nº de linfócitos > neutrófilos
Fumo: leucocitose
Obesidade: leucocitose
Doses elevadas de café: leucocitose
Estresse (em decorrência da liberação de epinefrina): leucocitose, neutrofilia,
eosinopenia, linfocitopenia e monocitose.
Aumento da FC, PA, exercícios intensos, digestão e medo: leucocitose
D) ALTERAÇÕES QUE PODEM SER ENCONTRADAS
Granulações tóxicas
As granulações tóxicas são pequenas formações em grânulos que aparecem no
citoplasma dos neutrófilos e refletem uma perturbação da maturação dos
mesmos, com persistência dos grânulos azurófilos nos estádios celulares maduros,
ou podem ainda ser o resultado da endocitose de agentes tóxicos (bactérias,
proteínas séricas desnaturadas) com formação de novos grânulos anormais. O
termo "tóxico" é usado para indicar o estado de funcionamento de muitas
células, que ocorre numa variedade de doenças como infecções sistêmicas,
câncer, pneumonia, coma diabético ou hepático, toxemia da gravidez,
envenenamento químico e em estados tóxicos.
Resposta medular acelerada a uma infecção, inflamação, queimadura etc,
com provável redução no número de mitoses nas células jovens
O neutrófilo faz fagocitose dos patógenos e lança enzimas citotóxicas, como a
peroxidase
Vacúolos/Vacuolizações tóxicas
Vacúolos citoplasmáticos; áreas circulares não coradas
Origem: fagolisossomas
Significam fagocitose de bactérias com grande atividade lisossômica
Organismo está perdendo a batalha.
Desvio à esquerda:
Aumento do número de bastonetes no sangue, tradicionalmente considerado
um indicador de infecção. Também podem surgir mielócitos ou metamielócitos.
Corresponde à quebra da hierarquia de liberação dos neutrófilos da reserva
granulocítica medular para o sangue.
Aumento de neutrófilos segmentados (jovens) na circulação periférica
Renata Valadão Bittar – Medicina UNIT/ P3
10
Leucocitose
Fisiológicos: estresse, exercícios físicos intensos, aumento da PA e FC, medo,
digestão...
Patológicos: infecção bacteriana, doenças metabólicas, agentes químicos,
leucemias, queimaduras, hemorragias, infarto, traumas, necroses...
Neutrofilia
Fisiológica: medo, esforço físico intenso, aumento da PA...)
Patológica: infecções bacterianas
Eosinofilia
Processos alérgicos, parasitoses (larvas), leucemia granulofítica eosinofílica,
reações anafiláticas, doenças de pele...
Basofilia
Associado a eosinofilia, leucemia granulofítica eosinofílica
Monocitose
Processos crônicos, abscessos, micoses (fungos), algumas bacterioses como
erisipela
Linfocitose
Vacinações (estímulo antigênico), leucemia linfocítica, processos crônicos, hipo
ou hiperadrenocorticismo
Leucopenia
Viroses, agentes físicos, químicos...
Neutropenia
Viroses
Eosinopenia
Processos infecciosos agudos, após administração de corticoides...
Basopenia
Não existe = achado fisiológicos
Monopenia
Não tem significação clínica
Linfocitopenia
Algumas viroses, estresse (cortisol), administração de drogas corticoesteroides e
imunossupressoras
Atipias Linfocitárias
Linfócitos não realizam fagocitose e, por isso, modificam a sua morfologia como
forma de defesa. É preocupante quando há porcentagem maior que 5% de
linfócitos atípicos. Acontece, por exemplo, na mononucleose, HIV, dengue...
E) FASES DA RESPOSTA LEUCOCITÁRIA
Nos processos tóxicos e infecciosos, os neutrófilos são os primeiros a reagirem,
depois os monócitos e os linfócitos
Renata Valadão Bittar – Medicina UNIT/ P3
11
Fase Neutrofílica ou de luta: Período inicial e agudo da infecção – observa-se:
leucocitose, neutrofilia, desvio à esquerda, anaeosinofilia, monocitopenia e
linfocitose
Fase Monocítica ou de Defesa: Período de vencimento ocorre: diminuição da
leucocitose, da neutrofilia e desvio à esquerda, reaparecimento dos eosinófilos,
linfócitos diminuÍdos ou normais e monocitose.
Fase Linfocítica ou de Cura: Período de convalescença, se verifica: diminuição
ou desaparecimento da leucocitose, < da neutrofilia, não mais desvio à
esquerda, linfocitose, eosinofilia e monócitos normais ou aumentados
F) INFECÇÕES BACTERIANAS OU VIRAIS?
Hemograma nas infecções Bacterianas:
WBC: aumentados
Nº de neutrófilos: aumentados
Nº de bastões: aumentados (desvio a esquerda)
Nº de linfócitos: diminuídos.
Ausência de eosinófilos.
Aumento de monócitos.
Leucocitoses;
Neutrofilias;
Eosinopenia;
Linfopenia
Monocitoses (alguns casos).
Infecção bacteriana nas fases aguda:
Neutrófilos saem para o combate;
Fagocitose de bactérias;
Granulações tóxicas;
Aumento de bastões;
Somem os eosinófilos da circulação.
Vacúolos citoplasmáticos
Infecção bacteriana na fase crônica:
Neutrofilias;
Monocitoses;
Eosinopenia;
Granulações tóxicas;
Vacúolos citoplasmáticos.
Renata Valadão Bittar – Medicina UNIT/ P3
12
(Continua com todas as alterações da infecção aguda + a entrada dos
monócitos)
Fase de cura:
Neutrófilos e Monócitos voltam ao valor de referência;
Linfócitos estimulam a formação de uma defesa mais potente;
Voltam os eosinófilos a circulação.
Hemograma nas viroses:
Diminuição do número de leucócitos;
Diminuição do número de neutrófilos;
Aumento do número de linfócitos;
Diminuição do número de plaquetas (em alguns casos);
Leucopenia;
Neutropenia;
Linfocitoses;
Atipías linfocitárias;
Plaquetopenias.
OBS: neutrófilos não agem contra vírus.
Renata Valadão Bittar – Medicina UNIT/ P3
13
Exemplo: Infecção Bacteriana
Leucocitose
Neutrofilia
Desvio à esquerda
Contagem normal de linfócitos
Monocitose
Sinal de fagocitose de patógenos
OBS: LEUCOGRAMA NA DENGUE
Leucopenia no máximo após 5 ou 6 dias de infecção;
Destruição induzida por vírus;
Inibição das células precursoras mieloides;
Maior aderência dos neutrófilos as células endoteliais lesadas.
Trombocitopenia: 5º a 7º dia após os sintomas:
*Depressão medular;
*Anticorpo anti plaquetas.
*Infecção do megacariócito pelo vírus.
Monocitose (atipias);
Aumento de 20% do hematócrito;
Alterações bioquímicas (TGO, TGP, GGT)
Alteração de Protrombina
Renata Valadão Bittar – Medicina UNIT/ P3
14
Uroanálise
A) CONCEITO
Sumário de urina: estuda os elementos normais do sedimento urinário e
patologias do trato renal.
Está dividido em parte física, química e microscópica, que é a análise do
sedimento urinário.
B) COMPOSIÇÃO
Coleta da urina: Importância da realização das etapas pré-analíticas
Asseio antes de colher a urina com água e sabão
Coletar o jato médio, desprezando o primeiro e último jato
Coletores estéreis e identificados com o nome do paciente
Tempo de entrega da amostra o mais rápido possível e sua análise em até 1 hora
Conservação da amostra.
1. Caracteres gerais: determinar as características físicas da urina
2. Pesquisa de elementos anormais: pesquisa química de substâncias na urina
3. Sedimentoscopia: exame microscópico do sedimento urinário
Composição da urina:
A composição da urina é muito variável, dependendo da dieta, estado
nutricional, do metabolismo, atividade física, função renal e função endócrina.
A urina é uma mistura complexa constituída 96% de água e 4% de substâncias
diversas provenientes da alimentação e do metabolismo como uréia, creatinina,
ácido úrico, células, cristais, muco, cálcio, clorestos, fosfato, sulfato etc.
1. Exame físico da urina (caracteres gerais):
a) Coloração
Normalmente, a urina tem cor amarela, resultante da excreção de 3
pigmentos: urocromo (amarelo), uroeritrina (vermelho) e urobilina (laranja),
que são originados no metabolismo normal do organismo.
A intensidade da cor da urina está relacionada com a concentração da
amostra. Uma urina mais clara pode ser observada com a ingestão
aumentada de líquidos, enquanto que a privação de líquidos proporciona a
excreção de uma urina mais escura e concentrada em solutos. Então, a urina
pode indicar a concentração urinária e o grau de hidratação da pessoa.
Varia desde a quase ausência de cor até tonalidades escuras. Estas
variações podem ser devidas as funções metabólicas normais, atividade
física, substâncias ingeridas ou patologias.
Renata Valadão Bittar – Medicina UNIT/ P3
15
Cor normal:
Varia do amarelo claro ao amarelo escuro.
b) Âmbar: Pode indicar bilirrubina;
c) Verde ou azul: medicamentos;
d) Avermelhada/rosada : presença de sangue
b) Aspecto da urina:
Normalmente, a urina tem um aspecto claro e transparente logo após a sua
emissão. Com o passar do tempo, ela tende a ficar mais turva pela presença de
muco e precipitação de cristais amorfos (fosfatos e uratos). Bactérias, piócitos,
hemácias, cilindros e cristais diversos podem ocasionar turbidez na urina.
Límpida é o normal.
Pode variar do ligeiramente turva a muito turva.
Turvação: Cristais, células, leucócitos, bactérias, muco, cilindros, leveduras.
OBS: nem sempre uma urina límpida é normal.
c) Cheiro
O cheiro normal da urina é característico, “sui generis”, ocasionado pela
presença de ácidos aromáticos voláteis. Com o envelhecimento, a urina
adquire um odor forte de amoníaco pela transformação bacteriana da ureia
em amônia. Infecções do trato urinário tornam o odor da urina pútrido. A
urina contendo corpos cetônicos tem um odor de acetona ou de frutas.
Odores anormais podem ser encontrados em situações de anormalidades
do metabolismo dos aminoácidos como na fenilcetonúria e outras.
d) Densidade
A densidade normal da urina varia de 1,010 a 1,030 e ela indica a concentração
de sólidos totais dissolvidos na urina. A densidade urinária varia com o volume
urinário e com a quantidade de solutos excretados, principalmente cloreto de
sódio e ureia. Deste modo, a densidade é um bom indicador do estado de
hidratação/desidratação do paciente.
Pode ser observada através do refratômetro ou nas fitas urinárias.
Dibetes Mellitus podem desencadear uma urina de alta densidade pela
presença de glicose (glicosúria).
Nos casos de pré-eclâmpsia, há aumento da densidade pela proteinúria
característica da desordem.
Na Diabetes Insipidus, há baixa densidade pela excreção de grandes volumes
urinários.
Nas doenças renais há redução da taxa de filtração glomerular e aumento das
concentrações séricas dos solutos, logo, a densidade diminui pela perda da
capacidade de concentração urinária.
e) Volume urinário:
Depende da quantidade excretada pelos rins. Em 24 horas deve ser excretado em torno
de 1200 a 1500 ml de urina.
Renata Valadão Bittar – Medicina UNIT/ P3
16
2. Pesquisa Química
Nessa etapa do exame de urina são realizadas as pesquisas de elementos
anormais que podem ser excretados com a urina. Alguns elementos indicam
alterações referentes a doenças do trato urinário enquanto que os outros vão
indicar alterações do metabolismo. Para se fazer a pesquisa dos elementos
anormais, utiliza-se uma amostra de urina homogeinezada, não centrifugada e
sem a adição de conservantes.
a)
Exame químico da urina: tiras ou fitas reagentes
Glicose
PH
Proteínas
Corpos cetônicos
Bilirrubinas
Urobilinogênio
Nitrito
Densidade
Leucócitos
Hemoglobina
Glicosúria:
Quando a glicose sanguínea ultrapassa o limiar renal ( 160 a 180 mg/dl) vai ser
detectada na urina.
OBS: É necessário o uso de tiras reagentes de marca confiável para evitar reações falso
positivas.
Cetonas:
Incapacidade de metabolizar carboidratos, aumento da perda de carboidratos por
vômitos, ingestão insuficiente de carboidratos e redução do peso.
A cetonúria demonstra deficiência de insulina e a necessidade de reajustes.
Provoca desequilíbrio eletrolítico, desidratação, acidose e até o coma diabético.
Proteínas:
A presença de proteínas no exame de urina não é normal.
A proteinúria muitas vezes reflete doença renal e deve ser investigada.
Quando existe algum comprometimento renal, geralmente vem acompanhada de
cilindros no sedimento urinário
Significado clínico da proteinúria:
Lesão de membrana glomerular ou reabsorção tubular;
Mieloma múltiplo
Nefropatia diabética;
Pré-eclâmpsia;
Proteinúria ortostática.
Sangue:
Hematúria (hemácias íntegras) ou Hemoglobinúria (hemácias destruídas).
Principais causas de hematúria: cálculos renais, traumatismos, doenças glomerulares,
tumores, pielonefrites, exercício físico intenso.
Principais causas de hemoglobinúria: anemias hemolíticas, reações transfusionais,
queimaduras graves, exercício físico intenso.
OBS: hematúria isolada no sumário de urina = litíase renal (cálculos renais)
Bilirrubinas : Indicação de hepatopatias.
Urobilinogênio: Resultante da transformação sofrida pela BD, do fígado para o intestino,
a partir da redução da bilirrubina pelas bactérias intestinais.
Também é indicativo de patologias hepáticas.
17
Renata Valadão Bittar – Medicina UNIT/ P3
Nitrito: Infecções do trato urinário por bactérias gram negativas.
Geralmente vem acompanhada por bacteriúria no sedimento urinário.
OBS: nitrito “+” = bactérias gram negativas/ nitrito ausente = bactérias gram positivas
b) pH urinário
Reflete a capacidade dos rins em manter a concentração dos íons hidrogênio
[H+] no plasma e nos líquidos extracelulares. No metabolismo normal há
formação de ácidos não voláteis (ácido sulfúrico, fosfórico, clorídrico, pirúvico,
lático, cítrico, corpos cetônicos) que serão excretados pelos rins como cátions,
cujo mais importante é o sódio. O bicarbonato é reabsorvido e as células
tubulares trocam íons hidrogênio por sódio do filtrado glomerular e através dessa
reação a urina torna-se ácida. Os íons hidrogênio também são excretados na
forma de íons amônio [NH4].
Indica distúrbios resultantes da incapacidade renal de produzir ou reabsorver
ácidos ou bases.
O conhecimento do PH urinário é importante na identificação dos cristais
urinários.
Urinas com PH acima de 9 podem indicar má conservação da urina.
A urina recém emitida tem um pH normal próximo de 6. Este valor tende a
aumentar pela ação das bactérias sobre a ureia formando amônia, quando a
análise é feita logo após a micção. Assim, uma urina de pH alcalino quase
sempre indica uma conservação e/ou manipulação inadequadas. Nesses
casos, deve-se solicitar uma nova amostra ao paciente. No entanto, uma
amostra fresca com pH alcalino pode significar uma infecção urinária, que
poderá ser confirmada pela presença de bactérias, piócitos e testes químicos
(nitrito e leucócito esterase).
A determinação do pH da urina é útil também para identificação de cristais no
sedimento urinário. Cristais de oxalato de cálcio, ácido úrico, urato amorfo são
normalmente encontradas em urinas ácidas, enquanto que cristais de fosfato
amorfo, fosfato triplo, carbonato de cálcio são associados a urinas alcalinas.
Urina ácida:
Dieta hiperproteica e por algumas frutas
DM, inanição, doenças respiratórias, anormalidade de secreção e reabsorção
de ácidos e bases pelas células tubulares.
Acidificação da urina no tratamento de determinados cálculos urinários pelo uso
de cloreto de amônio, metionina, fosfatos ácidos etc.
Urina Alcalina:
Dieta rica em frutas e vegetais diversos
Alcalose metabólica, hiperventilação respiratória e após vômitos
Alcalinização da urina no tratamento de determinados cálculos urinários pelo
uso de bicarbonato de sódio, citrato de potássio e acetozalamida
Medidas do pH:
As tiras reativas utilizam um sistema triplo de indicador, apresentando uma variação de
pH de 5 a 9.
3. Sedimentoscopia
Exame microscópico do sedimento urinário, compreendendo observação,
identificação e quantificação de todo material insolúvel presente na amostra
Renata Valadão Bittar – Medicina UNIT/ P3
18
(leucócitos, hemácias, células epiteliais, cilindros, cristais, flora bacteriana, muco,
leveduras, parasitas, espermatozoides, artefatos)
É de suma importância para o diagnósticos, prognóstico e constatação de cura
de diversas patologias renais porque fornece informações sobre a integridade
anatômica dos rins.
A sedimentoscopia confirma se o que a fita apresentou é verdadeiro ou não.
Finalização do exame urinário.
Análise microscópica dos elementos encontrados na urina.
Todo sedimento urinário deve conter a presença de algumas células epiteliais.
Além das células, o sedimento normal contém alguns leucócitos distribuídos nos
campos observados.
A presença de um número elevados de leucócitos no sedimento já é indicativo
de infecção urinária.
A presença de hemácias confirma um achado de hematúria no exame da fita
de urina.
Conclusão: A análise do sedimento urinário deve ser uma confirmação dos
achados no exame físico e químico da urina.
1. Hemácias
Confirma hematúria
2. Leucócitos
Confirma infecção bacteriana
3. Células epiteliais
Normalmente, vários tipos de células são encontrados no sedimento devido à
descamação normal das células velhas que recobrem o epitélio do trato urinário
e genital. Algumas células epiteliais eliminadas na urina podem indicar
processos inflamatórios ou doenças renais.
4. Cilindros
São os únicos elementos exclusivamente renais encontrados no sedimento
urinário.
Os tipos diferentes de cilindros encontrados nos sedimentos urinários representam
diferentes quadros clínicos do paciente.
Os cilindros hialinos em pequenas quantidades são os únicos considerados
normais.
Os outros tipos de cilindros são patológicos e indicam comprometimento renal
Cilindro Hemático: Glomerulonefrite, exercício físico intenso.
Cilindro Leucocitário: Pielonefrite.
Cilindros granulares: Glomerulonefrite ou Pielonefrite.
5. Cristais
É comum encontra-los na urina.
São formados a partir da precipitação de sais de urina submetidos a alterações
de PH, temperatura ou concentração.
Existem os cristais normais em urinas ácidas e alcalinas e os cristais patológicos.
A presença de cristais na urina é muito comum, mas de um modo geral, o
significado clínico é limitado. A identificação dos cristais é importante para a
investigação de doenças hepáticas, dos erros inatos do metabolismo, litíase
renal e de determinadas alterações metabólicas.
Cristais normais em urinas ácidas:
Ácido úrico, oxalato de cálcio, uratos amorfos.
Urinas alcalinas:
Fosfato triplo, fosfatos amorfos fosfato de cálcio.
Cristais anormais
Cistina
Renata Valadão Bittar – Medicina UNIT/ P3
19
Leucina
Colesterol
Sulfonamidas
Tirosina.
6. Muco
Corresponde ao material proteico produzido pelas glândulas e células epiteliais
do sistema urogenital. Normalmente não tem significado clínico, podendo estar
em nível aumentado por contaminação vaginal ou por espermatozoides.
7. Flora bacteriana
A presença de bactérias na urina (bacteriúria) juntamente com leucócitos e
testes positivos de nitrito e leucócito esterase é uma indicação de processos
infecciosos.
8. Artefatos e contaminantes
Artefatos: gotículas de gordura, pelos, grânulos de amido, tecidos, grãos de
pólen...
Contaminantes: leveduras, parasitas, espermatozoides...
ITU: Infecção do Trato Urinário
Turvação
Nitrito
Sangue
Leucócitos
Bacteriúria
Sintomas mais comuns: Disúria, diminuição do volume urinário, tenesmo.
20
Renata Valadão Bittar – Medicina UNIT/ P3
ERITROGRAMA
a) CONCEITO
É o estudo dos glóbulos vermelhos e faz parte do hemograma.
O Estudo da Série Vermelha é feito pela contagem de hemácias, determinação do
hematócrito, dosagem de hemoglobinas, cálculo dos índices hematimétricos e
visualização microscópica dos eritrócitos (hemácias).
B) INDICAÇÕES
Estudar as anemias (ferropênica, megaloblástica e de doenças crônicas) e as
eritrocitoses.
C) COMPOSIÇÃO
É composto por parâmetros e índices hematimétricos.
Os parâmetros são:
RBC: Número total de hemácias;
HEMATÓCRITO: Percentagem da hemácia no volume total de sangue;
HEMOGLOBINA: Proteína responsável pela oxigenação do sangue.
Os índices hematimétricos são:
VCM: Volume Corpuscular Médio;
Indica o tamanho das hemácias que podem apresentar normocitose,
microcitose ou macrocitose.
HCM: Hemoglobina Corpuscular Média;
CHCM: Concentração da Hemoglobina Corpuscular Média;
Ambos expressam a cor das hemácias que podem estar normocrômicas,
hipocrômicas ou hipercrômicas
RDW: Índice Geral de Anisocitose
Expressam as diferenças de tamanho que podem existir entre as
hemácias na lâmina do paciente
É o índice que expressa a anisocitose
Elevado (acima de 15%)
Renata Valadão Bittar – Medicina UNIT/ P3
21
Não tem importância clínica quando abaixo da referência.
D) TERMOS TÉCNICOS
Anisocitoses por microcitose ou macrocitose
É uma anormalidade que acontece em várias alterações hematológicas, portanto
inespecífica. Representa junto com o valor do RDW um diferencial na classificação
de várias anemias. A anisocitose só tem sentido no eritrograma ou hemograma
quando acompanhada da microcitose ou macrocitose (existem algumas situações
em visualizamos as duas populações eritrocitárias).
Microcitose
Hemácias diminuídas de tamanho. Este termo deve ser usado quando o VCM estiver
abaixo da referência! VCM abaixo de 80 fentolitros (adultos). A microcitose é uma
forma de defesa da hemácia que percebe a redução da quantidade de ferro e
diminui de tamanho para conseguir manter o pouco ferro que ainda possui.
Ex: anemia ferropriva
Macrocitose
Hemácias aumentadas de tamanho. Este termo deve ser usado quando o VCM
estiver acima da referência. VCM acima de 100 fentolitros (adultos).
Ex: anemia megaloblástica
Anisocromias:
Nos diferentes tipos de anemias, os eritrócitos podem sofrer variações em seu
conteúdo hemoglobínico e consequentemente, na intensidade de sua coloração.
Este
estado patológico constitui anisocromia eritrocítica, que indica insuficiência
da medula óssea.
Normocromia
São eritrócitos com quantidade normal de hemoglobina, corando-se, pelos
métodos habituais, de róseo com uma zona central clara, correspondente à sua
concavidade.
Hipocromia
Renata Valadão Bittar – Medicina UNIT/ P3
22
São eritrócitos de tamanho reduzido ou normal, apresentando-se
descorados, sobretudo
na zona central, em virtude
pálidos ou
da quantidade
de
hemoglobina, anormalmente escassa. A predominância destes elementos constitui
a hipocromia.
de absorção
A hipocromia ocorre em geral, nas anemias por deficiência, a falta
ou armazenamento de ferro (anemias primárias ou secundárias,
microcíticas ou
normocíticas). Pode ser citado quando ocorre a diminuição do
HCM (*) e/ou do CHCM. Qualquer condição que provoca microcitose pode vir
acompanhada de hipocromia. Se apenas um desses índices estiver alterado, HCM
ou CHCM, já indica hipocromia pois significa que pelo menos uma parte dessas
hemácias estão hipocrômicas.
Ex: anemia ferropriva
Hipercromia
São células em geral, de grande tamanho, apresentando-se intensamente coradas
e em muitos casos, sem a zona central, clara, observada
normalmente em
consequência de seu conteúdo hemoglobínico anormalmente intenso. A
predominância destes elementos constitui a hipercromia. A hipercromia pode ser
aparente, por aumento do tamanho das células, guardando paralelismo com o
volume das mesmas. A hipercromia ocorre em geral, nas anemias por deficiência,
falta de absorção ou de armazenamento de vitamina B12 e ácido fólico (anemia
perniciosa),
e
também
observada
na
anemia
hemolítica
constitucional
(microsferócitos hipercrômicos).
Policromasia
Presença de reticulócitos em sangue periférico (hemograma). O termo é usado para
descrever hemácias com cores diferentes. O significado clínico é que a medula está
mandando a célula precursora da hemácia para o sangue periférico. A primeira
interpretação sobre a policromasia é que há uma estimulação da medula óssea.
Essa estimulação pode ter uma causa benigna, como, por exemplo, o resultado
positivo de um tratamento com suplementação por sulfato ferroso, ácido fólico e
vitamina B12 e pode ter uma causa maligna como a presença de neoplasias.
Renata Valadão Bittar – Medicina UNIT/ P3
23
Quando a policromasia é descrita no hemograma de um paciente que está fazendo
uso de sulfato ferroso, é a prova que a medula está respondendo ao tratamento.
Deve ser sempre investigada cuidadosamente.
Pecilocitoses ou Poiquilocitoses
Diferença no formato das hemácias. Qualquer formato anormal da hemácia
caracteriza uma poiquilocitose ou pecilocitose. É obrigado a sua descrição quando
encontrada na lâmina do paciente. Principais causas de pecilocitoses:
o
Anemias carenciais e hemolíticas;
o
Hepatopatias;
o
Patologias gástricas;
o
Neoplasias;
o
Trauma ou choque celular.
Renata Valadão Bittar – Medicina UNIT/ P3
24
E)
ANEMIAS
Embora o hematócrito e a contagem do número de hemácias possam estar
alterados, o melhor resultado do hemograma para se chegar à conclusão de que
um paciente está anêmico é a dosagem de hemoglobinas. Por definição, anemia
é a diminuição da capacidade de transporte do oxigênio. Então, a avaliação direta
da quantidade do pigmento existente nas hemácias, responsável pelo transporte
de oxigênio, fornece a informação mais fidedigna para análise e conclusão.
Assim, dosagem de hemoglobinas inferior a 12,5 g/dl para pacientes adultos,
independentemente do sexo, idade e altitude em que vivem no Brasil, permite a
conclusão de anemia; e permite também, classificar a anemia de acordo com a
intensidade em leve, moderada e severa.
OBS: o ser humano não tem perda fisiológica de ferro, com exceção das mulheres
durante o período menstrual. As perdas são patológicas:
Sangramentos por úlceras, gastrites, miomas;
Parasitoses;
Deficiente alimentar;
Gestação.
1. ANEMIA FERROPRIVA
Características do eritrograma:
Hemoglobina e hematócritos abaixo do valor de referência;
VCM e HCM abaixo do valor de referência;
RDW acima do valor de referência;
Presença de microcitose, hipocromia e na maioria dos casos pecilocitoses por
eliptócitos e células em alvo.
OBS: células em alvo = hemácias que perderam a hemoglobina
Fisiopatologia:
A hemoglobina é uma proteína globular encontrada no interior dos eritrócitos,
formada por 4 átomos de ferro e é responsável pela coloração vermelha
do sangue, transporte de oxigênio e equilíbrio ácido-base pois remove o dióxido
de carbono.
Renata Valadão Bittar – Medicina UNIT/ P3
25
A hemoglobina é formada por quatro subunidades que se encontram unidas por
ligações não covalentes. Cada uma dessas subunidades é formada por uma
porção proteica (globina) e um grupo prostético (heme).
A hemácia tem vida de cerca de 120 dias e, após isso, sofre lise liberando a
hemoglobina do seu interior. Esta, por sua vez, se fragmentará em GLOBINA que
constitui os aminoácidos das proteínas e em HEME que é composta por 1 átomo
de ferro ligado a 4 átomos nitrogênios.
Como não há perda fisiológica de ferro, este será depositado sob a forma de
FERRITINA no fígado e medula óssea com o auxílio da proteína de transporte
TRANSFERRINA.
Na ausência ou diminuição do ferro, vai ocorrer uma diminuição na
concentração da hemoglobina, a hemácia vai reagir diminuindo seu tamanho
para “segurar” o resto da hemoglobina que está dentro da mesma.
Com a diminuição da hemácia e diminuição da concentração da
hemoglobina, o morfologista descreverá a microcitose e hipocromia presentes
na lâmina do paciente.
Como ocorrerá diferença no tamanho das hemácias, o RDW estará aumentado
também caracterizando uma anisocitose.
OBS: Anemia Ferropriva em estágio inicial x Anemia Ferropriva instalada
Como nós temos a ferritina que é uma proteína de reserva, ela é a primeira a ser
utilizada em caso de carência do ferro para, em último caso, prosseguir para a
utilização do ferro sérico. Logo, o paciente que apresenta anemia ferropriva em
fase inicial poderá demonstrar um eritrograma dentro dos parâmetros normais,
porém, o valor da ferritina estará alterado e, mediante isso, já se pode iniciar o
tratamento e prover um melhor prognóstico ao paciente.
A ferritina, por ser um estoque de ferro, irá diminuir de quantidade antes que o
ferro da periferia seja utilizado, justificando o porquê de se encontrar pacientes
com anemia ferropriva em fase inicial com hemograma normal e apenas a
ferritina alterada.
Em virtude desse fator, o médico deve SEMPRE solicitar o hemograma e o valor
da ferritina para que, dessa forma, possa descartar uma anemia ferropriva.
A instalação do quadro leva alguns meses, que é quando, geralmemte, o
paciente procura atendimento médico. Ninguém dorme bem e acorda
anêmico.
O quadro instalado de anemia ferropriva cursará com anisocitose por
microcitose, hipocromia e hemoglobina e hematócrito baixos.
Renata Valadão Bittar – Medicina UNIT/ P3
26
Quando esse quadro apresentar-se somado a uma eosinofilia, estará indicando
uma parasitose e o parasitológico de fezes pode ser solicitado para
confirmação.
Sinais e sintomas: astenia, palidez de mucosas, fâneros comprometidos e, em
casos mais graves, arritmia cardíaca.
Hemoglobina abaixo de 7% é limítrofe e já com indicação de transfusão
sanguínea.
Diante de uma suspeita, o hematologista deverá solicitar a CINÉTICA DO FERRO
que é composta pela ferritina, transferrina e capacidade de fixação do ferro =
TIB. Quanto menos a quantidade de ferro, maior a capacidade de fixação dos
ligantes.
Em relação ao tratamento, a origem do problema deve ser investigada e
tratada. No caso do déficit de ingesta de ferro, a suplementação com sulfato
ferroso está indicada. Entretanto, há casos como a presença de miomas e o
fluxo menstrual intenso, neoplasias e parasitoses que o sulfato ferroso não será
suficiente, pois a causa do problema permanecerá. Sendo assim, os miomas e
as parasitoses deverão ser tratados para evitar a perda excessiva de sangue,
bem como as neoplasias e cada caso avaliado separadamente pelo
profissional.
Se com esses exames não for possível chegar a causa, pode-se solicitar um
exame de pesquisa de sangue oculto nas fezes e, caso este apresente resultado
positivo, o paciente precisará se submeter a uma colonoscopia para
investigação.
2. ANEMIA MEGALOBLÁSTICA
Grupo de alterações caracterizadas por defeito de síntese de DNA (ciclo das
pirimidinas, purinas e inibição de polimerase de DNA) e, em menor grau de RNA,
que originam assincronismo de maturação e de divisão celular, caracterizadas
por células megaloblásticas caracterizadas por células megaloblásticas.
Também descrita como síndrome megaloblástica por comprometer as 3
linhagens (glóbulos vermelhos, glóbulos brancos e plaquetas).
Características do eritrograma:
Hemoglobina e hematócritos diminuídos
VCM e HCM aumentados
RDW: Acima do valor de referência
Anisocitose por macrocitose, policromasia, hemácias jovens (eritoblastos)
Renata Valadão Bittar – Medicina UNIT/ P3
27
Fisiopatologia:
Na ausência do ácido fólico e vitamina B12, a hemácia imatura não consegue
terminar o seu amadurecimento e é mandada para a circulação imatura e
aumentada de tamanho.
Ácido fólico e vitamina B12 são essenciais para a ocorrência da eritropoese e
agem no DNA de maturação dos eritrócitos, leucócitos e plaquetas também,
conferindo a PANCITOPENIA que é o comprometimento das 3 linhagens.
Além das alterações das hemácias, podem ser encontrados neutrófilos
multisegmentados e macroplaquetas.
Devido à falta de amadurecimento são visualizados os macrócitos ou
megaloblastos pois as células nascem gigantes e vão diminuindo de tamanho
com o decorrer da eritropoese, que é o crescimento e amadurecimento dos
glóbulos vermelhos.
A pancitopenia também acontece em casos de leucemia e todas as alterações
devem ser cuidadosamente investigadas. Antes da solicitação da realização de
um mielograma para o diagnóstico diferencial, o paciente pode fazer um
exame de dosagem do ácido fólico e vitamina B12.
Renata Valadão Bittar – Medicina UNIT/ P3
28
3. ANEMIA DE DOENÇAS CRÔNICAS
É definida como uma anemia hipoproliferaiva e é o tipo mais frequente entre
pacientes hospitalizados.
Laboratorialmente pode apresentar-se por hipoferremia na presença de
estoques adequados de ferro (ferritina).
Ocorre sempre associada a infecções crônicas como tuberculose, HIV,
neoplasias, doenças inflamatórias como o Lúpus e artrite reumatoide, doenças
inflamatórias intestinais, doenças renais, dentre outras.
Fisiopatologia:
Ativação do sistema imune e inflamatório, liberação de citocinas e proteínas de
fase aguda, como a proteína C reativa, provocando:
o
Anormalidades no metabolismo do ferro e deficiente utilização do mesmo;
o
Produção inadequada de eritropoetina e bloqueio na resposta dos precursores
eritróides a EPO;
o
Redução no tempo de vida das hemácias;
o
Proliferação e diferenciação inadequada das células eritróides.
As citocinas liberadas durante os processos inflamatórios bloqueiam o estoque
de ferro sérico que é a ferritina, e esta, por sua vez, não conseguirá chegar nas
hemácias para reposição. Logo, o paciente apresente ferritina normal e ferro
sérico baixo.
Geralmente são anemias normo normo, ou seja, normocíticas e normocrômicas,
mas com a retenção do ferro, pode haver microcitose e hipocromia.
A retenção do ferro ocorre devido à presença das citocinas que reduzem o ferro
para a eritropoese, causando uma discreta ferropenia (ferro sérico) , mas com
estoques normais (ferritina).
OBS: Neste tipo de anemia, os índices hematimétricos estão normais. Apenas a
hemoglobina e hematócritos estão diminuídos.
Quem caracteriza uma anemia é a HEMOGLOBINA.
Mulheres adultas: Hemoglobina = 12g/dl.
Homens adultos: Hemoglobina = 13g/dl.
Gestantes: Hemoglobina = 10,5 – 11g/dl
OBS: Em algum momento da vida o exame pode acusar alterações como a
microcitose e hipocromia. Isso vai depender do estado do paciente, se diminuiu a
Renata Valadão Bittar – Medicina UNIT/ P3
29
ingesta de ferro ou se perdeu sangue por algum motivo como, por exemplo, os
pacientes renais crônicos que precisam se submeter constantemente a diálises e, por
isso, são espoliados com frequência.
3.1 HEMOGRAMA NA INSUFICIÊNCIA RENAL CRÔNICA
Principal causa da anemia é a deficiência de Eritropoetina (EPO);
Anemia normo, normo, podendo ser micro/hipo a depender do estado que o
paciente se encontra;
Toxinas urêmicas e drogas podem contribuir para a inibição da eritopoese;
Laboratorialmente apresenta-se com hemoglobina, hematócrito e RBC baixos,
índices normais;
Morfologia das hemácias pode vir acompanhada de algumas pecilocitoses
como esquizócitos e crenação (equinócitos e acantócitos);
Fisiopatologia:
A Eritropoetina ou EPO é um Hormônio Glicoprotéico produzido naturalmente
nos seres humanos e nos animais pelos rins (90%) e fígado (10%), a função da
Eritropoetina é principalmente de regular a eritropoiese, nome que se dá a
produção de células vermelhas do sangue, hemácias.
Toxinas urêmicas e drogas podem contribuir para a inibição da eritopoese;
É de fundamental importância a cinética do ferro para acompanhar esses
pacientes: ferro, ferritina e IST;
Leucograma e plaquetograma geralmente normais, salvo quando estão
associados a outras patologias infecciosas.
Além da hemodiluição, outros fatores como deficiência de ferro devido ao
aumento da massa eritrocitária, consumo de ferro pelo feto e perda sanguínea
durante o parto, além da deficiência de ácido fólico decorrente de seu
consumo podem acentuar esta anemia.
O paciente com IRC deve ser tratado com reposição de EPO que vai agir na
hemoglobinização, especificamente nas duas últimas fases da eritropoese.
A EPO é indicada para aqueles pacientes que têm a capacidade de produção
reduzida mediante comprometimento dos rins ou fígado.
O paciente com IRC é espoliado a cada diálise pois perde sangue na instalação
da fístula e, com isso, pode ser indicado a suplementação com sulfato ferroso
também devido à perda patológica de ferro. A conduta dependerá do
resultado da cinética do ferro. Além dessa perda patológica, devido às
Renata Valadão Bittar – Medicina UNIT/ P3
30
restrições nutricionais severas desse tipo de paciente, ele também pode ter uma
ingesta deficiente de ferro.
3.2 ANEMIAS HEMOLÍTICAS
São anemias aonde ocorre a destruição da hemácia antes dos 120 dias
Tipo de anemia crônica
Geralmente são genéticas e não têm cura
Existem vários tipos de anemias hemolíticas
Algumas com clínica mais grave, outras com clínica branda e assintomáticas
A maioria destas anemias hemolíticas são normocíticas e normocrômicas,
podendo em algum momento apresentar anisocitoses e alterações de cor.
Fisiopatologia:
A anemia hemolítica ocorre quando a medula óssea for incapaz de compensar,
por aumento da produção, a destruição prematura dos glóbulos vermelhos. Se
a medula óssea for capaz de compensar a destruição dos glóbulos vermelhos,
não se desenvolve anemia.
O mais comum é a troca do ácido glutâmico pela valina.
As causas de anemia hemolítica incluem infecções, certos medicamentos,
distúrbios auto-imunes e distúrbios hereditários.
Os tipos de anemia hemolítica incluem:
o
Anemia aplástica
o
Anemia aplástica secundária
o
Doença da hemoglobina S-C
o
Anemia hemolítica por deficiência de G6PD
o
Eliptocitose hereditária
o
Esferocitose hereditária
o
Ovalocitose hereditária
o
Anemia hemolítica auto-imune idiopática
o
Anemia hemolítica não imunológica causada por agentes químicos ou físicos
o
Anemia hemolítica imune secundária
o
Doença da hemoglobina S-B-talassemia
Um exemplo de anemia hemolítica bem comum é a ANEMIA FALCIFORME.
Anemia falciforme é uma anemia muito grave causada pela troca de dois
aminoácidos durante a formação da hemoglobina.
Renata Valadão Bittar – Medicina UNIT/ P3
31
É irreversível e a hemácia assume um formato de meia lua chamada de
hemácia em foice. Esta hemácia de formato em foice é rígida e não consegue
passar pelos capilares sanguíneos causando trombos em vários vasos
sanguíneos.
Estas hemácias são destruídas muito rapidamente pelo baço e não existe tempo
para a medula óssea enviar novas hemácias para circulação. A conclusão é
que a destruição é maior que a produção.
O paciente na maioria dos casos torna-se dependente de transfusões
sanguíneas de repetição. Também torna-se vulnerável a infecções respiratórias,
pois esta hemoglobina defeituosa não faz oxigenação adequadamente.
A
alteração
mais
importante
do
hemograma
é
a
pecilocitose
por
DREPANÓCITOS e a intensa anemia instalada do paciente.
O Exame confirmatório para esta anemia é a Eletroforese de Hemoglobina.
Neste exame é expresso a formação da nossa hemoglobina normal: AA. O
paciente falciforme é SS. Existe o paciente que carrega o gene, mas não tem a
doença: AS. Não adianta fazer uso do sulfato ferroso para este paciente.
Sinais e sintomas: o paciente tem tendência a apresentar CRISES VASOOCLUSIVAS pela facilidade de formação de trombos devido à presença de
drepanócitos que são hemácias rígidas que ficam estagnadas nos vasos.
OBS: o quadro clínico só aparece no bebê a partir dos 6 meses pois, até lá, este
tem a proteção das hemoglobinas fetais que estarão em maior quantidade
naquele momento.
OBS: outros exames que devem ser solicitados a pacientes com anemia
falciforme:
Cinética do ferro
Ureia e creatinina (o alto nível de destruição de hemácias sobrecarrega os rins e
fígado)
TGO e TGP
Bilirrubina (com o aumento da degradação das hemácias, haverá aumento do
nível de bilirrubina indireta no sangue)
O diagnóstico de anemia falciforme só poderá ser confirmado mediante a
eletroforese da hemoglobina.
Eletroforese de Hemoglobina
Renata Valadão Bittar – Medicina UNIT/ P3
32
Exame específico para diagnosticar hemoglobinopatias.
A Hemoglobina normal é composta de :
HB A1(97%)
HB A2 (2,5%)
HB Fetal (0.5%)
Patologias mais investigadas: Anemia Falciforme e Talassemias.
PASSO A PASSO:
Eritrograma
Determinação do hematócrito (mulheres – 36% a 48% / homens – 39% a 50%)
Cálculo dos índices hematimétricos
Confecção do esfregaço sanguíneo
Coloração rápida dos esfregaços sanguíneos
Hematócrito
Colher o sangue com EDTA
Encher o capilar e centrifugar por 5 minutos em microcentrífuga
Ler em escala padronizada e calcular os índices hematimétricos
HTC = Determinação Universal
Hemoglobina = HTC/3
RBC: HTC + 4 (constante) ou /9 (constante) cálculo para pacientes com
hematócritos normais
VCM = HTC x 10/RBC
HCM = hemoglobina x 10/RBC
CHCM = hemoglobina x 100/HTC
RDW = não existe cálculo
MAY GRÜNWALD - GIEMSA
Método para coloração de células de sangue periférico, medula óssea ou para
estudo citológico de elementos celulares. Somente para uso diagnóstico in vitro.
PASSO A PASSO:
Colocar as lâminas em estante apropriada e colocar o 1º corante (MAY
GRUNWALD) sobre todo o esfregaço e marcar 2 minutos
Após os 2 minutos, colocar água destilada, homogeinezar e esperar mais 2
minutos
Renata Valadão Bittar – Medicina UNIT/ P3
33
Retirar o excesso e colocar o 2º corante (GIEMSA)
Marcar 15 minutos
Lavar em água corrente para retirar o excesso e limpar as costas das lâminas
com algodão e álcool
Esperar secar e ler em objetiva de 40x ou imersão 100x
Renata Valadão Bittar – Medicina UNIT/ P3
34
VDRL e FTA-Abs
A sífilis é uma doença infecciosa sistêmica, de evolução crônica, e é um
grande agravo de saúde pública em todo o mundo. O agente etiológico é a
bactéria Treponema pallidum, uma espiroqueta adquirida na maioria dos
casos durante relações sexuais.
Seu diagnóstico é baseado na avaliação clínica, na identificação direta do T.
pallidum e no teste sorológico. Sendo que este último é o mais frequentemente
utilizado no diagnóstico, isso por que, o paciente na maioria das vezes, quando
procura o serviço de saúde, está em um estágio mais avançado da doença.
Os testes mais utilizados são o VDRL (teste de antígeno não treponêmico) e o
FTA-ABS (teste treponêmico).
a) CONCEITO E FISIOPATOLOGIA
VDRL
Tem como sinônimo LUES - sorologia para sífilis. Exame para diagnosticar
pacientes com sífilis. O VDRL utiliza como antígeno a cardiolipina que
normalmente ocorre no soro em níveis baixos e apresenta-se elevado na sífilis. O
VDRL é uma reação de floculação, apresentando alta sensibilidade e baixa
especificidade.
O diagnóstico laboratorial da sífilis depende da sua fase de infecção.
Os exames incluem a pesquisa direta em campo escuro do Treponema
pallidum, melhor indicada na fase primária da doença, os testes sorológicos nãoespecíficos, antilipídicos ou reagínicos, e os específicos ou antitreponêmicos.
Entre os testes não-específicos, dispomos do VDRL (Venereal Disease Research
Laboratory) e do RPR (Rapid Plasma Reagin). São testes quantitativos, ambos de
baixo custo, que ficam positivos entre as segunda e quarta semanas após
aparecimento do cancro de inoculação e apresentando títulos mais elevados
nas formas secundárias, recente latente e tardia.
Por serem quantitativos e a pela tendência de se tornarem negativos entre seis
e 12 meses, são os mais indicados para acompanhamento pós-terapêutico da
doença.
São testes não específicos, pois detectam anticorpos antilipídicos que surgem
tanto na sífilis como em outras doenças (cardiolipina).
Renata Valadão Bittar – Medicina UNIT/ P3
35
É um teste de triagem, baixo custo, rápido, alta sensibilidade, baixa
especificidade e consegue detectar logo nas primeiras semanas da infecção.
Os títulos do VDRL são considerados positivos quando 1/16 ou superiores.
Títulos inferiores são considerados falso-positivos quando os testes treponêmicos
forem negativos.
Títulos baixos podem ser permanentes, como no lúpus eritematoso sistêmico, na
síndrome antifosfolipídica e outras colagenoses, na hepatite crônica e no uso
abusivo
de
drogas
ilícitas
injetáveis,
na
hanseníase,
na
malária,
na
mononucleose, na leptospirose ou podem ser temporários em algumas
infecções, vacinações, medicamentos e transfusões de hemoderivados. Às
vezes, pode ocorrer na gravidez e em idosos.
A presença de grande quantidade de anticorpos pode evitar que haja
floculação no soro puro (falso-negativo). Nessas ocasiões, a diluição do soro
tornará a reação positiva. Esse fenômeno é chamado de "efeito prozona" e
acontece em 1% dos doentes com secundarismo sifilítico, não sendo observado
nos testes treponêmicos.
Como é utilizada no acompanhamento pós-terapêutica, a titulação do
paciente deve ir reduzindo com o tratamento para confirmar que este está
sendo adequadamente realizado.
O VDRL é indispensável no seguimento pós-tratamento da sífilis. Recomenda-se
o exame a cada seis meses, até o final do segundo ano. Os títulos diminuem
quatro vezes após três meses e oito vezes aos seis meses.
Quando qualquer outra DST é diagnosticada, incluindo a infecção pelo HIV, a
pesquisa sorológica para sífilis é obrigatória.
SÍFILIS: é possível a reinfecção. Não existe imunidade adquirida.
ASPECTO NEGATIVO: por ter baixa especificidade, pode apresentar resultado
equivocados devido a alguns fatores:
A) FALSO-POSITIVO
o
Doenças auto-imunes como lúpus e artrite reumatoide
- Se a titulação for ½ ou ¼ pode ser que os anticorpos da mãe tenham
sido passados para o bebê, mas titulações muito altas do bebê falam a
favor de que o mesmo seja portador da patologia.
o
Falta de jejum para a realização do exame
- O jejum mínimo para a realização do VDRL é de 4 horas tendo em vista
que o reagente do exame é feito com o antígeno CARDIOLIPINA que é
Renata Valadão Bittar – Medicina UNIT/ P3
36
um fosfolipídio (proteína + lipídio) e pode sofrer influência da
alimentação.
o
Reação cruzada por algumas viroses
- Vírus da Herpes e citomegalovírus
OBS:
IgM: fase aguda/infecção recente
IgG: infecção passada
Se o paciente tiver contato com o Treponema pallidum, a IgG será positiva para
sempre, fato a que chamamos de CICATRIZ SOROLÓGICA.
Considera-se cicatriz sorológica a persistência, após os dois anos, de reaginas
em baixos títulos (de soro puro até 1:4), com provas treponêmicas positivas (FTAAbs). Sorologias persistentes em títulos elevados, mesmo com LCR normal, devem
ser acompanhadas por maior tempo, devido à possibilidade de existirem outros
reservatórios de treponemas; retratamentos nesses casos assintomáticos são
ineficazes.
b) FALSO-NEGATIVO
o
Efeito pró-zona
- Acontece quando a quantidade de anticorpos do paciente é superior
a de antígeno (reagente).
- Todas as reações que envolvem aglutinação antígeno-anticorpo não
se deve fazer a titulação total apenas. O reagente já possui uma
concentração definida, feito com partículas “x” de antígeno e se tiver
uma concentração superior de anticorpo do que de antígeno
(reagente) no soro, não vai haver aglutinação.
- Nesse caso, a indicação é de se realizar a titulação total e ½: pega 50ml
de soro + 50ml de salina para realizar a diluição do soro do paciente e
remover metade dos anticorpos que lá estavam para que estes sejam
proporcionais aos antígenos que são os reagentes.
Renata Valadão Bittar – Medicina UNIT/ P3
37
FTA- ABS
Os testes treponêmicos ou confirmatórios, como o FTA-Abs (Fluorescent
Treponemal Antibody Absorption), o TPHA (Treponema Pallidum Hemagglutinatio
Test) e o teste imunoenzimático (ELISA) são específicos e qualitativos, nos quais
se emprega o antígeno do T. pallidum.
Essas reações também se tornam positivas a partir da segunda semana após o
aparecimento do cancro sifilítico, assim se mantendo em todas as fases
evolutivas da sífilis não estando indicadas para o acompanhamento póstratamento da doença.
As reações específicas, como FTA-ABS e ELISA, raramente são falso-reagentes,
exceto em casos específicos, como na borreliose de Lyme, em que o FTA-ABS é
positivo e o VDRL geralmente é negativo.
O procedimento é formado por duas reações. Na primeira etapa, o soro do
paciente é colocado em contato com o substrato antigênico. Se os anticorpos
estiverem presentes no soro, estes se ligam ao antígeno, formando um
complexo antígeno-anticorpo.
Se o soro testado não contém anticorpos dirigidos contra este antígeno em
particular, não se formará o complexo antígeno-anticorpo e todos os
componentes do soro serão eliminados na etapa de lavagem.
Na segunda etapa adiciona-se uma antigamaglobulina humana marcada
com isotiocianato de fluoresceína. Se o complexo antígeno-anticorpo formouse na primeira etapa, a antigamaglobulina marcada fluoresceína adere-se ao
mesmo. Poderá ser observada uma reação positiva, com fluorescência verde
maçã brilhante, através de um microscópio de fluorescência.
Atualmente, a pesquisa para sífilis é realizada combinando testes específicos e
não específicos, e a maioria dos autores utiliza o VDRL ou o RPR e o FTA-ABS ou
o ELISA.
As reações específicas, como FTA-ABS e ELISA, raramente são falso-reagentes,
exceto em casos específicos, como na borreliose de Lyme, em que o FTA-ABS é
positivo e o VDRL geralmente é negativo.
A presença de grande quantidade de anticorpos pode evitar que haja
floculação no soro puro (falso-negativo). Nessas ocasiões, a diluição do soro
tornará a reação positiva. Esse fenômeno é chamado de "efeito prozona" e
acontece em 1% dos doentes com secundarismo sifilítico, não sendo observado
nos testes treponêmicos.
38
Renata Valadão Bittar – Medicina UNIT/ P3
VDRL positivo e FTA-ABS positivo confirmam o diagnóstico de sífilis.
VDRL positivo e FTA-ABS negativo indicam outra doença que não sífilis.
VDRL negativo e FTA-ABS positivo indicam sífilis em fase bem inicial ou
sífilis já curada ou sífilis terciária.
VDRL negativo e FTA-ABS negativo descartam o diagnóstico de sífilis.
Renata Valadão Bittar – Medicina UNIT/ P3
39
BILIRRUBINAS TOTAL, DIRETA E INDIRETA
a) CONCEITO E FISIOPATOLOGIA
A maior parte da bilirrubina (80-85%) provém da degeneração de hemácias
velhas (cerca de 0,8% das hemácias são destruídas diariamente). O restante
provém de outras proteínas hêmicas (citocromos e mioglobina).
No citoplasma dos macrófagos, a hemoglobina é quebrada em globina
(proteína) e heme. A globina é digerida em aminoácidos que serão reutilizados.
O heme é cindido por ação da enzima heme-oxidase. Perde o ferro e a porfirina
tem seu anel tetrapirrólico aberto a nível de uma das pontes de meteno, com
liberação de uma molécula de monóxido de carbono (CO). O pigmento que
resulta é a biliverdina. Esta sofre ação da enzima biliverdina-redutase e passa
a bilirrubina, um pigmento amarelo.
A bilirrubina (na forma não-conjugada, ou indireta) é liberada pelas células do
SER (sistema reticular endotelial) e, sendo pouco hidrossolúvel, circula no plasma
ligada à albumina. Esta variedade de bilirrubina é processada para eliminação
no fígado.
A bilirrubina não conjugada é captada pelos hepatócitos, que adicionam 2
moléculas de ácido glicurônico à bilirrubina por molécula, tornando-a
hidrossolúvel. Esta forma, dita conjugada ou direta, é secretada ativamente
pelos hepatócitos para o interior dos canalículos biliares existentes entre eles. É a
forma encontrada na bile.
O metabolismo hepático da bilirrubina envolve 3 fases: a) captação, b)
conjugação e c) excreção. Esta última é o passo limitante e o mais susceptível
de falha em caso de doença hepatocítica.
Captação: a bilirrubina é removida da albumina na superfície sinusoidal dos
hepatócitos por um sistema de alta capacidade. Mesmo em condições
patológicas, este não é um fator limitante. É um sistema de transporte facilitado
que permite equilibrar a concentração de bilirrubina dentro e fora do
hepatócito. Como a bilirrubina que entra é logo ligada a proteínas
chamadas ligandinas, a concentração de bilirrubina livre no citoplasma é
sempre baixa, de modo que o equilíbrio é favorável à entrada de mais
bilirrubina.
Renata Valadão Bittar – Medicina UNIT/ P3
40
Conjugação: ocorre no retículo endoplásmico liso do hepatócito, catalizada
pela
enzima UDP-glicuronil-transferase,
em
2
passos,
formando
primeiro monoglicuronato, depois diglicuronato, que é a forma predominante.
A quantidade insuficiente desta enzima no recém-nascido causa a icterícia
fisiológica do 2o ao 5o dia após o nascimento (ver abaixo).
Excreção: é um processo de transporte ativo com consumo energético, e o
passo limitante de todo o processo. Ocorre a nível da membrana do hepatócito
que constitui a parede dos canalículos biliares. Quando este processo está
diminuído, a bilirrubina que continua sendo conjugada no citoplasma do
hepatócito não pode ser excretada na bile e termina por passar para o sangue,
um processo chamado regurgitação. Normalmente, toda bilirrubina excretada
na bile está na forma conjugada.
DESTINO
FINAL
DA
BILIRRUBINA
No íleo e intestino grosso, os glicuronatos são removidos por enzimas bacterianas
(b-glicuronidases), resultando os urobilinogênios, que são incolores. Estes são
oxidados a compostos corados, as urobilinas ou estercobilinas, que dão cor às
fezes. Parte da urobilina reabsorvida nos intestinos (ciclo enterohepático) é
excretada na urina, dando-lhe cor amarela.
B) Valores dos exames laboratoriais
Bilirrubina Total = 1,2 mg/dL
Bilirrubina direta ou conjugada = 0,4 mg/dL
Bilirrubina indireta ou não-conjugada = 0,8 mg/dL
ICTERÍCIA FISIOLÓGICA OU DO RECÉM-NASCIDO: O bebê tem excesso de
bilirrubina indireta ou não-conjugada devido a imaturidade do fígado: há maior
produção de bilirrubina, há maior número de hemácias e estas vivem menos
tempo, sendo logo degradadas e acumulando mais bilirrubina.
A icterícia aparece em 48 a 72 horas após o nascimento, chega ao máximo
entre o terceiro e o quinto dias e desaparece até o oitavo dia.
A incompatibilidade de grupo sanguíneo Rh (mãe Rh-negativo e bebê Rhpositivo), que provoca anemia hemolítica no feto, já foi um problema frequente,
mas atualmente é rara como resultado do uso profilático de imunoglobulina antiRh em mães Rh-negativas.
Renata Valadão Bittar – Medicina UNIT/ P3
41
Outras causas de icterícia neonatal são algumas infecções congênitas e más
formações biliares. A atresia biliar é uma obstrução congênita das vias biliares
que exige cirurgia urgente para corrigí-la.
Aumentos da bilirrubina não conjugada podem ser tóxicos para o cérebro de
recém-nascidos até duas a quatro semanas de vida, levando a síndrome de
Kernicterus. Após essa idade, a barreira entre o sangue e o líquido
cefalorraquiano está desenvolvida e impede a passagem da bilirrubina para o
cérebro.
Níveis elevados de bilirrubina não constituem em si um problema, mas devem ser
investigados porque indicam uma situação a ser avaliada e tratada.
A urina normal não contém bilirrubina. Entretanto, níveis elevados de bilirrubina
conjugada, que é solúvel em água, são eliminados na urina e identificados na
urinálise de rotina.
A associação de icterícia e colúria (bilirrubina na urina) sugere doença hepática
ou obstrução biliar. Icterícia sem colúria sugere anemia hemolítica, quando há
predomínio da bilirrubina não conjugada, que não é excretada na urina.
O aumento da bilirrubina indireta, portanto, é causado pelo aumento da
degradação do heme ou deficiência da conjugação no fígado;
O aumento da bilirrubina direta é causado principalmente por deficiência na
eliminação da bilirrubina pela bile;
Causas de aumento da bilirrubina conforme a bilirrubina predominantemente aumentada
BILIRRUBINA NÃO-CONJUGADA (INDIRETA)
BILIRRUBINA CONJUGADA (DIRETA)
Doença hepatocelular (ex:
hepatites)
Eritropatias
Hemólise
Hiperesplenismo,
autoimune
Aumento da produção
de bilirrubina
Eritropoese ineficaz (ex:
talassemias)
Doença colestática (ex: CBP)
S. de DubinJohnson
Doença do
fígado
Síndrome de
Destruição de hematomas
Distúrbio do
metabolismo
Redução da
conjugação
Rotor
Hiperbilirrubinemia neonatal
Colestase
benigna
Jejum
Colestase da
gravidez
Síndrome de Gilbert
Síndromes de Crigler-Najjar
Doença do trato biliar (ex: tumor)
Doenças extraDoença pancreática (ex:
hepáticas
carcinoma)
Renata Valadão Bittar – Medicina UNIT/ P3
42
Nas hepatopatias agudas, a bilirrubina direta está aumentada assim como a
TGO, TGP e gma GT
A bilirrubina indireta é aumentada na presença de anemias hemolíticas
Renata Valadão Bittar – Medicina UNIT/ P3
43
TESTE DE COOMBS
Teste da Antiglobulina Direta (Coombs Direto)
A principal finalidade deste teste é a detecção de hemácias revestidas de
anticorpos, ou seja, hemácias sensibilizadas "in vivo". É muito utilizado na
investigação de reações transfusionais, no diagnóstico de doença hemolítica
perinatal e de anemias hemolíticas auto-imunes.
Mistura-se as hemácias do paciente ao soro de Coombs e o teste positivo será
aquele com hemaglutinação. O significado é que existem hemácias revestidas
por anticorpo autoimune causando possível hemólise.
Tecnicamente, baseia-se no fato de que os anticorpos que recobrem as
hemácias
podem
ser
identificados
pela
adição
de
anticorpos
antigamaglobulina humana. Quando positivo, ou seja, indicando a presença de
anticorpos aderidos às hemácias, formam-se pontes entre elas, levando ao
fenômeno
visível
de
aglutinação.
Teste da Antiglobulina Indireta (Coombs Indireto):
O
teste
de
Coombs
indireto
permite
a
identificação
de
anticorpos
antieritrocitários no soro. É importante para a avaliação de gestantes Rh (-)
(avaliação de sensibilização), em pacientes com Rh (-) para avaliação da
variante Du e nas fases pré-transfusionais, especialmente em pacientes já
transfundidos, em que pode ter ocorrido sensibilização para Rh e outros sistemas.
O teste indireto identifica in vitro diferentes anticorpos, de acordo com a fase do
teste que apresentou positividade. O teste é realizado em quatro diferentes
etapas, conhecidas como: fase fria (reativos à temperatura ambiente),
geralmente anticorpos da classe IgM; fase em meio proteico, identifica os
anticorpos IgM e também anticorpos incompletos (da classe IgG); fase quente
(à temperatura de 37°C), detecta anticorpos que só reagem a essa temperatura
(geralmente IgG); e a última etapa, que identifica aglutininas da classe IgG e
anticorpos fixadores de complemento.
A ocorrência de aglutinação e/ou de hemólise durante quaisquer das etapas
indica a possibilidade da presença de anticorpos irregulares.
Renata Valadão Bittar – Medicina UNIT/ P3
44
Mistura-se o soro do paciente a hemácias O-. Adiciona-se então o soro de
Coombs e observa-se para ver se há hemólise. O significado é que o anticorpo
circulante já adsorveu as hemácias e ainda sobrou muito anticorpo no soro do
paciente – configura estado de hiperprodução de anticorpos antihemácia.
Consiste na Pesquisa de Anticorpos Irregulares (P.A.I.), onde iremos determinar a
ausência ou a presença de anticorpos livres no soro ou plasma de doadores e
pacientes.
Quando obtivermos um P.A.I. positivo, será indicativo da presença de um
anticorpo irregular no plasma deste paciente ou doador de sangue, o que nos
levará a realização de um outro teste denominado de Identificação de
Anticorpos Irregulares (I.A.I.), onde iremos determinar a especificidade deste
anticorpo, ou seja, contra que aglutinógeno específico este anticorpo é voltado.
A anemia hemolítica autoimune (AHA) definida pela curta duração dos glóbulos
vermelhos em razão da resposta humoral autoimune associada à TAD positivo é
causada pela presença de anticorpos não específicos e identificáveis que
reagem com antígenos de superfície dos glóbulos vermelhos. A anemia aparece
quando a porcentagem de destruição dos glóbulos vermelhos excede a
capacidade regenerativa da medula óssea.
Na hemólise autoimune, o revestimento dos autoanticorpos não danifica os
glóbulos vermelhos, mas causa a hemólise por ativação do complemento,
induzindo interações com o sistema mononuclear fagocítico.
O teste de Coombs ou Antiglobulina Direta (TAD) constitui método elementar e
simples para demonstração da presença de IgG e/ou complemento revestindo
a superfície dos eritrócitos in vivo. A utilização do TAD é mais apropriada no
estudo das anemias hemolíticas em que se suspeite de origem imune. Se positivo,
tem elevado valor preditivo de origem imune em um paciente com anemia
hemolítica.
No
entanto,
a
presença
de
TAD
positivo
não
significa,
necessariamente, que um indivíduo tenha anemia hemolítica, sendo, por vezes,
positivo em indivíduos hematologicamente normais.
Da mesma forma que a ausência de TAD positivo não exclui presença de AHA,
também sua positividade, ainda que em coexistência com anemia que pode
ser devida a múltiplas causas, não deve ser encarada imediatamente como
sinônimo desta doença.
O TAD pode ser positivo em pacientes com estados infecciosos, sob tratamento
de vários fármacos ou sem significado clínico conhecido. Quando se detecta
um autoanticorpo com padrão de reatividade semelhante ao da AHA, mas sem
Renata Valadão Bittar – Medicina UNIT/ P3
45
evidência de hemólise, provavelmente haverá outros fatores envolvidos que
interferem com a atividade do sistema macrofágico.
Uma hipótese será que a depressão da atividade fagocitária do sistema
macrofágico
pode
fazer
com
que
um
número
de
autoanticorpos
suficientemente elevado para ser detectado in vitro não tenha a capacidade
de provocar hemólise. Um exemplo frequente é o uso de fármacos
imunossupressores, nomeadamente corticoterapia; outro é a existência de
doença autoimune, como o lúpus eritematoso sistêmico, em que a presença de
grandes quantidades de complexos imunes circulantes poderá saturar os
receptores macrofágicos, impedindo-os de retirar eficazmente os eritrócitos da
circulação.
No entanto, esses autoanticorpos podem ser encontrados em indivíduos
saudáveis, nomeadamente em doadores de sangue, desconhecendo-se
qualquer doença associada. A positividade pode manter-se indefinidamente
sem qualquer significado clínico, regredir ou, em um pequeno número de casos,
evoluir para AHA.
Renata Valadão Bittar – Medicina UNIT/ P3
46
GRUPOS SANGUÍNEOS
a) CONCEITO
A importante descoberta de que as hemácias humanas pertenciam a diferentes
grupos sanguíneos foi realizada por Landsteiner em 1900, que identificou o
sistema ABO.
Este sistema foi então dividido em quatro grupos sanguíneos: A, B, AB e O; onde
os indivíduos classificados como:
"A" possuem aglutinogênio A nas hemácias e anticorpos contra B no plasma.
"B" possuem aglutinogênio B nas hemácias e anticorpos contra A no plasma.
"AB” possuem aglutinogênios A e B nas hemácias e não possuem anticorpos no
plasma.
"O" não possuem aglutinogênios nas hemácias e possuem anticorpos contra A e
B no plasma.
Os antígenos da superfície das hemáceas ao encontrarem os anticorpos
correspondentes, produzem aglutinação celular. Por esta razão, os antígenos
dos eritrócitos são também chamados de aglutinógenos.
Para a determinação do tipo sanguíneo utilizamos a pesquisa de aglutinogênios
nas hemácias (tipagem Direta), e para a confirmação destes mesmos grupos
sanguíneos realizamos a tipagem Reversa, onde detectaremos os seus
respectivos anticorpos.
Na tabela a seguir poderemos observar a relação existente entre aglutinogênios
e anticorpos correspondentes nos respectivos grupos sanguíneos.
b) PASSO A PASSO DO EXAME
Lavar o sangue do paciente 3x com soro fisiológico
Após a 3ª lavagem, fazer diluição a 2% ou 5%
Renata Valadão Bittar – Medicina UNIT/ P3
47
Separar 3 tubos e colocar duas gotas do sangue diluído, mais duas gotas do soro
anti-A, anti-B e anti-D respectivamente em cada tubo
Centrifugar os 3 tubos mais 3 minutos
Interpretação:
Aglutinou no tubo A: paciente A
Aglutinou no tubo B: paciente B
Não houve aglutinação: paciente O
Aglutinou nos tubos A e B: paciente AB
Aglutinou no tubo anti-D: paciente Rh +
Não aglutinou no tubo anti-D: paciente Rh -
2- Determinação do fator Rh: O fator Rh foi descoberto em 1940 por Landsteiner e
Wiener. A partir daí foram descobertos aproximadamente 40 ou mais aglutinógenos
diferentes no sistema Rh, porém na prática procura-se determinar a presença ou
ausência de um deles, especificamente o aglutinógeno D. A presença do aglutinógeno
"D" irá caracterizar o indivíduo como Rh Positivo e sua ausência como Rh negativo.
C) VARIANT DVOU
Dfraca
Exame confirmatório do Rh
Alguns pacientes são Rh fracamente positivos e é necessário o uso de um soro
revelador que irá “revelar” se o paciente é realmente negativo ou fracamente
positivo.
PROCEDIMENTO:
Após a classificação inicial do tubo anti-D negativo, colocar por 20 minutos o
anti-D no banho maria a 37oC
Após 20 minutos, lavar 3x o tubo anti-D com salina e colocar uma gota do soro
de Coombs (soro revelador) e centrifugar por mais 3 minutos
INTERPRETAÇÃO:
Se aglutinar, paciente é Rh +
Se não aglutinar, paciente é Rh –
48
Renata Valadão Bittar – Medicina UNIT/ P3
OBS: a lavagem das hemácias é feita para remover os outros grupos sanguíneos pois
estes antígenos são leves e estão na membrana da hemácia,
Grupos MN, DUFF e Bomb
A cada lavagem o sobrenadante vai ficando mais límpido.