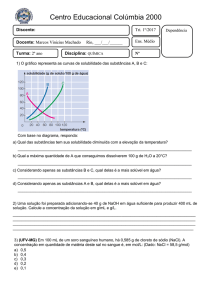
1. Sabendo-se que a concentração de O2 na atmosfera ao
nível do mar é 20,9% em volume. Justifique porque a
afirmação adiante está CERTA ou ERRADA.
"O volume molar de ar à CNTP contém 6,7g de O2".
composições diferentes. A tabela a seguir apresenta as
pressões parciais, em mmHg, dos gases da respiração em
determinado local.
2. Qual a massa molecular de 45g de uma substância
gasosa que está dentro de um recipiente de 3 litros a uma
pressão de 5atm e a uma temperatura de 27°C?
Dado: R = 0,082 atm.L/mol.K
3. Nitrato de bário pode ser preparado em meio aquoso,
através das transformações químicas a seguir:
Etapa 1: BaCl2 + Na2CO3 → BaCO3
Etapa 2: BaCO3 + HNO3 → Ba(NO3)2
Nas etapas 1 e 2, ocorrem, respectivamente:
a) precipitação de carbonato de bário e desprendimento de
dióxido de carbono.
b) precipitação de carbonato de bário e desprendimento de
hidrogênio.
c) desprendimento de cloro e desprendimento de dióxido
de carbono.
d) desprendimento de dióxido de carbono e precipitação de
nitrato de bário.
e) desprendimento de cloro e neutralização do carbonato
de bário.
4. Considere as seguintes afirmações:
I. Óxidos como Na2O, MgO e ZnO são compostos iônicos.
II. Óxidos como K2O, BaO e CuO são básicos.
III. Óxido de carbono, nitrogênio e enxofre são compostos
moleculares.
IV. PbO2 e MnO2 são oxidantes fortes.
Destas afirmações estão CORRETAS:
a) Apenas I e II.
b) Apenas I e III.
c) Apenas III e IV.
d) Apenas I, II e III.
e) Todas.
5. Sódio, assim como o hidrogênio, reage com cloro para
formar:
a) um sal e uma base.
b) um composto iônico e um covalente.
c) dois sais.
d) dois compostos iônicos.
e) dois compostos covalentes.
6. A reação de 1mol de ácido fosfórico com dois mols de
hidróxido de sódio produz:
a) 2 mols de Na3PO4.
b) 1 mol de Na2HPO4.
c) 3 mols de NaH2PO4.
d) 2 mols de Na3PO3.
e) 1 mol de NaH2PO2 e 1 mol de Na2HPO3.
7. Ao assoprarmos água de cal, estamos:
a) produzindo carbonato de cálcio.
b) injetando oxigênio na solução.
c) tornando a solução azul.
d) formando um óxido como produto.
e) mudando a solução do estado líquido para o estado
gasoso.
8. Na respiração humana o ar inspirado e o ar expirado têm
Qual é o valor de x, em mmHg?
a) 12,4.
b) 31,7.
c) 48,2.
d) 56,5.
e) 71,3.
9. Para a realização de um experimento, será necessário
encher de gás um balão de 16,4L que a 127°C suporta a
pressão máxima de 2,0atm. Nestas condições, a quantidade
mais adequada para encher o balão é:
Dados: H=1, C=12, 0=16 e S=32, R=0,082(atm. L. K-1.
Mol-1)
a) 10g de hidrogênio.
b) 24g de metano.
c) 45g de etano.
d) 64g de dióxido de enxofre.
e) 78g de acetileno (etino).
10. Observe a equação:
Zn + 2HCl → ZnCl2 + H2
A quantidade de zinco, em gramas que deve reagir para
produzir 0,56 litros de H2 medidos a 0°C e 2 atmosferas
de pressão, é de:
Dados: H = 1, Cl = 35,5, Zn = 65,4
a) 1,63 g.
b) 3,27 g.
c) 4,90 g.
d) 6,54 g.
e) 8,17 g.
11. Para preparar 1,2 litros de solução 0,4M de HCl, a
partir do ácido concentrado (16M), o volume de água, em
litros, a ser utilizado será de:
a) 0,03.
b) 0,47.
c) 0,74.
d) 1,03.
e) 1,17.
12. Quatro tubos contêm 20mL (mililitros) de água cada
um. Coloca-se nesses tubos dicromato de potássio
(K2Cr2O7) nas seguintes quantidades:
A solubilidade do sal, a 20°C, é igual a 12,5g por 100mL
de água. Após agitação, em quais dos tubos coexistem,
nessa temperatura, solução saturada e fase sólida?
a) Em nenhum.
b) Apenas em D.
c) Apenas em C e D.
d) Apenas em B, C e D.
e) Em todos.
13. Para matar baratas, precisamos fazer uma solução
aquosa a 30% de ácido bórico (d=1,30g/cm3), com
concentração molar de (Dados: H=1, B=10,8, O=16)
a) 6,5 M.
b) 6,0 M.
c) 5,5 M.
d) 5,0 M.
e) 4,5 M.
14. A seguir é apresentada a concentração, em mg/kg, de
alguns íons na água do mar:
Íon Mg+2, (SO4)-2, Na+, Cl-.
Concentração 1350, 2700, 10500, 19000.
Dentre esses íons, os que estão em menor e maior
concentração molar são respectivamente:
a) Cl- e Mg+2.
b) (SO4)-2 e Na+.
c) Mg+2 e Na+.
d) Mg+2 e Cl-.
e) (SO4)-2 e Cl-.
Massas atômicas: O = 16; Na = 23; Mg = 24; S = 32; Cl =
35,5
15. Quando se adiciona cal viva (CaO) à água, há uma
liberação de calor devida à seguinte reação química:
CaO + H2O Ca (OH)2 + X kcal/mol
Sabendo-se que as entalpias de formação dos compostos
envolvidos são a 1ATM e 25°C (condições padrão)
∆H (CaO) = -151,9 kcal/mol
∆H (H2O) = -68,3 kcal/mol
∆H (Ca(OH)2) = -235,8 kcal/mol
Assim, o valor de X da equação anterior será:
a) 15,6 kcal/mol
b) 31,2 kcal/mol
c) 46,8 kcal/mol
d) 62,4 kcal/mol
e) 93,6 kcal/mol
16. Observe o gráfico.
O valor da entalpia de combustão de 1mol de SO2 (g), em
kcal, a 25°C e 1atm, é:
a) - 71.
b) - 23.
c) + 23.
d) + 71.
e) + 165.
17. A oxidação de açúcares no corpo humano produz ao
redor de 4,0 quilocalorias por grama de açúcar oxidado. A
oxidação de um décimo de mol de glicose (C6H12O6) vai
produzir aproximadamente:
Massas atômicas: H = 1,0; C = 12; O = 16
a) 40 kcal
b) 50 kcal
c) 60 kcal
d) 70 kcal
e) 80 kcal
18. São dadas as entalpias padrão de formação das
seguintes substâncias:
Substâncias /ÐH° de formação (kJ/Mol)
CO2 (g)
∆H° = -393,3
H2O(g)
∆H° = -285,8
CH3 - OH(l) ∆H° = -238,5
Na combustão completa de 0,5 mol de metanol, a 25°C e
1atm de pressão há
a) liberação de 726,3 kJ
b) absorção de 726,3 kJ
c) liberação de 363,2 kJ
d) absorção de 363,2 kJ
e) liberação de 181,6 kJ
19. São dadas as seguintes energias de ligação:
C
om os dados fornecidos é possível prever que a reação
2HCl(g) + F2(g) → 2HF(g) + Cl2(g)
tenha ∆H, em kJ, da ordem de
a) - 584,9, sendo endotérmica.
b) - 352,3, sendo exotérmica
c) - 220,9, sendo endotérmica
d) + 220,9, sendo exotérmica.
e) + 352,3, sendo endotérmica.
2A(g) + B‚(g) → 2AB(g)
colocou-se os seguintes dados:
20. Dado o diagrama de entalpia para a reação X + Y →Z
a seguir, a energia de ativação para a reação inversa Z →
X+Y é:
A velocidade da reação pode ser expressa pela reação
a) v = k 2[A]
b) v = k [B]2
c) v = k [A] [B]
d) v = k [A]2 [B]
e) V = K [A] [B]2
a) 60 kcal.
b) 35 kcal.
c) 25 kcal.
d) 10 kcal.
e) 0 kcal.
21. Seja a reação: X → Y + Z. A variação na concentração
de X em função do tempo é:
A velocidade média da reação no intervalo de 2 a 5
minutos é:
a) 0,3 mol/L.min
b) 0,1 mol/L.min
c) 0,5 mol/L.min
d) 1,0 mol/L.min
22. A decomposição do peróxido de hidrogênio pode ser
representada pela equação:
2H2O2(l) → 2H2O(l) + 1O2(g)
∆H < 0
Das seguintes condições:
I. 25°C e ausência de luz
II. 25°C e presença de catalisador
III. 25°C e presença de luz
IV. 35°C e ausência de luz
V. 35°C e presença de catalisador
aquela que favorece a CONSERVAÇÃO do peróxido de
hidrogênio é
a) I
b) II
c) III
d) IV
e) V
23. No estudo cinético de uma reação representada por
24. A elevação de temperatura aumenta a velocidade das
reações químicas porque aumenta os fatores apresentados
nas alternativas, EXCETO
a) A energia cinética média das moléculas.
b) A energia de ativação.
c) A freqüência das colisões efetivas.
d) O número de colisões por segundo entre as moléculas.
e) A velocidade média das moléculas.
25. 160 gramas de uma solução aquosa saturada de
sacarose a 30°C são resfriados a 0°C. Quanto do açúcar
cristaliza?
Temperatura °C Solubilidade da sacarose
g/100 g de H‚O
0
180
30
220
a) 20 g.
b) 40 g.
c) 50 g.
d) 64 g.
e) 90 g.
GABARITO
1. Verdadeira. Um mol de ar contém 0,209 mol de
oxigênio, portanto, 6,7g de O2.
2. MM = 73,8 u
3. [A]
4. [E]
5. [B]
6. [B]
7. [A]
8. [B]
9. [D]
10. [B]
11. [E]
12. [D]
13. [A]
14. [E]
15. [A]
16. [B]
17. [D]
18. [C]
19. [B]
20. [A]
21. [B]
22. [A]
23. [D]
24. [B]
25. [A]