EQUILÍBRIOS IÔNICOS
É o equilíbrio químico particular que
se estabelece entre uma substância
química e seus íons separados
Constantes de Ionização
Considere os seguintes equilíbrios que ocorrem em solução aquosa:
Os valores de Kc expressam as diferentes tendências que as reações têm para acontecer.
O ácido perclórico(HClO4) possui uma tendência muito maior de liberar íon H+ do que o
ácido cianídrico(HCN).
O HClO4 é mais forte que o HCN
Essas constantes de equilíbrio são conhecidas como constantes de ionização ou
constantes de dissociação ácida sendo simbolizadas por Ka. Quanto maior for o valor da
constante de ionização de um ácido(Ka), maior será a força desse ácido.
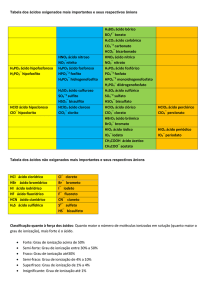
Valores da constante de ionização ácida(K ), a 25°C
Quando um ácido apresenta mais de 1 hidrogênio ionizável, podemos escrever uma
constante de acidez para cada etapa da ionização. Assim,por exemplo para o ácido
sulfúrico:
A primeira ionização ocorre mais facilmente, portanto K1 > K2
Nos poliácidos fracos a concentração hidrogeniônica(H+) pode ser atribuída à primeira
ionização, já que a concentração devida à segunda ionização é desprezível, se comparada
com a primeira ionização.
Da mesma maneira como definimos constante de ionização para ácidos, podemos
fazê-lo para bases. A constante de basicidade é simbolizada por Kb , e analogamente
aos ácidos temos:
LEI DA DILUIÇÃO DE OSTWALD
Expressão matemática que relaciona a constante de ionização (K) com o grau de
Ionização ( a) e a concentração em mol/L de uma solução de um ácido ou base.
Ao adicionarmos um ácido à água, podemos relacionar o número de mol adicionados
com o número de mol ionizado.
Essa relação é dada pela expressão
denominada grau de ionização (a).
Ao adicionarmos n mol do ácido HÁ na água, temos:
Esse nome “Lei da Diluição” se deve ao fato de a fórmula permitir prever o que acontece
quando diluímos uma solução de ácido fraco ou base fraca. A constante de equilíbrio
possui um valor constante a uma temperatura fixa e, dessa forma, o grau de ionização
aumenta(a) quando se diminui a concentração molar de uma solução e vice-versa.