DESENVOLVIMENTO DO SISTEMA
NOCICEPTIVO E SUPRESSOR DA DOR
Márcio Rafael Siega – Acadêmico 4º ano – Medicina
Faculdade de Medicina do Triângulo Mineiro
Uberaba - MG
Introdução
Durante o desenvolvimento do sistema nociceptivo e
supressor da dor, que começa na 6 ª sem/IG, várias fibras
serão diferenciadas, reorganizadas ou destruídas ao longo
da vida embrionária e ainda não serão totalmente
organizadas ao nascimento. Essa reformulação vai
depender
dos
estímulos
,
contextos,
estado
comportamental, atividade neuronal , experiência e
fatores emocionais, étnicos, etários , sexuais e familiares.
Logo, os sinais nociceptivos e as lesões teciduais
contribuem para os processos de maturação do SNC.
Desenvolvimento anatômico
Nociceptores cutâneos
7 ª sem/IG: surge na região perioral
20 ª sem/IG: presente em toda a superfície cutânea e
mucosas
CPME
6 ª sem/IG: início do desenvolvimento das sinapses entre
fibras sensitivas aferentes e internerônios.
30 ª sem/IG: desenvolvimento completo do CPME
(lâmina I)
Córtex
8 ª sem/IG: início do desenvolvimento
20 ª sem/IG: desenvolvimento completo de 1 bilhão de
neurônios
22-26 ª sem/IG: desenvolvimento de conexões tálamocorticais e intracorticais, importantes na percepção
sensitiva, já que a maioria das vias dolorosas fazem
sinapse no tálamo.
Vias nociceptivas:
30 ª sem/IG: início da mielinização dos feixes nervosos da
medula até o tálamo.
30-37 ª sem/IG: início da mielinização dos feixes nervosos
do tálamo até o córtex.
Lactentes e infância: mielinização dos feixes nervosos que
comunica os centros nociceptores como tronco, tálamo e
córtex com hipotálamo e sistema límbico, responsável
pelo componente afetivo da dor.
Desenvolvimento neuroquímico
Ocorre intensa proliferação e diferenciação de
neurônios e aumento do número de receptores.
Neurônios que não são solicitados são destruídos.
Supõe-se que eventos dolorosos acarretam mudanças
na
expressão
de
determinadas
moléculas,
influenciando nas reações aos estímulos dolorosos
posteriores. Logo, experiências dolorosas ocorridas
nos períodos precoces da vida podem comprometer o
comportamento futuro do ser humano frente à dor.
Efeitos imediatos são decréscimo do limiar à
sensibilidade aos 18 meses, alterações no
temperamento aos 3 anos e elevado índice de
somatização dos 3 a 4 anos.
Lesão tecidual libera: íons K+, bradicinina e linfocinas,
gerando prostanóides.
Neuromediadores:
substância P(produzido por 20% dos neurônios
ganglionares do adulto) e serotoninas, os mais
presentes no feto. A sP está relacionado em áreas de
nocicepção. Serotonina age como sinal trófico o
desenvolvimento do cérebro.
Opióides: beta-endorfinas, metencefalinas e dinorfinas:
analgesia no neonato.
Gaba: atua como neuromodulador, tem mais função
trófica do que sináptica no feto.
Neuromediadores:
peptídeo relacionado com o gene da
calcitonina(PGRC)- produzido por 40-50% dos
neurônios ganglionares do adulto, relacionado
com nocicepção.
peptídeo vasoativo intestinal (PVI),
Glutamato,
somatostatina,
RNAm da galanina ,
neuropeptídeo Y (NPY).
Controladores do crescimento neuronal
(neurotrofinas):
Tipos:
NT-3,
Fator neurotrófico derivado do cérebro
(FNDC),
Fator de crescimento nervoso (FCN)
Fator neurotrófico derivado da glia
(FNDG).
Superexpressão de FCN:
Ocorre após lesões teciduais, mesmo no
adulto. Altera a formação da rede
neuronal no sistema nervoso imaturo.
Resulta em hiperinervação (hiperalgesia)
da pele na região de lesões no período
neonatal.
Administração de anti-FCN:
Reduz a sensibilidade à dor em neonatos.
Repercuções da lesão neuronal:
O desenvolvimento do sistema nervoso pré-natal é
mais vulnerável à lesão periférica do que o adulto,
devido à maior dependência dos sinais neurais
oriundos da periferia para a sobrevivência dos
neurônios (uso e desuso).
O FCN e FNDG e a expressão de p75( receptor de
NT) podem prevenir a morte do neurônios
ganglionares que ocorre após a axotomia neonatal. A
perda neuronal se deve a expressão de proteínas que
induzem a apoptose. Os fatores reduzem a
concentração de radicais livres de oxigênio
intracelular, minimizando a morte celular.
AMPA e NMDA e receptores metabotrópicos:
relacionados
com
o
neurotransmissor
Glutamato, e o mecanismo de ação envolve
canais de cálcio e magnésio).
Cainato: regulação de crescimento e
desenvolvimento nervoso. Envolve canais de
cálcio.
Receptores de neurocininas: sP principalmente,
PVI, PGRC, somatostatina, etc).
Receptores opióides: agonistas opióides
realizam ações antinociceptivas no neonato.
Presentes desde o 1 º dia de vida.
Receptores de serotonina: não há evidências de
supressão da dor nos neonatos, porém é uma via
de supressão da dor.
Receptor purinérgico: seus antagonistas possuem
atividade antinociceptiva.
Canais de sódio: um tipo específico é o
responsável
pelas
correntes
das
fibras
nociceptivas. Sua inibição pode contribuir para a
analgesia.
Receptores canabinóides: modulador em gânglios
que produzem sP e PGRC.
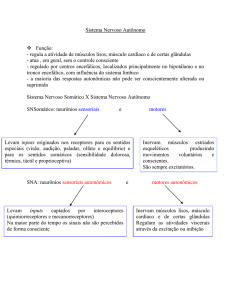
Desenvolvimento do sistema neurovegetativo:
Promovem integração do SNC com os tecidos
inervados, afim de trazer uma resposta aos estímulos
que chegam ao córtex cerebral.
São divididos em dois grupos: simpático e
parassimpático.
SNA simpático: origina das células caudais do tubo
neural. Seu crescimento é dependente de FCN. Fica
pronto só após o nascimento.
SNA parassimpático: origina das células rostrais do
tubo neural. Seu crescimento não depende de FCN.
Comanda funções como freqüência cardíaca e
respiratória no feto e neonato, até a maturação do
Simpático.
Desenvolvimento dos fatores de estresse no feto
humano:
8 ª Sem/IG: hipotálamo produz Dopamina,
Noradrenalina e 5-HT.
8-16 ª Sem/IG: medula espinhal e gânglios da
raiz dorsal produzem sP, PGRC, PVI, NKA,
somatostatina.
10 ª Sem/IG: medula da adrenal:
noradrenalina.
15-18 ª Sem/IG: hipófise - ACTH, endorfina e
FLC
20 ª Sem/IG: córtex da adrenal – ACTH
hipofisário produz cortisol.
Desenvolvimento funcional
Até a 20 ª Sem/IG , o cérebro já apresenta sinais de
atividade.
Atividade das vias supressoras da dor: vias rostrocaudais como vias adrenérgicas, serotoninérgicas e
interneurônios do CPME. Estas vias estão imaturas no
neonato, controlando menos a aferência, ficando prontas
nas primeiras semanas de vida, o que explica reflexos
vigorosos do neonato à dor. Essa imaturidade talvez é
devido aos baixos níveis d naurotransmissores e à baixa
atividade dos receptores.
Os
estímulos
dolorosos
induzem
a
reações
comportamentais reflexas. Logo, as vias nociceptivas
estão ativas, mas será que o feto ou neonato tem
consciência da dor?
Tipos de reações comportamentais no feto.
7 ª Sem/IG: inclinação da cabeça após
estimulação tátil na região perioral.
10 ª Sem/IG: mãos sensíveis ao toque.
24-28 ª Sem/IG: sono calmo e ativo, vigília
calma e ativa, variação diurna.
25 ª Sem/IG: responde a estímulos acústicos,
sensação vestibular.
26 ª Sem/IG: responde à luz, expressão facial
específica à dor. Relacionado com a formação
do sistema motor emocional, responsável por
expressões facias.
Caracteriza-se pela extensão contralateral
dos membros superiores quando a
estimulação é repetida. A estimlação
mecânica repetida de prematuros até 32
sem/IG gera sensibilização, refletindo
hiperexcitabilidade da ME neonatal e
resulta aumento da amplitude e número de
respostas e queda no limiar de atividade
neuronal. Com o progredir da IG, as
conexões na ME são reorganizadas e
diminuem a excitabilidade e aumenta o
limiar de sensibilização.
Alodínea pode ser demonstrada em neonatos
prematuros extremos após lesão tecidual. O
limiar do RFC evocado no pé lesado foi
menor que o pé contralateral não lesado.
Procedimentos repetidos (lancetagem do
calcanhar) diminuem o limiar do RFC nos
neonatos e geram hiperalgesia secundária,
desencadeando respostas comportamentais
mais intensas, incluindo retirada rápida do
membro e movimentos corporais difusos e
globais.
Diferenciação entre dor e nocicepção:
Nocicepção envolve interações neuronais
complexas , que envolvem sistemas excitatórios
e supressores, e reflexos comportamentais a
estímulos dolorosos.
Dor envolve nocicepção(percepção da dor) e
consciência da dor , sua origem, seu significado,
suas conseqüências e como aliviar. Para isso ,
deve haver atividade cortical, que é evidenciado
pelo choro, expressão facial, capacidade de
visualização e consciência espacial de pessoas e
objetos.
Bases neurobiológicas do
desenvolvimento psicológico na
infância
Pode-se correlacionar temporalmente o
aparecimento de um comportamento com
a emergência de novas conexões no SNC,
mas não que estas conexões sejam causa
primária do fenômeno comportamental.
Inibição do tronco encefálico: diferenciação dos
neurônios piramidais em GABAérgicos, inibindo
interneurônios que vão frear os reflexos de
preensão palmar aos 3 meses de idade.
1) Sorriso endógeno, relacionado ao N. facial e
trigêmio que surgem do tronco encefálico.
2) Choro espontâneo: inibição do tronco pelo
córtex, modulando formação reticular, substância
cinzenta periaquedutal , núcleo do trato solitário e
núcleo parabraquial, estruturas que controlam os
movimentos respiratórios e laríngeos envolvidos na
vocalização aflitiva e choro.
Melhora da memória de reconhecimento:
Desenvolvimento de conexões tálamohipocampais nos 2 a 3 meses de vida.
Melhora da memória de ação:
Capacidade de resgatar memórias.
Desenvolvimento de conexões no córtex
pré-frontal nos 7 a 9 meses de vida.
Ansiedade da separação e medo de
estranhos:
O medo surge quando o bebê vê a
aproximação do adulto não-familiar e o
compara com as imagens que tem dos
adultos familiares, pois ele não consegue
unir essas imagens. Até os 4 e 5 meses, o
bebê não tem esse medo, e aos 10 meses de
vida, com o desenvolvimento de conexões
entre córtex e amígdala através da capsula
interna, são proeminentes o medo de
estranhos e da separação.