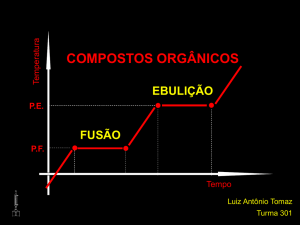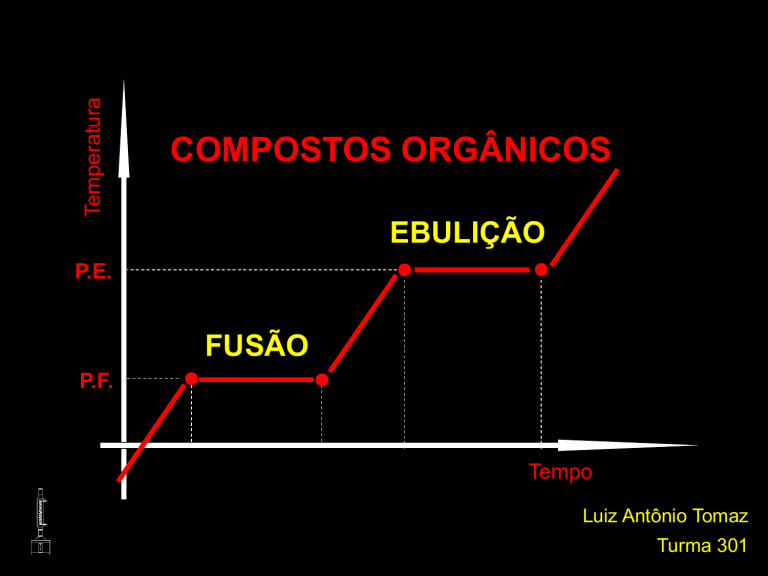
Temperatura
COMPOSTOS ORGÂNICOS
EBULIÇÃO
P.E.
FUSÃO
P.F.
Tempo
Luiz Antônio Tomaz
Turma 301
Uma substância pode ser sólida,
líquida ou gasosa.
Dependendo, é claro,da temperatura e
da pressão em que se encontre.
Quase todos os corpos, com o aumento
de temperatura, passam do estado
sólido ao líquido e, daí, ao gasoso.
Toda mudança de estado é
acompanhada de absorção ou
de liberação o de energia. Na
fusão de um sólido e na
evaporação de um líquido há
recebimento de energia do
exterior.
Na condensação de um gás e
na solidificação de um líquido
há envio de energia ao
exterior.
Resumindo . . .
Energia (calor) fornecida
O fornecimento de
energia faz com que
diminuam as forças de
atração entre as
moléculas, o que
facilita a separação
das mesmas.
Atração molecular menor
Assim, quanto maiores forem as interações entre
as moléculas, mais fortemente unidas estarão e
mais difícil será a mudança de estado físico.
(A) Gás
(B) Líquido
(C) Sólido
Saliente-se que dois fatores estão diretamente ligados
ao aumento dessas interações:
1. Massa molecular
(tamanho da molécula)
2. Forças intermoleculares
propano
Massa molecular
O aumento da massa
molecular dificulta o
desprendimento de uma
molécula da fase sólida
ou líquida, para passar,
por exemplo, para a
fase gasosa.
P.E. - 42 °C (231,1 K )
n-octano
P.E. 125,52 °C (398,7 K)
Forças intermoleculares
Sendo mais intensas as
forças de atração entre as
moléculas, maior a
dificuldade em separá-las;
maiores são os pontos de
fusão e de ebulição.
Forças intermoleculares
APOLAR
(dipolo . . .)
POLAR
(dipolo . . .)
MUITO POLAR
instantâneo-induzido
permanente-permanente
pontes de hidrogênio
> forças intermoleculares > P.F. e P.E.
Mas atenção ! ! !
x
METANO
P.E. – 161ºC
ETANO
P.E. – 89ºC
Se quisermos comparar P.F. e
P. E. de várias
substâncias, precisamos
manter constante um dos
fatores.
As funções orgânicas
Diante do que foi exposto até
agora, a seguir,
analisaremos pontos de
fusão (P.F.) e de ebulição
(P.E.), considerando-se
algumas das principais
funções orgânicas.
Hidrocarbonetos
Sendo constituídos por moléculas apolares
(ligações intermoleculares são dipolo
instantâneo-dipolo induzido), não há
interações muito fortes.
Hidrocarbonetos
Mas essas forças aumentam com
aumento das cadeias carbônicas
(massas moleculares),
aumentando também os P.F. e
P.E.
Decano, HC de cadeia longa.
Hidrocarbonetos
FÓRMULA
P.E. (ºC)
Metano
CH4
- 161
Etano
CH3CH3
- 89
Propano
CH3CH2CH3
- 42
n- butano
CH3 CH2 CH2CH3
-1
n-pentano
CH3 CH2 CH2 CH2CH3
36
n-hexano
CH3 CH2 CH2 CH2 CH2CH3
69
AUMENTO
SUBSTÂNCIA
Ainda os Hidrocarbonetos . . .
Ramificação
O que acontece quando,
comparando dois
hidrocarbonetos que têm
massas moleculares
equivalentes, um apresenta
cadeia linear e outro com
cadeia ramificada?
2-metil-pentano
Metil-butano, MM = 72u;
P.E. = 28ºC(1 atm)
Ainda os Hidrocarbonetos . . .
X
AUMENTO
Nesse caso, terá maior P.F.
e de P.E. o de cadeia
normal. É que a cadeia
normal aumenta a superfície
de contato, aumentando as
forças intermoleculares.
n-pentano, M.M. = 72u;
P.E. = 36ºC(1 atm)
Ainda os Hidrocarbonetos . . .
A parafina, por exemplo, é
sólida em temperatura
ambiente. Atribui-se aos seus
30 atomos de carbono o alto
ponto de fusão.
A parafina é composta por
alcanos (hidrocarbonetos).
Ainda os Hidrocarbonetos . . .
Aliás, o fracionamento
do petróleo, mistura
de vários
hidrocarbonetos, se
baseia exatamente
nesse fator
determiante dos
respectivos pontos de
ebulição.
Destilação fracionada do petróleo
1- Retirada do sal e da água, que se misturaram ao petróleo.
2 - Aquecimento do óleo em fogo direto a 320ºC e, então, ocorre separação.
3 – O petróleo é aquecido junto com vapor de água, facilitando a destilação.
4 - Saída dos produtos, já separados..
5 - Produtos consumíveis.
Destilação fracionada do petróleo
Quanto maior a quantidade de carbonos, maior o ponto de ebulição (P.E.).
Destilação fracionada do petróleo
FRAÇÃO
INTERVALO DE
TEMPERATURA
PRINCIPAIS COMPONENTES
GLP
-165º a 30ºC
CH4 C2H6 C3H8 C4H10
Éter do petróleo
30º a 90ºC
C5H12 C6 H14 C7H16 C8H18 C9H20 C10H22
Gasolina
30º a 200ºC
C10H22 C11H24 C12H26 C13H28 C14H30 C15H32
Querosene
175º a 275ºC
Moléculas maiores
Óleos
Lubrificantes
175º a 400ºC
Moléculas maiores
Parafina
350ºC
Moléculas maiores
Alcatrão
resíduo
Moléculas maiores
Por essa tabela, podemos perceber que os gases são os
primeiros produtos a se separar do óleo bruto.
Os álcoois são ótimos
combustíveis, especialmente
os de cadeia curta, por serem
bastante energéticos. Poluem
menos que os hidrocarbonetos
e, fundamentalmente, são
renováveis.
CH3 – CH2 – CH2 – CH2 – CH2 – OH
Álcoois
1 - pentanol
Álcoois
Os álcoois, do ponto de vista
de ligações intermoleculares,
são muito polares, devido às
pontes de hidrogênio.
Ponte de hidrogênio
M.M. = 74u; P.E. = 118ºC
Quanto maior for a massa
molecular (tamanho da
molécula), maiores serão os
pontos de fusão e de ebulição.
n-butanol
Álcoois
Álcoois
A tabela mostra . . .
FÓRMULA (M.M.)
P.E. (ºC)
Metanol
CH3OH (32)
64,5
Etanol
CH3CH2OH (46)
78,3
1-propanol
CH3CH2CH2OH (60)
97,0
1- butanol
CH3 CH2 CH2CH2OH (74)
118,0
1-pentanol
CH3 CH2 CH2 CH2CH2OH (88)
138,0
1-hexanol
CH3CH2CH2CH2CH2CH2OH (102)
157,1
AUMENTO
SUBSTÂNCIA
Ramificação.
Álcoois
Os álcoois de cadeia
normal possuem P.F. e
P.E. maiores do que os
de cadeia ramificada,
desde que tenham
M.M. equivalentes.
2-propanol
M.M. = 74u; P.E. = 108ºC
n-butanol
M.M. = 74u; P.E. = 118ºC
Álcoois x poliálcoois
etano-1, 2-diol
M.M. = 62u; P.E. = 197,3 °C
1-propanol
M.M. = 60u; P.E. = 97,0 °C
O aumento do número
de hidroxilas (- OH), faz
com que aumentem P.F.
e P.E., pois mais pontes
de hidrogênio são
formadas.
Álcoois x ácidos carboxílicos
H
Grupo
funcional
Quanto às forças
intermoleculares, álcoois e ácidos
carboxílicos se assemelham, mas
estes formam duas pontes de
hidrogênio, sendo mais polares
que os primeiros.
O
C
O
Álcoois x ácidos carboxílicos
O
H
C
O
O
C
H
O
As duas pontes de hidrogênio
aumentam a polaridade.
Álcoois x ácidos carboxílicos
As consequências disso . . .
SUBSTÂNCIA
FÓRMULA (M.M.)
P.E. (ºC)
Etanol
Ácido metanoico
1-propanol
Ácido etanoico
CH3CH2OH (46)
HCOOH (46)
CH3CH2CH2OH (60)
CH3COOH (60)
78,3
100,5
97,0
118,0
Ácidos carboxílicos x ácidos carboxílicos
Como vimos,espera-se dos ácidos carboxílicos
elevados P.F. e P.E., em especial com o aumento da
cadeia carbônica.
SUBSTÂNCIA
FÓRMULA
P.E. (ºC)
Ácido metanoico
Ácido etanoico
Ácido propanoico
CHOOH
CH3COOH
CH3CH2COOH
100,5
118,0
141,0
163,5
Outras funções orgânicas
Quero dizer que, para
outras funções
orgânicas, valem os
fatores analisados até o
momento, ou seja,
forças intermoleculares
e tamanho da molécula.
O
Aldeídos e cetonas
C
R1
R2
O grupo funcional dos aldeídos e das cetonas
determina que as moléculas sejam polares (dipolodipolo permanente). Não há pontes de hidrogênio. Isso
propicia P.F. e P.E. menos elevados em relação aos
álcoois, por exemplo. Contudo, aumentam com o
aumento da cadeia carbônica.
Aldeídos e cetonas
FÓRMULA
P.E. (ºC)
Metanal
HCHO
- 21
Etanal
CH3CHO
20
Propanal
Propanona
CH3CH2CHO
CH3 – CO – CH3
49
56
Butanal
Butanona
CH3CH2CH2CHO
CH3 – CO – CH2CH3
76
80
AUMENTO
SUBSTÂNCIA
Fenois
Os fenois são polares
devido à presença do
grupo – OH. Também são
oobservadas as pontes de
hidrogênio. Vale também
para análise dos P.F. e
P.E. o tamanho da
molécula (M.M.).
Curiosidade !
O “peeling” consiste na aplicação
de fenol, um esfoliante da pele,
resultando na destruição de
partes da epiderme ou derme,
seguida de regeneração dos
tecidos com o surgimento de uma
nova pele.
Fenois
Curiosidade !
À direita, paciente 7 dias
após”peeling” com fenol.
Será o “peeling”
seguro? O que leva
as pessoa à
realização de tal
procedimento?
Fenois
Fenol, P.E.(ºC, 1 atm) = 182
Ortocresol, P.E.(ºC, 1 atm) = 191
Éteres
Éter etílico
(etoxietano)
O éter etílico possui como propriedade
característica a extrema volatilidade.
Por quê?
Éteres
O fraco momento dipolar (entenda-se moléculas apolares)
propicia aos éteres baixos P.F. e P.F., comparando-se, por
exemplo, com álcoois e fenois de M.M. próximas.
Éteres
FÓRMULA
P.E. (ºC)
Metoximetano
H3COCH3
- 24
Metoxietano
CH3OCH2CH3
8
Etoxietano
CH3CH2OCH2CH3
35
Propoxibutano
CH3CH2CH2OCH2CH2CH3
91
AUMENTO
SUBSTÂNCIA
c
Éteres
O éter dimetílico (DME) é o mais
simples dos éteres. Atualmente, essa
substância, por seu baixo P.E. e por
não ser tóxica, vem sendo utilizada
em “sprays” nas áreas de pintura,
cosmética, ... , em substituição aos
chamados CFC’s.
Ésteres
Etanoato de metila.
Os ésteres resultam da reação de ácido
carboxílico com álcool . . .
Ésteres
Ácido propanoico
Etanol
Propanoato de metila
(ester)
Tal reação é dita esterificação.
Água
Ésteres
Lembrando que
flavorizantes são
substâncias ou misturas,
normalmente ésteres,
acrescentadas a um
alimento, bebida ou
medicamento para
suplementar ou modificar
seu "flavor" próprio ou para
mascarar o original.
Ésteres
Por exemplo, acetato
de etila possui odor
agradável,
semelhante ao de
frutas sendo
comercializado com o
nome de acetila.
Ésteres
E quanto aos P.F. e P.E.
dos ésteres?
Perceba, primeiramente, as
polaridades das moléculas
de ácido carboxílico e de
álcool, as quais dão origem
aos ésteres.
Ésteres
Entretanto, com o
surgimento do grupo
funcional característico dos
ésteres não há polaridade
significativa. Mais
especificamente, não há
pontes de hidrogênio.
Ésteres
Assim, são líquidos
com M.M. pequena e
viscosos ou sólidos
com M.M. maior, em
temperatura
ambiente.
Ésteres
FÓRMULA
P.E. (ºC)
Etanoato de metila
H3CCOOCH3
57,5
Etanoato de etila
H3CCOOCH2CH3
77,0
Etanoato de n-propila
H3CCOOCH2CH2CH3
102,0
Etanoato de n-butila
H3CCOOCH2CH2CH2CH3
126,0
AUMENTO
SUBSTÂNCIA
c
Aminas
Ponte de hidrogênio
Além disso, podem formar
pontes de hidrogênio
(exceto aminas terciárias).
Aminas
Trimetilamina
Aminas têm geometria
piramidal (derivados da
amônia), resultando em
significativa polaridade.
Aminas
Cheiro de peixe: moléculas
volatilizadas de metilamina.
Apresentam P.F. e
P.E. maiores do
que dos
hidrocarbonetos
(apolares).
Entretanto, notase que são
menores do que
os dos álcoois e
dos ácidos
carboxílicos.
Aminas
Aminas terciárias têm P.F.
e P.E. menores, pois não
há presença de pontes de
hidrogênio. Já as aminas
secundárias (maiores
M.M.) apresentam P.F. e
P.E. mais elevados do que
as secundárias.
Aminas
FÓRMULA
P.E. (ºC)
Metilamina
H3C - NH2
- 7,5
Dimetilamina
(H3C)2 - NH
7,5
Etilamina
C2H5 - NH2
17,0
Dietilamina
(C2H5)2 – NH
55,0
AUMENTO
SUBSTÂNCIA
c
Amidas
H
H
Nas amidas, as forças
intermoleculares são do
tipo polares e intensas.
Além disso, os grupos
carbonila e amina
determinam várias pontes
de hidrogênio.
Amidas
Em consequência, os
P.F. e P.E. das amidas
são elevados, inclusive
na comparação com
álcoois e ácidos
carboxílicos de M.M.
equivalentes.
Ureia: amida sólida em
temperatura ambiente.
Uma questão de vestibular
(ITA) – Assinale a alternativa que contém a afirmação falsa, comparandose 1-propanol e 1-butanol:
(A) A temperatura de ebulição do 1-butanol é maior.
(B) Na maioria dos compostos orgânicos predominam ligações covalentes.
(C) Nas condições de operação, a volatilidade do 1-butanol é maior.
(D) O 1-propanol é mais solúvel em água.
(E) O 1-butanol é mais solúvel em n-hexano.