Figura 1. Clone SmAST03
(A) Sequência de aminoácidos (394 aa) do inserto do clone SmAST03; em letras
minúsculas, 5´ 3´ UTR e cauda poli A; em letras maiúsculas, sequência codificadora
(RHOct) e aminoácidos correspondentes. (B) Sequência de aminoácidos de RHOct
correspondentes aos últimos 39 aminoácidos de Rho GTPase de Schistosoma
mansoni. Em destaque, sítio ativo SAK (amarelo) e sítio de Genranilgeranilação
(vermelho)
Figura 2. Clonagem do fragmento RHOct no vetor PCR2.1 topo.
Evidencia-se um gel de agarose 1% corado com brometo de etídeo; Observamos o
padrão de 100 pares de base (1), reações de PCR realizadas com os plasmídeos
pBlueScript/SmAST03 (2) e PCR2.1/RHOct (3-6) usando os primers RHOctF e RHOctR
(2 e 3), M13R e M13U (4), RHOctF e M13U (5), RHOctR e M13R (6) e os produtos da
digestão do plasmídeo PCR2.1/RHOct com a enzima de restrição BamHI (7).
Figura 3. Clonagem do fragmento RHOct no vetor pcDNA 3.1+.
Observamos um gel de agarose 1% corado com brometo de etídeo contendo padrão
100 pares de base (1); fragmento RHOct (2) purificado da digestão de PCR2.1/RHOct
com BamHI; plasmídeo pcDNA 3.1+ (3) digerido com BamHI; produtos da amplificação
por PCR do plasmídeo pcDNA 3.1/RHOct usando os primers RHOctF e RHOctR (4),
RHOctF e BGHR (5); produtos da digestão com BamHI do plasmídeo pcDNA
3.1+/RHOct.
Figura 4. Pareamento de RHOct com Rho GTPase de Schistosoma mansni.
Figura 5. Cultivo de células dendríticas da medula óssea de camundongos BALB/c.
Observamos fotos representativas de diferentes cultivos de céluas dendríticas no
aumento de 300X. Em destaque, no 1o dia de cultivo, grumos de células em divisão
(setas maiores) e células esféricas indiferenciadas por todo campo. No 5 o dia de cultivo,
grumos menores de céluals em divisão (setas maiores), presença de células esféricas
indiferenciadas (setas menores) e, por todo campo, células com morfologia típica de
células dendríticas – maiores, granulosas e com projeções laterias. No 8 o dia de cultivo,
observamos células dendríticas.
Figura 6. Ensaio de MTT de células dendríticas cultivadas em diferentes tempos na
presença de solução de MTT.
Observamos a progressão da formação e deposição de cristais de formazan nas
células dendríticas viáveis (aumento 300X).
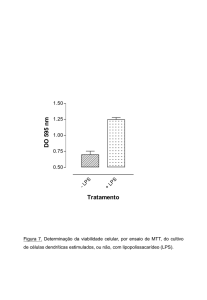
Figura 7. Determinação da viabilidade celular, por ensaio de MTT, do cultivo de células
dendríticas estimulados, ou não, com lipopolissacarídeo (LPS).
Figura 8. Fagocitose apresentada por células dendríticas cultivadas na presença de
esferas de látex conjugadas a isotiocianato de fluoresceína (FITC).
Observa-se, em microscopia de confocal, (A) Célula dendrítica em luz transmitida no
aumento de ........ X. (B) Fluorescência das esferas – FITC em consequência da
incidência do laser a ........ nm. (C) Imagem sobreposta de A e B, a fluorescência das
esferas – FITC coincide com a região citoplasmática da célula dendrítica.
Figura 9. Taxa de fagocitose das esferas – FITC por células dendríticas cultivadas em
diferentes tratamentos.
Est – Estufa; Sk – Agitação.
Figura 10. Célula dendrítica cultivada após transfecção com plasmídeo DsDIIred.
Observa-se, em microscopia de confocal, uma célula dendrítica (A) em luz transmitida
no aumento de ......X. (B) Fluorescência emitida pela proteína RFP em consequência da
incidência do laser a ....... nm. (C) Imagem sobreposta de A e B, a fluorescência da
RFP coincide com a região citoplasmática da célula dendrítica.
Figura 11. Determinação da viabilidade celular, por ensaio de MTT, de células
dendríticas transfectadas com DsDIIred ou pcDNA3.1/RHOct em diferentes tempos de
cultivo.
Figura12. Determinação da viabilidade celular, por ensaio de MTT, de células
dendríticas transfectadas com DsDIIred em diferentes concentrações do reagente de
transfecção effectene.