Gustavo Vila Nova Alves
Lorena Pierina Marcelino Cordeiro
Introdução
Aminas
Hidrocarbonetos
Amidas
Álcoois
Haletos Orgânicos
Fenóis
Referências
Éteres
Ésteres
Aldeídos
Cetonas
Ácidos Carboxílicos
Bibliográficas
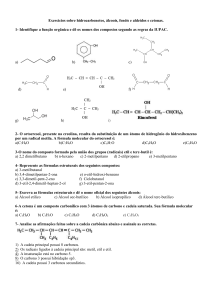
Os compostos orgânicos são constituídos por átomos de
carbono distribuídos em cadeias ou átomos ligados
diretamente a átomos de hidrogênio.
Eles podem ser sintetizados naturalmente (por
organismos vivos) ou artificialmente, o que foi
comprovado pelo químico Friedrich Wöhler.
Eles são classificados de acordo com radicais ligados à
cadeia de carbono. Compostos com o mesmo radical
possuem características e funções semelhantes.
Os hidrocarbonetos possuem em sua constituição
apenas átomos de carbono e hidrogênio.
Os hidrocarbonetos de cadeia aberta são divididos em:
alcanos (com apenas ligações simples); alcenos (com
uma ligação dupla); alcinos (com uma ligação tripla);
alcadienos (com duas ligações duplas).
Os de cadeia fechada são divididos em: cicloalcanos
(com apenas ligação simples); cicloalcenos (com uma
ligação dupla); aromáticos (com ligações simples e
duplas alternadamente).
Alcano
Butano (C4H10)
Alceno
Eteno (C2H4)
Alcino
Alcadieno
Etino (C2H2)
Conhecido como Acetileno
1,3-butadieno (C4H6)
Cicloalcano
Cicloalceno
Ciclohexano (C6H12)
Ciclobuteno (C4H6)
Aromáticos
Anel Benzeno (C6H6)
Hidrocarbonetos de até 4 carbonos são gasosos ao
nível do mar e temperatura ambiente, quando
apresentam de 5 a 17 carbonos são líquidos e acima de
17 são sólidos.
Apresentam baixa densidade , no máximo 1,0 g/cm³
Compostos praticamente apolares, suas moléculas se
mantêm unidas por dipolo induzido.
São utilizados nas indústrias petroquímicas pois esses
hidrocarbonetos constituem grande parte do petróleo
fornecendo matéria prima para diversos materiais
como borracha, plástico, tintas entre outros.
Os álcoois são constituídos pelo grupo hidroxila ligado a
um ou mais átomos de carbono.
Esses compostos são classificados de acordo com a
posição da hidroxila e seu número sendo distintos em:
monoálcool (apenas uma hidroxila); diálcool (duas
hidroxilas); Poliálcool (mais de dois grupos hidroxilas);
álcoois primários (hidroxila ligada a extremidade da
cadeia); álcoois secundários (hidroxila unida ao carbono
secundário); álcoois terciários (hidroxila ligada ao
carbono terciário); álcool de cadeia aberta (cadeia
linear); álcool de cadeia cíclica (cadeia fechada); álcool
de cadeia aromática (presença de anel benzeno)
Monoálcool
Diálcool
Propanol-1 (C3H7OH)
(C2H4(OH)2)
HO-CH2-CH2-OH
Poliácool
Álcoois primários
Glicerina (C3H5(OH)3)
Metanol (CH3OH)
Álcoois primários e saturados de cadeia normal com
até 11 carbonos são líquidos e incolores , acima de 11
carbonos são sólidos;
São muito reativos;
Os principais álcoois são: Metanol, Glicerol e o Etanol.
São compostos que apresentam o grupo hidroxila ligado
diretamente ao anel benzênico , esse grupo pode ser
divido em fenóis comum e Cresóis.
O cresól apresenta fórmula molecular C7H8O .
Já o fenol comum apresenta a formula molecular
C6H6O.
Alguns dos compostos que são formados com o fenol
comum são: aspirina; ácido pícrico; baquelítes;
fenolftaleína.
Fenol comum
Hidroxibenzeno
Cresóis
Apresentam ação antibacteriana e fungicida;
São incolores e se apresentam no estado sólido em
geral;
São extraídos do alcatrão da hulha;
Possuem aplicação na fabricação de cosméticos,
resinas, corantes e até explosivos.
São compostos com um átomo de oxigênio entre 2
cadeias de carbono, ou seja um oxigênio ligado a dois
átomos, os éteres são classificados de acordo com os
radicais ligados ao oxigênio.
Éter simétrico : radicais são iguais.
Éter assimétrico : radicais são diferentes.
Éter simétrico
Éter assimétrico
São pouco solúveis e incolores;
Éteres de maior massa molar estão em um estado
sólido ,com dois ou três carbonos são líquidos e acima
de 3 carbonos voláteis;
Antigamente; eram utilizados na medicina como
anestésico, porém causam irritação no trato
respiratório;
Hoje em dia são utilizados como solvente de tintas e
também na fabricação das sedas e outros materiais.
Semelhantes aos éteres com um oxigênio entre os
radicais de carbono, porém os ésteres apresentam um
grupo carbonilo(CO) também entre os radicais carbono.
São ligados por um radical alifático ou aromático (ou seja
grupo carbonila ligado a um carbono primário) e além
disso os aldeídos são ligados a um ou mais grupos
formila ou aldoxila (conhecida como CHO) sempre
localizado na extremidade da cadeia.
Cetonas também apresentam um grupo carbonila, porém não
ligado a um carbono primário como os Aldeídos, mas sim
ligados a um carbono secundário onde acaba se formando um
grupo funcional.
A classificação das cetonas se dá em relação a quantidade de
carbonilas e seu radical, podendo ser classificada em: cetona
simétrica (quando apresenta radicais iguais dos dois lados da
carbonila) ou cetona assimétrica (quando os radicais não são
iguais).
Além disso essas cetonas podem ser classificadas de acordo
com o número de carbonilas (monocetonas - 1 carbonila;
dicetonas; tricetonas e assim por diante).
Cetona simétrica
Cetona assimétrica
São basicamente compostos por uma carboxila
(carbonila+hidroxila) e tem como grupo funcional o COOH
Apresentam um ponto de ebulição e fusão maiores que
os álcoois quando apresentam mais de 10 carbonos;
São conhecidos como ácidos graxos;
Podem ser obtidos com a oxidação dos álcoois ou
aldeídos.
Aminas são compostos que apresentem nitrogênio em
sua cadeia. Com no máximo3 radicais orgânicos se
ligando a esse nitrogênio, ou dois ao NH ou apenas um
radical ao NH2.Esses radicais podem ser a Alquila ou
Arila.
Podem ser divididas em: amina primária(apenas 1
hidrogênio substituído pelo seu radical);amina
secundária(2 hidrogênios substituídos pelo seu
radical);amina terciária(3 hidrogênios substituídos pelo
seu radical).
Podem ser encontradas nos 3 estados físicos;
Quase sempre são incolores;
Podem ser encontradas em alguns compostos extraídos
de vegetais.
Amidas são compostos derivados da amônia (NH3),
apresentam o carbono e o grupo carbonila (C=O) e
também o grupo amina (NH2) em sua forma mais
simples é determinada como metanamida ,também
pode apresentar cadeias carbônicas mais extensas ,que
costumam apresentar substâncias sólidas e incolores.
Uma das amidas mais conhecidas é a uréia produzida
pelos animais , o produto final do metabolismo dos
mamíferos , ocorrendo na urina e em pequenas doses
no sangue.
São polares
Essas amidas podem ser utilizadas como adubo, assim
como em medicamentos e na produção de polímeros
como o nylon
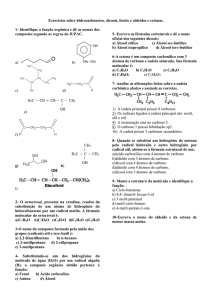
Substancias provenientes de um ou mais hidrogênios
que sofrem troca por um halogênio
Esses haletos orgânicos podem ser classificados de
acordo com o halogênio presente na cadeia carbônica
(Fluoreto-Fluor;Brometo-Bromo;Cloreto-Cloro;IodetoIodo)
Também pode ser classificado seu numero de atómos
halogênos (1-Mono-haleto;2-Di-haleto;3-Tri-haleto...)
Sua reatividade é tão contrastante que se divide em
mais dois grupos (Haletos de arila e Haletos de
Alquila)
Haletos de Alquila- Apresenta apenas 1 halogênio
ligado a um carbono saturado de hidrocarboneto de
cadeia aberta (CH3-CH2-CH2-I)
Haletos de Arila- Apresenta halogênio ligado
diretamente ao anel bênzenico
Esses haletos são utilizados principalmente como
solventes de plásticos , inseticidas e gases de
refrigeração .
http://www.brasilescola.com/quimica/alcoois.htm
http://www.mundoeducacao.com.br/quimica/classificacao-dos-alcoois.htm
http://www.educacaoadventista.org.br/ensino
medio/macetes/1119/identificacao-de-funcoes-organicas.html
http://www.brasilescola.com/quimica/funcoes-organicas.htm
http://www.infoescola.com/quimica/funcoes-organicas/
http://www.alunosonline.com.br/quimica/caracteristicas-propriedades-doshidrocarbonetos.html
http://www.brasilescola.com/quimica/fenois.htm
http://www.brasilescola.com/quimica/principais-fenois.htm
http://www.mundoeducacao.com.br/quimica/fenois.htm
http://www.portalsaofrancisco.com.br/alfa/funcoes-inorganicas/funcoesinorganicas-8.php
http://www.alunosonline.com.br/quimica/eteres.html
http://www.mundoeducacao.com.br/quimica/eteres.htm