Modelos Atômicos
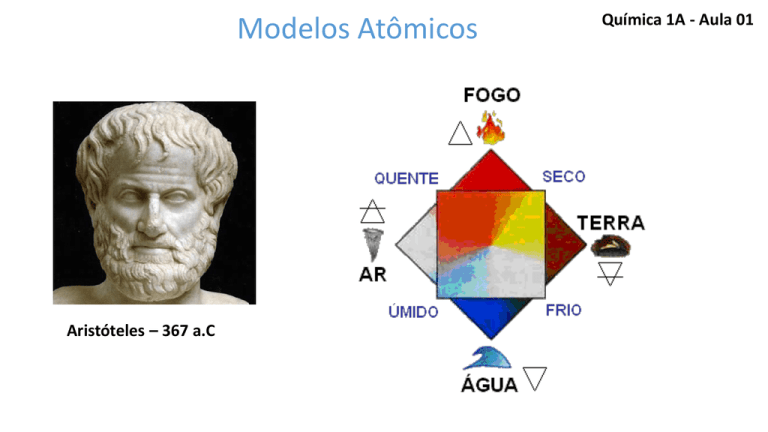
Aristóteles – 367 a.C
Química 1A - Aula 01
Modelos Atômicos
Química 1A - Aula 01
Leucipo e Demócrito (478 a.C.)
A matéria é descontínua e formada por partículas
indivisíveis: os átomos.
(A = Não ; tomo = parte )
ÁTOMO = não + divisível
Química 1A - Aula 01
Modelos Atômicos
Baseado nas “Leis Ponderais” (1808)
Modelo atômico de Dalton
Baseados nos experimentos de Lavosier e
Proust, o inglês John Dalton propõe a primeira
teoria atômica experimental em 1808. Seu
modelo é apelidadado de bola de bilhar, por
acreditar que o átomo é uma pequena bola
maciça e indivisível.
Esfera maciça;
Indivisível;
Indestrutível;
Imperecível;
Sem carga elétrica;
“Bola de Bilhar”
John Dalton
Modelos Atômicos
Química 1A - Aula 01
Modelo atômico de Thomson
Descoberta dos elétrons e os
raios catódicos
Após realizar diversas experiências utilizando
a ampola de Crookes, o físico britânico John
Thonson concluiu que o atómo possuia
particulas menores, ou seja, era divisível.
Essas particulas menores se chamam elétrons
e possuem cargas negativas.
John Dalton
J.John Thomson
Ampola de Crookes
raios catódicos
Modelos Atômicos
Química 1A - Aula 01
Ampola de Crookes
raios catódicos
Os raios tem trajetória reta
Os raios possuem massa
Os raios são de natureza negativa
Modelos Atômicos
Química 1A - Aula 01
Modelo atômico de Thomson
Descoberta dos elétrons e os
raios catódicos
Esfera maciça
Após realizar diversas experiências utilizando
a ampola de Crookes, o físico britânico John
Thonson concluiu que o atómo possuia
particulas menores, ou seja, era divisível.
Essas particulas menores se chamam elétrons
e possuem cargas negativas.
Positiva
Divisível
Indestrutível
Imperecível
Com carga elétrica
“Pudim de passas”
John Dalton
J.John Thomson
(UFSC) Uma das principais partículas atômicas é o elétron. Sua
descoberta foi efetuada por J. J. Thomson em uma sala do Laboratório
Cavendish, na Inglaterra, ao provocar descargas de elevada voltagem
em gases bastante rarefeitos, contidos no interior de um tubo de vidro.
No tubo de vidro “A”, observa-se que o fluxo de elétrons (raios
catódicos) colide com um anteparo e projeta sua sombra na parede
oposta do tubo.
No tubo de vidro “B”, observa-se que o fluxo de elétrons (raios
catódicos) movimenta um catavento de mica.
No tubo de vidro “C”, observa-se que o fluxo de elétrons (raios
catódicos) sofre uma deflexão para o lado onde foi colocada uma
placa carregada positivamente.
Observando os fenômenos que ocorrem nos tubos, podemos afirmar
CORRETAMENTE que:
01. gases são bons condutores da corrente elétrica.
02. os elétrons possuem massa – são corpusculares.
04. os elétrons possuem carga elétrica negativa.
08. os elétrons partem do cátodo.
16. os elétrons se propagam em linha reta.
32. o catavento entrou em rotação devido ao impacto dos elétrons
na sua superfície.
Modelos Atômicos
Química 1A - Aula 01
Modelo atômico de Rutherford
As experiências realizadas por Ernest
Rutherford, mostraram que o átomo era
muito mais complexo do que o apresentado
pelo modelo de Thomson. Utilizando a boa
vontade de dois de seus alunos (Geiger e
Marsden), partículas alfa positivas e uma
lâmina de ouro ele conseguiu provar que o
átomo era um grande espaço vazio.
Rutherford
John Dalton
J.John Thomson
Experiência de Rutherford
Modelos Atômicos
Química 1A - Aula 01
Modelos Atômicos
Os átomos são nucleares.
Modelo atômico de Rutherford
As experiências realizadas por Ernest
Rutherford, mostraram que o átomo era
muito mais complexo do que o apresentado
pelo modelo de Thomson. Utilizando a boa
vontade de dois de seus alunos (Geiger e
Marsden), partículas alfa positivas e uma
lâmina de ouro ele conseguiu provar que o
átomo era um grande espaço vazio.
Núcleo
Eletrosfera
Rutherford
O núcleo é pequeno e denso
(10000 a 100000 vezes menor que o
átomo).
O núcleo concentra toda a massa
do átomo.
O núcleo é positivo (prótons).
“Modelo Planetário”
John Dalton
J.John Thomson
Química 1A - Aula 01
Os elétrons giram ao redor do
núcleo numa região chamada
eletrosfera.
Química 1A - Aula 01
Modelos Atômicos
Modelo atômico de Rutherford- Bohr
Utilizando a nova teoria quântica de Planck,
Bohr aperfeiçoa o modelo de Rutherford,
mostrando que os elétrons estavam em
camadas definidas de energia.
M
L
K
N
Modelos Atômicos
Química 1A - Aula 01
Bohr baseado na Teoria Quântica de Max Planck(1900), propôs os
seguintes postulados:
1. Os elétrons nos átomos descrevem sempre
órbitas circulares ao redor do núcleo, chamadas
de camadas ou níveis de energia.
2. Cada um desses níveis possui um valor
determinado de energia (estados estacionários).
3. Os elétrons só podem ocupar os níveis que
tenham uma determinada quantidade de energia.
Modelos Atômicos
Página 9
M
L
K
N
Modelos Atômicos
Química 1A - Aula 01
4. Os elétrons podem saltar de um nível para outro mais externo,
desde que absorvam uma quantidade bem definida de energia
(quantum de energia).
Modelos Atômicos
Página 9
Modelos Atômicos
Química 1A - Aula 01
5. Ao voltar ao nível mais interno, o elétron emite um quantum de
energia, na forma de luz de cor bem definida ou outra radiação
eletromagnética (fóton).
Modelos Atômicos
Extra
Química 1A - Aula 01
Modelos Atômicos
Potássio
Arsênio
Modelos Atômicos
Página 9
Estrôncio
Cálcio
Sódio
Química 1A - Aula 01
Modelos Atômicos
6. Cada órbita é denominada de estado estacionário e pode ser
designada por letras K, L, M, N, O, P, Q. As camadas podem
apresentar:
K = 2 elétrons
L = 8 elétrons
M = 18 elétrons
N = 32 elétrons
O = 32 elétrons
P = 18 elétrons
Q = 8 elétrons
n=1
2
3 4
5
6
7 ....
7. Cada nível de energia é caracterizado por um número quântico (n),
que pode assumir valores inteiros: 1, 2, 3, etc.
Modelos Atômicos
Extra
Modelos Atômicos
Modelo Atômico Clássico
Prótons(+)
Núcleo
Nêutrons(0)
Eletrosfera
Elétrons(-)
Os nêutrons foram descobertos em
1932 por James Chadwick.
Modelos Atômicos
Química 1A - Aula 01
(UFSC) Rutherford bombardeou uma fina lâmina de ouro (0,0001 mm
de espessura) com partículas “alfa”, emitidas pelo Polônio (Po)
contido no interior de um bloco de chumbo (Pb), provido de uma
abertura estreita, para dar passagem às partículas a por ele emitidas.
Envolvendo a lâmina de ouro (Au), foi colocada uma tela protetora
revestida de sulfeto de zinco.
Modelos Atômicos
Extra
Observando as cintilações na tela revestida de sulfeto de zinco,
Rutherford verificou que muitas partículas a atravessavam a lâmina de
ouro sem sofrerem desvio (x), e que poucas partículas a sofriam
desvio (y). Assinale a(s) proposição(ões) CORRETA(S).
Modelos Atômicos
Extra
01. Partículas a possuem carga elétrica negativa.
04. Partículas a sofrem desvio ao colidirem com elétrons nas
eletrosferas dos átomos de Au.
08. Partículas a sofrem desvio ao colidirem com o núcleo dos
átomos de Au.
16. O tamanho do átomo é cerca de 10000 a 100000 vezes maior
que o seu núcleo.
Modelos Atômicos
Extra
35) (Ufpr) Considere as seguintes afirmativas sobre o modelo atômico
de Rutherford:
1. O modelo atômico de Rutherford é também conhecido como
modelo planetário do átomo.
2. No modelo atômico, considera-se que elétrons de cargas negativas
circundam em órbitas ao redor de um núcleo de carga positiva.
3. Segundo Rutherford, a eletrosfera, local onde se encontram os
elétrons, possui um diâmetro menor que o núcleo atômico.
4. Na proposição do seu modelo atômico, Rutherford se baseou num
experimento em que uma lamínula de ouro foi bombardeada por
partículas alfa.
d) Somente as afirmativas 1, 2 e 4 são verdadeiras.
Modelos Atômicos
Página 71
(Espcex (Aman)) Considere as seguintes afirmações, referentes à
evolução dos modelos atômicos:
I. No modelo de Dalton, o átomo é dividido em prótons e elétrons.
II. No modelo de Rutherford, os átomos são constituídos por um
núcleo muito pequeno e denso e carregado positivamente. Ao redor
do núcleo estão distribuídos os elétrons, como planetas em torno do
Sol.
III. O físico inglês Thomson afirma, em seu modelo atômico, que um
elétron, ao passar de uma órbita para outra, absorve ou emite um
quantum (fóton) de energia.
Das afirmações feitas, está(ão) correta(s)
a) apenas III.
b) apenas I e II.
c) apenas II e III.
d) apenas II.
e) todas
Modelos Atômicos
Extra
(Cftmg) Os recentes “apagões” verificados no Brasil, sobretudo no
Rio de Janeiro, mostram a grande dependência da sociedade atual
em relação a energia elétrica. O fenômeno da eletricidade só pode
ser explicado, no final do século XIX, por meio de experiências em
tubos, contendo um polo positivo e outro negativo, sob vácuo. Tais
experimentos resultaram no modelo atômico de
a) Bohr.
b) Dalton.
c) Rutherford.
d) Thomson.
Modelos Atômicos
Extra












