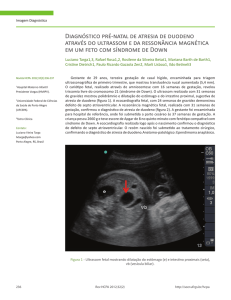
ACOMPANHAMENTO DE EVENTOS
ADVERSOS GRAVES (EAG’s) PELO COMITÊ
DE ÉTICA EM PESQUISA DO HCPA
Marcia Mocellin Raymundo
Anajara Gazzalle
Ana Paula Kurz de Boer
José Roberto Goldim
Grupo de Pesquisa e Pós-Graduação
Hospital de Clínicas de Porto Alegre
Tema livre apresentado no Congresso Brasileiro de Bioética Recife/2004
Boas Práticas Clínicas - GCP
É um padrão de qualidade
científica e ética, internacional, de
orientação
para
o
desenho,
condução, registro e relato de
estudos
que
envolvam
a
participação de seres humanos.
©Goldim et al/2004
Evento Adverso
Qualquer ocorrência médica inconveniente,
sofrida por um paciente ou indivíduo em
investigação clínica com produto farmacêutico e
que não apresenta, necessariamente, uma
relação causal com este tratamento. Um Evento
Adverso (EA) pode então ser qualquer sinal
desfavorável e não intencional (incluindo um
achado anormal de laboratório), sintoma ou
doença temporariamente associada ao uso de
um produto medicinal (em investigação), seja ele
relacionado ou não a este produto.
©Goldim et al/2004
Evento Adverso
CARACTERÍSTICAS
• Esperado
• Não esperado
• Relacionado
• Não relacionado
• Possivelmente relacionado
• Possivelmente não relacionado
• A relação não pode ser excluída
©Goldim et al/2004
Evento Adverso Grave
Qualquer evento adverso que resulte em:
• Morte
• Risco de vida
• Hospitalização ou prolongamento de internação
• Incapacidade temporária ou permanente
• Anomalia congênita
• Outros eventos médicos importantes
©Goldim et al/2004
Programa de Monitoramento de
Eventos Adversos CEP / HCPA
Início: Setembro de 2001
Objetivo: Acompanhar o andamento dos
projetos visando a proteção dos sujeitos
de pesquisa
©Goldim et al/2004
Programa de Monitoramento de
Eventos Adversos CEP / HCPA
Posicionamento do Pesquisador
1) A pessoa envolvida foi devidamente encaminhada para atendimento?
2) O evento indica novos riscos para outros participantes que não haviam
sido previstos no projeto?
3) Quais medidas necessárias para proteção dos participantes?
4) A pesquisa deve continuar ou ser interrompida?
5) Deve haver alteração do Termo de Consentimento?
6) No caso de haver alteração, esta deve ser comunicada a todos os
participantes?
7) Se houver necessidade de alteração do projeto ou do Termo, estas
novas versões já foram encaminhadas ao CEP/HCPA?
8) Situação do projeto
Posicionamento do CEP / HCPA
©Goldim et al/2004
Programa de Monitoramento de
Eventos Adversos CEP / HCPA
Número de Eventos Relatados: 2118
Número de Projetos: 139
Eventos no HCPA:
222
Eventos fora do HCPA: 1896
©Goldim et al/2004
CONSIDERAÇÕES FINAIS
O acompanhamento e controle dos
projetos pelos Comitês de Ética em
Pesquisa, baseados em normas e diretrizes
nacionais e internacionais, visam o bem
estar e a segurança dos participantes.
Devido ao crescente número de relatos
enviados ao CEP/HCPA, está sendo
implantado um formulário on-line, que visa
agilizar e qualificar a avaliação dos EAG’s e
seu conseqüente monitoramento.
©Goldim et al/2004