Os elementos químicos sempre foram agrupados de
modo a termos elementos semelhantes juntos, tendo
desta maneira o desenvolvimento
de várias tabelas até os
nossos dias atuais
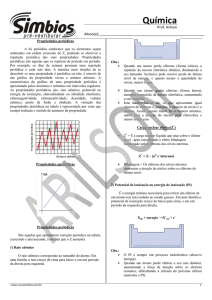
CLASSIFICAÇÃO PERIÓDICA DOS ELEMENTOS QUÍMICOS
1
18
1A
1º
0
1
1
2
H
2A
1,01
ELEMENTOS DE TRANSIÇÃO
Hidrogênio
2º
P
E
R
Í
O
D
O
S
3º
4º
3
Li
2
1
16
17
3A
4A
5A
6A
7A
5
B
2
3
2
4
6
C
7
N
2
5
8
O
2
2
4,00
Hélio
2
6
9
F
2
7
John
AlexanderChancourtois
Reina Newlands
Alexandre
Seaborg
3
10
11
12
4
5
7 Henry
8Seaborg
6
9 Moseley
S
Cl
Na
Mg
Si
P
Al
Dmitri
Mendeleev
7B
8B
3B
6B
8B ordem
8B de1Bsuas
2B massas atômicas
4B os5B
Organizou
elementos
em
Johann
W.
Döbereiner
Descoberta
douma
primeiro
elemento,
ooseu
fósforo.
DispôsRecebeu
os elementos
em
espiral
traçada
um
cilindro
e
Criou
Descobriu
oonúmero
Prêmio
todos
atômico,
Nobel
os em
elementos
observando
Química,
transurânicos
pelo
que em
número
trabalho.
de
osos
elementos
químicos
em
ordem
crescente
Br
Sc linhas
V horizontais,
Co
Ge
As
Ca Organizou
Cr
Zn
K
Ti
Ni
Se
Mn
Fe contendo
Ga
Cu
em
7
elementos
cada.
Agrupou
elementos
químicos
em
tríades
em
ordem
crescente
massa
O elemento
prótons
(números
dedenúmero
atômicos
um
elemento
atômico
dede
94
nunca
a106
102).
varia
da tabela
de
suas
massas
atômicas
e
Rb
Y que
Ru
Te
Sr Em
eram
feitas
a apresenta
partir
média
aritmética
Nb Mo
PddaAg
In
Sn
Tc
Sb
I
Cd
Rh
OZr oitavo
elemento
propriedades
Reconfigurou
e que
periódica
as propriedades
aétabela
chamado
periódica
dos
SEABORGIO,
elementos
colocando
são a
verificou
que
muitas
de
suas
propriedades
se Pb
repetiam
das
massas
dos
elementos
Pt
Hg
semelhantes
primeiro
Ausucessivamente
Bi
Po At
Tl
Ba
Ir e assim
Ta
Wao Re
Cs
Os
Hf
série actinídeos
funçõesem
de
abaixo
sua
seushomenagem
números
da série dos
atômicos
lantanídeos
10
Ne
9,01
10,81
12,01
18,99
20,18
Boro
14,00
15,99
Berílio
Carbono
Nitrogênio
Oxigênio
Flúor
Neônio
2
8
1
11
2
8
2
12
13
2
8
3
2
8
4
14
15
2
8
5
16
2
8
6
2
8
7
17
22,99
24,30
26,98
28,08
30,97
32,06
35,45
Sódio
Magnésio
Alumínio
Silício
Fósforo
Enxofre
Cloro
19
37
1,01
Rubídio
55
132,91
Césio
7º
15
6,94
39,09
6º
2
2
Be
14
Lítio
2
8
8
1
87
Fr
223,02
Frâncio
20
40,07
2
8
8
2
2
8
18
8
1
38
87,62
Estrôncio
2
8
18
18
8
1
56
2
8
18
32
18
8
1
88
137,33
Bário
Ra
226,03
Rádio
21
44,95
2
8
18
8
2
39
88,90
Ítrio
2
8
18
18
8
2
57
a
71
2
8
18
32
18
8
2
89
a
103
Nº atômico
SÍMBOLO
Massa atômica
Nome
2
8
9
2
Escândio
Cálcio
Potássio
5º
4
13
K
L
M
N
O
P
Q
22
47,86
2
8
10
2
2
40
8
18
91,22 10
Zircôno 2
72
178,49
Háfnio
50,94
2
8
11
2
Vanádio
Titânio
2
8
18
9
2
23
2
8
18
32
10
2
104
41
92,90
Nióbio
2
8
18
12
1
73
180,95
Tântalo
2
8
18
32
11
2
Db
262
261
Rutherfódio
51,99
Crômio
105
Rf
2
8
13
1
24
Li
Dúbnio
25
54,93
2
8
13
2
Manganês
42
2
8
18
13
1
95,94
Molibdênio
2
8
18
32
12
2
74
183,85
26
55,84
2
8
14
2
2
8
18
18
9
2
Ac
227,03
Actínio
2
8
18
32
18
9
2
90
2
43
8
18
98,90 14
Tecnécio 1
2
44
8
18
101,07 15
Rutênio 1
2
45
8
18
102,91 16
Ródio 1
2
46
8
18
106,42 18
2
8
18
32
13
2
2
8
18
32
14
2
2
8
18
32
17
2
8
18
32
17
1
75
186,21
Rênio
106
107
76
190,23
Ósmio
2
8
18
21
8
Praseodímio 2
Th
232,04
Tório
2
8
18
32
231,04 20
9
Protactínio
2
91
Pa
92
B
C
Hássio
Meitnério
2
8
18
23
8
2
Cr
U
238,03
Urânio
2
8
18
32
21
9
2
93
Np
237,05
Netúnio
192,22
Irídio
Mt
Hs
2
8
18
22
8
2
77
109
108
Sg Bh
Bóhrio
Seabórgio
7LiBe
Ca
2
8
18
32
18
10
2
58,69
Níquel
Si
62
2
8
18
24
150,36 8
Samário 2
Sm
29
63,54
2
8
18
1
78
195,08
Platina
110
2
8
18
107,87 18
1
Prata
47
79
196,97
Ouro
65,39
2
8
18
2
2
8
18
32
18
1
111
2
8
18
112,41 18
Cádmio 2
48
80
2
8
18
32
200,59 18
Mercúrio 2
63
P
2
64
8
18
25
157,25
8
2
Gadolínio
Eu Gd
151,96
137Ba
Európio
69,72
2
8
18
3
49
114,82
Indio
81
204,38
Tálio
32
72,61
2
8
18
4
2
8
18
32
22
9
2
2
8
18
32
239,05 23
9
Plutônio 2
94
Pu
2
8
18
32
241,06 24
9
Amerício 2
95
S
2
8
18
25
9
2
Am
2
8
18
32
244,06 25
9
Cúrio
2
96
Cm
33
74,92
2
8
18
5
Arsênio
Germânio
2
8
18
6
34
78,96
2
2
50
51
52
8
8
18
18
18
118,71 18 121,76 5 127,60
Telúrio
Estanho 4 Antimônio
2
8
18
32
18
3
2
82
8
18
32
207,2 18
Chumbo 4
2
83
8
18
32
208,98 18
Bismuto 5
79,90
Bromo
Selênio
2
8
18
18
3
35
2
8
18
18
6
84
209,98
Polônio
2
8
18
32
18
6
53
126,90
Iodo
85
209,99
Astato
2
8
18
18
7
2
8
18
32
18
7
Ar
2
8
8
39,94
Argônio
36
Kr
83,80
2
8
18
8
Criptônio
2
8
54
Xe 1818
131,29
Titânio
8
86
2
8
18
32
222,02 18
Radônio 8
Rn
112
Uun Uuu Uub
Ununúnio
Ununílio
40
NCa
OUnúmbio
88Sr
31
Gálio
Zinco
Cobre
Paládio
30
65
Tb
158,93
Térbio
F
2
8
18
27
8
2
Cl
2
8
18
28
162,50 8
Disprósio 2
66
Dy
67
Ho
164,92
Hólmio
2
8
18
29
8
2
Ti
SÉRIE DOS ACTINÍDEOS
89
2
8
16
2
28
Cobalto
Tungstênio
K
58,93
2
8
15
2
Ferro
SÉRIE DOS LANTANÍDEOS
23
Mg
Al
61
57
58 Na 59 Na
60
Pm
La Ce
Pr
Nd 146,92
138,91
140,12
144,24
140,91
39K Neodímio
Promécio
Lantânio
Cério
2
8
18
20
8
2
27
2
8
18
7
18
2
8
2
2
98
8
8
18
18
32
32
249,08 26 252,08 27
9
Berquélio 2 Califórnio 92
97
Bk
Cf
2
8
18
32
252,08 28
9
Einstênio 2
99
Es
S
E
M
E
L
H
68
AEr
167,26
N
Érbio
Ç
A
100
Fm
257,10
Férmio
2
8
18
30
8
2
Túlio
2
8
18
31
8
2
2
101
8
18
32
29 258,10
9
2 Mendelévio
2
8
18
32
30
9
2
69
Tm
168,93
Md
70
Yb
173,04
Itérbio
102
No
259,10
Nobélio
2
8
18
32
8
2
71
Lu
174,97
Lutécio
2
8
18
32
9
2
2
2
103
8
8
18
18
32
32
32
262,11 32
8
9
Laurêncio
2
2
Lr
Prof. Agamenon Roberto
www.auladequimica.cjb.net
Na tabela atual os elementos químicos ocupam
SETE LINHAS HORIZONTAIS
que são denominados de
PERÍODOS
Estes períodos são numerados
ou ordenados
de cima para baixo para melhor identificá-los
Podemos associar o
período de um elemento químico
com a sua
configuração eletrônica
O número de ordem do período
de um elemento
é igual ao número de níveis eletrônicos
que ele elemento possui
O elemento flúor tem 9 elétrons:
1s
2
2s
2
2p
5
ou
K=2
Possui deste modo apenas os
níveis 1 e 2 ou K e L com elétrons
( 2 níveis de energia )
Então este elementos localiza-se no
2º PERÍODO
da classificação periódica
L=7
O elemento ferro tem 26 elétrons:
1s
2
2s
2
2p
6
3s
2
3p
6
4s
2
3d
ou
K=2
L=8
M = 14
N=2
Possui deste modo apenas os níveis
1, 2, 3 e 4 ou K, L, M e N
com elétrons (4 níveis de energia)
Então este elementos localiza-se no
4º PERÍODO
da classificação periódica
6
FAMÍLIAS (GRUPOS ou COLUNAS)
Constituem as 18 linhas verticais
da classificação periódica
Estas linhas são numeradas de 1 a 8 e
subdivididas em A e B,
a IUPAC recomenda que
esta numeração seja de 1 a 18
Os elementos que estão no
subgrupo A
são denominados de representativos
e possuem o elétron diferencial em
subnível “ s ” ou “ p “
Os elementos que estão no
subgrupo B
são denominados de transição
e possuem o elétron diferencial em
subnível “ d “ ou “ f “
O elemento flúor de
número atômico 9
e distribuição eletrônica:
1s
2
2s
2
2p
5
É um elemento representativo,
pois possui o elétron diferencial
no subnível “ p “
O elemento cálcio de
número atômico 20
e distribuição eletrônica
1s 2 2s 2 2p 6 3s 2 3p
6
4s
É um elemento representativo,
pois possui o elétron diferencial
no subnível “ s “
2
O elemento ferro de
número atômico 26
e distribuição eletrônica
1s
2
2s
2
2p
6
3s
2
3p
6
4s
2
3d
6
É um elemento de transição (externa),
pois possui o elétron diferencial
no subnível “ d “
No grupo 3B e no 6º período
se encontra uma série de elementos
denominada de
série dos lantanídeos
No grupo 3B e no 7º período
encontramos uma série de elementos
denominada de
série dos actinídeos
Estas duas séries são os elementos de
transição interna
que possuem o elétron diferencial em
subnível “f”
01) A configuração eletrônica de um átomo é:
1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 5
1
2
3
4
5
6
7
Para este elemento podemos afirmar
V
II. É elemento de transição
V
III. Seu número atômico é 25
2 + 2 + 6 + 2 +
IV. Possui 7 subníveis de energia
a) somente I é correta.
b) somente II e III são corretas.
c) somente II, III e IV são corretas.
d) todas são corretas.
e) todas são falsas.
é de transição
F
I. É elemento representativo
6
+
2
+
V
5
= 25
O elemento flúor de número atômico 9
e distribuição eletrônica:
1s
2
2s
2
2p
5
ou
K=2
Possui 7 elétrons no último
nível
e se encontra na família 7A
L=7
O elemento cálcio de número atômico 20
e distribuição eletrônica:
1s
2
2s
2
2p
6
3s
2
3p
6
4s
ou
K=2
L=8 M=8
N=2
Possui 2 elétrons no último
nível
e se encontra na família 2A
2
01) Um elemento químico tem número atômico 33.
A sua configuração eletrônica indica que está
localizado na:
a) família 5A do período 3.
b) família 3A do período 3.
c) família 5A do período 4.
d) família 7A do período 4.
e) família 4A do período 7.
1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 3
1s 2
K=2
2s 2 2p 6
L=8
3s 2 3p 6 3d 10
M = 18
família 5A
período 4
4s 2 4p 3
N=5
04) Um elemento químico está na família 4A e no
5º período da classificação periódica. A sua
configuração eletrônica permitirá concluir que
seu número atômico é:
a) 50.
5º período: possui 5 níveis de energia.
b) 32.
família 4A: possui 4 elétrons no último nível
c) 34.
d) 82.
e) 46.
1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 2
1s 2
K=2
2s 2 2p 6
L=8
3s 2 3p 6 3d 10
M = 18
4s 2 4p 6 4d 10 5s 2 5p 2
N = 18
2 + 8 + 18 + 18 + 4 = 50
O=4
03)(PUC-PR) O subnível mais energético do átomo de um elemento
químico no estado fundamental é “5p ”. Portanto,4 o seu
número atômico e sua posição na tabela periódica serão:
a) 40, 5A, 4º período.
b) 34, 4A, 4º período.
Pág 90 / Ex. 3
c) 52, 6A, 5º período.
d) 56, 6A, 5º período.
e) 55, 5A, 5º período.
1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 4
número atômico 52, família 6A e 5º período
04) (Cefet-PR) Um “hacker” de programas de computador está prestes a violar um arquivo
importantíssimo de uma grande multinacional de indústria química. Quando ele violar este
arquivo, uma grande quantidade de informações de interesse público poderá ser divulgada. Ao
pressionar uma determinada tecla do computador, aparece a figura a seguir e uma mensagem
em forma de desafio:
“A senha é composta do símbolo de X, seguido do número de elétrons do seu átomo
neutro, do símbolo de Y, seguido do seu número atômico, e do símbolo de Z, seguido do
seu número de prótons”.
Pág 91 / Ex. 5
A senha que o hacker deve digitar é:
a) Ca40C12F15.
Y
b) Ca20C12F31.
c) Ca20C6F15.
d) Ca40C12P15.
e) Ca20C6P15.
Z
X
Para os elementos de transição (externa) observamos
o número
de elétrons do subnível “d”
mais energético
e seguimos a tabela abaixo
3B
4B
5B
6B
7B
8B
8B
8B
1B
1
2
3
4
5
6
7
8
9
d
d
d
d
d
d
d
d
d
2B
d
10
01) Assinale a alternativa que indica onde se encontra
o elemento químico cuja configuração eletrônica,
2
na ordem crescente de energia, finda em 4s 3d
a) grupo 3B e 2º período.
b) grupo 4A e 2º período.
c) grupo 4A e 5º período.
d) grupo 5B e 4º período.
e) grupo 5A e 3º período.
1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d
3
subnível de maior energia é o “ 3d “ com 3 elétrons: família 5B
utiliza 4 níveis de energia: 4º período
3
1A: família dos metais alcalinos
Li, Na, K, Rb, Cs, Fr.
2A: família dos metais alcalinos terrosos
Be, Mg, Ca, Sr, Ba, Ra.
3A: família do boro
B, Al, Ga, In, Tl.
4A: família carbono
C, Si,
Ge, Sn, Pb.
5A: família do nitrogênio
N, P,
As,
Sb,
Bi.
6A: família dos calcogênios
O, S, Se,
Te,
Po.
7A: família dos halogênios
F, Cl, Br, I, At.
ZERO: família dos gases nobres
He, Ne, Ar,
Kr,
Xe, Rn.
01) Na classificação periódica, os elementos “ Ba “
(grupo 2), “ Se “ (grupo 16) e “ Cl “ (grupo 17)
são conhecidos, respectivamente, como:
a) alcalino, halogênio e calcogênio
b) alcalino terroso, halogênio e calcogênio
c) alcalino terroso, calcogênio e halogênio
d) alcalino, halogênio e gás nobre
e) alcalino terroso, calcogênio e gás nobre
Se
alcalino terroso
calcogênio
Cl
halogênio
Ba
02) Assinale o grupo de elementos que faz parte
somente dos alcalinos-terrosos.
a) Ca, Mg, Ba.
b) Li, Na, K.
c) Zn, Cd, Hg.
d) Ag, Au, Cu.
e) Pb, Al, Bi.
família dos metais terrosos
Be, Mg, Ca, Sr, Ba,
Ra.
03) (Univale-SC) O bromato de potássio, produto
de aplicação controvertida na fabricação de pães
tem fórmula “ KBrO3 “. Os elementos que fazem
deste composto, na ordem indicada na fórmula,
são das famílias dos:
a) alcalinos, halogênios e calcogênios
b) halogênios, calcogênios e alcalinos
c) calcogênios, halogênios e alcalinos
d) alcalinos terrosos, calcogênios e halogênios
e) alcalinos terrosos, halogênios e calcogênios
K
Br
O
alcalinos
halogênios
calcogênios
Podemos classificar os elementos químicos de acordo com suas propriedades físicas
em
METAIS, SEMIMETAIS, AMETAIS e GASES NOBRES
A IUPAC recomenda que esta classificação seja, apenas,
METAIS, AMETAIS e GASES NOBRES
SEMIMETAIS
AMETAIS
B
He
C
N
O
F
Si
P
S
Cl Ar
Ge As
Ne
Se Br Kr
Sb Te
I
Xe
Po At Rn
METAIS
G
A
S
E
S
N
O
B
R
E
S
Constitui a maior parte dos elementos químicos
Suas principais características são:
Sólidos nas condições ambientes, exceto o
mercúrio, que é líquido
São bons condutores de eletricidade e calor
São dúcteis e maleáveis
Possuem brilho característico
Apenas 11 elementos químicos fazem parte deste grupo
(C, N, P, O, S, Se, F, Cl, Br, I e At)
Suas características são opostas à dos metais
Podem ser sólidos (C, P, S, Se I e At)
líquido (Br)
gasosos (N, O, F e Cl)
São maus condutores de eletricidade e calor
Não possuem brilho característico
Não são dúcteis nem maleáveis
Possuem propriedades intermediárias
entre os metais e os ametais
Este grupo é constituído por
7 elementos químicos
(B, Si, Ge, As, Sb, Te e Po)
São sólidos nas condições ambientes
São todos gases nas condições ambientes
Possuem grande estabilidade química, isto é,
pouca capacidade de combinarem com outros
elementos
Constituem os gases nobres os elementos
He, Ne, Ar, Kr, Xe e Rn
O elemento químico
HIDROGÊNIO
não é classificado em nenhum destes
grupos, ele possui características próprias
01) Possuem brilho característico, são bons
condutores de calor e eletricidade.
Estas propriedades são dos:
a) gases nobres.
b) ametais.
c) não metais.
d) semimetais.
e) metais.
02) Nas condições ambientes os metais são sólidos,
uma exceção é o:
a) sódio.
b) magnésio.
c) ouro.
d) mercúrio.
e) cobre.
03) Qual dos grupos abaixo possui apenas ametais?
a) B, Al e Ne.
b) Na, Ge e Rn.
c) W, Os e Po.
d) Si, Ge e As.
e) Br, S e O.
B, Si, Ge, As, Sb, Te,
Po.
04) (Fatec-SP) Imagine que a tabela periódica seja o mapa de um continente, e que os
elementos químicos constituam as diferentes regiões desse território.
A respeito desse “mapa”, são feitas
as seguintes afirmações:
N
O
L
S
I. Os metais constituem a maior parte do território desse continente.
II. As substâncias simples gasosas, não-metálicas, são encontradas no
Nordeste e na costa leste desse continente.
III. Percorrendo-se um meridiano (isto é, uma linha no sentido Norte-Sul),
atravessam-se regiões cujos elementos químicos apresentam
propriedades químicas semelhantes.
Dessas afirmações,
a)
b)
c)
d)
e)
apenas I é correta.
apenas I e II são corretas.
apenas I e III são corretas.
apenas II e III são corretas.
I, II e III são corretas.
Pág 90 / Ex. 01
Muitas características
dos elementos químicos se repetem
periodicamente, estas propriedades
são denominadas de
PROPRIEDADES PERIÓDICAS
Dois fatores são importantes na determinação
do raio atômico:
NÚMERO DE CAMADAS ELETRÔNICAS
e
CARGA NUCLEAR
8
16
O
S
K=2
K=2
L=6
L=8
L=6
Com o aumento do número de camadas ocorre um
aumento no raio do átomo e,
este aumento é de CIMA para BAIXO
em átomos pertencentes à mesma família
Este fator tem influência quando se
considera elementos químicos
de mesmo período na tabela periódica,
pois possuem o mesmo número de camadas
Quanto maior a carga nuclear
maior é a atração do núcleo pelos elétrons
periféricos, isto é, menor será o átomo e,
num mesmo período o tamanho do
átomo aumenta da
DIREITA para a ESQUERDA
O tamanho de um ÌON é diferente
do átomo que o originou
Um CÁTION tem um raio MENOR
que o átomo que o produziu
Um ÂNION tem um raio MAIOR
que o átomo que o produziu
01) Assinale a alternativa que indica corretamente a ordem
crescente dos raios atômicos:
a) Cs < Rb < K < Na < li.
Os elementos comparados
b) Cs < Li < Rb < Na < K.
pertencem a uma mesma família
c) K < Rb < Na < Cs < Li.
da tabela periódica
d) Li < Cs < Na < Rb < K.
e) Li < Na < K < Rb < Cs.
O raio atômico
aumenta de cima para baixo
02) O tamanho de um cátion e o tamanho de um ânion, comparado
com o do átomo de origem, é respectivamente:
a) menor e maior.
b) menor e menor.
c) maior e maior.
d) maior e menor.
e) maior e igual.
O cátion é MENOR que o átomo de origem
O ânion é MAIOR que o átomo de origem
03) Um professor decidiu decorar seu laboratório com um “relógio de química” no qual, no
lugar das horas estivessem elementos químicos, dispostos de acordo com seus respectivos
números atômicos, como mostra a figura abaixo.
Na
Ne
Mg
F
H
He
Li
Pág 99 / Ex. 09 / b
Be
O
N
C
B
Indique a hora que o relógio do professor marca quando o ponteiro dos minutos aponta
para o metal alcalino-terroso de menor raio atômico e o ponteiro das horas aponta para o
gás nobre do segundo período.
a) 8h25min.
b) 5h09min.
c) 2h55min.
d) 10h20min
e) 6h30min.
horas: 10
minutos: 20
É a energia mínima necessária para retirar um
elétron de um átomo neutro isolado no estado gasoso
Quanto menor for o átomo maior
será a dificuldade para
retirar seu elétron, isto é,
maior será a energia de ionização
A energia mínima necessária
A energia
mínimaelétron
necessária
para retirar
um segundo
de um cátion
para retirar um
elétron
de um átomo
neutrobivalente
isolado
monovalente
gasoso
produzindo
um cátion
no estado gasoso produzindo
um cátion monovalente
chama-se
chama-se
2ª ENERGIA
DE IONIZAÇÃO
1ª ENERGIA
DE IONIZAÇÃO
e será maior
que a
1ª ENERGIA DE IONIZAÇÃO
01) São dados cinco elementos genéricos e seus números atômicos:
A (Z = 17); B (Z = 15); C (Z = 13); D (Z = 12); E (Z = 11).
O elemento que apresenta a primeira energia de ionização mais
elevada é:
2
2
6
2
A: 1s
2s 2p
3s
3p 5
a) A.
b) B.
c) C.
B:
1s
2
2s
2
2p
6
3s
2
3p 3
família 7A
3° período
família 5A
d) D.
e) E.
3° período
C:
1s
2
2s
2
2p
6
3s
2
3p 1
3° período
família 3A
energia de
ionização
D: 1s
2
2s
2
2p
6
3s
2
família 2A
período
aumenta
3° período
E:
1s
2
2s
2
2p
6
3s
1
3° período
família 1A
02) (Covest-2005) As primeiras energias de ionização de K (Z = 19), Ca (Z = 20) e
S (Z = 16) são, respectivamente, 418,8 kj/mol, 589,8 kj/mol e 999,6 kj/mol.
Alguns comentários sobre estes números podem ser feitos.
F
V
V
V
1) O enxofre apresenta a menor energia de ionização, pois é o
elemento de menor número atômico entre os três.
2) A energia de ionização do potássio é a menor, pois se trata de um
elemento com apenas um elétron na última camada, o que facilita a
sua remoção
3) A energia de ionização do potássio é menor do que a do cálcio,
pois este último apresenta número atômico maior e dois elétrons de
valência, estando com o mesmo número de camadas eletrônicas
4) As energias de ionização do potássio e do cálcio são mais próximas,
pois são elementos vizinhos na tabela periódica
Está(ao) correto(s) apenas:
a)
b)
c)
d)
e)
1.
2.
3 e 4.
2 e 4.
2, 3 e 4.
É a energia liberada pelo átomo, isolado no estado
gasoso, quando recebe um elétron originando um
ânion
Não definimos
afinidade eletrônica para os
GASES NOBRES
É a tendência que os átomos têm de atraírem elétrons
Não definimos
eletronegatividade para os
GASES NOBRES
01) A energia liberada quando um elétron é adicionado
a um átomo neutro gasoso é chamada de:
a) entalpia de formação.
b) afinidade eletrônica.
c) eletronegatividade.
d) energia de ionização.
e) energia de ligação.
02) (Covest-2005) Dados os elementos químicos A (Z = 16). B (Z = 11), C (Z = 15)
e D (Z = 12), podemos afirmar que:
V 0 0 “A” e “C” possuem energia de ionização semelhantes.
V 1 1 A energia de ionização de “D” é maior que a de “B”.
V 2 2 O raio atômico de “C” é menor que o de “D”.
F 3 3 A afinidade eletrônica de “B” é maior que a de “A”.
V 4 4 O caráter metálico de “D” é maior que o de “C”.
B
D
A:
K = 2
L = 8
M = 6
B:
K = 2
L = 8
M = 1
C:
K = 2
L = 8
M = 5
D:
K = 2
L = 8
M = 2
AFINIDADE
CARÁTER
ELETRÔNICA
METÁLICO
ENERGIA
RAIO ATÔMICO
DE
IONIZAÇÃO
C
A